Thông Tin Thuốc
Các thuốc kháng virus trong điều trị Covid-19
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Biên soạn: ThS.DS. Hoàng Minh Thu, Đơn vị Dược lâm sàng, Khoa Dược, Bệnh viện K.
Hiệu đính: PGS.TS. Nguyễn Thị Liên Hương, Bộ môn Dược lâm sàng, Trường Đại học Dược Hà Nội.
Khi đại dịch COVID-19 bắt đầu, sự phát triển của các phương pháp điều trị kháng virus (antiviral therapy) mang lại đầy hứa hẹn. Kể từ đại dịch SARS-CoV 2002-2003 và nhiều đợt bùng phát MERS-CoV vào năm 2012, nhiều hợp chất mới và cũ đã được phát hiện có hoạt tính chống lại coronavirus in vitro, đem lại hy vọng về một hoặc nhiều phương pháp điều trị kháng virus hiệu quả. Trong số đó phải kể đến Remdesivir (Veklury ®, Gilead Sciences), Favipiravir (Avigan, Fujifilm), Molnupiravir (MK-4482 hay EIDD-2801, Merck & Co) và gần đây là Paxlovid (Nirmatrelvir [PF-07321332], ritonavir; Pfizer) – 4 thuốc kháng virus có tiềm năng nổi bật trong kiểm soát đại dịch COVID-19 hiện nay.
Cơ chế tác dụng
Các thuốc kháng virus trong điều trị COVID-19 được chia thành 2 nhóm: (1) ức chế enzyme polymerase (Remdesivir, Favipiravir, Molnupiravir) và (2) ức chế Enzym Protease (Paxlovid).
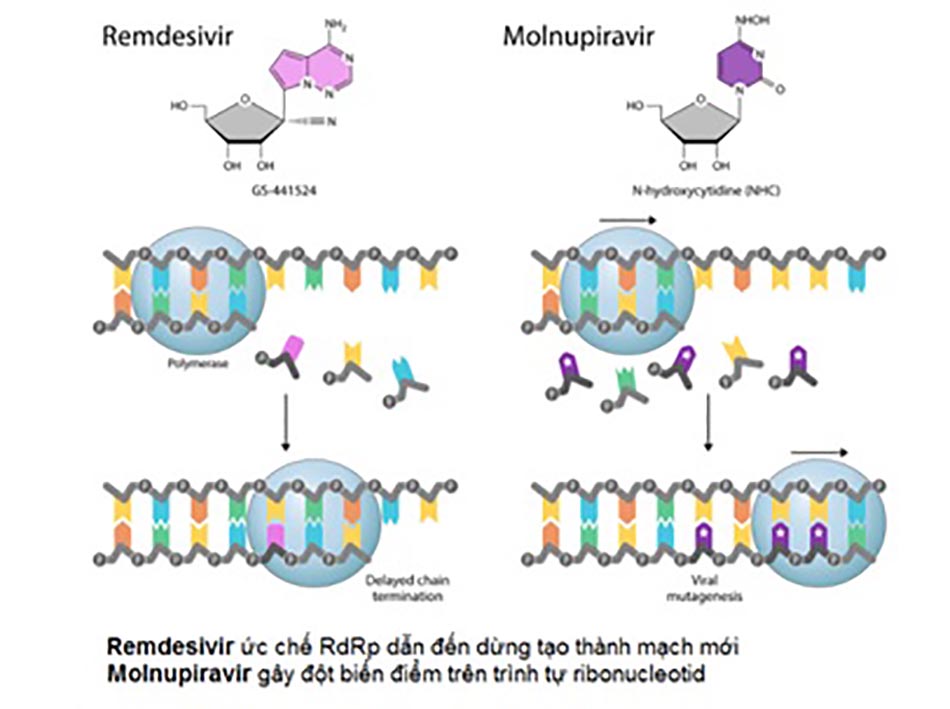
Remdesivir, Favipiravir, Molnupiravir là các thuốc kháng virus phổ rộng, được nghiên cứu ban đầu nhằm mục đích điều trị virus EBOLA (Remdesivir), cúm mùa (Favipiravir), virus viêm não ngựa Venezuela (Venezuelan equine encephalitis virus – VEEV) (Molnupiravir). Tuy nhiên sau đó, khả năng kháng coronavirus của các thuốc này được phát hiện và chúng trở thành những ứng viên tiềm năng trong kiểm soát đại dịch COVID-19. Trong khi Remdesivir được sử dụng bằng đường tĩnh mạch thì Favipiravir và Molnupiravir được bào chế dưới dạng các thuốc đường uống. Về mặt cơ chế, Remdesivir, Favipiravir, Molnupiravir đều nhằm tác dụng đến RdRp (RNA-dependent RNA polymerases) – RNA polymerase của virus – có vai trò xúc tác sự hình thành liên kết phosphodiester giữa các nucleotid trong quá trình tổng hợp RNA. Các thuốc kháng virus này là những tiền thuốc, khi vào cơ thể được chuyển hóa thành dạng hoạt tính có cấu trúc tương tự nucleoside. Do đó, RdRp “nhầm lẫn” chúng với các ribonucleoside và đưa chúng vào chuỗi RNA mới đang tổng hợp, dẫn đến ngừng quá trình tạo thành mạch mới (cơ chế của Remdesivir) hoặc tạo nên các đột biến trong trình tự ribonucleotide của virus (cơ chế của Molnupiravir và Favipiravir), kết quả là ức chế sự nhân lên của chúng (Hình 1).
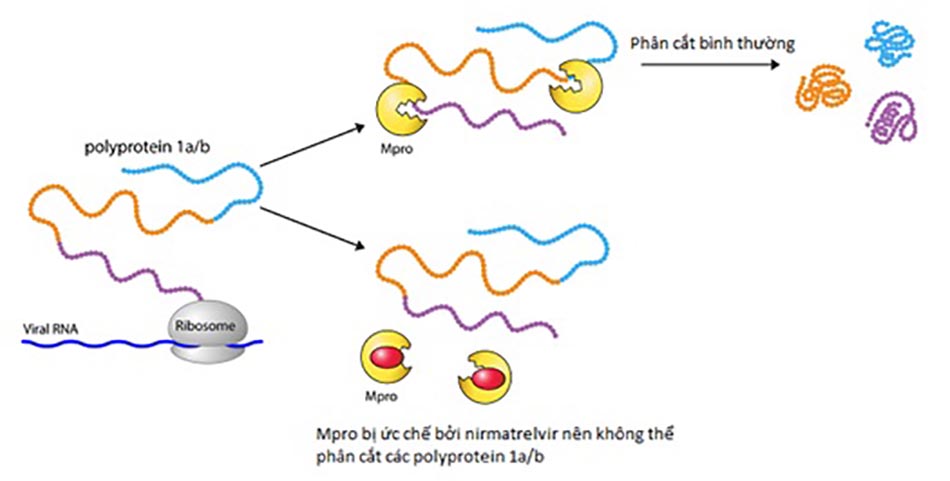
Khác với 3 thuốc trên đều hướng tới RNA polymerase của virus, đích nhắm của Paxlovid là Enzyme Protease của SARS-CoV-2. Paxlovid được thiết kế để sử dụng bằng đường uống, gồm 2 thành phần là Nirmatrelvir và ritonavir. Nirmatrelvir ức chế hoạt động của SARS-CoV-2-3CL protease (Mpro), enzyme đóng vai trò phân cắt các polyprotein của virus. Hậu quả là các protein không được giải phóng để thực hiện chức năng của mình, dẫn tới quá trình nhân lên của virus bị dừng lại (Hình 2). Sử dụng đồng thời với liều thấp ritonavir giúp làm chậm quá trình chuyển hóa hoặc phân hủy của Nirmatrelvir, giúp Nirmatrelvir duy trì hoạt tính trong thời gian dài hơn với nồng độ cao hơn để chống lại virus.
Thông tin cấp phép và dữ liệu từ các thử nghiệm lâm sàng
Remdesivir
Remdesivir là thuốc duy nhất được FDA phê duyệt đầy đủ trong điều trị COVID-19 (22/10/2020). Ban đầu, thuốc được phê duyệt khẩn cấp trên bệnh nhân nhập viện mức độ nặng, sau đó mở rộng cho bệnh nhân nhập viện ở tất cả các mức độ. Phê duyệt này dựa trên kết quả của 3 thử nghiệm ngẫu nhiên, có đối chứng trên các bệnh nhân nhập viện điều trị COVID-19 với mức độ từ nhẹ đến nặng, bao gồm: thử nghiệm ACTT-1 trên bệnh nhân từ nhẹ đến nặng, thử nghiệm GS-US-540-5773 trên bệnh nhân nặng và thử nghiệm GS-US-540-5774 trên bệnh nhân trung bình. Thử nghiệm ACTT-1, thử nghiệm đa trung tâm, ngẫu nhiên, mù đôi, có đối chứng trên 1062 bệnh nhân COVID-19, cho thấy Remdesivir vượt trội hơn so với giả dược trong việc rút ngắn thời gian hồi phục (10 ngày so với 15 ngày) ở người lớn nhập viện do COVID-19 và có bằng chứng nhiễm trùng đường hô hấp dưới. Lợi ích Remdesivir mang lại lớn nhất ở nhóm có chỉ định thở oxy và gần như hạn chế ở nhóm bệnh nhân thở oxy lưu lượng cao, thở máy hay đặt ECMO.
Gần đây, dữ liệu của thử nghiệm Remdesivir trên bệnh nhân ngoại trú (PINETREE) cũng đã được công bố. Kết quả cho thấy, phác đồ Remdesivir 3 ngày giúp giảm 87% nguy cơ nhập viện hoặc tử vong trên đối tượng bệnh nhân nguy cơ cao.
Tuy nhiên, hiệu quả của Remdesivir trong điều trị COVID-19 vẫn còn là vấn đề tranh cãi do các dữ liệu chưa đồng nhất. WHO khuyến cáo không sử dụng Remdesivir để điều trị bệnh nhân COVID-19 nội trú dựa trên một tổng quan hệ thống và phân tích gộp của 4 thử nghiệm ngẫu nhiên trên 7333 bệnh nhân nhập viện vì COVID-19 (bao gồm cả thử nghiệm ACTT-1 ở trên và thử nghiệm Solidarity của WHO – thử nghiệm lớn nhất với trên 5000 bệnh nhân). Kết quả cho thấy Remdesivir không ảnh hưởng đáng kể đến tỷ lệ tử vong, thở máy, thời gian hồi phục và các kết cục lâm sàng quan trọng khác. Dựa trên khuyến cáo của WHO, EMA quyết định chỉ phê duyệt có điều kiện đối với Remdesivir đồng thời yêu cầu các dữ liệu lâm sàng đầy đủ từ Gilead và thử nghiệm Solidarity của WHO để xem xét.
Favipiravir
So với Remdesivir, Favipiravir có phần ít dữ liệu lâm sàng về hiệu quả và tính an toàn hơn. Thuốc đã được sử dụng trong điều trị COVID-19 ở một số nước như Nhật Bản, Nga, Ấn Độ, Trung Quốc, Thái Lan… Chính phủ Nga đã phê duyệt nhanh Favipiravir dựa trên các kết quả sớm của thử nghiệm thích ứng [COVID-FPR-01], thử nghiệm pha II/III ngẫu nhiên, nhãn mở, đa trung tâm đang tiến hành trên 390 bệnh nhân mắc COVID-19 mức độ trung bình. Kết quả sớm từ 60 bệnh nhân (40 bệnh nhân sử dụng Favipiravir và 20 bệnh nhân được chăm sóc chuẩn) cho thấy nhóm bệnh nhân dùng Favipiravir hạ sốt nhanh hơn (3 ngày so với 6 ngày), loại bỏ virus nhanh hơn (4 ngày so với 9 ngày) và đến ngày thứ 10, tỷ lệ RT-PCR âm tính trong nhóm này lên tới 87,5%.
Tại Nhật Bản, một báo cáo sơ bộ quan sát trên 2158 bệnh nhân COVID-19 sử dụng Favipiravir cho thấy tỷ lệ cải thiện lâm sàng sau 7 ngày điều trị là 73,8%, 66,6% và 40,1%, tương ứng với mức độ bệnh nhẹ, trung bình và nặng, trong khi sau 14 ngày, tỷ lệ này lần lượt là 87,8%, 84,5% và 60,3%. Tăng acid uric máu (15,5%) và bất thường về chức năng gan (7,4%) là những độc tính thường gặp nhất liên quan đến việc sử dụng Favipiravir. Các nghiên cứu ở Nga, Nhật Bản cho thấy tính hiệu quả và an toàn của Favipiravir trong điều trị COVID-19, đặc biệt ở nhóm bệnh nhân nhẹ – trung bình. Tuy nhiên, cần có các thử nghiệm đối chứng ngẫu nhiên lớn để chứng minh liệu thuốc này có mang lại những lợi ích lâm sàng như rút ngắn thời gian nằm viện hay giảm nhu cầu oxy không.
Paxlovid
Ngày 22/12/2021, FDA đã phê duyệt khẩn cấp Paxlovid trong điều trị COVID-19 nhẹ đến trung bình trên bệnh nhân từ 12 tuổi trở lên. Đây là thuốc kháng virus đường uống đầu tiên được FDA chấp thuận để điều trị COVID-19. Chấp thuận này dựa trên kết quả của thử nghiệm pha II/III ngẫu nhiên, mù đôi EPIC-HR. Theo đó, Paxlovid giảm được 89% nguy cơ nhập viện hoặc tử vong ở những bệnh nhân COVID-19 nguy cơ cao điều trị ngoại trú, sử dụng thuốc trong vòng 3 ngày đầu khởi phát triệu chứng. Với những bệnh nhân sử dụng thuốc trong vòng 5 ngày đầu kể từ khi có triệu chứng, nguy cơ sẽ giảm 88%. Kết quả cũng chỉ ra tải lượng virus ở ngày thứ 5 của nhóm bệnh nhân điều trị Paxlovid giảm gần 10 lần so với nhóm sử dụng placebo. Nirmatrelvir không chỉ cho thấy khả năng kháng virus nhất quán chống lại các biến thể đã được xác định trước đó (bao gồm Alpha, Beta, Delta, Gamma, Lambda và Mu) mà còn thể hiện tiềm năng ức chế 3CL protease của biến thể Omicron in vitro. Sau FDA, ngày 27/12/2021, Hàn Quốc trở thành nước thứ 2 phê duyệt khẩn cấp Paxlovid để điều trị COVID-19.
Molnupiravir
Ngày 04/11/2021, Anh trở thành quốc gia đầu tiên phê duyệt cho Molnupiravir trong điều trị bệnh nhân COVID-19. Sau đó ngày 23/12/2021, FDA đã phê duyệt khẩn cấp Molnupiravir trong điều trị COVID-19 nhẹ đến trung bình cho bệnh nhân từ 18 tuổi trở lên. Các phê duyệt này dựa trên kết quả thử nghiệm pha III MOVe-OUT trên 1433 bệnh nhân COVID-19 nhẹ và trung bình đang được điều trị ngoại trú. Theo đó, Molnupiravir giúp giảm 30% nguy cơ nhập viện hoặc tử vong ở người bệnh COVID-19 nhẹ và trung bình. Ngoài ra, dựa trên dữ liệu giải trình tự virus có được từ khoảng 40% người tham gia, Molnupiravir đã chứng minh hiệu quả nhất quán trên các biến thể virus Gamma, Delta và Mu.
Hướng dẫn sử dụng trên thế giới và tại Việt Nam
Remdesivir, Favipiravir, Molnupiravir và Paxlovid đều đã được sử dụng ở một hoặc nhiều quốc gia trên thế giới. Tại Việt Nam, các thuốc này đều chưa được Cục Quản lý dược phê duyệt nhưng được sử dụng theo Hướng dẫn chẩn đoán và điều trị COVID-19 của Bộ y tế (ngoại trừ Paxlovid do thuốc này chưa được đưa vào Hướng dẫn). Chỉ định và liều dùng của các thuốc tại các quốc gia khác nhau được tổng hợp trong Bảng 1. Một số lưu ý về tác dụng không mong muốn, chống chỉ định và thận trọng của các thuốc được trình bày trong Bảng 2.
Bảng 1. So sánh chỉ định và liều dùng của các thuốc kháng virus trong các hướng dẫn trên thế giới và tại Việt Nam
| Hoạt chất (đường dùng) | Chỉ định | Liều dùng | ||
| Trên thế giới | Tại Việt Nam | Trên thế giới | Tại Việt Nam | |
| Remdesivir 100mg (tiêm truyền tĩnh mạch) |
FDA: phê duyệt trong điều trị COVID-19 cho bệnh nhân nội trú bao gồm người lớn và trẻ em trên 12 tuổi với cân nặng không dưới 40kg (bao gồm cả bệnh nhân thở máy xâm nhập hoặc chạy ECMO). Vẫn phê duyệt khẩn cấp trên bệnh nhân trẻ em dưới 12 tuổi với cân nặng không dưới 3,5kg. EMA: phê duyệt có điều kiện trong điều trị COVID-19 ở người lớn và thanh thiếu niên từ 12 tuổi trở lên với cân nặng không dưới 40kg bị viêm phổi có chỉ định thở oxy |
BYT: bệnh nhân nội trú, mức độ trung bình và nặng, khởi phát bệnh chưa quá 10 ngày có suy hô hấp phải thở oxy, thở oxy lưu lượng dòng cao, hoặc thở máy không xâm nhập. Không nên bắt đầu sử dụng cho người bệnh COVID-19 cần thở máy xâm nhập, chạy ECMO. Với các trường hợp đã được điều trị bằng Remdesivir trước khi thở máy xâm nhập hoặc ECMO thì có thể tiếp tục dùng Remdesivir cho đủ liệu trình. |
FDA: Người ≥ 12 tuổi và cân nặng > 40kg: Ngày đầu 200mg, những ngày sau 100mg/ngày, truyền tĩnh mạch 1 lần trong 30 – 120 phút. Người < 12 tuổi hoặc cân nặng 3,5 kg – 40 kg (EUA): Ngày đầu 5 mg/kg, các ngày sau 2,5 mg/kg, truyền tĩnh mạch 1 lần trong 30 – 120 phút. Thời gian điều trị: 5 – 10 ngày (khuyến cáo 10 ngày áp dụng đối với bệnh nhân thở máy xâm nhập, hoặc chạy ECMO, hoặc bệnh nhân không cần thở máy xâm nhập hay chạy ECMO nhưng chưa có cải thiện lâm sàng sau 5 ngày). EMA: (Người ≥ 12 tuổi và cân nặng > 40kg) liều dùng tương tự FDA. Thời gian điều trị: 5 – 10 ngày |
BYT: Người ≥ 12 tuổi và cân nặng > 40kg: Ngày đầu 200mg, những ngày sau 100mg/ngày, truyền tĩnh mạch 1 lần trong 30 – 120 phút. Người < 12 tuổi hoặc cân nặng 3,5 kg – 40 kg (EUA): Ngày đầu 5 mg/kg, các ngày sau 2,5 mg/kg, truyền tĩnh mạch 1 lần trong 30 – 120 phút. Thời gian điều trị: 5 – 7 ngày. |
| Favipiravir 200mg (uống) |
Nhật Bản, Nga, Thái Lan, Ấn Độ, Saudi Arabia: bệnh nhân COVID-19 mức độ nhẹ, trung bình | BYT: bệnh nhân COVID-19 mức độ nhẹ, trung bình | Ấn Độ: Liều dùng: ngày đầu uống 1800mg/lần x 2 lần/ngày, các ngày sau uống 800 mg/lần x 2 lần/ngày. Thời gian điều trị: 2-14 ngày. Nga: Liều dùng: (Bệnh nhân dưới 75kg) ngày đầu uống 1600mg/lần x 2 lần/ngày, các ngày sau uống 600 mg/lần x 2 lần/ngày. (Bệnh nhân 75-90kg) ngày đầu uống 2000mg/lần x 2 lần/ngày, các ngày sau uống 800 mg/lần x 2 lần/ngày. Thời gian điều trị: 2-10 ngày |
BYT: Liều dùng: ngày đầu uống 1600mg/lần x 2 lần/ngày, các ngày sau uống 600 mg/lần x 2 lần/ngày Thời gian điều trị: 5 – 7 ngày |
| Molnupiravir 400mg (uống) |
FDA: phê duyệt khẩn cấp trong điều trị COVID-19 nhẹ đến trung bình trên bệnh nhân người lớn dương tính với test nhanh SARS-CoV-2, có nguy cơ cao tiến triển nặng (nhập viện và tử vong), và không tiếp cận được hoặc không phù hợp với các liệu pháp điều trị COVID-19 khác đã được FDA phê duyệt. Anh (MHRA): phê duyệt có điều kiện trong điều trị bệnh nhân COVID-19 nhẹ đến trung bình có nguy cơ tiến triển nặng từ 18 tuổi trở lên |
BYT: Theo thuyết minh đề cương thử nghiệm lâm sàng đã được phê duyệt Hướng dẫn chăm sóc sức khỏe tại nhà cho người F0 của Sở y tế TPHCM: bệnh nhân COVID-19 nhẹ |
FDA: Liều dùng: 800mg/lần x 2 lần/ngày. Thời gian điều trị: 5 ngày Anh (MHRA): Tương tự FDA. |
BYT: Theo thuyết minh đề cương thử nghiệm lâm sàng đã được phê duyệt Hướng dẫn chăm sóc sức khỏe tại nhà cho người F0 của Sở y tế TPHCM: 800mg/lần x 2 lần/ngày. Thời gian điều trị: 5 ngày |
| Paxlovid (Nirmatrelvir và ritonavir) (uống) |
FDA: phê duyệt khẩn cấp trong điều trị COVID-19 nhẹ đến trung bình trên bệnh nhân từ 12 tuổi trở lên | BYT: Chưa có | FDA: Liều dùng: 300mg Nirmatrelvir và 100mg ritonavir/lần x 2 lần/ngày. Thời gian điều trị: 5 ngày |
BYT: Chưa có |
Bảng 2. Một số thông tin lưu ý trong sử dụng các thuốc kháng virus
| Hoạt chất (đường dùng) | Chống chỉ định | Tác dụng không mong muốn |
Chú ý |
|---|---|---|---|
| Remdesivir 100mg (tiêm truyền tĩnh mạch) |
Tiền sử quá mẫn với bất kỳ thành phần nào trong công thức thuốc. Suy giảm chức năng thận (mức lọc cầu thận ước tính eGFR < 30mL/phút). Tăng enzyme ALT > 5 lần giá trị giới hạn trên của khoảng giá trị bình thường. |
Các phản ứng do quá mẫn: tụt huyết áp, buồn nôn, nôn, chảy mồ hôi; Có thể gây chậm nhịp xoang; Tăng enzyme gan: ALT có thể tăng gấp >10 lần so với trước khi sử dụng, có thể đi kèm với tổn thương gan về mặt lâm sàng; Thời gian prothrombin kéo dài. |
Không dùng Remdesivir đơn độc, cần phối hợp thêm với corticoid. Phụ nữ có thai (PNCT) và nuôi con bằng sữa mẹ: Chưa có dữ liệu đầy đủ. Không khuyến cáo trừ trường hợp lợi ích vượt trội so với nguy cơ. Không nên sử dụng Remdesivir cho PNCT trong trường hợp cho chỉ định khác. |
| Favipiravir 200mg (uống) |
PNCT, phụ nữ đang có kế hoạch có thai. < 18 tuổi Suy gan nặng, suy thận nặng Phụ nữ cho con bú |
Rối loạn trên hệ tiêu hóa. Rối loạn tâm thần. Tăng acid uric, giảm số lượng bạch cầu trung tính, tăng men gan, tăng triglycerid máu |
Chú ý ít nhất 2 ngày đầu dùng thuốc do có thể gây rối loạn tâm thần Tiền sử gout vì có thể làm tăng acid uric và làm nặng thêm bệnh |
| Molnupiravir 400mg (uống) |
Mẫn cảm với các thành phần của thuốc. | Các triệu chứng giống cúm và triệu chứng hô hấp trên, nhức đầu, đau cơ, tiêu chảy và buồn nôn | Không khuyến cáo sử dụng trên PNCT và cho con bú do chưa có dữ liệu đầy đủ |
| Paxlovid (Nirmatrelvir và ritonavir) (uống) | Sử dụng đồng thời với các thuốc chuyển hóa nhiều qua CYP3A như pethidin, piroxicam, colchicin, lovastatin, simvastatin… Sử dụng đồng thời với các thuốc cảm ứng mạnh CYP3A như phenobarbital, carbamazepin, phenytoin, St. John’s Wort… |
Rối loạn tiêu hóa, tiêu chảy, tăng huyết áp đau cơ | Không khuyến cáo sử dụng trên bệnh nhân suy thận nặng hoặc suy gan nặng. Chưa có dữ liệu đầy đủ trên PNCT và cho con bú. Paxlovid có thể làm giảm hiệu quả của các thuốc tránh thai. |
Kết luận
Remdesivir, Favipiravir, Molnupiravir đều là các thuốc kháng virus phổ rộng, khi vào trong cơ thể chuyển hóa thành dạng có hoạt tính tác động trực tiếp đến ARN polymerase, còn Paxlovid (Nirmatrelvir [PF-07321332], ritonavir) ức chế Enzym Protease, kết quả là ngăn cản quá trình nhân lên của virus. Remdesivir được sử dụng qua đường tĩnh mạch và là thuốc duy nhất được cả FDA và EMA phê duyệt trong điều trị COVID-19. Trong khi đó, ba thuốc còn lại đều sử dụng qua đường uống, 2 trong 3 thuốc (Paxlovid và Molnupiravir) đã được FDA phê duyệt khẩn cấp, còn Favipiravir cũng đã được cấp phép sử dụng tại Nga, Ấn Độ và sử dụng rộng rãi ở một số quốc gia. Mặc dù vậy, chúng ta vẫn cần thêm các dữ liệu nghiên cứu để khẳng định tính hiệu quả và an toàn của các thuốc, đặc biệt trên các đối tượng bệnh nhân suy gan, suy thận hay phụ nữ có thai.
Tài liệu tham khảo
- Bộ Y tế, Quyết định số 4689/QĐ-BYT về Hướng dẫn chẩn đoán và điều trị COVID-19 ban hành ngày 06/10/2021.
- Bộ Y tế, Quyết định số 5666/QĐ-BYT về việc sửa đổi, bổ sung một số điểm của Hướng dẫn chẩn đoán và điều trị COVID-19 ban hành ngày 12/12/2021.
- Cassandra Willyard. How antiviral pill Molnupiravir shot ahead in the COVID drug hunt. Nature (2021). https://www.nature.com/articles/d41586-021-02783-1.
- EMA (2020). Veklury (Remdesivir) product information. https://www.ema.europa.eu/en/documents/other/veklury-product-information-approved-chmp-25-june-2020-pending-endorsement-european-commission_en.pdf
- FDA (2020). Veklury (Remdesivir) full prescription information. https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/214787Orig1s000lbl.pdf
- FDA (2021). Fact sheet for healthcare providers: emergency use authorization for Molnupiravir.
- FDA (2020). Fact sheet for healthcare providers emergency use authorization (EUA) of Veklury® (Remdesivir) for hospitalized pediatric patients weighing 3.5 kg to less than 40 kg or hospitalized pediatric patients less than 12 years of age weighing at least 3.5 kg.
- FDA (2021). Fact sheet for healthcare providers: emergency use authorization for Paxlovid.
- FDANEWS (2020). Favipiravir Earns Temporary Approval in Russia. https://www.fdanews.com/articles/197395-Favipiravir-earns-temporary-approval-in-russia.
- Glenmark (2020). Unlocking the treatment for mild to moderate covid-19 in India. https://www.glenmarkpharma.com/sites/default/files/Glenmark-FabiFlu-Press-Brief.pdf.
- Kaiming Tao, Philip L. Tzou et al. SARS-CoV-2 antiviral therapy. Clinical microbiology reviews (2021).
- Merck (2021). Merck and Ridgeback’s Investigational Oral Antiviral Molnupiravir Reduced the Risk of Hospitalization or Death by Approximately 50 Percent Compared to Placebo for Patients with Mild or Moderate COVID-19 in Positive Interim Analysis of Phase 3 Study.
- Merck (2021). Merck and Ridgeback Biotherapeutics Provide Update on Results from MOVe-OUT Study of Molnupiravir, an Investigational Oral Antiviral Medicine, in At Risk Adults With Mild-to-Moderate COVID-19.
- MHRA (2021). First oral antiviral for COVID-19, Lagevrio (Molnupiravir), approved by MHRA.
- Munetaka Ueda, Tetsuya Tanimoto et al. Japan’s Drug Regulation During the COVID-19 Pandemic: Lessons From a Case Study of Favipiravir. Clinical pharmacology & therapeutics (2021). https://ascpt.onlinelibrary.wiley.com/ doi/10.1002/cpt.2251.
- NIH. Remdesivir. COVID-19 treatment guidelines. https://www.covid19treatment guidelines.nih.gov/therapies/antiviral therapy/Remdesivir/. Truy cập ngày 27/10/2021.
- Pfizer (2021). Pfizer Receives U.S. FDA Emergency Use Authorization for Novel COVID-19 Oral Antiviral Treatment.
- Robert L. Gottlieb, M.D., Ph.D., Carlos E. Vaca, M.D. et al. Early Remdesivir to Prevent Progression to Severe Covid-19 in Outpatients. NEJM (2021). https://www.nejm.org/doi/full/10.1056/NEJMoa2116846
- Shashank Joshi, Jalil Parkar et al. Role of Favipiravir in the treatment of COVID-19. International journal of infectious diseases (2021). https://www.ijidonline. com/article/S1201-9712(20)32273-6/fulltext.
- WHO (2020). WHO recommends against the use of Remdesivir in COVID-19 patients. https://www.who.int/news-room/feature-stories/detail/who-recommends-against-the-use-of-Remdesivir-in-covid-19-patients.