Bệnh Nhi khoa, Bệnh tim mạch
CÁC KHÍA CẠNH DI TRUYỀN CỦA BỆNH TIM BẨM SINH
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết CÁC KHÍA CẠNH DI TRUYỀN CỦA BỆNH TIM BẨM SINH – Tải file PDF Tại đây.
Tác giả: Bác sĩ Vũ Tài
GIỚI THIỆU
Trong gần 4 thập kỷ, việc đánh giá di truyền của bệnh tim bẩm sinh (CHD) chỉ có thể được đánh giá bằng nhiễm sắc thể đồ thông thường, chủ yếu cho biết các bất thường về số lượng nhiễm sắc thể (ví dụ, trisomy 21) và bằng cách mô tả các tình trạng hội chứng ở trẻ sơ sinh mắc CHD và các dị tật ngoài tim liên quan ( ví dụ, hội chứng Holt-Oram, hội chứng DiGeorge). Hơn nữa, mối liên quan của CHD với các bất thường di truyền bị đánh giá thấp, và được cho là khoảng từ 10% đến 15% (1), với phần lớn các khiếm khuyết được cho là do các nguyên nhân đa yếu tố. Sự ra đời nhanh chóng của các công nghệ di truyền mới trong hai thập kỷ qua đã cho phép giải mã bộ gen người và giúp hiểu rõ hơn và phân loại nhiều dị tật. Các kỹ thuật microarray cho phép đánh giá các biến thể số lượng bản sao (CNV) mà không quan sát được dưới kính hiển vi. Ngoài microarray, việc sử dụng ngày càng nhiều giải trình tự nhắm mục tiêu (bảng gen các bệnh tim) và giải trình tự toàn bộ exome (WES) hoặc giải trình tự toàn bộ bộ gen (WGS) đã cho thấy mối liên quan cao hơn giữa CHD với các bất thường di truyền, theo thứ tự là 30% của các trường hợp (2). Trong thập kỷ qua, một số nghiên cứu di truyền đã được thực hiện trên một nhóm lớn trẻ em mắc CHD đã xác định được một loạt các gen mới chịu trách nhiệm cho các dị tật tim không do nhiễm sắc thể (3,4). Những khám phá này sẽ giúp điều chỉnh các xét nghiệm di truyền với sự hiểu biết tốt hơn về các gen gây ra dị tật tim, do đó nâng cao khả năng tư vấn cho bệnh nhân. Lĩnh vực di truyền tim mạch người đang tiến triển với tốc độ nhanh chóng, và các xét nghiệm di truyền mới cho các dạng bất thường tim khác nhau thường xuyên được ứng dụng vào trong lâm sàng. Trong chương này, trước tiên chúng ta sẽ thảo luận về các nguyên lý của các kỹ thuật di truyền hiện có và sau đó mở rộng về ba nhóm bất thường di truyền chính sau đây: (1) lệch bội nhiễm sắc thể được phát hiện bằng nhiễm sắc thể đồ thông thường, (2) mất đoạn và lặp đoạn được phát hiện bằng phân tích microarray, và (3) các khiếm khuyết đơn gen được phát hiện thông qua bảng gen các bệnh tim hoặc giải trình tự exome.
Phân tích nhiễm sắc thể và nhiễm sắc thể đồ thông thường
Phân tích nhiễm sắc thể được thực hiện trên các tế bào nuôi cấy được xử lý để ngừng tăng trưởng ở kỳ giữa, khi đó các nhiễm sắc thể được nhìn thấy. Kỹ thuật nhuộm băng đặc biệt (thường là băng G) được sử dụng để xác định các nhiễm sắc thể riêng biệt theo dạng băng tối và băng sáng đặc hiệu của chúng. Việc phân tích được thực hiện dưới kính hiển vi và các nhiễm sắc thể được phân loại thành bảy nhóm, từ A đến G, dựa trên chiều dài và vị trí tâm động của chúng. Danh pháp chỉ tâm động là “cen” và telomere (cấu trúc đầu mút) là “ter.” Nhánh ngắn của mỗi nhiễm sắc thể được ký hiệu là “p” (nhỏ) và nhánh dài là “q” (lớn). Mỗi nhánh được chia thành một số băng và dưới băng.
Kỹ thuật nhiễm sắc thể đồ truyền thống này xác định phần lớn (> 75%) các bất thường nhiễm sắc thể có ý nghĩa lâm sàng bao gồm trisomy 21, 18 và 13, thể tam bội và lệch bội liên quan đến nhiễm sắc thể giới tính, chẳng hạn như đơn bội X (hội chứng Turner) và XXY (hội chứng Klinefelter). Với kính hiển vi quang học, các chuyển đoạn cân bằng hoặc không cân bằng lớn cũng có thể được chẩn đoán ngoài các trisomy dạng khảm hiếm gặp và các nhiễm sắc thể bất thường về mặt cấu trúc. Cũng có thể xác định được mất đoạn nhiễm sắc thể lớn (> 5-10 triệu cặp base [MB]), chẳng hạn như phần lớn các trường hợp mất đoạn 4p- (hội chứng Wolf Hirschhorn) hoặc mất đoạn 5p- (hội chứng Cri-du-Chat). Các mất đoạn nhỏ, được gọi là vi mất đoạn, chẳng hạn như vi mất đoạn 22q11.2 (hội chứng DiGeorge; sẽ được thảo luận ở phần sau), thường quá nhỏ để có thể xác định được bằng phương pháp này. Các vi mất đoạn có thể được phát hiện bằng cách sử dụng phương pháp lai tại chỗ phát huỳnh quang chọn lọc (FISH) khi nghi ngờ các tình trạng như vậy (ví dụ: FISH đối với mất đoạn 22q11.2 trong bất thường thân nón) hoặc kiểm tra toàn bộ nhiễm sắc thể bằng phương pháp lai so sánh bộ gen (CGH) ( microarray; sẽ thảo luận ở phần sau).
Kỹ thuật FISH
FISH là một kỹ thuật di truyền tế bào sử dụng các đầu dò huỳnh quang đặc hiệu, được áp dụng để phát hiện và xác định vị trí có hoặc không có các vùng ADN đặc hiệu trên nhiễm sắc thể. FISH sử dụng một sợi ADN đơn, được gọi là đầu dò, tương ứng với một locus cụ thể và chỉ gắn với phần bổ sung tương ứng trên nhiễm sắc thể. Chất huỳnh quang với nhiều màu sắc khác nhau được sử dụng để có thể quan sát dưới kính hiển vi huỳnh quang. FISH có thể được ứng dụng trực tiếp trên các tế bào đang trong quá trình phân chia, và thường được áp dụng trước sinh để chẩn đoán nhanh trisomy. Kỹ thuật FISH được sử dụng để xác định các vi mất đoạn cũng được thực hiện trực tiếp trên các nhiễm sắc thể ở kỳ giữa với việc bổ sung thêm các đầu dò FISH. Nhìn chung, hai đầu dò được sử dụng. Đầu dò thứ nhất (màu xanh lục) là đầu dò đối chứng được sử dụng để xác định cả hai bản sao của nhiễm sắc thể mục tiêu. Đầu dò thứ hai (màu đỏ tươi) lai với trình tự của vùng quan tâm trên nhiễm sắc thể mục tiêu. Khi có mất đoạn, thường xảy ra trên một NST trong cặp NST, ghi nhận tình trạng thiếu tín hiệu màu đỏ, vì đầu dò không thể gắn với vùng mục tiêu trên nhiễm sắc thể. Khi một bất thường tim cụ thể được chẩn đoán ở thai nhi và một thủ thuật xâm lấn được thực hiện, người ta thường xét nghiệm FISH để kiểm tra vi mất đoạn 22q11.2 ngoài nhiễm sắc thể đồ.
Array CGH (Microarray) và CNV
Array CGH, hoặc microarray, là một kỹ thuật rất nhạy, so sánh ADN của bệnh nhân (bao gồm tất cả các nhiễm sắc thể) với một mẫu ADN đối chứng, để xác định sự khác biệt giữa hai bộ NST. Sự mất cân bằng trong ADN của bệnh nhân, được gọi là CNV bao gồm giảm (mất đoạn) và tăng (lặp đoạn) và có thể được xác định bằng kỹ thuật này. Thay vì kiểm tra một mất đoạn, chẳng hạn như với FISH, tất cả các vùng có thể có của nhiễm sắc thể được kiểm tra để tìm mất đoạn và lặp đoạn. Giải thích về các khía cạnh kỹ thuật của CGH nằm ngoài phạm vi của cuốn sách này, nhưng điều quan trọng đó là CGH phát hiện sự mất cân bằng ADN trong các nhiễm sắc thể trên một kích thước nhất định (ví dụ: ngưỡng 50 Kb), một số trong số đó có thể có ý nghĩa lâm sàng không rõ ràng. Trong vài năm gần đây, kỹ thuật microarray này đã trở nên phổ biến mặc dù có giá thành cao và những hạn chế của nó. Một số trung tâm cung cấp CGH như một lựa chọn đầu tay để kiểm tra di truyền sau khi sinh thiết gai nhau hoặc chọc ối, trong khi những trung tâm khác hạn chế sử dụng CGH khi nghi ngờ sự mất cân bằng ADN hoặc như một xét nghiệm hàng thứ hai sau khi phân tích nhiễm sắc thể đồ bình thường. Trong một phân tích gộp của Jansen và cộng sự (5), cho thấy rằng đối với các dị tật tim thai, CGH phát hiện thêm 7% các bất thường nhiễm sắc thể sau khi loại trừ lệch bội và mất đoạn 22q11.2. Với phát hiện này, việc thảo luận về lựa chọn CGH cho bệnh nhân mắc dị tật, đặc biệt là CHD, sẽ trở nên hợp lý. Tính sẵn có và chi phí của CGH cũng nên được tính vào quyết định này.
Giải trình tự thế hệ mới, giải trình tự Exome và các khiếm khuyết đơn gen
Cho đến gần đây, việc tìm kiếm bản đồ di truyền cho một khiếm khuyết đơn gen chỉ được giới hạn trong các gia đình có một số anh chị em bị ảnh hưởng bởi một khiếm khuyết gen đã biết. Với sự phát triển nhanh chóng của các xét nghiệm di truyền, đặc biệt với những tiến bộ trong giải trình tự ADN, (các) khiếm khuyết gen trong nhiều bệnh di truyền lâm sàng đã được xác định và hiện có thể được xét nghiệm trong vòng vài ngày. Kỹ thuật này thường được gọi là giải trình tự thế hệ mới (NGS) hoặc giải trình tự song song hàng loạt để nhấn mạnh rằng nó là mới và nhanh chóng, so với giải trình tự Sanger trước đó (giải trình tự thế hệ đầu tiên), chỉ cho phép phân tích một vùng gen cụ thể và tốn nhiều thời gian hơn. Sự ra đời của NGS với giá cả phải chăng và nhanh chóng đã tạo ra một cuộc cách mạng về di truyền các dị tật ở người và dẫn đến sự hiểu biết tốt hơn về các con đường bệnh sinh của nhiều loại bệnh. Một số dị tật trước đây được coi là các thực thể riêng biệt nay đã được phân loại lại thành các nhóm dị tật với các đặc điểm lâm sàng và di truyền chung. Ví dụ, hội chứng Noonan (được thảo luận ở phần sau của chương này), được coi là một hội chứng di truyền riêng biệt, hiện thuộc về một nhóm hội chứng di truyền được gọi là RASopathies, và bao gồm các khiếm khuyết trong 17 gen. Một nhóm hội chứng di truyền khác hiện được gọi là ciliopathies và có điểm chung là các đột biến gen liên quan đến sự phát triển và chức năng của nhung mao. Trong thập kỷ qua, các nghiên cứu di truyền trên trẻ em và thai nhi mắc CHD đã làm sáng tỏ căn nguyên của CHD trong nhiều tình trạng.
Xét nghiệm trước sinh không xâm lấn
Xét nghiệm trước sinh không xâm lấn (NIPT) là một xét nghiệm di truyền được cung cấp như một xét nghiệm sàng lọc trong tam cá nguyệt thứ nhất và thứ hai của thai kỳ để tìm các trisomy 21, 13 và 18, monosomy X và các bất thường nhiễm sắc thể giới tính. Xét nghiệm này dựa trên sự hiện diện của ADN tự do của thai nhi (cfADN) trong tuần hoàn mẹ, chủ yếu từ quá trình chết theo chương trình của tế bào nhau thai (6). Quá trình chết theo chương trình của tế bào nhau thai giải phóng vào tuần hoàn của mẹ những đoạn ADN nhỏ có thể được phát hiện từ khoảng tuần thứ 4 đến tuần thứ 7 của thai kỳ (7). Người ta ước tính rằng khoảng 2% đến 20% cfADN lưu hành trong tuần hoàn mẹ có nguồn gốc từ thai nhi (7). Thời gian bán hủy của cfADN ngắn và thường không thể phát hiện được trong vòng vài giờ sau sinh (8). Chi tiết về các khía cạnh kỹ thuật của NIPT nằm ngoài phạm vi của cuốn sách này, nhưng các xét nghiệm khác nhau sẵn có trên lâm sàng dựa trên việc phân lập và đếm số lượng cfADN bằng phương pháp giải trình tự.
NIPT có hiệu suất rất tốt trong việc sàng lọc trisomy 21. Trong các nghiên cứu đã được công bố, tỷ lệ phát hiện trisomy 21 là 99% với tỷ lệ dương tính giả là 0,16% (9). Tỷ lệ phát hiện trisomy 18 là 97% trong khi tỷ lệ dương tính giả là 0,15% (9). Cho đến nay, NIPT được khuyến cáo là xét nghiệm sàng lọc cho các nhóm dân số có nguy cơ cao. Với tỷ lệ dương tính giả rất thấp, tích hợp NIPT để sàng lọc trisomy 21 ở các nhóm dân số có nguy cơ cao sẽ giảm nhu cầu xét nghiệm xâm lấn không cần thiết. Gần đây, xét nghiệm mất đoạn 22q11.2 đã được đưa vào trong NIPT và cho thấy độ nhạy từ 70% đến 75% với độ đặc hiệu là 99,5% (10).
Cần nhấn mạnh rằng NIPT là một xét nghiệm sàng lọc chứ không phải xét nghiệm chẩn đoán, và do đó, nên thận trọng khi sử dụng NIPT trong việc đánh giá di truyền của CHD. Do mối liên quan tương đối cao của CHD với sự mất cân bằng nhiễm sắc thể, nên giải thích ý nghĩa của kết quả NIPT bình thường trong trường hợp thai nhi mắc CHD cho bệnh nhân và nên làm thêm xét nghiệm chẩn đoán xâm lấn. Công nghệ NIPT hiện đang được mở rộng để cho phép sàng lọc các trường hợp mất đoạn và lặp đoạn nhiễm sắc thể. Các tác giả tin rằng xét nghiệm chẩn đoán xâm lấn phù hợp hơn trong trường hợp mắc CHD do có mối liên quan cao với bất thường di truyền. Tư vấn di truyền không định hướng là rất quan trọng trong trường hợp này để cung cấp một danh sách toàn diện về các lựa chọn cho gia đình khi đối mặt với chẩn đoán CHD trước sinh.
SIÊU ÂM ĐÁNH GIÁ THAI NHI MẮC CHD KHI NGHI NGỜ BỆNH LÝ DI TRUYỀN
Việc phát hiện CHD trước sinh ở thai nhi đòi hỏi phải siêu âm đánh giá chi tiết, do có mối liên quan cao giữa CHD với các dị tật ngoài tim, dao động từ 30% đến 50% trong một số loạt ca bệnh. Xác định xem liệu CHD là đơn độc hay là một phần của hội chứng di truyền là điều rất cần thiết để tư vấn cho bệnh nhân và đánh giá tiên lượng lâu dài. Trong những trường hợp hiếm, loại CHD tự nó cung cấp đủ thông tin về các mối liên quan, hoặc không có chúng cũng cho phép tư vấn cho bệnh nhân. Ví dụ về điều này là đối với u cơ vân tim và mối liên quan của chúng với phức hợp xơ cứng củ (TSC) hoặc chuyển vị đại động mạch đơn giản đơn độc là rất phổ biến. Tuy nhiên, đối với hầu hết các CHD, có rất nhiều mối liên quan có thể có và do đó cần đánh giá thai nhi chi tiết. Thông thường, bước đầu tiên trong đánh giá siêu âm là tìm kiếm các “marker soft” và / hoặc dị tật ngoài tim mà gợi ý sự hiện diện của một trong những bất thường số lượng nhiễm sắc thể phổ biến có thể được phát hiện bằng nhiễm sắc thể đồ. Hơn nữa, siêu âm đánh giá thai chi tiết là điều cần thiết cùng với tìm kiếm kỹ lưỡng các dấu hiệu của các hội chứng di truyền liên quan. Điều này chỉ có thể đạt được nếu người khám nhận thức được các mối liên quan khác nhau và các khía cạnh kiểu hình của các hội chứng khác nhau. Trong trường hợp nhiễm sắc thể đồ thai nhi bình thường, nên thảo luận với bệnh nhân về lợi ích của xét nghiệm di truyền bổ sung. Có sẵn các bảng về các mối liên quan khác nhau của CHD với các bất thường di truyền và có hướng dẫn quản lý lâm sàng có tính chất truyền thống trong những trường hợp như vậy. Sự hiện diện các dấu hiệu kín đáo trên siêu âm có thể giúp cho người khám xác định được mối liên quan di truyền mà nếu không có dấu hiệu kín đáo đó thì có thể hoàn toàn không quan sát thấy. Tứ chứng Fallot (TOF) là một ví dụ điển hình vì nó có thể xảy ra đơn độc, nhưng cũng thường liên quan với trisomy 21 và 18, mất đoạn 22q11.2, hội chứng Alagille, hội chứng CHARGE, và những hội chứng khác. Một ví dụ khác là sự hiện diện của kênh nhĩ thất (AVSD), có liên quan với trisomy 21 hoặc 18 trong hơn 50% trường hợp, nhưng cũng có thể là một phần của hội chứng đồng dạng (Chương 41), hoặc đơn độc hoặc trong bệnh cảnh rối loạn vận động nhung mao nguyên phát. AVSD cũng được quan sát thấy trong mất đoạn 22q11.2 và các mất đoạn khác, cũng như trong hội chứng CHARGE (13%) (11).
==>> Xem thêm: Một số biến chứng cần lưu ý sau phẫu thuật tim bẩm sinh
CHD VÀ BÁT THƯỜNG SỐ LƯỢNG NHIỄM SẮC THỂ
Tần suất bất thường nhiễm sắc thể ở trẻ mắc CHD được ước tính từ 5% đến 15% từ dữ liệu sau khi sinh (1,12,13). Trong một nghiên cứu bệnh chứng dựa trên dân số bao gồm 2102 trẻ sinh sống, được xác định bởi dị tật tim mạch của chúng, các bất thường về nhiễm sắc thể được phát hiện ở 13% trường hợp(1). Trong nghiên cứu này, hội chứng Down xảy ra ở 10,4% trẻ bị dị tật tim mạch, với các trisomy khác, mỗi loại xảy ra < 1% trường hợp (1). Dữ liệu tương tự đã được báo cáo từ ba cơ quan đăng ký lớn về dị tật bẩm sinh, bao gồm 1,27 triệu ca sinh (13). Tần suất nhiễm sắc thể đồ bất thường ở thai nhi bị dị tật tim cao hơn và đã được báo cáo dao động từ 30% đến 40% bởi một số nghiên cứu (14-16). Tỷ lệ bất thường nhiễm sắc thể cao hơn ở thai nhi bị dị tật tim khi so sánh với thai nhi sinh sống ở nhóm chứng, chủ yếu là do tăng tỷ lệ tử vong trước sinh ở thai nhi lệch bội, ước tính là 30% đối với trisomy 21, 42% đối với trisomy 13, 68% đối với trisomy 18 và 75% đối với hội chứng Turner (17). Hãy nhớ rằng các nghiên cứu trước đó đã báo cáo nhiều trường hợp CHD với nhiều dị tật về cấu trúc hơn, điều này có thể làm gia tăng mối liên quan về di truyền. Không chỉ là mối liên quan của các dị tật tim bẩm sinh và bất thường nhiễm sắc thể ở trẻ sinh sống thấp hơn so với thai nhi, mà sự phân bố của các bất thường nhiễm sắc thể cũng lệch về phía hội chứng Down ở quần thể sơ sinh (1,13), một lần nữa có thể là do tỷ lệ tử vong trước sinh cao của trisomy 18 và 13 và mono X.
Một số chẩn đoán tim cụ thể thường liên quan với bất thường nhiễm sắc thể hơn những chẩn đoán khác. Các nghiên cứu trước sinh và sau sinh phù hợp với các chẩn đoán tim cụ thể có nhiều khả năng liên quan với bất thường nhiễm sắc thể.
Nhìn chung, dị tật bên phải tim ít liên quan đến bất thường nhiễm sắc thể đồ. Mặt khác, AVSD, thông liên thất (quanh màng) (VSD) và thông liên nhĩ (ASD), TOF, thất phải hai đường ra (DORV) và hội chứng thiểu sản tim trái (HLHS), thường liên quan với bất thường nhiễm sắc thể ở thai nhi và trẻ sơ sinh. Bảng 2.1 liệt kê các chẩn đoán tim cụ thể ở trẻ nhỏ mắc các dị tật tim mạch không phức tạp từ ba cơ quan đăng ký lớn (13) và tỷ lệ mắc mới tương ứng của các bất thường số lượng nhiễm sắc thể số liên quan.
Phần lớn thai nhi bị dị tật tim và bất thường nhiễm sắc thể có các bất thường ngoài tim kèm theo khác, theo thứ tự từ 50% đến 70% (14,16). Sự phân bố của các bất thường ngoài tim thường theo dạng điển hình được ghi nhận trong mỗi hội chứng nhiễm sắc thể mà không có bất kỳ bất thường cụ thể nào chiếm ưu thế. Ở thai nhi mắc CHD rõ ràng là đơn độc, tỷ lệ bất thường nhiễm sắc thể vẫn tăng đáng kể (15%-30%) và do đó cần tư vấn di truyền thích hợp (14,16). Khi đưa ra chẩn đoán bất kỳ bất thường nào trong xét nghiệm di truyền ở thai nhi, siêu âm tim sẽ được chỉ định dựa trên mối liên quan có thể có của các dị tật tim.
Trong các phần sau, chúng ta sẽ thảo luận về các lệch bội phổ biến hơn được phát hiện có liên quan với CHD ở thai nhi.
Hội chứng Down (Trisomy 21)
Định nghĩa bệnh
Hội chứng Down là do sự hiện diện của 3 bản sao của nhiễm sắc thể 21. Đây là bất thường nhiễm sắc thể phổ biến nhất ở người với tỷ lệ xuất hiện trung bình là 1: 500 trong dân số chung. Vì 30% thai nhi mắc trisomy 21 chết trong tử cung, tỷ lệ hiện mắc trong thai kỳ cao hơn so với lúc sinh. Trong 95% trường hợp, trisomy 21 là do xảy ra lỗi trong quá trình giảm phân của mẹ, tăng theo tuổi mẹ, trong khi 5% còn lại là do chuyển đoạn không cân bằng, không phụ thuộc vào tuổi của bố và có thể có nguồn gốc từ mẹ hoặc bố. Những người bị trisomy 21 có các đặc điểm lâm sàng riêng biệt liên quan đến chậm phát triển trí tuệ ở các mức độ khác nhau. Cũng có thể có các bất thường về cấu trúc và miễn dịch.
Chẩn đoán di truyền
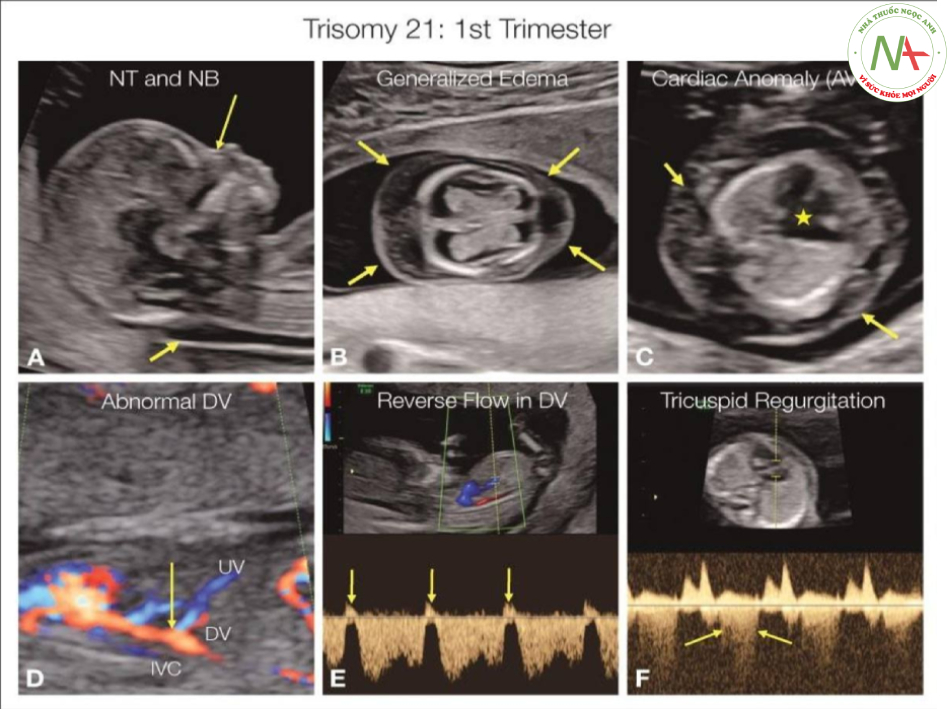
Chẩn đoán di truyền có thể đạt được trước sinh trên mô thai nhi thu thập từ chọc ối, simh thiết gai nhau, hoặc lấy mẫu máu thai nhi. Chẩn đoán di truyền thông qua nhiễm sắc thể đồ với kỹ thuật băng G. Kỹ thuật FISH thường được dùng để nhanh chóng xác nhận chẩn đoán. Trisomy 21 cũng có thể được nghi ngờ với xét nghiệm sàng lọc NIPT với độ chính xác cao (99%). Trên siêu âm trước sinh, sự hiện diện của các bất thường cấu trúc tim và ngoài tim đặc trưng, cũng như các soft marker, có thể gợi ý rất nhiều đến sự hiện diện của trisomy 21 (Bảng 2.1) (Hình 2.1 đến 2.4).
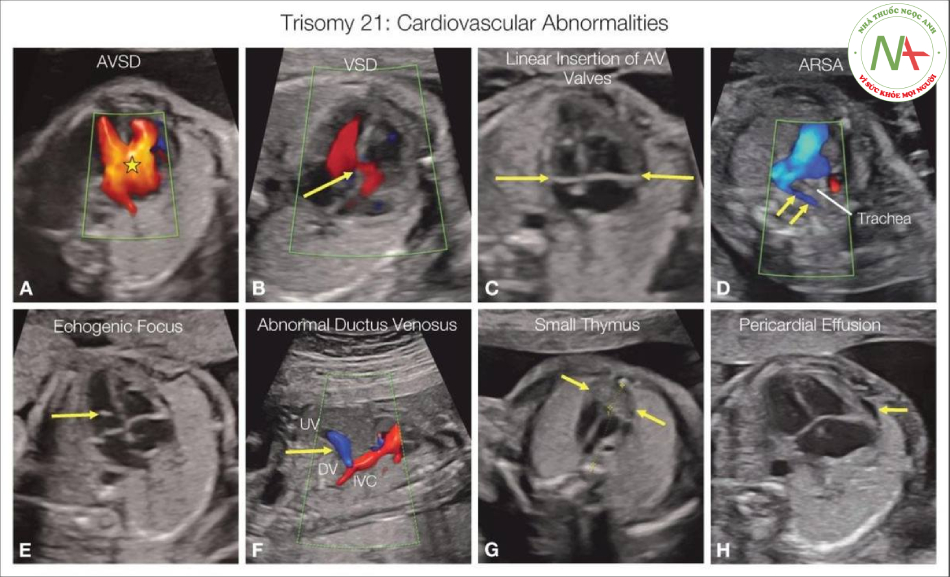
Các bất thường tim mạch ở thai nhi trisomy 21 thường bao gồm kênh nhĩ thất (AVSD) (dấu sao A), thông liên thất (VSD) (mũi tên B), van nhĩ thất cắm thẳng hàng với khiếm khuyết tim (mũi tên C), động mạch dưới đòn phải lạc chỗ (ARSA) (mũi tên D), với đường đi của động mạch phía sau khí quản, nốt tăng âm trong tim (mũi tên E), tĩnh mạch rốn (UV) có đường đi bất thường với không có ống tĩnh mạch hoặc ống tĩnh mạch (DV) có kết nối bất thường (mũi tên F). Tuyến ức (mũi tên G) có thể nhỏ ở những thai nhi mắc trisomy 21 với tỷ lệ tuyến ức-lồng ngực nhỏ. Dịch màng ngoài tim (mũi tên H) cũng có thể được thấy ở thai nhi trisomy 21 kèm theo dị tật tim.
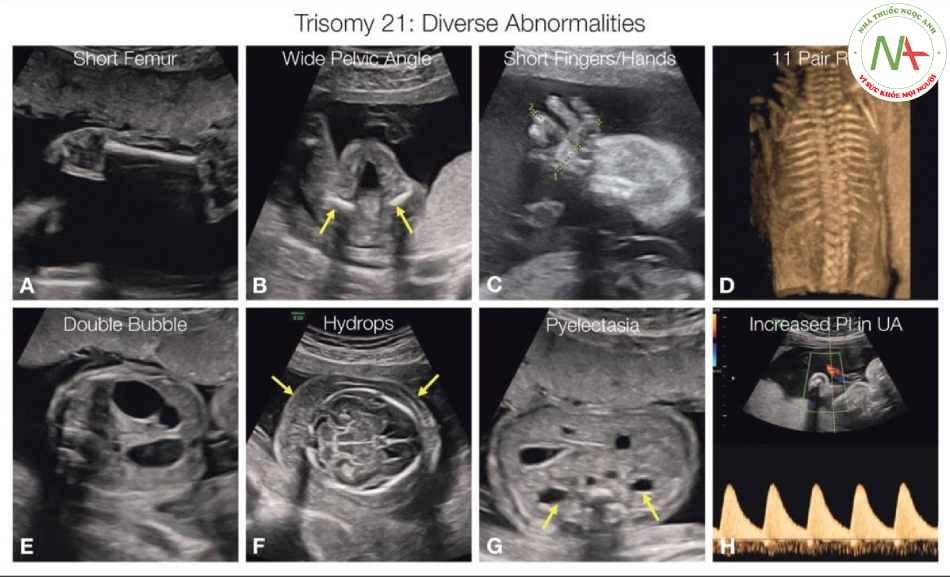
Thai nhi trisomy 21 có thể có các bất thường đa dạng bao gồm cả hệ xương, chẳng hạn như xương đùi ngắn (A), góc chậu rộng (mũi tên B), bàn tay và ngón tay ngắn kèo theo vẹo ngón (C) và xương sườn 11 đôi (D). Các bất thường khác đôi khi được phát hiện bao gồm tắc tá tràng như bóng đôi (E), phù thai (mũi tên F), cho thấy ở đây là phù da đầu, giãn bể thận (mũi tên G) và đôi khi (H) tăng chỉ số xung (PI) trong Doppler động mạch rốn (UA) với Doppler tử cung bình thường (không hiển thị).
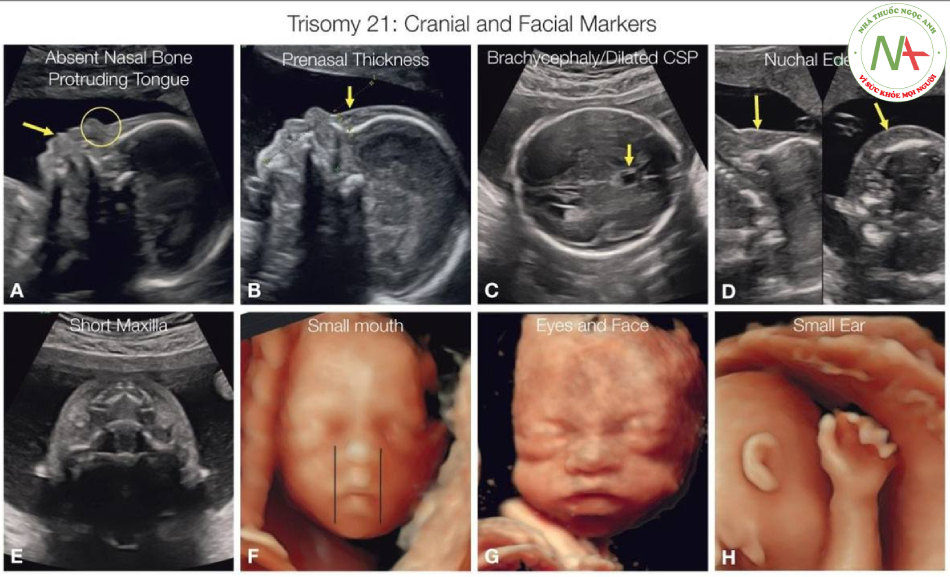
Các dấu hiệu sọ và mặt ở thai nhi trisomy 21 bao gồm không có xương mũi (hình tròn-A), lưỡi nhô ra với miệng mở (mũi tên A), dày da trước mũi (mũi tên B), đầu ngắn (C), giãn hộp vách trong suốt (CSP)) (mũi tên C), phù da gáy (mũi tên D), thấy ở mặt cắt dọc (D-trái) hoặc ngang (D-phải). Thiểu sản giữa mặt trong trisomy 21 có liên quan đến xương hàm trên ngắn (E) và miệng nhỏ (F). Các đặc điểm trên khuôn mặt của trisomy 21 có thể phát hiện được trên siêu âm 3D và được hiển thị trong hình G. Tai nhỏ (H) cũng có thể được phát hiện nhưng rất không đặc hiệu.
Các dấu hiệu ở tim
Các dấu hiệu trên tim ở thai nhi trisomy 21 có ở hơn 50% trường hợp và bao gồm AVSDs, VSD (buồng nhận hoặc quanh màng), TOF và các dị tật ít phổ biến khác (Ebstein, DORV, hẹp eo động mạch chủ [CoA], v.v.) (Hình 2.2). Ngoài ra, các biến thể / dấu hiệu giải phẫu ở ngực có thể có liên quan đến trisomy 21 và bao gồm động mạch dưới đòn phải lạc chỗ, nốt tăng âm trong tim, van nhĩ thất cắm thẳng hàng, tràn dịch màng ngoài tim, hở van ba lá, và những dấu hiệu khác. Hình 2.2 cho thấy các ví dụ về dấu hiệu trên tim ở một số thai nhi bị trisomy 21.
Các dấu hiệu ngoài tim
Các dị tật cấu trúc như teo tá tràng hoặc thực quản ở trisomy 21 đôi khi được phát hiện (Hình 2.3), nhưng ít phổ biến hơn nhiều so với các biến thể giải phẫu (Hình 2.4). Các dấu hiệu giải phẫu liên quan đến trisomy 21 rất phổ biến và có thể thấy trong một số hệ thống cơ quan, bao gồm hệ bạch huyết, xương, não, mặt, thận, bụng và nhau thai / nước ối. Bảng 2.2 liệt kê các dấu hiệu siêu âm phổ biến liên quan đến trisomy 21. Phần lớn thai nhi bị trisomy 21 (> 90% trường hợp) có thể được phát hiện ở tuổi thai sớm, bằng xét nghiệm sàng lọc di truyền 3 tháng đầu (Hình 2.1), bao gồm tuổi mẹ, đo khoảng sáng sau gáy (NT) và các dấu ấn sinh hóa. Khảo sát giải phẫu chi tiết trong ba tháng đầu thai kỳ cũng có thể cải thiện việc phát hiện trisomy 21. Để biết thêm chi tiết, hãy tham khảo cuốn sách của tác giả về siêu âm ba tháng đầu thai kỳ (18).
Hội chứng Edwards (Trisomy 18)
Định nghĩa bệnh
Hội chứng Edwards là do sự hiện diện của ba bản sao nhiễm sắc thể 18. Đây là trisomy nhiễm sắc thể thường phổ biến hàng thứ hai ở người, sau trisomy 21. Trisomy 18 xảy ra ở khoảng 1: 4000 trẻ sinh sống, nhưng trước sinh tỷ lệ này cao hơn nhiều vì trên 60% thai nhi bị trisomy 18 chết trong tử cung. Trong hầu hết các trường hợp, cơ chế bệnh sinh di truyền là do sự không phân chia trong quá trình giảm phân của mẹ, trong khi một số ít trường họp (5%) có thể do chuyển đoạn không cân bằng. Hầu hết trẻ sơ sinh bị trisomy 18 chết trong vòng vài ngày hoặc vài tuần sau khi sinh, do bất thường tại tim và ngoài tim và suy chậm tăng trưởng. Rất ít trường hợp sống được vài tháng.
Chẩn đoán di truyền
Trisomy 18 chủ yếu được chẩn đoán trước sinh dựa vào nhiễm sắc thể đồ, tương tự như trisomy 21. Trisomy 18 cũng có thể bị nghi ngờ cao trên NIPT với độ chính xác cao nhung cần xác nhận chẩn đoán bằng xét nghiệm xâm lấn. Trên siêu âm, trisomy 18 có thể bị nghi ngờ nhiều do có nhiều bất thường cấu trúc tại tim và ngoài tim kèm theo thai giới hạn tăng trưởng.
Các phát hiện ở tim
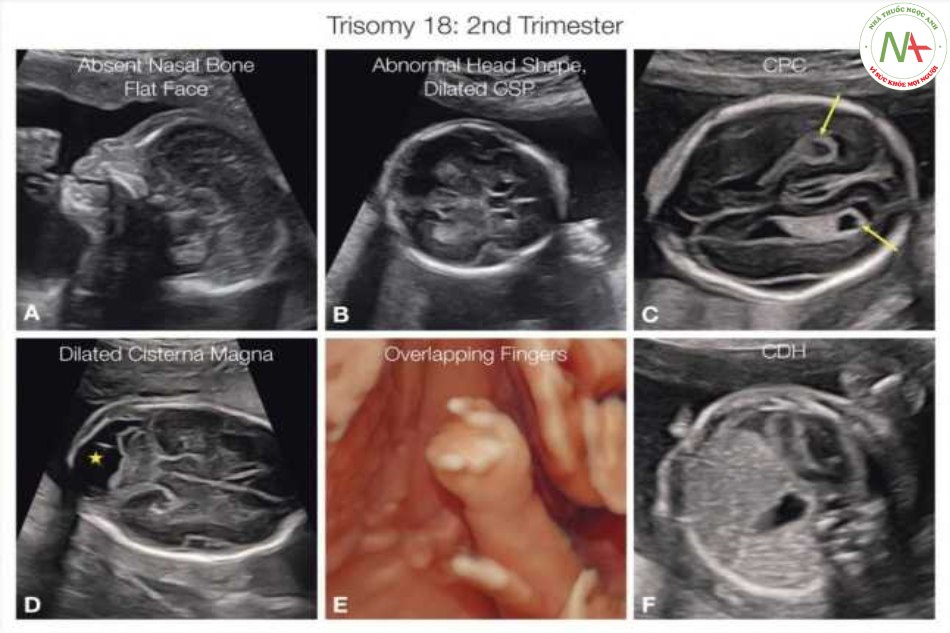
DỊ tật cấu trúc tim ở thai nhi bị trisomy 18 gặp ở hơn 80% trường hợp và bao gồm khiếm khuyết vách ngăn với bất thường ra, chẳng hạn như TOF và DORV. Ngoài ra, có thể phát hiện AVSDs, bệnh đa lá van của van bán nguyệt, hoặc động mạch dưới đòn phải lạc chỗ, w… Hình 2.5 đến 2.7 cho thấy các ví dụ về các phát hiện ở tim và ngoài tim ở một số thai nhi bị trisomy 18.
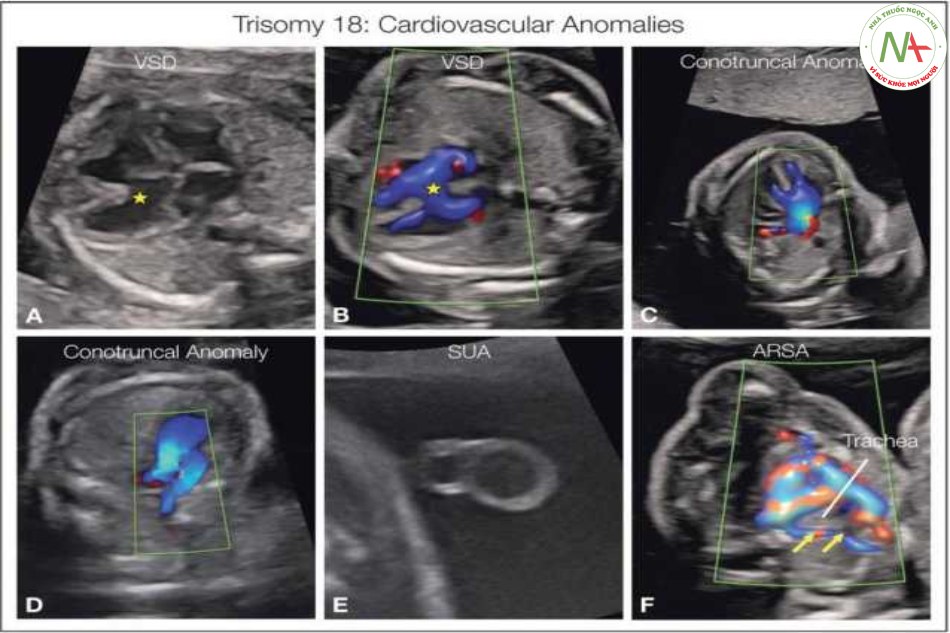
Các bất thường tim mạch ở thai nhi bị Trisomy 18 không phải là quá điển hình nhưng hầu như luôn luôn bao gồm thông liên thất (A, B), hoặc kèm theo kênh nhĩ thất hoặc thường gặp hon với bất thường thân nón (C, D), như tứ chứng của Fallot (D) hoặc thất phải hai đường ra (C). Các bất thường mạch máu điển hình khác là một động mạch rốn (SUA) (E) và các bất thường khác như động mạch dưới đòn phải lạc chỗ (ARSA) (F) hoặc kết nối ống tĩnh mạch bất thường như được phát hiện ở các thể lệch bội khác.
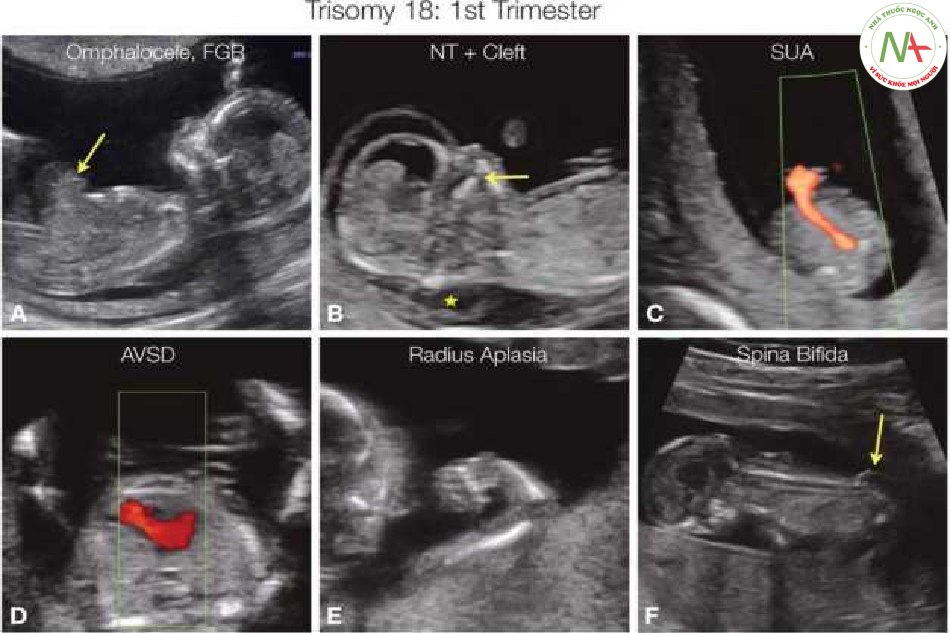
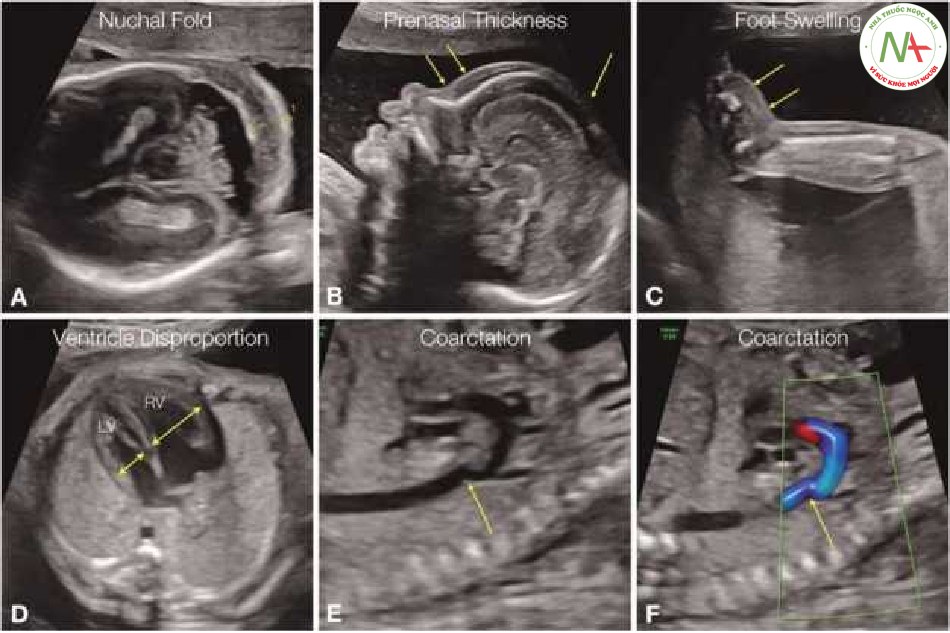
Trong tam cá nguyệt thứ nhất, thai nhi bị trisomy 18 (hội chứng Edwards) có thể biểu hiện nhiều dị tật nặng và thường nghiêm trọng bao gồm thai giới hạn tăng trưởng (A), thoát vị rốn (mũi tên A), khoảng sáng sau gáy dày (NT) (dấu sao B), khe hở mặt, được hiển thị ở đây với khe hở hàm trên (Barrow), một động mạch rốn (C), bất thường tim, chẳng hạn như kênh nhĩ thất (AVSD) (D), hoặc những bất khác như bất thường thân nón (không được hiển thị) và bất thường xương với bất sản xương quay (E) hoặc tật nứt đốt sống hở (F), w…
Hình 7 Trong tam cá nguyệt thứ hai, thai nhi trisomy 18 thường bị giới hạn tăng trưởng, biến dạng khuôn mặt như trong hình A với khồng có xương mũi và khuôn mặt phẳng. Các dấu hiệu về não bao gồm hình dạng đầu bất thường, “dấu hiệu quả dâu tây” với giãn hộp vách trong suốt (CSP) (B), nang đám rối mạch mạc (CPC) (mũi tên C) và giãn bể lớn (sao D). Bàn tay thường có các ngón chồng lên nhau (E). Các dị tật phổ biến khác bao gồm thoát vị rốn, tật chẻ đốt sống hoặc thoát vị hoành bẩm sinh (CDH) (F).
Các dấu hiệu ngoài tim
Ngoài tình trạng thai giới hạn tăng trưởng, một số bất thường khác có thể gặp trong trisomy 18 ở các hệ cơ quan như não, mặt, cơ xương, thận, ổ bụng, nhau thai / dây rốn và nước ối. Hình 2.6 và 2.7 cho thấy một số bất thường liên quan đến trisomy 18, và Bảng 2.3 cung cấp tóm tắt các bất thường phổ biến nhất được phát hiện ở trisomy 18.
==>> Xem thêm: Một số vấn đề quản lý chuyên biệt bệnh tim bẩm sinh
Hội chứng Patau (Trisomy 13)
Định nghĩa bệnh
Hội chứng Patau là do sự hiện diện của ba bản sao nhiễm sắc thể 13. Nó là trisomy nhiễm sắc thể thường phổ biến hàng thứ ba ở người. Tần suất khoảng 1: 8000 ca sinh sống, nhưng tỷ lệ này cao hon nhiều trong bào thai, vì phần lớn các thai nhi trisomy 13 chết trong tử cung. Trong hầu hết các trường hợp (80%), căn nguyên là do sự không phân chia trong quá trình giảm phân của mẹ, trong khi 20% các trường họp là do chuyển đoạn không cân bằng. Hầu hết trẻ bị trisomy 13 chết ở giai đoạn sơ sinh do có các dị tật nghiêm trọng.
Chẩn đoán di truyền
Trisomy 13 chủ yếu được chẩn đoán trước sinh dựa vào nhiễm sắc thể đồ, tương tự như trisomy 21 và 18. Trisomy 13 cũng có thể được nghi ngờ trên NIPT nhưng cần xác nhận bằng xét nghiệm chẩn đoán xâm lấn. Trên siêu âm trước sinh, có thể nghi ngờ trisomy 13 khi có các dị tật cấu trúc tim và ngoài tim khác nhau.
Các phát hiện ở tim
Các bất thường cấu trúc tim gặp ở hơn 50% thai nhi trisomy 13 và bao gồm khiếm khuyết vách ngăn, tắc nghẽn đường ra thất trái, CoA, HLHS, một hoặc nhiều nốt tăng âm trong tim, nhịp tim nhanh, động mạch dưới đòn phải lạc chỗ và các bệnh loạn sản đa lá van.
Các dấu hiệu ngoài tim
Ngoài tình trạng thai giới hạn tăng trưởng, nhiều cơ quan có thể bị ảnh hưởng, bao gồm dị tật từ nhẹ đến nặng của hệ thần kinh trung ương, mặt, cơ xương, thận, nhau thai / dây rốn và nước ối. Hình 2.8 cho thấy một số bất thường liên quan đến trisomy 13, và Bảng 2.4 cung cấp bản tóm tắt về nhũng bất thường phổ biến nhất được phát hiện ở trisomy 13.
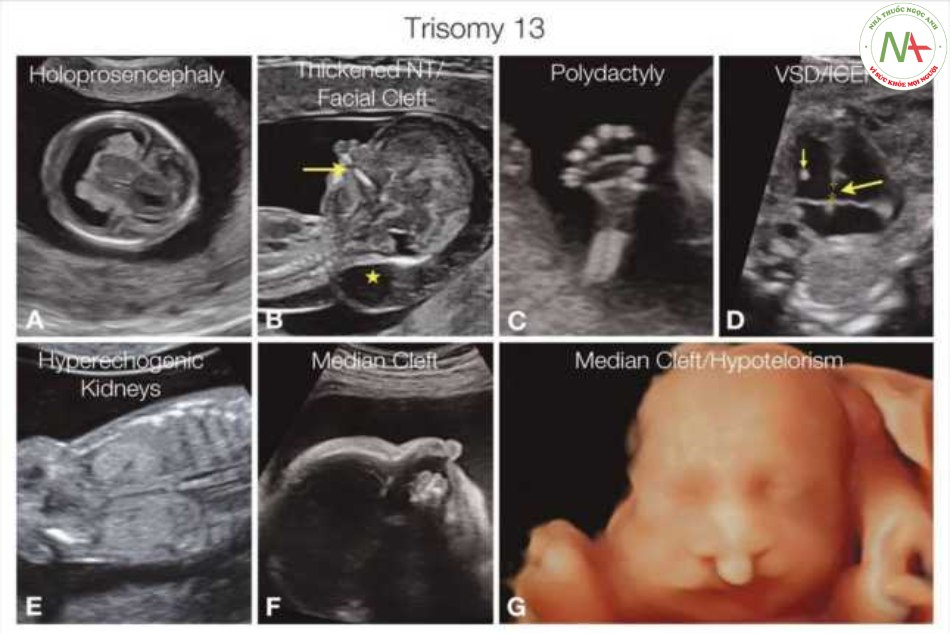
Thai nhi bị trisomy 13 (hội chúng Patau) rất thường gặp dị tật nghiêm trọng trong 3 tháng đầu và 3 tháng giữa của thai kỳ. Các dị tật điển hình bao gồm holoprosencephaly (A), khoảng sáng sau gáy dày (NT) (dấu sao B), khe hở mặt, được thề hiện với khe hở hàm trên (mũi tên B) và thừa ngón (C). Các bất thường tim có thể gặp như nhịp tim nhanh trong tam cá nguyệt thứ nhất và tam cá nguyệt thứ hai bao gồm nốt tăng âm trong tim trong tim (ICEF) (mũi tên nhỏ-D), thông liên thất (VSD) (mũi tên lớn-D), tắc nghẽn đường ra thất trái với hẹp eo động mạch chủ, hoặc thậm chí hội chứng thiểu sản tim trái, vv… Các bất thường ở thận bao gồm thận loạn sản tăng âm (E). Hình thái khuôn mặt bất thường bao gồm khe hở mặt ở đường giữa (F và G), dị tật ở mắt với tật hai mắt gần nhau (G) và độc nhãn.
Hội chứng Turner (Monosomy X)
Định nghĩa bệnh
Hội chứng Turner (Monosomy X) được đặc trưng bởi tình trạng mất hoàn toàn hoặc một phần của một trong các nhiễm sắc thể X ở nữ giới. Tần suất 1: 2000 trẻ sinh sống và không giống như các trisomy nhiễm sắc thể thường (21, 18 và 13), hội chứng Turner không phụ thuộc vào tuổi mẹ. Phần lớn phôi và thai bị hội chứng Turner chết ở quý 1 hoặc đầu quý 2 của thai kỳ do phù thai và nang bạch huyết lớn. Ở những thai nhi còn sống, thường gặp các bất thường ở cổ, tim và thận, kèm theo tình trạng giới hạn tăng trưởng.
Chẩn đoán di truyền
Hội chứng Turner chủ yếu được chẩn đoán trước sinh dựa vào nhiễm sắc thể đồ, tương tự như các trisomy. Hội chứng Turner cũng có thể được nghi ngờ trên NIPT nhưng cần được xác nhận bằng xét nghiệm chẩn đoán xâm lấn. Nên nghi ngờ hội chứng Turner khi thai nhi có nang bạch huyết, cổ dày. Monosomy X toàn phần hoặc bán phần cũng có thể là một phát hiện bất ngờ trên NIPT hoặc chọc ối ở một thai nhi có vẻ bình thường.
Các phát hiện ở tim
Dị tật cấu trúc tim ở thai nhi mắc hội chứng Turner gặp ở 30% đến 50% trường họp và bao gồm tắc nghẽn đường ra thất trái với van động mạch chủ hai lá, CoA, hẹp van động mạch chủ và HLHS. Cũng có thể gặp các bất thường tĩnh mạch.
Các dấu hiệu ngoài tim
Ngoài cổ dày, có thể phát hiện các rối loạn bạch huyết khác, bao gồm phù bàn chân, phù dưới da, tràn dịch màng phổi, cổ trướng và w…. Các bất thường thận là phổ biến. Thai giới hạn tăng trưởng với xưong dài ngắn lại cũng có thể được phát hiện ở nửa sau của thai kỳ. Các triệu chứng nhẹ thường thấy trong các trường họp khảm (46, XX / 46, XO). Hình 2.9 và 2.10 cho thấy một số bất thường liên quan đến hội chứng Turner, và Bảng 2.5 cung cấp tóm tắt các bất thường phổ biến nhất trong hội chứng Turner.
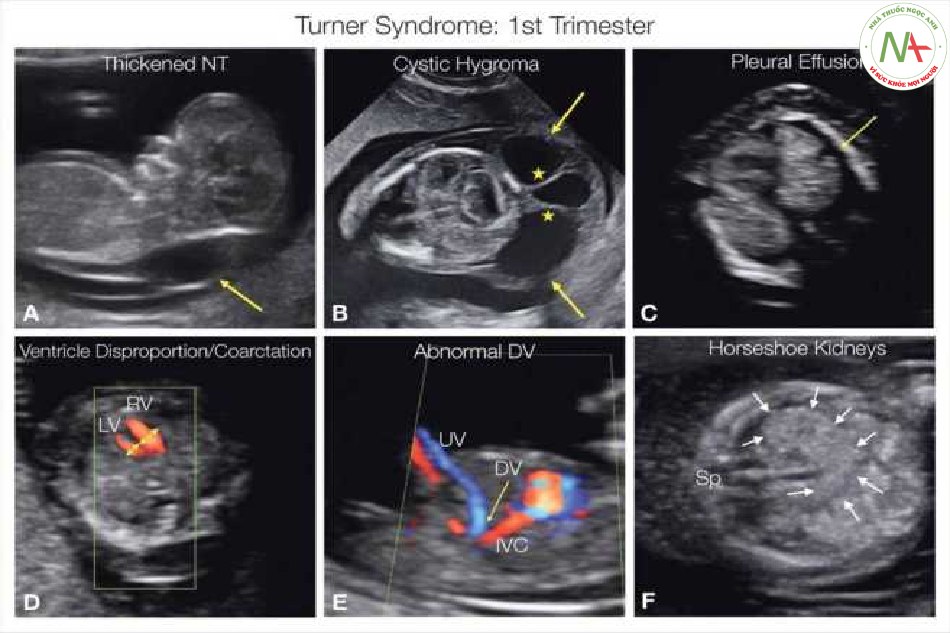
Trong ba tháng đầu thai kỳ, thai nhi mắc hội chứng Turner (monosomy X) có thể biểu hiện với khoảng sáng sau gáy dày (NT) (mũi tên A), nang bạch huyết như một dấu hiệu điển hình (mũi tên B và các dấu sao), và các dấu hiệu rối loạn bạch huyết khác, chẳng hạn như tràn dịch màng phổi (mũi tên C). Có thể có các dấu hiệu ở tim, thường là nhịp tim nhanh và hai tâm thất không cân xứng với tâm thất trái hẹp (LV) so với tâm thất phải (RV), một dấu hiệu của hẹp eo động mạch chủ (D). Cũng có thể thấy tĩnh mạch rốn (ƯV) có đường đi bất thường, ống tĩnh mạch (DV) kết nối bất thường hoặc không có (E). Lưu ý ở E rằng DV kết nối với tĩnh mạch chủ dưới (IVC). Thận bất thường cũng được thấy trong hội chứng Turner, ở đây được thể hiện là thận móng ngựa (mũi tên F). sp, xương sống.
Hình 10: Trong tam cá nguyệt thứ hai, thai nhi mắc hội chứng Turner (monosomy X) có thể biểu hiện khi thai nhi nữ bị rối loạn bạch huyết, chẳng hạn như nếp gấp da gáy dày (A), dày da trước mũi (mũi tên B), phù mu chân (mũi tên C), và đôi khi tràn dịch màng phổi (không được hiển thị). Các dị tật tim điển hình bao gồm tắc nghẽn đường ra thất trái, chẳng hạn như hội chứng thiểu sản tim trái hoặc như được thể hiện ở đây là hẹp eo động mạch chủ với hai tâm thất không cân xứng ở mặt cắt bốn buồng (mũi tên hai đầu D) và eo động mạch chủ hẹp với dấu hiệu “shelf’ ở mặt cắt dọc cung động mạch chủ trong thang xám (mũi tên E) và trong Doppler màu (mũi tên F). LV, tâm thất trái; RV, tâm thất phải.
Tam bội
Ở thể tam bội, có thêm một bộ nhiễm sắc thể đon bội hoàn chỉnh, dẫn đến mỗi tế bào có 69 nhiễm sắc thể thay vì 46 nhiễm sắc thể. Bộ nhiễm sắc thể đon bội bổ sung có thể có nguồn gốc từ mẹ hoặc bố. Loại có nguồn gốc từ “bố” được gọi là “diandric triploidy” và loại có nguồn gốc từ “mẹ” được gọi là “digynic triploidy”. Hai loại thể tam bội này có những đặc điểm khác nhau, thường có thể phân biệt được trên siêu âm.
Dạng điển hình của thể tam bội có nguồn gốc từ bố bao gồm bánh nhau có dạng chửa trứng, với thai nhi tăng trưởng bình thường, trong khi thể tam bội có nguồn gốc từ mẹ, thai giới hạn tăng trưởng nặng với bánh nhau nhỏ, nhưng không phải có dạng chửa trứng. Sự khác biệt về bánh nhau này được phản ánh trong hồ sơ sinh hóa, với thể tam bội có nguồn gốc từ bố liên quan đến tăng p-hCG tự do và giảm nhẹ PAPP-A trong huyết thanh mẹ, và thể tam bội có nguồn gốc từ mẹ liên quan đến giảm rõ rệt p-hCG tự do và PAPP-A trong huyết thanh mẹ. Trong tam cá nguyệt thứ nhất, một đặc điểm quan trọng khác của thể tam bội có nguồn gốc từ mẹ là chiều dài đầu mông (CRL) ngắn đáng kể và kích thước giữa chu vi bụng và đầu có sự khác biệt rõ rệt, thường là trên 2 tuần tuổi thai, thường kèm theo giãn hố sau. Sự bất tương xứng về kích thước giữa đầu và bụng này gần như là dấu hiệu bệnh lý đặc trưng của thể tam bội có nguồn gốc từ mẹ trên siêu âm. Các dị tật tim và ngoài tim có thể có ở cả hai loại thể tam bội, nhưng chúng không đủ đặc hiệu để giúp nghi ngờ chẩn đoán.
CHD VÀ CÁC HỘI CHỦNG LẶP VÀ MẤT ĐOẠN NHIỄM SẮC THẺ
Một số nghiên cứu đã phân tích việc phát hiện CNV gây bệnh bằng microarray ở thai nhi có dị tật tim và các dị tật khác (19 21). Có sự khác biệt về phương pháp giữa các nghiên cứu, vì một số nghiên cứu đã loại trừ thai nhi và trẻ bị lệch bội và mất đoạn 22ql 1.2 ra khỏi phân tích của họ, trong khi những nghiên cứu khác thì không (22). Một phân tích gộp về chủ đề này – trên 13 ấn phẩm và 1.131 trường họp – phát hiện ra rằng hiệu suất của CNV có ý nghĩa lâm sàng (sau khi loại trừ lệch bội và mất đoạn 22ql 1.2) là 3,4% ở CHD đơn độc và 9,3% ở CHD hội chứng, với trung bình là 7% (5). Hiệu suất này thay đổi tùy thuộc vào dị tật tim cụ thể (20,23,24) (ví dụ, thấp trong hội chứng đồng dạng và cao trong cung động mạch chủ bên phải), nhưng phát hiện này sẽ không ảnh hưởng đến quyết định thực hiện xét nghiệm microarray cho tất cả thai kỳ có thai nhi bị CHD. Trong một nghiên cứu đa trung tâm bao gồm 239 thai nhi bị CHD đơn độc, 19 thai nhi (7,9%) được phát hiện có CNV gây bệnh và sau khi loại trừ 12 thai nhi bị mất đoạn 22ql 1.2, hiệu suất là 3,1% (21). Gần đây, một nghiên cứu tiến cứu lớn được thực hiện trong 5 năm đã phân tích nhiễm sắc thể đồ và microarray ở 602 thai nhi mắc CHD (25). Phát hiện di truyền bất thường được ghi nhận ở 21% thai nhi, 14,2% có nhiễm sắc thể đồ bất thường và 6,6% có microarray bất thường (25). Như được thấy trong các nghiên cứu trước đó, một nửa thai nhi có microarray bất thường là mất / lặp đoạn 22ql 1.2 và một nửa còn lại cho thấy các phát hiện CNV khác. Hình 11 cho thấy những thai nhi bị dị tật tim và vồ số mất đoạn và lặp đoạn được phát hiện bằng phân tích microarray.
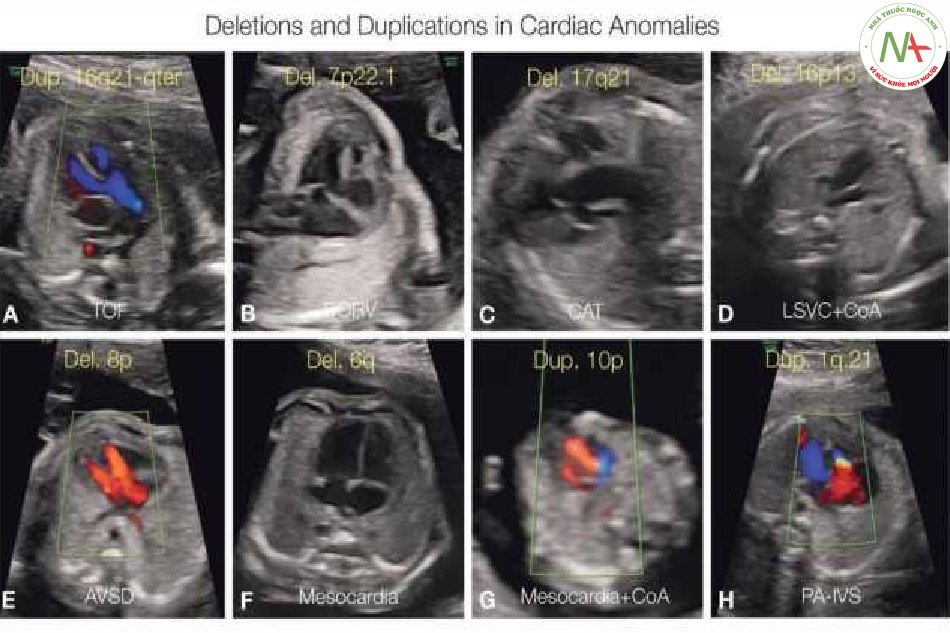
Các dị tật tim của thai nhi có nhiễm sắc thể đồ bình thường và không có vi mất đoạn 22ql 1.2 vẫn có 2% đến 5% nguy cơ liên quan đến biến thể số lượng bản sao (CNV) dưới dạng mất đoạn hoặc lặp đoạn. Nguy cơ cao hơn nếu phát hiện các dấu hiệu ngoài tim kèm theo. Dưới đây là 8 thai nhi có các dị tật tim khác nhau với mất đoạn hoặc lặp đoạn, được phát hiện bằng microarray và được liệt kê trên các hình tương ứng (A-H). Các chẩn đoán tim liên quan bao gồm TOF (A), DORV (B), CAT (C), LSVC với CoA (D), kênh nhĩ thất không cân bằng (AVSD) (E), tim ở trung tâm đơn độc (F), tim ở trung tâm với CoA (G), và teo van động mạch phổi với vách liên thất nguyên vẹn (PA-IVS) (H).
Tóm lại, tiêu chuẩn tuyển chọn vào nghiên cứu ảnh hưởng đến tỷ lệ dương tính của lệch bội và microarray bất thường. Nhìn chung, 14% thai nhi mắc CHD có lệch bội và lên đến 7% có thể có một microarray bất thường; một nửa trong số này là mất đoạn hoặc lặp đoạn 22ql 1.2, và một nửa còn lại bao gồm vô số các vi mất đoạn và vi lặp đoạn khác. Tỷ lệ này cao hơn ở cả hai nhóm nếu tính cả dị tật tim với dị tật ngoài tim, và tỷ lệ này khác ở nhóm CHD đơn độc với các dị tật tim khác nhau (5,20,21,25).