Chưa có sản phẩm trong giỏ hàng.
Nivolumab
Danh pháp
Tên chung quốc tế
Nhóm thuốc
Nivolumab là thuốc gì? Thuốc chống ung thư
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01F – Kháng thể đơn dòng và liên hợp thuốc kháng thể
L01FF – chất ức chế Pd-1/pdl-1 (protein chết tế bào theo chương trình 1/phối tử chết 1)
L01FF01 – Nivolumab
Mã UNII
31YO63LBSN
Mã CAS
946414-94-4
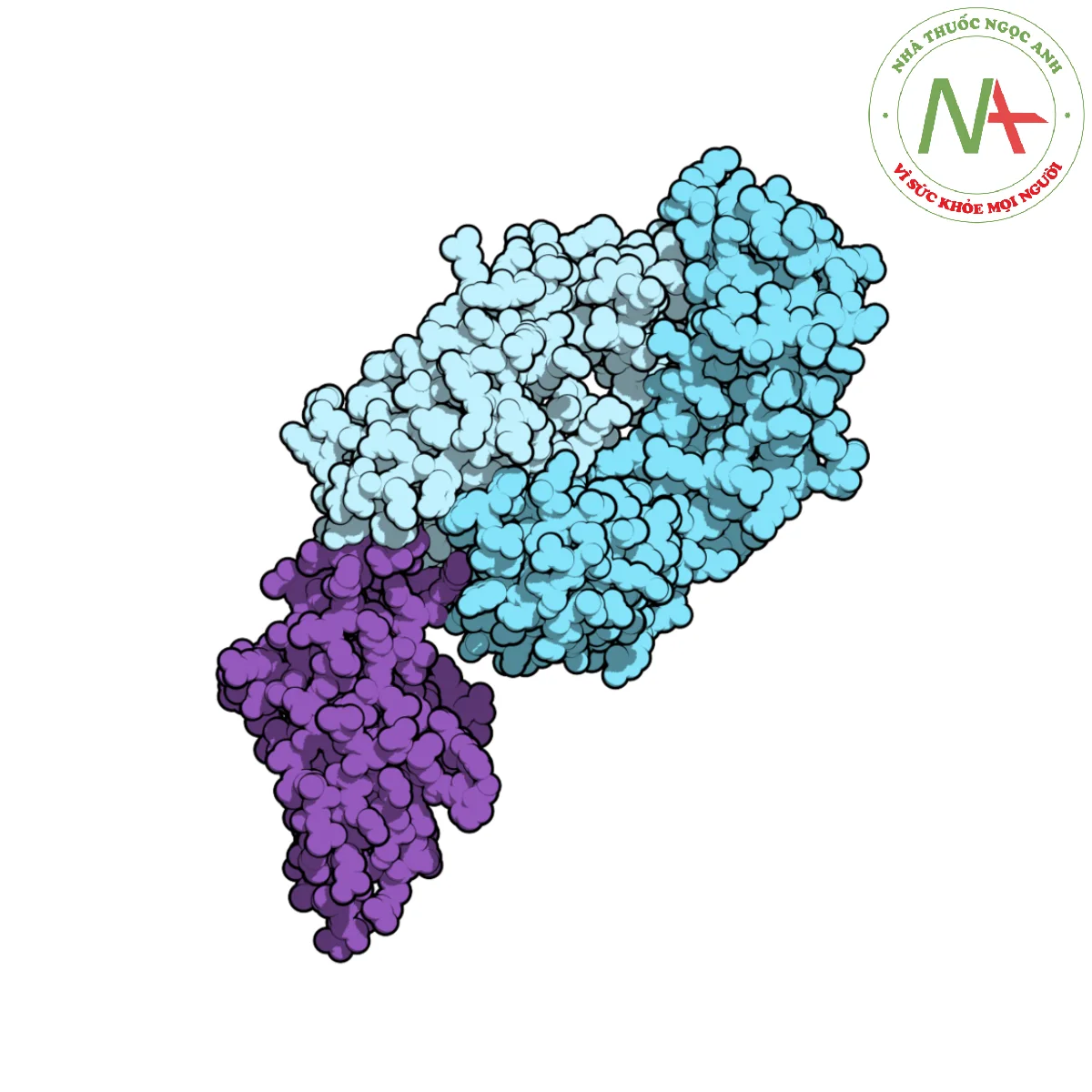
Cấu trúc phân tử
Công thức phân tử
C6362H9862N1712O1995S42
Phân tử lượng
143599.39 g•mol−1
Cấu trúc phân tử
Tính chất
Nivolumab là một kháng thể globulin miễn dịch đơn dòng G 4 hoàn toàn của con người đối với PD-1. Chuỗi nặng gamma 1 là 91,8% do con người thiết kế chưa được sửa đổi trong khi chuỗi nhẹ kappa là 98,9%.
Dạng bào chế
Dung dịch tiêm

Nguồn gốc
- Nivolumab thuốc được tạo ra dưới quyền sở hữu trí tuệ của Ono Pharmaceutical liên quan đến PD-1 và dưới sự hợp tác nghiên cứu được ký kết vào năm 2005 giữa Ono và Medarex.Thông qua sự hợp tác nghiên cứu với Ono, nó đã được phát minh tại Medarex bằng cách sử dụng chuột biến đổi gen có hệ thống miễn dịch nhân bản; việc phát hiện và xác định đặc tính in vitro của kháng thể, ban đầu được gọi là MDX-1106/ONO-4538, đã được công bố (rất lâu sau đó) vào năm 2014.Theo thỏa thuận giữa các công ty vào năm 2005, Medarex nắm độc quyền nivolumab ở miền Bắc America và Ono giữ quyền ở tất cả các quốc gia khác ngoại trừ Bắc Mỹ. Bristol-Myers Squibb mua lại Medarex vào năm 2009 với giá 2,4 tỷ USD, phần lớn nhờ vào sức mạnh của chương trình ức chế điểm kiểm tra.
- Kết quả thử nghiệm lâm sàng đầy hứa hẹn được công bố vào năm 2012, đã gây hứng thú cho các nhà phân tích trong ngành và trên các phương tiện truyền thông chính thống; PD-1 đang được theo đuổi một cách nhiệt tình như một mục tiêu sinh học vào thời điểm đó, với các công ty bao gồm Merck với pembrolizumab (Keytruda), Roche (thông qua công ty con Genentech ) với atezolizumab, GlaxoSmithKline phối hợp với công ty công nghệ sinh học Maryland Amplimmune ; và Teva hợp tác với công ty công nghệ sinh học CureTech của Israel đang cạnh tranh.
- Ono đã nhận được sự chấp thuận từ cơ quan quản lý Nhật Bản để sử dụng nivolumab để điều trị khối u ác tính không thể cắt bỏ vào tháng 7 năm 2014, đây là sự chấp thuận theo quy định đầu tiên đối với chất ức chế PD-1 ở bất kỳ đâu trên thế giới.
- Merck đã nhận được sự chấp thuận đầu tiên của FDA cho thuốc ức chế PD-1, pembrolizumab (Keytruda), vào tháng 9 năm 2014.
- Nivolumab đã nhận được sự chấp thuận của FDA cho việc điều trị khối u ác tính vào tháng 12 năm 2014. Vào tháng 4 năm 2015, Ủy ban Sản phẩm Thuốc Sử dụng cho Con người của Cơ quan Dược phẩm Châu Âu đã khuyến nghị phê duyệt Nivolumab cho khối u ác tính di căn như một liệu pháp đơn trị liệu.
- Vào tháng 3 năm 2015, FDA Hoa Kỳ đã phê duyệt nó để điều trị ung thư phổi tế bào vảy.
- Vào ngày 19 tháng 6 năm 2015, Cơ quan Dược phẩm Châu Âu (EMA) đã cấp giấy phép tiếp thị có giá trị trên toàn Liên minh Châu Âu.
- Vào tháng 11 năm 2015, FDA đã phê duyệt nivolumab là phương pháp điều trị bậc hai cho bệnh ung thư biểu mô tế bào thận sau khi cấp chỉ định liệu pháp đột phá cho ứng dụng, chỉ định theo dõi nhanh và trạng thái xem xét ưu tiên.
- Vào tháng 5 năm 2016, FDA đã phê duyệt nivolumab để điều trị cho bệnh nhân mắc bệnh ung thư hạch Hodgkin cổ điển
- Vào ngày 20 tháng 12 năm 2017, FDA đã cấp phép cho nivolumab để điều trị bổ trợ khối u ác tính có liên quan đến các hạch bạch huyết hoặc cho bệnh di căn bằng cách cắt bỏ hoàn toàn.
- Vào ngày 16 tháng 4 năm 2018, FDA đã cấp phép nivolumab kết hợp với ipilimumab để điều trị bước đầu cho bệnh nhân ung thư biểu mô tế bào thận tiến triển có nguy cơ trung bình và kém.
- Vào ngày 15 tháng 6 năm 2018, Cục Quản lý Dược phẩm Trung Quốc đã phê duyệt nivolumab, phương pháp điều trị ung thư miễn dịch đầu tiên của đất nước và là liệu pháp PD-1 đầu tiên.
- Vào tháng 10/2020, Cơ quan FDA đã phê duyệt việc kết hợp nivolumab với ipilimumab để điều trị bước đầu cho người lớn mắc u trung biểu mô màng phổi ác tính (MPM) không thể cắt bỏ bằng phẫu thuật.
- Vào tháng 4 năm 2021, FDA đã phê duyệt nivolumab, kết hợp với một số loại hóa trị, để điều trị ban đầu cho những người bị ung thư dạ dày tiến triển hoặc di căn, ung thư chỗ nối dạ dày thực quản và ung thư biểu mô tuyến thực quản
Dược lý và cơ chế hoạt động
- Nivolumab là một kháng thể IgG4 đơn dòng, hoàn toàn của người, liên kết với thụ thể death-1 (PD-1) được lập trình sẵn với độ đặc hiệu và ái lực cao. PD-1 được biểu hiện trên các tế bào T và làm giảm phản ứng miễn dịch của chúng khi liên kết các phối tử PD-L1 và PD-L2 trên APC. Cơ chế này đóng vai trò then chốt trong việc điều chỉnh dung nạp trung tâm và ngoại biên.
- Tuy nhiên, trong bệnh ung thư, biểu hiện PD-L1 bất thường của tế bào khối u hoặc tế bào miễn dịch trong vi môi trường khối u sẽ vô hiệu hóa các tế bào lympho xâm nhập khối u biểu hiện PD-1, do đó cho phép các tế bào khối u thoát khỏi sự nhận biết và loại bỏ miễn dịch. Bằng cách ức chế chức năng PD-1, nivolumab giải phóng các tế bào miễn dịch khỏi sự ức chế miễn dịch bệnh lý, cho phép chúng nhận biết và chống lại các tế bào khối u.
Dược động học
Hấp thu
Các nghiên cứu dược động học cho thấy nivolumab thể hiện dược động học tuyến tính với sự gia tăng tỷ lệ thuận với liều lượng về nồng độ đỉnh và AUC. Thời gian đạt nồng độ đỉnh trong huyết tương dao động từ 1-4 giờ. Các đặc tính dược động học hấp thu tương ứng với việc dùng liều 10 mg/kg được báo cáo lần lượt là Cmax, Tmax và AUC lần lượt là 242 µg/kg, 2,99 giờ và 68100 µg\*h/mL.
Chuyển hóa
Chưa có nghiên cứu chính thức nào về quá trình chuyển hóa cụ thể của nivolumab nhưng với tư cách là một kháng thể đơn dòng ở người, nó đã được đề xuất là có thể phân hủy thành các peptide nhỏ và các axit amin riêng lẻ.
Phân bố
Thể tích phân bố ở trạng thái ổn định khi dùng liều nivolumab 10 mg/kg được báo cáo là 91,1 mL/kg. Ở liều từ 0,1 đến 20 mg/kg thể tích phân bố được báo cáo là 8L.
Thải trừ
Tốc độ thanh thải ước tính của nivolumab là 9,4 mL/giờ. Tỷ lệ thanh thải dường như tăng lên theo trọng lượng cơ thể.
Ứng dụng trong y học
Nivolumab là một loại thuốc điều trị ung thư thuộc nhóm thuốc ức chế điểm kiểm soát miễn dịch (ICI). Tùy thuộc vào chỉ định, nó có thể được dùng dưới dạng đơn lẻ hoặc kết hợp với ipilimumab (chất ức chế điểm kiểm soát miễn dịch chống CTL4). Nivolumab hiện được FDA chấp thuận để điều trị:
- Khối u ác tính
- Khối u ác tính không thể cắt bỏ hoặc di căn, dưới dạng đơn trị liệu hoặc kết hợp với ipilimumab
- Là một liệu pháp bổ trợ cho bệnh liên quan đến hạch bạch huyết hoặc di căn sau khi cắt bỏ hoàn toàn.
- Ung thư phổi không phải tế bào nhỏ
- Di căn, với sự tiến triển trong hoặc sau khi hóa trị liệu dựa trên bạch kim (và sau khi tiến triển theo các liệu pháp nhắm mục tiêu đối với quang sai khối u gen EGFR hoặc ALK trong trường hợp có những quang sai này).
- Là liệu pháp đầu tiên kết hợp với ipilimumab trong NSCLC di căn hoặc tái phát có biểu hiện PD-L1 bằng hoặc cao hơn đến 1% mà không có quang sai khối u gen EGFR hoặc ALK.
- Là liệu pháp đầu tiên kết hợp với ipilimumab, được thực hiện với hai chu kỳ hóa trị liệu bạch kim đôi
- Ung thư biểu mô tế bào thận b
- Sau liệu pháp chống tạo mạch.
- trước đây chưa được điều trị, có nguy cơ trung bình hoặc kém, kết hợp với ipilimumab.
- Ung thư biểu mô tế bào vảy (SCC) ở đầu và cổ: Tái phát hoặc di căn với bệnh tiến triển trên hoặc sau liệu pháp dựa trên bạch kim.
- U trung biểu mô màng phổi: Kết hợp với ipilimumab trong điều trị ung thư trung biểu mô màng phổi không thể cắt bỏ.
- Ung thư phổi tế bào nhỏ (SCLC): Di căn, tiến triển sau hóa trị liệu dựa trên bạch kim và ít nhất một liệu pháp bổ sung.
- Ung thư biểu mô tiết niệu
- Tiến triển hoặc di căn, cho thấy bệnh tiến triển trong hoặc sau khi hóa trị liệu dựa trên bạch kim
- Bệnh tiến triển trong vòng 12 tháng sau khi điều trị tân dược hoặc bổ trợ bằng hóa trị liệu dựa trên bạch kim.
- Ung thư đại trực tràng (CRC) với độ bất ổn kính hiển vi cao (MSI-H) hoặc thiếu sửa chữa không khớp (dMMR): Di căn, ở bệnh nhân từ 12 tuổi trở lên, tiến triển sau khi điều trị bằng fluoropyrimidine, oxaliplatin và irinotecan. Nó có thể được dùng dưới dạng đơn trị liệu hoặc kết hợp với ipilimumab.
- Ung thư biểu mô tế bào gan (HCC): Sau lần điều trị trước đó bằng sorafenib, kết hợp với ipilimumab
- Ung thư hạch Hodgkin cổ điển: Sau khi tái phát hoặc tiến triển sau ghép tế bào gốc tạo máu tự thân (HSCT) và brentuximab vedotin, hoặc ít nhất ba liệu pháp toàn thân (bao gồm HSCT tự thân)
- Ung thư biểu mô tế bào vảy thực quản (ESCC): Sau hóa trị liệu dựa trên fluoropyrimidine và bạch kim trước đó
Tác dụng phụ
- Có báo cáo về phản ứng truyền nghiêm trọng với Nivolumab. Trong trường hợp xảy ra phản ứng truyền dịch, phải ngừng điều trị ngay lập tức và cung cấp dịch vụ chăm sóc theo triệu chứng. Do cơ chế hoạt động kích hoạt tế bào T của nó, các tác dụng phụ khi điều trị bằng nivolumab thường có tính chất tự miễn dịch. Các tác dụng phụ liên quan đến miễn dịch (iRAE) có thể ảnh hưởng đến bất kỳ hệ thống cơ quan nào.
- Một số tác dụng phụ chỉ mang tính tạm thời và có thể kiểm soát được. Tuy nhiên, một số khác đe dọa tính mạng và cần điều trị ức chế miễn dịch tích cực và ngừng thuốc vĩnh viễn. Các irAE phổ biến nhất ảnh hưởng đến hệ thống bao gồm hệ thống tiêu hóa và da, thường biểu hiện dưới dạng phát ban ngứa, tiêu chảy hoặc viêm đại tràng. Khi tình trạng viêm nội tiết qua trung gian miễn dịch giảm bớt, chức năng tuyến có thể bị tổn hại, do đó cần phải thay thế hormone vĩnh viễn. Điều này bao gồm suy giáp do nivolumab gây ra, suy tuyến yên, suy tuyến thượng thận và đái tháo đường týp 1.
- Viêm phổi qua trung gian miễn dịch là một tác dụng phụ hiếm gặp có biểu hiện nghiêm trọng. Viêm cơ tim liên quan đến miễn dịch là một tác dụng phụ rất hiếm gặp với tỷ lệ tử vong cao. Các tác dụng phụ ít gặp hơn bao gồm ở mắt (viêm màng bồ đào, viêm kết mạc, viêm cơ cơ quanh mắt), viêm gan, bệnh nội tiết như suy giáp, suy tuyến yên, suy tuyến thượng thận. Các tác dụng phụ hiếm gặp khác bao gồm những tác dụng phụ ảnh hưởng đến hệ thần kinh (viêm não, hội chứng Guillain-Barré).
- Đã có báo cáo rằng sự xuất hiện của irAE ở bệnh nhân dùng ICI có tương quan với kết quả tốt hơn. Đặc biệt, các irAE cấp độ thấp, cũng như các irAE có tính chất nội tiết hoặc da liễu, được phát hiện có liên quan đến hiệu quả điều trị khối u tốt hơn.
- Liệu pháp lựa chọn cho các irAE nặng và đe dọa tính mạng bao gồm corticosteroid toàn thân. Prednisolone được dùng từ 1 đến 2 mg/kg hoặc tiêm tĩnh mạch, nếu cần thiết, cùng với điều trị dự phòng loét dạ dày và loãng xương. Trong những trường hợp kháng steroid, hãy bổ sung ức chế miễn dịch bằng các thuốc như infliximab, mycophenolate mofetil hoặc cyclophosphamide. Globulin miễn dịch tiêm tĩnh mạch cũng được sử dụng trong trường hợp nhiễm độc độ IV như một phương pháp thay thế trong các trường hợp kháng steroid
Độc tính ở người
Quá liều nivolumab khó xảy ra và chưa được mô tả trong các thử nghiệm lâm sàng. Không có cách điều trị cụ thể cho tình trạng quá liều nivolumab. Do đó, điều quan trọng nhất là phải đảm bảo liều lượng và khoảng thời gian dùng thuốc thích hợp. Trong trường hợp quá liều, bệnh nhân phải được theo dõi chặt chẽ và điều trị triệu chứng ngay lập tức ngay khi có dấu hiệu phản ứng bất lợi xảy ra.
Liều dùng
- Nivolumab được dùng dưới dạng tiêm truyền tĩnh mạch trong 30 phút. Phác đồ dùng thuốc phổ biến nhất là 240 mg mỗi hai tuần hoặc 480 mg mỗi bốn tuần. Liều lượng phụ thuộc vào chỉ định. Nivolumab có thể được pha loãng trong dung dịch natri clorua 9 mg/mL (0,9%) hoặc trong dung dịch glucose 50 mg/mL (5%) để tiêm. Bất kể chất pha loãng được sử dụng là gì, nên sử dụng ngay sau khi chuẩn bị dung dịch. Nivolumab có thể được dùng dưới dạng liệu pháp kết hợp với Ipilimumab cho khối u ác tính không thể cắt bỏ hoặc di căn, RCC tiến triển và CRC di căn (MSI-H hoặc dMMR).
- Khi dùng kết hợp, nivolumab phải được truyền trước Ipilimumab và phải sử dụng các túi truyền riêng biệt. Nói chung, không nên trộn lẫn hoặc tiêm nivolumab trên cùng một đường truyền tĩnh mạch với một loại thuốc khác. Cho đến khi sử dụng, nivolumab phải được bảo quản trong tủ lạnh ở nhiệt độ từ 2 đến 8 độ C (36 F đến 46 F), tránh ánh sáng (trong bao bì gốc). Nó không nên bị đóng băng hoặc lắc.
Chống chỉ định
- Không có chống chỉ định điều trị bằng nivolumab. Điều quan trọng cần lưu ý là một số bối cảnh quan trọng chưa được đề cập trong các nghiên cứu lâm sàng, chẳng hạn như tương tác thuốc, sử dụng trong thai kỳ và cho con bú. Một số nghiên cứu trên mô hình động vật đã cho thấy độc tính đối với phôi thai. Vì IgG4 ở người được biết là có khả năng vượt qua hàng rào nhau thai nên có một con đường tiềm năng để truyền kháng thể đến thai nhi đang phát triển.Việc sử dụng nivolumab khi mang thai cần được cân nhắc cẩn thận trong trường hợp lợi ích tiềm tàng lớn hơn nguy cơ cho bệnh nhân và thai nhi. Có những báo cáo tài liệu về việc mang thai thành công, khả thi ở những bệnh nhân dùng nivolumab dưới dạng đơn trị liệu hoặc kết hợp với ipilimumab.
- Nên tránh thai ít nhất 5 tháng sau liều nivolumab cuối cùng. Không khuyến khích cho con bú đồng thời với liệu pháp nivolumab vì kháng thể có thể được truyền vào sữa mẹ. Các nghiên cứu đánh giá khả năng sinh sản của bệnh nhân dùng nivolumab vẫn chưa được công bố. Vẫn chưa biết liệu nivolumab có ảnh hưởng đến khả năng sinh sản của nam hay nữ hay không. Bệnh nhân cần được thông báo kỹ lưỡng về vấn đề này và nên cung cấp tư vấn sinh sản cho bệnh nhân trong độ tuổi sinh sản. Mặc dù các tình trạng tự miễn dịch hoặc viêm nhiễm từ trước không phải là chống chỉ định đối với liệu pháp nivolumab, nhưng đã có báo cáo rằng những bệnh nhân này có tỷ lệ điều trị ức chế miễn dịch và nhập viện cao hơn sau khi điều trị bằng ICI
Tương tác với thuốc khác
- Sử dụng betamethasone, budesonide, cortisone,deflazacort, dexamethasone, triamcinolone, prednisone, prednisolone, methylprednisolone, hydrocortisone, có thể làm giảm tác dụng của nivolumab, điều này có thể làm cho thuốc kém hiệu quả hơn trong việc điều trị.
- Bằng chứng hạn chế cho thấy dimethyl fumarate, diroximel fumarate, monomethyl fumarate có thể có khả năng gây tổn thương thận và sử dụng nó với các loại thuốc khác cũng có thể ảnh hưởng đến thận, chẳng hạn như nivolumab, có thể làm tăng nguy cơ.
- Efgartigimod alfa, Rozanolixizumab có thể làm giảm nồng độ trong máu và tác dụng của nivolumab.
- Sử dụng các loại thuốc như nivolumab cùng với thalidomide và dexamethasone, pomalidomide và dexamethasone để điều trị bệnh đa u tủy có thể làm tăng nguy cơ mắc các tác dụng phụ nghiêm trọng và đe dọa tính mạng cũng như tử vong so với chỉ sử dụng pomalidomide và dexamethasone.
Lưu ý khi sử dụng
- Kiểm tra trước khi điều trị bằng nivolumab bao gồm hỏi bệnh sử lâm sàng và khám thực thể. Điều này bao gồm đánh giá lâm sàng cơ bản kỹ lưỡng về tất cả các hệ cơ quan. Đặc biệt có liên quan là việc đánh giá da liễu hoàn chỉnh cũng như đánh giá các thói quen và khiếu nại về đường tiêu hóa. Một nghiên cứu hình ảnh gần đây để theo dõi hiệu quả điều trị là cần thiết trước khi điều trị. Nhiễm trùng cấp tính và cận lâm sàng nên được loại trừ thông qua xét nghiệm huyết thanh học ( M. bệnh lao, Virus viêm gan B và C, virus gây suy giảm miễn dịch ở người, C ytomegalovirus ). Các xét nghiệm trong phòng thí nghiệm cần thiết trước và trong khi điều trị bằng nivolumab bao gồm công thức máu toàn phần có phân biệt và hóa học lâm sàng, bao gồm xét nghiệm chức năng gan và bảng nội tiết.
- Việc theo dõi các dấu hiệu tim mạch như troponin I hoặc T là phù hợp vì nó có thể là sự thay đổi duy nhất ở những bệnh nhân viêm cơ tim không có triệu chứng, bệnh có tỷ lệ tử vong cao. Tăng transaminase gan không có triệu chứng là một phát hiện phổ biến và, khi được phát hiện, đảm bảo cần phải nỗ lực để loại trừ bệnh viêm gan liên quan đến tự miễn dịch.
Một vài nghiên cứu về Nivolumab
Nivolumab: Liệu pháp miễn dịch trong khối u ác tính

Nghiên cứu được tiến hành nhắm mục đích đánh giá ề việc sử dụng nivolumab cho khối u ác tính di căn. Phương pháp nghiên cứu dựa trên các số liệu và thông tin thu được sau khi đưa thuốc ra thị trường. Kết quả cho thấy những bệnh nhân mắc khối u ác tính tiến triển đã có đáp ứng một phần với nivolumab. Nivolumab giúp huy động các tế bào lympho của hệ thống miễn dịch đã bị bất hoạt bởi các tế bào khối u ác tính, tăng cường khả năng cơ thể nhận biết ung thư là bất thường.
Tài liệu tham khảo
- Thư viện y học quốc gia, Nivolumab, pubchem. Truy cập ngày 02/09/2023.
- Adriana Rendon ; Appaji Rayi, Nivolumab,pubmed.com. Truy cập ngày 02/09/2023.
- Heather Bayless , Susan Schneider (2015) Nivolumab: Immunotherapy in Malignant Melanom,pubmed.com. Truy cập ngày 02/09/2023.