Nhà thuốc Ngọc Anh – Chương 10: Mỡ và tế bào gốc
Tác giả: Dr.Mario Goisis, Sara Izzo, AndreaSbarbati, Giamaica Conti và Giovanni Francesco Nicoletti
Nguồn sách: Sách: Quy trình PRP và Tiêm cấy mỡ nâng cao -Tác giả: Dr: Mario Goisis
Vai trò của tế bào gốc
Tế bào gốc trung mô của người (hMSCs) có đặc tính biệt hóa đa năng. Các tế bào này có thể được lấy từ các khu vực khác nhau bao gồm tủy xương (hBMSCs), tủy răng, máu dây rốn, màng hoạt dịch, nhau thai, da, dây rốn, cơ xương, thạch Wharton, sụn chêm, sữa mẹ, sụn, dây chằng, và mô đệm (ASCs).
Một số lượng lớn các ứng dụng của hMSC đã được mô tả trong tài liệu.Ví dụ, hMSCs đã được sử dụng để sửa chữa cơ tim ở những trái tim bị nhồi máu của chuột [1, 2], để cải thiện sự tái tạo mảnh ghép trong quá trình cấy ghép ở chuột mắc bệnh tiểu đường [3], và để điều trị bệnh lý thần kinh ruột liên quan đến viêm ruột [4].MSCs được biết đến là có khả năng tái tạo sụn khớp và được đề xuất để điều trị viêm xương khớp (OA), một chứng rối loạn thoái hóa khớp mãn tính đặc trưng bởi sự phá hủy sụn khớp.
Trên thực tế, hMSCs có thể điều chỉnh phản ứng miễn dịch bằng tác dụng ức chế miễn dịch và kháng viêm paracrine. Tái tạo sụn khớp ở mô hình viêm khớp ở thỏ sau khi tiêm nội khớp hMSCs xenogeneic đã được mô tả [5–7].Jo và cộng sự đã đánh giá tính an toàn và hiệu quả của việc tiêm nội khớp MSCs có nguồn gốc từ mô mỡ tự thân (AD-MSCs) cho viêm xương khớp đầu gối.
Họ chỉ ra rằng tiêm AD-MSC trong khớp vào khớp gối bị thoái hóa khớp giúp cải thiện chức năng và giảm đau ở khớp gối và sửa chữa các tổn thương ở sụn của nó, bằng cách tái tạo sụn khớp giống hyalin, mà không gây ra các tác dụng phụ [8]
Vai trò của ASC trong thẩm mỹ và y học tái tạo.Làm giàu ASC của mô ghép chất béo cải thiện sự sống sót củaMảnh ghép đáng kể.Hiệu quả của ASC trong việc giảm tỷ lệ tái hấp thu của mô mỡ đã được chứng minh bởi Kolle và cộng sự vào năm 2013 trong một bài báo khoa học quan trọng được xuất bản trên Lancet [9].
Các tác giả đã báo cáo kết quả của một thử nghiệm mù ba, có đối chứng với giả dược được sử dụng để so sánh tỷ lệ sống sót của mô ghép mỡ không làm giàu so với mô ghép giàu chất béo với tế bào gốc có nguồn gốc từ mô mỡ tự thân (ASCs).
Mười ba bệnh nhân khỏe mạnh đã trải qua hai lần lấy mỡ cách nhau 14 ngày: một để cách ly ASC và mở rộng ex-vivo bằng thao tác tế bào và một để chuẩn bị ghép mỡ. Hai mô mỡ tinh khiết (mỗi phần 30 mL) lấy từ lần hút mỡ thứ hai đã được chuẩn bị trước cho mỗi người tham gia. Một mảnh ghép đã được làm giàu với ASC (20 × 10 (6) tế bào trên mỗi mL chất béo) được mở rộng trong quá trình thử nghiệm và một mảnh ghép khác không làm giàu ASC. Ghép sau được sử dụng như một đối chứng. Các mảnh ghép chất béo được tiêm một cách dưới da như một liều bolus theo trình tự ngẫu nhiên.
Các xét nghiệm MRI đo thể tích mô mỡ được tiêm ngay sau khi tiêm và sau 121 ngày.So với các mảnh ghép đối chứng, các mảnh ghép được làm giàu ASC cho thấy khối lượng mô mỡ và mô liên kết mới được tạo ra cao hơn. Mô liên kết mới được tạo ra được coi là sản phẩm của ASC, vì loại mô này thường không được phát hiện trong mô mỡ dưới da. Những kết luận này phù hợp với khả năng phân biệt của ASC, đặc biệt, ở dạng giống như nguyên bào sợi của chúng [10].Các mảnh ghép chất béo được làm giàu ASC bảo toàn hơn 80% khối lượng bolus ban đầu của chúng 4 tháng sau.
Hiệu quả làm trắng của tế bào gốc có nguồn gốc từ mỡ
Hiệu quả của tế bào gốc có nguồn gốc từ mỡ (ASC) trong việc giảm tổng hợp mela-nin đã được chứng minh bằng thực nghiệm trong ống nghiệm và in vivo trên các mô hình động vật [11, 12].
Trên thực tế, ASC có tác dụng làm trắng thông qua cơ chế paracrine. Đặc biệt, hoạt động của tyrosinase, đóng một vai trò quan trọng trong việc tổng hợp melanin, đã bị ức chế bởi ASCs. Để làm rõ cơ chế hoạt động làm trắng của ADSCs, mức độ biểu hiện của các protein tạo hắc tố đã được đánh giá. Đặc biệt, các biểu hiện của tyrosinase và TRP1 đã được điều chỉnh giảm [13].ASC là những chất tiêu hủy gốc tự do và được ưu đãi với hoạt tính chống oxy hóa mạnh, có thể dẫn đến sự xâm nhập của quá trình tổng hợp melanin [12].
Tuy nhiên, không chỉ hoạt động chống oxy hóa mà còn tiết ra các cytokine cụ thể của ASC có thể góp phần vào hiệu quả làm trắng. TGF-b đóng vai trò ức chế sự hình thành sắc tố, vì nó cản trở hoạt động của tyrosinase.Một mức độ cao của yếu tố tăng trưởng này đã được phát hiện trong ASC, có thể chịu trách nhiệm cho việc ức chế tổng hợp mela-nin bởi ADSC-CM [12].Mặc dù cần có các nghiên cứu lâm sàng sâu hơn, việc sử dụng ADSC và các yếu tố bài tiết của chúng cho thấy khả năng ứng dụng tuyệt vời trong các rối loạn da tăng sắc tố (Hình 10.1 và 10.2).
Các tác động thúc đẩy mọc tóc của ADSC
Một số báo cáo đã chứng minh rằng các yếu tố tăng trưởng như PDGF, HGF, VEGF và fibronectin kích thích sự phát triển của lông ở các mô hình động vật và lâm sàng [12, 14].
Để xác định xem liệu những tác động nội tiết này của ADSC có thể thúc đẩy sự phát triển của tóc hay không, Won và cộng sự đã nghiên cứu tác động của ADSC đối với tế bào nhú da ở người được nuôi cấy (hDPCs). Điều trị ADSC làm tăng đáng kể sự gia tăng hDPCs lên đến 130% sau 48 giờ.
Nghiên cứu động vật trên chuột bạch đã xác nhận những kết quả này [14]. Đặc biệt, về mặt mô học, da lưng của những con chuột được điều trị bằng ADSC-CM cho thấy số lượng nang lông tăng lên.
Nghiên cứu này chỉ ra rằng ADSCs thúc đẩy sự phát triển của tóc bằng cách tăng sự gia tăng của các DPC và kích hoạt giai đoạn anagen của chu kỳ tóc (Hình.10.3) Gần đây, có báo cáo rằng điều trị bằng phương tiện điều trị ADSCs (ADSC-CM) có hiệu quả đối với chứng rụng tóc kiểu phụ nữ (FPHL). Một nghiên cứu hồi cứu, quan sát về kết cục ở 27 bệnh nhân có FPHL và được điều trị bằng ADSC-CM đã được thực hiện. Các tác giả đã sử dụng các đầu kim nhỏ để cho phép ASC-CM khắc sâu vào làn da của con người.
Để đánh giá hiệu quả của phương pháp điều trị, hồ sơ bệnh án của bệnh nhân và hình ảnh tam giác đã được phân tích. ASC-CM cho thấy hiệu quả trong điều trị FPHL sau 12 tuần điều trị (Shin và cộng sự, 2015). Ví dụ, độ dày của tóc và mật độ tóc tăng lên đáng kể, và không có bệnh nhân nào báo cáo phản ứng phụ [15].Fukuoka và Suga cũng báo cáo tác dụng của một sản phẩm thương mại có chứa dung dịch protein của môi trường điều hòa tế bào gốc có nguồn gốc từ mỡ trong việc phục hồi tóc. Thuốc được tiêm trong da ở 22 bệnh nhân bị rụng tóc [16]. Những bệnh nhân này được điều trị 3-5 tuần một lần trong tổng số sáu buổi, và tóc của họ đã tăng lên đáng kể ở cả bệnh nhân nam và nữ.
Nguồn gốc của tế bào gốc
Về mặt lâm sàng, hai nguồn tế bào gốc trung mô ở người (hMSCs) được khai thác phổ biến nhất là tủy xương (hBMSCs) và chất béo (hASCs).
De Ugarte và cộng sự. đã chứng minh không có sự khác biệt đáng kể về năng suất giữa các tế bào mô đệm, động học tăng trưởng, sự già đi của tế bào, khả năng biệt hóa đa dòng và hiệu quả truyền gen giữa hBMSCs và hASCs.
Việc lấy tủy là một phương pháp điều trị tương đối đau và xâm lấn. Và với sự già đi, số lượng và nồng độ hMSC thu được bằng cách hút tủy suy giảm.
Ngược lại, hMSC có thể được tìm thấy với một lượng dồi dào trong chất béo. hASC giữ được khả năng tồn tại tốt và tiềm năng khác biệt ngay cả ở những bệnh nhân lớn tuổi, với tỷ lệ lão hóa thấp hơn và khả năng tăng sinh cao hơn [17, 18].
Tế bào gốc và tê tại chỗ
Người ta báo cáo rằng lidocaine có thể có tác động tiêu cực đến ASC. Trên thực tế, nồng độ từ 0,03% trở lên của lidocain có thể gây độc cho tế bào gốc [19].Goldman và cộng sự. đã tiến hành hút mỡ dưới gây mê toàn thân trên một vùng dưới ánh sáng tiêu chuẩn bằng lidocaine [20].
Ở mặt đối diện, hút mỡ được thực hiện dưới vòi phun không có lidocain. Năm ml mỡ hút ra đã được xử lý để phân lập SVF. Các ASC kết dính được đếm sau 24 giờ nuôi cấy.Việc loại bỏ lidocain làm giảm đáng kể quá trình chết của SVF và ASC trong khi hút mỡ [20].Vì lý do này, điều rất quan trọng là loại bỏ lidocain hoặc các loại thuốc gây tê khác được tiêm trong quá trình lấy mỡ. Rửa là một quy trình hiệu quả để thực hiện điều này.
Đồng thời, tại thời điểm tiêm tế bào gốc, chỉ nên sử dụng thuốc gây tê bên ngoài vùng điều trị mong muốn và / hoặc sử dụng tê khối thần kinh vùng để tránh sự tiếp xúc giữa tế bào gốc và gây tê cục bộ [19, 21]
Tế bào gốc và thuốc
Gần đây, Bowen đã thực hiện một cuộc đánh giá các loại thuốc dược phẩm và chất bổ sung có thể có tác dụng bất lợi trong việc chữa lành ASC. Đặc biệt, việc sử dụng các loại thuốc chống viêm nonsteroid nên được ngừng sử dụng ít nhất 5 ngày trước khi làm thủ thuật vì tác động tiêu cực của chúng đối với việc chữa lành.
Vì corticosteroid có tác động tiêu cực đến quá trình hồi phục, nên trì hoãn thủ thuật ít nhất 8 tuần sau khi tiêm steroid. Nếu có thể, nên ngừng sử dụng steroid dạng hít trước khi làm thủ thuật.
Một số cảnh báo đã được đưa ra liên quan đến ảnh hưởng của chất ức chế men khử 3-hydroxy-3-methyl-glutaryl-coenzyme A (HMG-CoA) (ví dụ: atorvastatin [Lipitor]) và chất ức chế bơm proton (omeprazole) đối với sự phát triển của tế bào gốc trong ống nghiệm . Đặc biệt, chất ức chế HMG-CoA reductase làm giảm hình thành tang sinh mạch. Đối với những người đang hoặc đã sử dụng chất ức chế HMG-CoA reductase, nên cân nhắc việc bổ sung coenzyme Q-10 [22]
Các giao thức khác nhau để phân lập tế bào gốc có nguồn gốc từ mỡ (ASCs)
Enzym tiêu hóa
Hầu hết các quy trình cho phân lập tế bào gốc có nguồn gốc từ mỡ sử dụng quá trình phân hủy bằng enzym với collagenase và sau đó phát triển trong môi trường có nguồn gốc từ động vật (Bảng 10.1). Trong các giao thức này, tế bào gốc phải chịu sự thao tác rộng rãi (Hình 10.4). Thao tác mở rộng và nói chung, mở rộng ex-vivo rất khó thực hiện do các yêu cầu về tuân thủ “sản xuất tế bào” theo Hướng dẫn Thực hành Sản xuất Tốt (cGMP) hiện hành [23].Hơn nữa, quá trình tiêu hóa bằng enzym mất khoảng 3–27 giờ. Mặc dù vậy, nó yêu cầu thuốc thử có nguồn gốc từ động vật.
Bảng 10.1 Giao thức cách ly tiêu chuẩn
| Cách ly tiêu chuẩn |
| Hút hết nước muối và dầu |
| Rửa 250 ml chất béo 3–5 lần, mỗi lần trong 5 phút trong nước muối đệm phosphat (PBS), loại bỏ pha dưới cho đến khi trong |
| Thêm 0,075% collagenase trong PBS và ủ trên máy lắc ở 37 ° C trong 1 giờ |
| Thêm Dulbecco’s Modified Eagle Medium (DMEM) chứa 10% huyết thanh (FBS) để trung hòa collagenase |
| Ly tâm chất béo đã tiêu hóa trong các ống 50 ml ở 1200 × g trong 10 phút |
| Đặt lại các tấm trong dung dịch ly giải tế bào đỏ 160 mM (amoni clorua-NH4 CI) và ủ trong 10 phút |
| Ly tâm ở 1.200 × g trong 10 phút |
| Rửa các tế bào 2 lần trong PBS |
| Đặt lại các tấm và đường ngang tế bào qua lưới nylon 100 μm |
| Thời lượng: khoảng 3–27 giờ. Vật liệu: máy ly tâm, máy lắc gia nhiệt, NH4CI, DMEM, FBS, PBS, lưới nylon 100 μm |
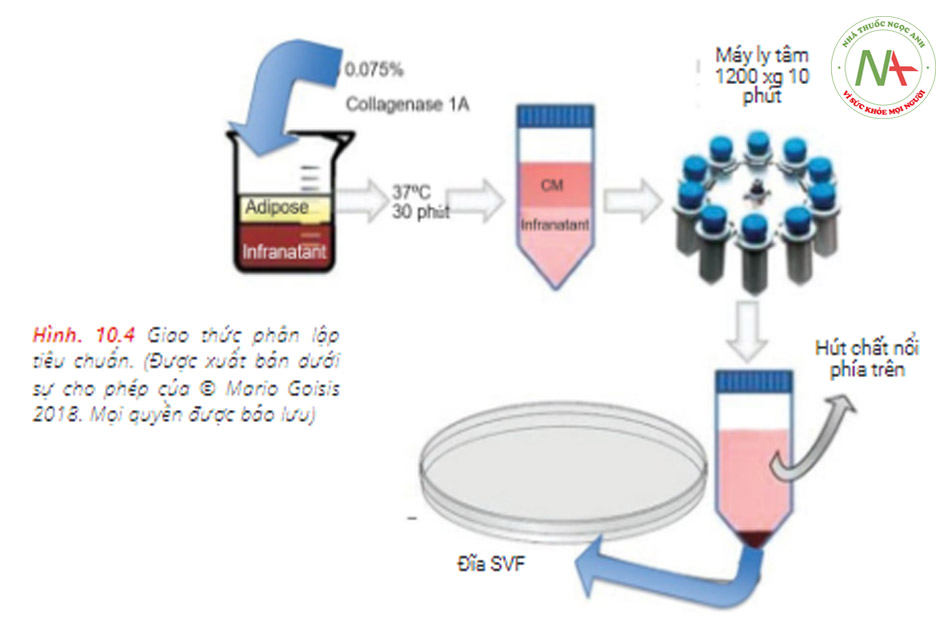
(collagenase). Collagenase dư có khả năng độc hại và có liên quan đến nguy cơ mắc các tác dụng phụ nghiêm trọng, chẳng hạn như phản ứng dị ứng, mà cũng có thể gây loét da, chấn thương dây thần kinh và tổn thương gân hoặc dây chằng [23].
Hơn nữa, phân hủy bằng enzym là một quy trình rất tốn kém. Collagenase có giá khoảng $ 20 hoặc khoảng € 18 cho mỗi 100 g tiêu hóa mô mỡ, trong khi các yếu tố khác liên quan (huyết thanh, Dulbecco’s Modified Eagle Medium và nước muối đệm phosphat) có giá khoảng $ 15 hoặc € 13 cho mỗi quy trình [23]
Cách ly cơ học bằng máy lắc rung
Raposio và cộng sự. đã trình bày một chiến lược mới và hiệu quả để cô lập các tế bào gốc có nguồn gốc từ mỡ từ việc thu hoạch mỡ thông thường [23].
Toàn bộ quy trình mất khoảng 15 phút; không sử dụng colagen, huyết thanh hoặc thuốc thử có nguồn gốc từ động vật.
Đặc biệt, phòng mổ hoặc phòng phẫu thuật được trang bị máy lắc rung và máy ly tâm, cả hai đều được đặt trên một băng luồng khí nhiều lớp. Quy trình phân lập được thực hiện từng bước dưới tủ thổi khí tầng, do đó giảm thiểu rủi ro nhiễm bẩn.
Trong nghiên cứu của Raposio và cộng sự, mô mỡ được thu hoạch bằng các quy trình hút mỡ tiêu chuẩn bằng cách sử dụng các ống cannula có đầu tù thông thường được gắn vào ống tiêm LuerLok 10 ml. Thành phần của mỗi ống tiêm, khoảng 10 mL, được chuyển đến phía dưới băng luồng khí thành các ống nghiệm bằng nhựa 10 ml.
Sau đó, các ống này được đặt trong máy lắc rung ở tốc độ 6.000 vòng / phút trong 6 phút và ngay sau đó, được quay ly tâm ở tốc độ 1.600 vòng / phút trong 6 phút. Sau đó, trong cùng một băng luồng khí, tầng ở dưới cùng của mỗi ống được thu thập bằng hệ thống pipet tự động và được đổ vào ống tiêm LuerLok 10 ml.
Raposio và cộng sự. đã chứng minh rằng quy trình này dẫn đến một quần thể tế bào gốc dồi dào hơn 12% so với quy trình được phân lập bằng cách sử dụng quy trình enzym tiêu chuẩn.Nó không yêu cầu mở rộng hoặc thao tác tế bào gốc, và do đó, nó không phải tuân theo các hạn chế quy định do Nguyên tắc cGMP áp đặt.
Bộ Microfat SVF: Phân lập cơ học trong hệ thống kín
Năm 2016 (hội nghị FACE, London), Goi-sis và cộng sự trình bày nguyên mẫu của một bộ công cụ mới để cô lập các tế bào gốc có nguồn gốc từ mỡ.Không sử dụng collagenase, huyết thanh hoặc thuốc thử có nguồn gốc từ động vật. Vì kit SVF microfat không yêu cầu mở rộng hoặc thao tác tế bào gốc, do đó, nó không phải tuân theo các hạn chế quy định do Hướng dẫn cGMP áp đặt.Ống cannula được sử dụng để thu hoạch chất béo được gọi là ống cannula Goisis.
Trên cơ sở các kết quả tương tự thu được bằng cách sử dụng các cannula nhỏ, chất béo được thu hoạch bằng cách sử dụng cannula Goisis có tỷ lệ thành phần mô đệm và mạch máu cao hơn (dẫn đến cải thiện năng suất của ADSC cô lập).
Đặc biệt, các xét nghiệm mô học được thực hiện trên 247 mẫu đã chứng minh rằng các tế bào mỡ được thu hoạch bằng cách sử dụng cannula Goisis có liên quan đến tỷ lệ phần trăm cao của các thành phần mô đệm và mạch máu khi so sánh với chất béo được thu hoạch bằng cách sử dụng công nghệ cannula một cổng. [24].
Phòng điều trị được trang bị máy rung và máy ly tâm, cả hai đều được đặt gần bệnh


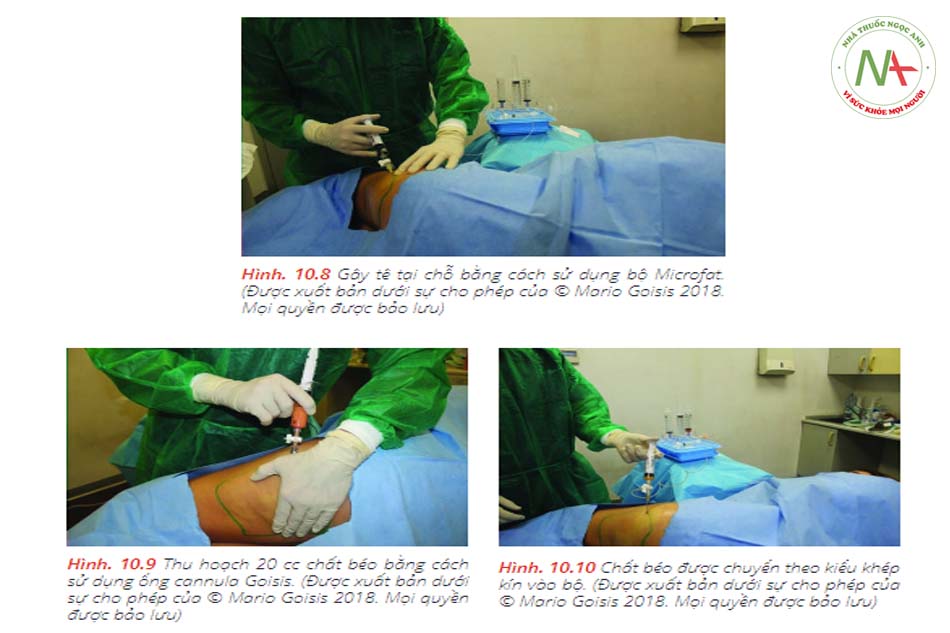



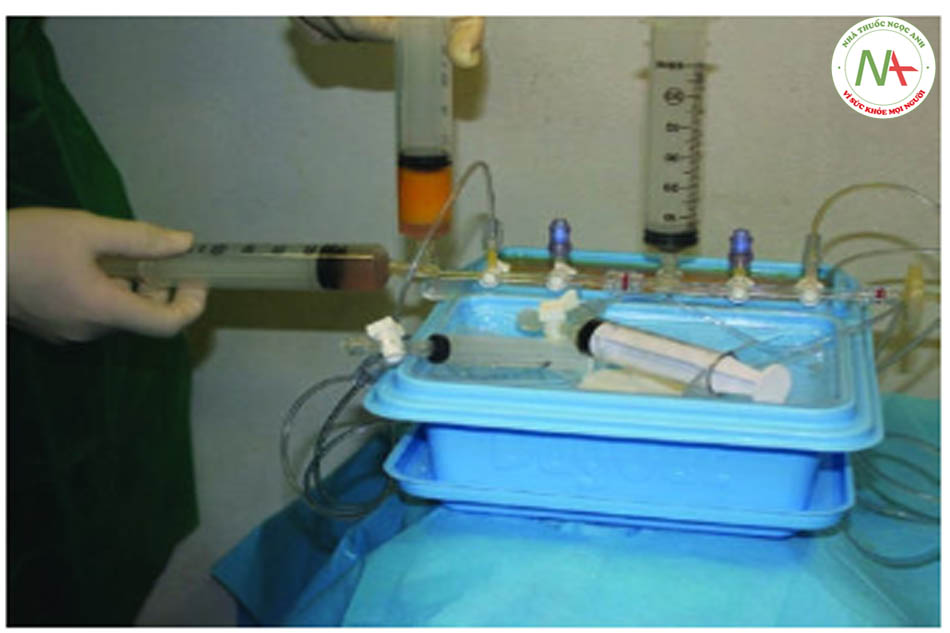

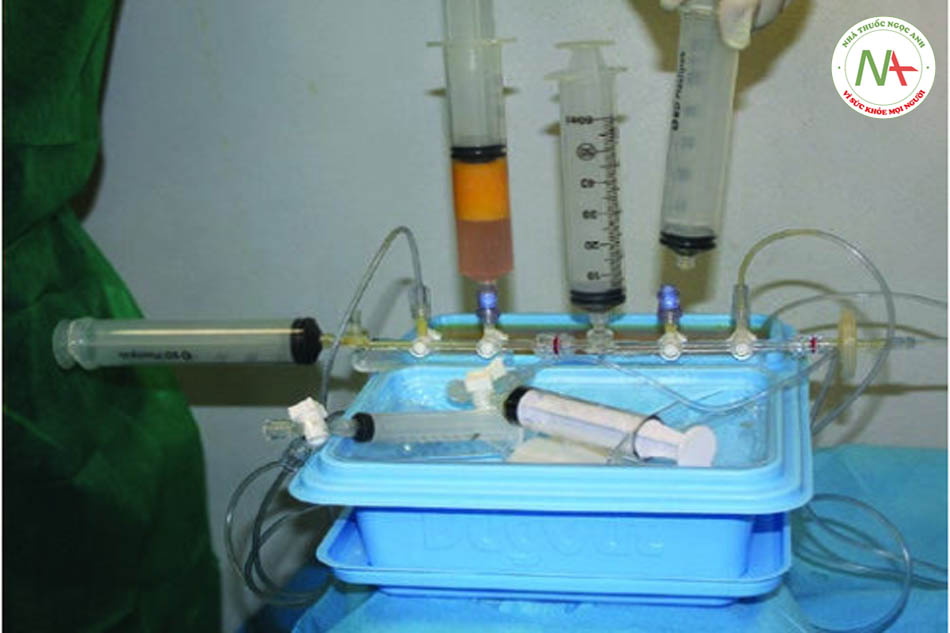
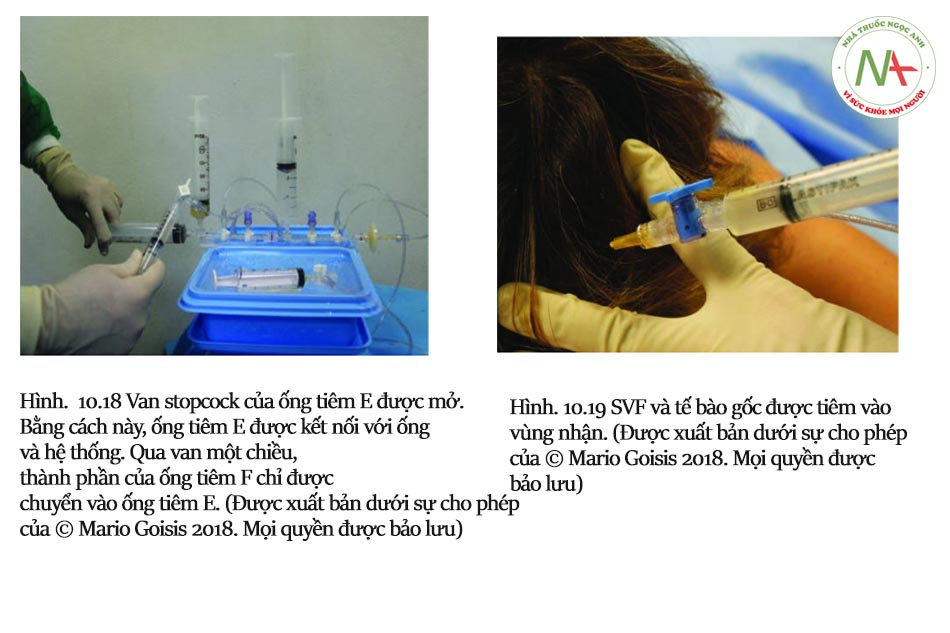
Goisis và cộng sự so sánh các giao thức, IMCAS 2019) vai trò của bộ Microfat SVF Kit và khả năng tồn tại của tế bào gốc đã được thảo luận. Số lượng tế bào gốc của 2 mẫu khác nhau được đo ở 72 giờ, 7 ngày và 14 ngày sau khi thu mẫu. Mẫu đầu tiên là microfat được thu hoạch bằng Goisis Cannula và được xử lý bằng Hệ thống Goisis, với giá trị tế bào gốc cao (5600, 6300, 6500).
Mẫu thứ hai là siêu lọc, với mức độ tế bào gốc khá đáng kể (2478, 3500 và 3900). một số hình ảnh của tế bào gốc được báo cáo trong hình ảnh. Kính hiển vi ánh sáng của ADSc nuôi cấy sau khi Goisis xử lý mỡ hút ra. Trung mô tế bào gốc được đặc trưng bởi nhiều tế bào chất và nhân trung tâm. Sau bảy ngày tế bào nuôi cấy khá hợp lưu trong bình nuôi cấy.
Quét bản sao hiển vi điện tử của tế bào gốc trung mô được nuôi cấy trong bảy ngày. Bảng điều khiển Độ phóng đại thấp hơn chứng tỏ tình trạng hợp lưu của các tế bào. Bảng B cho thấy sự phóng đại của các tế bào và các nhánh tế bào chất rất dài nhô ra khỏi tế bào.
Kính hiển vi lên tế bào gốc trung mô biểu hiện-đồng thời các điểm đánh dấu SEEA3 và CD105. Sự biểu hiện của hai điểm đánh dấu này cho phép xác định một quần thể nhỏ các tế bào gốc trung mô được đặc trưng bởi đa năng và có khả năng biệt hóa trong các tế bào trưởng thành khác nhau. bảng A hiển thị dân số phụ ở một bệnh nhân 35 tuổi, trong khi bảng B hiển thị dân
PRL® mỡ chuyển hóa Giàu Tiểu cầu
Phương pháp PRL® (Platelet-Rich Lipo-transfer) là kết quả của kinh nghiệm nhiều năm trong việc sử dụng mô mỡ được làm giàu bằng huyết tương giàu tiểu cầu (PRP) và phân đoạn mạch máu mô đệm (SVF) trong các quy trình phẫu thuật khác nhau.Hệ thống PRL bao gồm ba thiết bị:
• Hệ thống tách Fastkit SVF để cách ly SVF
• Hệ thống C.Punt để chuẩn bị PRP
• Hệ thống trộnFastkit là một phương pháp dựa trên việc lọc chọn lọc SVF và tách bằng ly tâm Nó dựa trên một thiết bị dùng một lần làm giảm dần kích thước của các cụm mô mỡ (từ các cụm có đường kính 1–3,5 mm đến các cụm 0,2–0,8 mm), đồng thời loại bỏ dầu và tế bào đỏ. Toàn bộ quá trình xảy ra trong một hệ thống ngâm hoàn toàn. Thiết bị tiêu chuẩn 225 mL Lipogems cho phép xử lý khoảng 100–130 mL mỡ hút ra để thu được khoảng 60–100 mL sản phẩm cuối cùng. Sản phẩm này là một dẫn xuất mô mỡ với vẻ ngoài của một sản phẩm được thao tác tối thiểu có thể được tiêm. Nó không yêu cầu mở rộng hoặc thao tác trên tế bào gốc, và do đó, nó không phải tuân theo các hạn chế quy định của Hướng dẫn cGMP. Mô học của sản phẩm có nguồn gốc từ lipogem cho thấy mô mỡ bị phân mảnh và tổn thương mô mỡ.
Lipogems
Hệ thống Lipogems (Lipogems Interna-tional S.R.L., Milan, Ý) là một thiết bị không có enzyme được sử dụng để thu được một dẫn xuất mô mỡ được làm giàu cao trong các phần tử giống pericyte Mặc dù vậy, Lipogems cần được phân loại là một hệ thống thu hoạch, xử lý và tiêm trở lại chất béo của con người. Trên thực tế, Lipogems không thể phân lập tế bào gốc. Sản phẩm cuối cùng (Lipogems) chứa các tế bào mỡ trưởng thành trộn với các tế bào gốc [1]
Nanofat: Kỹ thuật Tonnard
Vào năm 2013 Tonnard và cộng sự xuất bản một kỹ thuật sáng tạo. Chất béo thu hoạch được nhũ hóa cơ học và lọc cho đến khi thu được hỗn dịch lỏng. Tonnard gọi đây là “chất béo nano – nanofat” [25].Đặc biệt, quá trình nhũ hóa chất béo được thực hiện bằng cách di chuyển chất béo giữa hai ống tiêm 10 cc, được kết nối bởi một đầu nối LuerLok. Sau 30 lần trôi qua, chất béo trở nên lỏng và có dạng hơi trắng (Hình 10.33a, b). Trên thực tế, chất béo đã bị phân mảnh và biến đổi thành dạng nhũ tương. Sau khi nhũ hóa, chất lỏng mỡ được lọc qua vải nylon vô Đánh giá mô học và khả năng tồn tại cho thấy chất béo nano đã làm mất cấu trúc bình thường của mô mỡ.
Nói chung, tế bào mỡ bị phá hủy và thay thế bằng nhũ tương nhờn. Tuy nhiên, việc phân lập và nuôi cấy đã chứng minh rằng một số lượng lớn tế bào gốc trung mô chất lượng tốt vẫn có trong các mẫu chất béo nano.Tonnard coi chất béo nano như một quy trình kỹ sư hóa mô in vivo. Trên thực tế, tác dụng chính của chất béo nano là hoạt động của tế bào gốc.Trong chất béo nano, phần mạch mô đệm không được tinh chế mà được trộn với dầu và phần tế bào mỡ chết. Tuy nhiên, theo ý kiến của Tonnard, việc tách phần mạch mô
Nanograft: Kỹ thuật Planas
Mục đích chính của kỹ thuật Planas nano-fat là tránh tiếp xúc với không khí.Vì lý do này, theo kinh nghiệm của mình, Planas đã không dùng đến việc lọc chất béo qua vải nylon như mô tả ban đầu của Tonnard và cộng sự, trong nỗ lực duy trì toàn bộ quy trình trong một hệ thống kín, nhằm giảm nhiễm trùng và oxy hóa của mô.
Vì không sử dụng vải nylon nên việc tiêm ban đầu được thực hiện bằng một kim nhọn 25-GA, rộng hơn một chút so với kim được sử dụng bởi Tonnard và cộng sự. Kim 25GA được sử dụng như một bộ lọc cơ học cho những phần tử không bị nhũ tương, đặc biệt là trong mô liên kết. Đôi khi cần phải thay kim nhiều lần trong quá trình làm thủ thuật vì nó bị tắc bởi mô liên kết này.
Tất nhiên, việc sử dụng kim có đường kính lớn hơn làm tăng sự xuất hiện của bầm máu sau khi điều trị.
Một sự đổi mới là sự ra đời của Bộ công cụ Nanofat (Nanofat Planas Kit), cho phép một người thực hiện quá trình nhũ hóa và lọc chất béo bằng một hệ thống hoàn toàn khép kín.Thiết bị này bao gồm hai ống tiêm 10 mL mỗi ống được kết nối với một thiết bị ba chiều, một túi thu 10 mL với một sợi 120 μ bên trong, và một ống tiêm 10 ml khác cho chất béo nano – nanofat
Một bộ lọc lưới nylon với các lỗ lưới 120 μ là lựa chọn tối ưu với tầm nhìn vừa để ngăn sản phẩm không bị vón cục hoặc tắc nghẽn và giữ nguyên vẹn các tế bào gốc vì các lỗ hở nhỏ có thể làm hỏng sản phẩm tế bào được thu thập.
Với thiết bị này, quá trình nhũ hóa chất béo được thực hiện, bằng cách dịch chuyển chất béo 30 lần giữa hai ống tiêm, thông qua đầu nối 3 chiều. Khi hành động này đã được thực hiện xong, đầu nối sẽ được xoay và gửi các thành phần trong ống tiêm vào túi thu thập, nơi các hạt còn sót lại được lọc; nội dung này được hút trực tiếp qua ống tiêm 10 cc sau đó Thông qua một đầu nối LuerLok, chất béo nano được chuyển đến ống tiêm LuerLok 1 mL, và sau đó được thâm nhập bằng cách sử dụng kim 27–30-GA.
Phân tích tế bào gốc Nanofat
Các mẫu chất béo đã được nhũ tương hóa đã được gửi để đánh giá mô đến Phòng thí nghiệm Tế bào gốc và Ung thư, tại Viện Nghiên cứu Vall d ́Hebron (Barcelona, Tây Ban Nha). Sử dụng phương pháp đo tế bào dòng chảy, sự hiện diện của các tế bào CD34 + sống được đã được phân tích. Ngoài ra, kiểm tra bằng kính hiển vi tương phản được sử dụng để hiển thị các mô mỡ bị gián đoạn và các tế bào chết.
Sử dụng kính hiển vi huỳnh quang, Tonnard và cộng sự cho rằng các tế bào mỡ không thể sống được và cấu trúc mô mỡ không bình thường đã được phát hiện khi phân tích các mẫu chất béo đã được nhũ tương hóa [25]. Tuy nhiên, khi nhũ tương này được đưa qua máy phân loại tế bào được kích hoạt từ tính để lựa chọn tế bào CD34 +, họ đã thu được các sản phẩm có chứa tối đa 100.000 tế bào CD34 + trên 100 mL mỡ hút được.
Phân loại tế bào từ tính cho phép phân tách nhanh các tế bào mong muốn với sản lượng và độ tinh khiết tuyệt vời, đồng thời duy trì chức năng của tế bào. Tuy nhiên, độ tinh khiết của các tế bào được phân loại không phải là một thông số hiệu suất đủ và việc phục hồi hầu hết các tế bào gốc có trong sản phẩm chất béo ban đầu là rất mong chờ.Để khắc phục những hạn chế liên quan đến năng suất và / hoặc phục hồi số lượng tế bào gốc sau khi tách tế bào từ tính, chúng tôi đã thực hiện phép đo miễn dịch huỳnh quang trực tiếp đối với số lượng tế bào tuyệt đối CD34 + bằng phương pháp đo tế bào dòng hội tụ âm. Trong nghiên cứu của chúng tôi, phần còn lại tế bào từ chất béo được nhũ tương hóa đồng thời được nhuộm bằng kháng thể PE-CD34 và FITC-CD45, và Vybrant (R) DyeCycle ™ Violet (DCV), một chất nhuộm axit nucleic thấm tế bào có thể thâm nhập vào nhân mà không cần cố định tế bào, và nó tương thích với nhiều ứng dụng tế bào sống.
Một cách ngắn gọn, chất béo đã nhũ tương được lọc qua lưới nylon 52 μm, và nước thải đầu ra được thu thập cho các xét nghiệm đo tế bào dòng chảy. Các phần chất béo nano (100 μL) được nhuộm bằng PE-CD34, FITC-CD45 và DCV trong 20 phút ở RT, được phát hiện qua ánh sáng.
Phép đo lưu lượng tế bàoTất cả các phép đo tế bào đều được thực hiện bằng Máy đo tế bào tiêu điểm Attune® (Life Technologies, Carlsbad, CA). Các mẫu nanofat được nhuộm đồng thời bằng PE-CD34, PE-CD133, FITC-CD45 và DCV. Filtrekết hợp được sử dụng bao gồm 555 DLP, BP 530/30 (FITC) và 620 DLP, 574/26 (PE). Quá trình chuyển đổi bị dừng khi thu thập được tối thiểu 10.000 sự kiện DCV + được giám sát trực tiếp. FITC, PE và DCV huỳnh quang được thu thập theo thang đo logarit.
Kết quả
Phân tích tế bào gốc
Tế bào CD34 + được phát hiện trong chất béo nhũ tương (> 50% tổng số tế bào DCV; Hình 10.46a), và gần một nửa số tế bào CD34 + đồng biểu hiện CD45 (43,22%; Hình 10.46b), cho thấy nguồn gốc tạo máu của chúng. Những kết quả này cho thấy sự phong phú của các tế bào CD34 + từ các mẫu chất béo nano, cho thấy rằng mô mỡ có thể tạo thành một ổ chứa thiếu oxy cho các tế bào gốc tạo máu CD34 +.
Sự tăng sinh trong các tế bào CD34 có thể được giải thích bởi vì mô đệm có thể tạo ra một cái bẫy để cô lập các tế bào CD34 + tuần hoàn máu ngoại vi. Mô mỡ đặc biệt thiếu oxy (40–50 mmHg), và đây có thể là lý do giải thích cho sự xuất hiện của tế bào gốc CD34 +, hỗ trợ cho một nhóm bằng chứng ngày càng tăng cho thấy rằng nhiều loại tế bào gốc khác nhau tồn tại trong một môi trường thiếu oxy
Nanofat: Bộ Goisis Nanofat Kit
Bộ công cụ Goisis (www.microfat.com) là một hệ thống để rửa chất béo và sản xuất chất béo nano. Tất cả các thủ tục được thực hiện bằng một hệ thống khép kín. Bằng cách này, giảm nguy cơ nhiễm trùng và không có sự tiếp xúc giữa chất béo và không khí.
Đặc biệt, microfat được thu hoạch bằng cách sử dụng hộp microfat (www.microfat.com).Sau đó, ống tiêm chứa đầy microfat được kết nối với bộ DE nanofat. Sản xuất chất béo nano dựa trên một hệ thống khép kín, không tiếp xúc với không khí.Thủ tục rất nhanh chóng và hiệu quả.
Tham khảo thêm
1. Bianchi F, Maioli M, Leonardi E, Olivi E, Pasquinelli G, Valente S, Mendez AJ, Ricordi C, Raffaini M, Tremolada C, Ventura C. A new nonenzymatic method and device to obtain a fat tissue derivative highly enriched in peri-cyte-like elements by mild mechanical forces from human lipoaspirates. Cell Transplant. 2013;22(11):2063–77.
2. Ventura C, Cantoni S, Bianchi F, Lionet-ti V, Cavallini C, Scarlata I, Foroni L, Maioli M, Bonsi L, Alviano F, Fossati V, Bagnara GP, Pas-quinelli G, Recchia FA, Perbellini A. Hyaluro-nan mixed esters of butyric and retinoic acid drive cardiac and endothelial fate in term pla-centa human mesenchymal stem cells and enhance cardiac repair in infarcted rat hearts. J Biol Chem. 2007;282(19):14243–52.
3. Cavallari G, Olivi E, Bianchi F, Neri F, Foroni L, Valente S, Manna GL, Nardo B, Ste-foni S, Ventura C. Mesenchymal stem cells and islet cotransplantation in diabetic rats: improved islet graft revascu- larization and function by preconditioned with natural mol-ecules. Cell Transplant. 2012;21(12):2771–81.
4. Stavely R, Robinson AM, Miller S, Boyd R, Sakkal S, NurgaliK. Human adult stem cells derived from adipose tissue and bone marrow attenu-ate enteric neuropathy in the guinea-pig model of acute colitis. Stem Cell Res Ther. 2015;6(1):244.
5. Wang W, He N, Feng C, Liu V, et al. Human adipose-derived mes- enchymal pro-genitor cells engraft into rabbit articular car-tilage. Int J Mol Sci. 2015;16:12076–91.
6. Chang YH, Liu HW, Wu KC, Ding DC. Mesenchymal stem cells and their clinical applications in osteoarthritis. Cell Trans-plant. 2016;25:937.
7. Sato M, Uchida K, Nakajima H, Mi-yazaki T, Guerrero AR, Watanabe S, Roberts S, Baba H. Direct transplantation of mesenchy-mal stem cells into the knee joints of Hartley strain guinea pigs with sponta- neous osteo