Thông Tin Thuốc
Thuốc tương đương sinh học là gì? Những điều cần biết về tương đương sinh học của thuốc
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Hiện nay, thị trường dược phẩm của nước ta ngày càng được mở rộng và phong phú. Ngày càng nhiều thuốc từ nước ngoài được nhập khẩu về Việt Nam, làm cho thị trường thuốc Việt Nam trở nên đa dạng, có thuốc có giá thành thấp song song với có thuốc giá thành cao. Giữa thị trường rộng lớn có cả thuốc đắt và rẻ, làm thế nào để có thể lựa chọn và sử dụng thuốc một cách an toàn, hợp lý, kinh tế và hiệu quả?
Một trong số các tiêu chí để trả lời câu hỏi trên, đó là về Tương đương sinh học của thuốc. Vậy tương đương sinh học là gì? Thuốc tương đương sinh học có an toàn không? Hãy cùng Nhà Thuốc Ngọc Anh tìm hiểu những thông tin về Thuốc tương đương sinh học trong bài viết ngay sau đây nhé.
Một số định nghĩa
Thực tế trên thị trường hiện nay, các thuốc biệt dược ngày một tràn lan trên thị trường, làm sao để đánh giá đó là một thuốc tốt, an toàn thì chúng cần phải được xem xét tới sinh khả dụng và tương đương sinh học. Với việc áp dụng các đặc tính dược động học, dược lực học, thử nghiệm lâm sàng và các thử nghiệm in vitro,…. Sẽ giúp xác minh được tác dụng, độ an toàn và tính hợp lý của thuốc. Bên cạnh đó còn giúp người mua tiết kiệm được chi phí, lựa chọn được thuốc có giá thành hợp lý nhưng vẫn đảm bảo hiệu quả và an toàn.
Sinh khả dụng là thông số giúp biểu thị tốc độ và mức độ hấp thu của một thuốc là nhanh hay chậm, là nhiều hay ít.
Trong khi đó, Tương đương sinh học giúp đánh giá một thuốc khác có cùng dạng bào chế, cùng tương đương sinh học,…với một thuốc đã có sẵn, nhờ đó mà có thể tìm ra và phát triển một loại thuốc mới có tác dụng tương đương nhưng nhiều đặc tính mới hơn, giá thành rẻ hơn.
Sinh khả dụng
Sinh khả dụng (Bioavailability): là một đặc tính thể hiện tốc độ và mức độ hấp thu của một dược chất hoặc một nhóm chất có tác dụng được giải phóng ra ở dạng bào chế và sẵn có ở tuần hoàn chung.
Tương đương bào chế
Tương đương bào chế (Pharmaceutical equivalence): những thuốc có chứa cùng loại dược chất với cùng một hàm lượng trong cùng một dạng bào chế, có cùng đường dùng và đạt cùng một mức tiêu chuẩn chất lượng, những thuốc này được xem là tương đương bào chế với nhau.
Tương đương sinh học
Tương đương sinh học (Bioequivalence) được định nghĩa: hai thuốc được coi là tương đương sinh học với nhau nếu chúng là những thuốc tương đương về bào chế hoặc là thế phẩm bào chế, và sinh khả dụng của hai thuốc này sau khi được dùng ở cùng một mức liều trong cùng một điều kiện thử nghiệm tương tự nhau, dẫn tới hiệu quả điều trị của chúng về cơ bản được xem là sẽ tương đương nhau.
Thuốc tương đương sinh học
Thuốc tương đương sinh học (Biosimilar) là thuốc có cấu trúc và chức năng tương tự như một thuốc sinh học.
Thuốc sinh học (hay sinh phẩm) là thuốc có bản chất là protein hoặc đoạn protein (có thể từ tự nhiên hoặc tổng hợp). Nguồn gốc của các thuốc sinh học không giống các loại thuốc khác, thuốc sinh học được sản xuất từ các vật thể sống như vi khuẩn hay nấm men hoặc các tế bào động vật.
Tương ứng với một số thuốc sinh học gốc có thể có một hoặc nhiều thuốc tương đương sinh học. Thuốc tương đương sinh học có cấu trúc tương tự nhưng không giống hoàn toàn so với thuốc sinh học gốc. Thuốc tương đương sinh học có cơ chế tác động gần như giống hoàn toàn so với thuốc gốc. Điều này có nghĩa là thuốc tương đương sinh học cũng được công nhận về mức độ an toàn và hiệu quả không kém gì thuốc sinh học gốc.
So sánh Thuốc tương đương sinh học và Thuốc Generic
Thuốc generic có thể được gọi là bản sao của thuốc biệt dược gốc (brand name). Thuốc generic có cơ chế tác động không khác gì thuốc biệt dược gốc và có thể được sử dụng như là một sự lựa chọn thay thế cho thuốc biệt dược gốc trong một số trường hợp điều trị cho các bệnh lý được chỉ định bởi thuốc biệt dược gốc.
Thuốc tương đương sinh học có thể được xem như là một phiên bản generic của thuốc sinh học. Tuy nhiên, chúng vẫn có sự khác biệt đáng quan tâm như: Không như thuốc generic, thuốc tương đương sinh học không phải bản sao y hệt của thuốc sinh học gốc mà chúng chỉ có cơ chế tác động tương tự nhưng không giống hoàn toàn.
Giống nhau
- Đều đã được so sánh và đánh giá với các thuốc gốc trong một số thử nghiệm lâm sàng.
- Các thuốc gốc được sử dụng làm chất chuẩn để đối chiếu đều đã được Cơ quan quản lý thực phẩm và dược phẩm Hoa Kỳ (FDA) chấp thuận và cấp phép lưu hành.
- Đều được FDA đánh giá theo các quy trình nghiêm ngặt tuy nhiên được rút ngắn hơn so với các quy trình của thuốc gốc.
- Đều được đánh giá về mức độ an toàn và có hiệu quả tương tự như thuốc gốc.
- Đều được xem là những lựa chọn điều trị tiết kiệm chi phí hơn hơn so với sử dụng thuốc gốc.
Khác nhau
| Thuốc tương đương sinh học | Thuốc Generic |
| Có nguồn gốc tự nhiên, không thể sao chép 100% vì các vật thể sống rất phức tạp và có thể thay đổi môi trường sống. | Có nguồn gốc từ những hợp chất hóa học tổng hợp. Có thể được sao chép 100%. |
| Chỉ có một vài điểm tương đồng về nguồn gốc hay cơ chế tác động tương tự với thuốc sinh học gốc | Giống hoàn toàn thuốc gốc |
| Khi so sánh với thuốc gốc cần thêm dữ liệu nghiên cứu vì có những điểm khác so với thuốc sinh học gốc. | Cần ít dữ liệu nghiên cứu hơn vì là bản sao với thuốc gốc |
| Khi đã được cấp phép lưu hành, cần thêm một phê duyệt đặc biệt để được sử dụng thay thế cho thuốc sinh học gốc | Không cần thêm phê duyệt khi đã được cấp phép lưu hành |
|
Quy trình phê duyệt của FDA khác nhau |
|
Tính an toàn của thuốc tương đương sinh học
Tương tự như các thuốc khác, một thuốc tương đương sinh học để được sử dụng trong điều trị cần được đánh giá thông qua các thử nghiệm lâm sàng và được cấp phép lưu hành bởi FDA.
Trong các thử nghiệm lâm sàng, các thuốc tương đương sinh học được so sánh với thuốc sinh học gốc. Các thử nghiệm lâm sàng được thiết kế nhằm đánh giá mức độ an toàn và hiệu quả của thuốc tương đương sinh học so với thuốc sinh học gốc trong điều trị của cùng một bệnh lý nhất định. Các quy trình của thử nghiệm lâm sàng cũng như đánh giá này đều thực hiện rất nghiêm ngặt tuy nhiên có thể rút ngắn thời gian hơn so với các thử nghiệm và đánh giá trước đó với thuốc sinh học gốc
Trong các nghiên cứu so sánh tương đương sinh học với các thuốc sinh học gốc thường đánh giá trên một số khía cạnh nhất định. Các thử nghiệm cần phải chứng minh được cả hai thuốc trên:
- Có cùng nguồn gốc
- Tương đồng về liều lượng và hiệu lực tác dụng
- Có đường dùng như nhau
- Có tác dụng như nhau trong việc điều trị cùng một bệnh lý
- Có các tác dụng không mong muốn tương tự nhau
Một thuốc tương đương sinh học sau khi đã được đánh giá trong các thử nghiệm lâm sàng nhằm chứng minh tính an toàn khi sử dụng trên người và được FDA cấp phép lưu hành, điều đó có nghĩa là thuốc này đã đạt tất cả các tiêu chuẩn nghiêm ngặt về tính an toàn và hoàn toàn an tâm đưa vào sử dụng.
Tại sao cần phải phát triển các thuốc tương đương sinh học?
Các thuốc sinh học gốc được các công ty sản xuất bỏ ra rất nhiều công sức và chi phí từ khâu nghiên cứu đến sản xuất nên chúng thường có giá thành rất cao. Do đó, các thuốc sinh học gốc thường ít người có khả năng tiếp cận được, mặc dù các thuốc này có thể xem là có tác dụng điều trị tốt nhất cho cùng một bệnh lý.
Nhằm giúp càng có nhiều người được tiếp cận với các phác đồ điều trị hiệu quả, Quốc hội Hoa Kỳ đã thông qua các đạo luật cạnh tranh về giá thành và phát minh sinh phẩm ( viết tắt là BP CIA). Đạo luật này đã cho phép FDA rút ngắn quy trình cấp phép lưu hành đối với các thuốc tương đương sinh học. Nhờ đó người bệnh có thể tiếp cận được với những phác đồ điều trị hiệu quả bằng thuống tương đương sinh học với giá thành lại rẻ hơn rất nhiều. Bên cạnh đó, còn làm đa dạng hơn trong sự lựa chọn cho phác đồ điều trị.
Tuy nhiên, số lượng các thuốc tương đương sinh học được thử nghiệm, được đánh giá không phải lúc nào cũng có sẵn và được cấp phép lưu hành cũng có những giới hạn. Ngoài ra, còn phải phụ thuộc đến các số lượng và các loại bệnh lý có thể được điều trị bằng các thuốc tương đương sinh học và số lượng thuốc tương đương sinh học được phép sử dụng.
Thiết kế Thử tương đương sinh học
Thử tương đương sinh học là quá trình nghiên cứu cực kì phức tạp và tốn kém vì cần phải có các trang thiết bị hiện đại và cần phải được thực hiện invivo trên những tình nguyện viên, phải tiến hành đo nồng độ của thuốc trong máu ở từng thời điểm nhất định.
Một thử nghiệm tương đương sinh học trước hết cần được dự trù bằng bản đề cương nghiên cứu (Protocol), nếu bản đề cương này được chấp thuận, thì sẽ được tiếp tục tiến hành tuần tự để có các kết quả thực nghiệm được chứng minh là đáng tin cậy.
Việc triển khai nghiên cứu tương đương sinh học bao gồm 2 giai đoạn chính: giai đoạn lâm sàng và giai đoạn phân tích định lượng.
Giai đoạn lâm sàng:
Người tình nguyện khỏe mạnh được khám sàng lọc phải, đạt được các tiêu chuẩn về khám lâm sàng (như nhịp tim, huyết áp, thân nhiệt, đường huyết, cân nặng…), đạt chỉ số tốt trong các xét nghiệm hóa sinh nếu cần thiết. Những người tình nguyện được tuyển chọn này phải ký một văn bản cam kết, đồng ý tình nguyên tham gia nghiên cứu để thử nghiệm đạt chuẩn y đức.
Sau đó, người tình nguyện được phân chia ngẫu nhiên để dùng thuốc nghiên cứu và thuốc đối chứng theo liệu trình tuân thủ đề cương nghiên cứu. Các mẫu dịch sinh học được lấy tại các thời điểm khác nhau theo đề cương đã được phê duyệt, bảo quản và chuyển sang giai đoạn phân tích.
Giai đoạn phân tích:
Tiến hành thử sinh khả dụng invivo với hai thuốc thử nghiệm (generic) và thuốc đối chiếu (biệt dược gốc) :nhằm xác định trị số Cmax, Tmax, AUC. Để có các trị số chính xác, cách cho uống thuốc, lấy mẫu máu ở người tình nguyện, cách nhận định lượng dược chất trong máu phải theo đúng qui cách. Trong thời gian nghiên cứu, người tình nguyện còn được theo dõi tác dụng phụ, độ an toàn của thuốc.
Xử lý thống kê đúng quy cách các trị số Cmax, Tmax, AUC để xác định độ tin cậy:các trị số đo được có sự sai lệch sẽ được phân tích bằng phương pháp ANOVA và Two One – Sided Test để chấp nhận khoảng tin cậy 90% và giới hạn sự sai lệch là 80 – 120% (trong trường hợp xử lý số liệu có chuyển log người ta dùng giới hạn sự chênh lệch là 80 – 125%) nhằm xem hai thuốc thử nghiệm và đối chiếu có tương đương sinh học hay không và đưa ra kết luận cuối cùng.
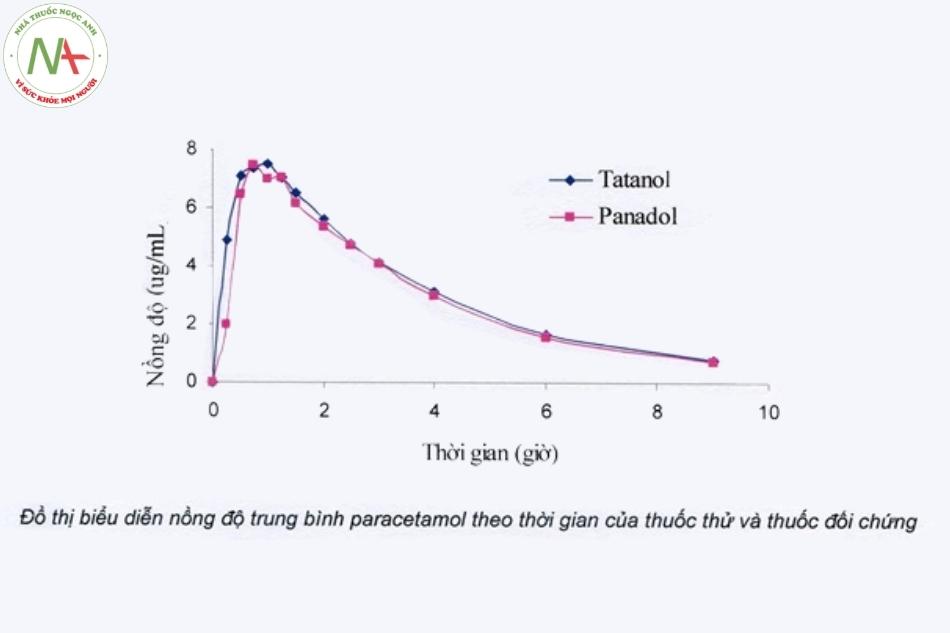
Hai thuốc được cho là tương đương khi kết quả thống kê cho thấy các thông số dược động học thu được là tương tự nhau theo quy định.
Quy trình Thử tương đương sinh học của một thuốc tại Việt Nam
Quy trình Thử tương đương sinh học của một thuốc được quy định cụ thể tại Điều 100 và Điều 101 Luật dược Việt Nam được trải qua 4 giai đoạn chính:
Bước 1: Cần đăng ký để tiến hành nghiên cứu thử tương đương sinh học của thuốc
Bước 2: Đơn đăng ký nghiên cứu thử tương đương sinh học của thuốc được phê duyệt.
Bước 3: Tiến hành tổ chức thực hiện thử tương đương sinh học của thuốc theo quy trình.
Bước 4: Nghiệm thu kết quả và phê duyệt kết quả của quá trình thử tương đương sinh học của thuốc.

Ý nghĩa của thử tương đương sinh học
Thử tương đương sinh học vừa có ý nghĩa trong khoa học, vừa là cơ sở pháp lý cho các nhà quản lý cũng như là minh chứng đảm bảo cho việc sử dụng thuốc an toàn, hiệu quả và hợp lý.
Chính vì vậy, nghiên cứu tương đương sinh học cần phải được tiến hành một cách có quy trình nghiêm ngặt và kỹ lưỡng, tại các đơn vị thử nghiệm có tư cách pháp nhân, được các cơ quan quản lý có thẩm quyền đánh giá và công nhận kết quả. Những đơn vị này cần phải được trang bị đầy đủ cơ sở vật chất để đáp ứng các yêu cầu khi phải dùng những kỹ thuật cao, luôn được chuẩn hóa Ngoài ra, đội ngũ những người tham gia tình nguyện dùng thuốc cần phải đạt các tiêu chuẩn về tình trạng sức khỏe, độ tuổi, cân nặng, giới tính,…
Các cơ quan Thử tương đương sinh học tại Việt Nam.
Trước đây, tại Việt nam, Viện Kiểm nghiệm thuốc Trung ương (Hà Nội) và Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh là hai cơ sở chính đảm nhận thực hiện các quy trình Thử tương đương sinh học.
Tính đến ngày 7/5/2021, Việt Nam đã có 6 cơ sở uy tín Thử tác dụng sinh học. Danh sách các cơ sở, bạn đọc có thể đọc thêm tại đây.
Tài liệu tham khảo
- Bộ Y tế, Thông tư số 10/2020/TT-BYT, Quy định về thử tương đương sinh học của thuốc.
- The American Cancer Society , What Are Biosimilar Drugs?, truy cập ngày 24 tháng 5 năm 2022

bài viết cung cấp đủ thông tin cần thiết, rất cảm ơn các dược sĩ