Bệnh hô hấp
Thông khí hướng dẫn bằng áp lực đẩy so với thông khí bảo vệ phổi ở bệnh nhân ARDS: Một nghiên cứu ngẫu nhiên có kiểm soát tiền cứu
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Thông khí hướng dẫn bằng áp lực đẩy so với thông khí bảo vệ phổi ở bệnh nhân ARDS: Một nghiên cứu ngẫu nhiên có kiểm soát tiền cứu. file pdf ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
TÓM TẮT
Bối cảnh: Các phân tích thứ cấp của các thử nghiệm ngẫu nhiên có đối chứng cho thấy áp lực đẩy (DP) ≤ 14 cm H2O có thể liên quan đến việc cải thiện kết quả lâm sàng ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS). Do đó, mục đích của nghiên cứu này là đánh giá hiệu quả của thông khí được hướng dẫn bởi DP so với thông khí bảo vệ phổi thông thường (PLV) đối với kết quả lâm sàng ở bệnh nhân ARDS.
Phương pháp: Trong thử nghiệm tiền cứu, có kiểm soát này, 110 bệnh nhân mắc ARDS được phân ngẫu nhiên theo chiến lược thở máy vào nhóm PLV thông thường và nhóm thở máy do DP hướng dẫn (bằng cách duy trì giá trị DP ≤ 14 cm H2O). Kết quả lâm sàng là tỷ lệ tử vong vào ngày thứ 28 (kết quả chính), PaO2/FiO2, độ giãn nở tĩnh (Cstat), rối loạn chức năng (các) cơ quan, thời gian thở máy (MV) và thời gian nằm trong ICU.
Kết quả: Tỷ lệ tử vong vào ngày thứ 28 đã giảm ở nhóm thở máy theo hướng dẫn của DP so với nhóm PLV (20% so với 5,45%); tỷ lệ nguy cơ là 0,26 (95% CI: 0,09 đến 0,73). Chỉ số PaO2/FiO2, Cstat và số ngày không có MV cao hơn ở nhóm thở máy có hướng dẫn DP so với nhóm PLV. Rối loạn chức năng cơ quan, thời gian MV và thời gian nằm ICU ở nhóm thở máy theo hướng dẫn của DP thấp hơn đáng kể so với nhóm PLV.
Kết luận: Ở những bệnh nhân mắc ARDS, thông khí theo hướng dẫn của DP cho thấy khả năng sống sót, Cstat và oxygen hóa được cải thiện và tỷ lệ rối loạn chức năng cơ quan, thời gian MV và thời gian nằm trong ICU thấp hơn so với PLV.
Giới thiệu
Chiến lược bảo vệ phổi sử dụng thể tích khí lưu thông (4–6 ml/kg trọng lượng cơ thể dự đoán (predicted body weight − PBW)), PEEP hướng dẫn FiO2 và áp lực cao nguyên ≤ 30 cm H2O ở bệnh nhân mắc ARDS giúp cải thiện khả năng sống sót [1]. Giá trị tối ưu của PEEP phản ánh sự cân bằng giữa huy động phổi, căng phồng phổi và/hoặc rối loạn chức năng huyết động [2]. Việc sử dụng thông khí bảo vệ phổi (protective lung ventilation − PLV) thông thường có liên quan đến việc cải thiện oxygen hóa và khả năng sống sót ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (ARDS) [3, 4].
Cho đến nay, tỷ lệ tử vong vẫn còn cao mặc dù đã sử dụng chiến lược PLV, điều này có thể phản ánh sự mất cân bằng giữa thể tích khí lưu thông, thao tác PEEP, huy động phổi và siêu bơm phồng, như thể hiện trong các thử nghiệm lâm sàng. Ngoài ra, có những phản ứng mâu thuẫn khi điều chỉnh PEEP và thể tích khí lưu thông trong chiến lược PLV [5–7].
Việc tính toán thể tích khí lưu thông theo PBW không xem xét bệnh lý không đồng nhất của phổi trong ARDS với độ giãn nở khác nhau của hệ hô hấp [8]. Áp lực đẩy (DP) là tỷ lệ giữa thể tích khí lưu thông với Cstat. Nó có thể được tính đơn giản tại đầu giường là áp lực cao nguyên trừ đi PEEP [9]. Amato và cộng sự đã chỉ ra trong các phân tích thứ cấp của họ rằng DP là biến số chính cần được tối ưu hóa trong quá trình thở máy (mechanical ventilation − MV) ở bệnh nhân ARDS và liên quan đến khả năng sống sót được cải thiện [10].
Thử nghiệm của chúng tôi cho thấy rằng việc giữ DP ≤ 14 cm H2O ở bệnh nhân ARDS có thể cải thiện kết quả lâm sàng của bệnh nhân do giảm tổn thương phổi do thở máy. Do đó, mục đích của nghiên cứu này là đánh giá tác động của chiến lược thông khí được hướng dẫn bởi DP so với PLV thông thường đối với kết quả lâm sàng ở bệnh nhân ARDS. Kết quả chính là tỷ lệ tử vong vào ngày thứ 28. Các kết quả phụ bao gồm oxygen hóa, độ giãn nở của phổi, rối loạn chức năng (các) cơ quan, thời gian MV và thời gian nằm viện ICU.
Phương pháp
Nghiên cứu song song ngẫu nhiên có kiểm soát tiền cứu này được thực hiện tại Đơn vị Chăm sóc Chuyên sâu Phẫu thuật (SICU) của Bệnh viện Đại học Tanta, Ai Cập, sau khi được ủy ban đạo đức của tổ chức phê duyệt (mã phê duyệt 32.422/06/18) và được đăng ký tại Cơ quan đăng ký thử nghiệm lâm sàng Pan African (Số ID; PACTR201807132391075). Nhận được sự đồng ý bằng văn bản từ người thân của bệnh nhân. Tất cả các dữ liệu thu thập được chỉ được sử dụng cho nghiên cứu này. Nghiên cứu đã được mở nhãn là mù của nghiên cứu không thể truy cập được. Nghiên cứu được thực hiện từ tháng 8 năm 2018 đến tháng 1 năm 2020.
Tiêu chí đưa vào nghiên cứu như sau: Bệnh nhân ≥ 18 tuổi ở cả hai giới, đang điều trị bằng MV và đáp ứng định nghĩa ARDS của Berlin [11] khi được chỉ định khởi phát cấp tính trong vòng một tuần, tỷ số P/F ≤ 300 mmHg với PEEP ≥5 cm H2O, Hình mờ hai bên phổi được thể hiện bằng X- quang ngực hoặc siêu âm phổi phù hợp với phù phổi và loại trừ tình trạng quá tải dịch và suy tim khi không có nguyên nhân rõ ràng của ARDS.
Phụ nữ mang thai và bệnh nhân có thông số huyết động không ổn định (MAP dưới 65 mmHg hoặc bất kỳ liều thuốc vận mạch và/hoặc hỗ trợ tăng co bóp nào), tràn khí màng phổi hoặc rối loạn chức năng (không phải rối loạn chức năng phổi) theo thang điểm đánh giá suy cơ quan tuần tự (SOFA) ở mức thời gian phân bổ đã được loại trừ.
Phong bì kín được sử dụng để phân nhóm ngẫu nhiên bệnh nhân dựa trên lựa chọn PEEP và chiến lược thông khí vào nhóm PLV thông thường (nhóm đối chứng) và nhóm thông khí theo hướng dẫn của DP. Việc chọn ngẫu nhiên và tuyển sinh được thực hiện bởi một bác sĩ không tham gia nghiên cứu.
Bắt đầu thở máy
Tất cả các bệnh nhân được giữ ở tư thế nửa nằm và được quản lý bằng chiến lược bảo vệ phổi bằng chế độ kiểm soát thể tích (VC). Thể tích khí lưu thông được đặt ở mức 6 mL/kg, dựa trên PBW. Áp lực cao nguyên (Pplat) được giữ ≤ 30 cmH2O trong suốt quá trình nghiên cứu bằng cách giảm VT theo từng bước 1 ml/kg xuống mức 4 ml/kg. Mức oxy được chấp nhận (SpO2 88– 95% hoặc PaO2 60–80 mmHg) được duy trì bằng cách đặt FiO2 ban đầu ở mức 40% và sau đó điều chỉnh nếu mức oxy mục tiêu không được đáp ứng. PEEP ban đầu được đặt ở mức 5 cmH2O, trong khi tần số máy thở được đặt để duy trì thông khí phút đầy đủ (7 đến 9 L/phút) và pH động mạch >7,25–7,44. Tỷ lệ hít vào và thở ra (tỷ lệ I/E) ban đầu được đặt ở mức 1:2. Tất cả bệnh nhân được an thần bằng cách truyền liên tục midazolam (0,1 mg/kg/giờ) và giãn cơ bằng cách tiêm nhanh 3 mg cis-atracurium theo yêu cầu trong quá trình chuẩn độ PEEP đã được điều chỉnh trong ca làm việc buổi sáng theo phân bổ nhóm mỗi ngày một lần. Việc lựa chọn PEEP được hướng dẫn bởi mạng ARDS [3] như trong Bảng 1 ở nhóm I trong khi lựa chọn PEEP được đặt để giữ DP ≤ 14 cm H2O ở nhóm II thông qua thao tác điều chỉnh giá trị PEEP tăng thêm 2 cm H2O để đạt được giá trị mục tiêu của DP với điều kiện duy trì huyết động ổn định của bệnh nhân.
Nếu DP mục tiêu không được đáp ứng, thể tích khí lưu thông sẽ giảm 1 ml/kg theo các bước thấp nhất là 4 ml/kg PBW.
Tất cả các bệnh nhân được quản lý theo chiến lược thông khí trong mỗi nhóm cho đến khi đáp ứng các tiêu chí cai máy và theo cùng một quy trình cai máy, theo quy trình đơn vị.
Thu thập dữ liệu và phép đo
Đối với mỗi bệnh nhân, các dữ liệu sau được thu thập: tỷ lệ tử vong vào ngày thứ 28 (kết quả chính), tỷ lệ P/F, Cstat, rối loạn chức năng/các cơ quan theo điểm số SOFA, huyết động học (áp lực động mạch trung bình và nhịp tim), chấn thương khí áp, thời gian nằm viện. MV, phân loại cai máy (cai đơn giản, khó hoặc kéo dài), ngày không MV (không hỗ trợ thở sau khi rút ống nội khí quản thành công) vào ngày thứ 28, ngày không rối loạn chức năng (các) cơ quan vào ngày thứ 28 và thời gian nằm ICU. Bệnh nhân được theo dõi trong 28 ngày.
Phương pháp thống kê
Cỡ mẫu
Tính toán cỡ mẫu bằng gói thống kê phần mềm Epi-Info (phiên bản 2002) do Tổ chức Y tế Thế giới (WHO) và Trung tâm Kiểm soát và Phòng ngừa Dịch bệnh (CDC) tạo ra, Atlanta, Georgia, Hoa Kỳ. Số lượng bệnh nhân trong cỡ mẫu được tính ở N = 55 trong mỗi nhóm dựa trên khoảng tin cậy (CI) 95%, hiệu suất nghiên cứu 80%, tỷ lệ nhóm: nhóm là (1:1) và kết quả chính ở nhóm chứng (tỷ lệ tử vong ở ngày thứ 28) là 32%, trong khi ở nhóm nghiên cứu là 10%.
Bảng 1. Kết hợp FiO2 (%) và PEEP (cmH2O) theo mạng lưới ARDS [3]
| FiO2 (%) | 30 | 40 | 40 | 50 | 50 | 60 | 70 | 70 | 70 | 80 | 90 | 90 | 90 | 100 |
| PEEP (cmH2O) | 5 | 5 | 8 | 8 | 10 | 10 | 10 | 12 | 14 | 14 | 14 | 16 | 18 | 20-24 |
Phân tích thống kê
Phân tích thống kê được thực hiện bằng SPSS v25 (IBM Inc. Chicago, USA). Thử nghiệm Shapiro-Wilks được sử dụng để kiểm tra tính quy phạm của dữ liệu. Dữ liệu định lượng có phân phối chuẩn được biểu thị bằng giá trị trung bình và độ lệch chuẩn (trung bình ± SD) và được so sánh bằng thử nghiệm t không ghép cặp. Dữ liệu định lượng có phân phối bất thường được biểu thị dưới dạng dải trung vị và dải tứ phân vị (IQR) và được so sánh bằng phép thử Mann-Whitney giữa cả hai nhóm. Dữ liệu định tính được biểu thị dưới dạng tần suất và tỷ lệ phần trăm (%) và được so sánh bằng phép thử Chi-square hoặc Fisher Exact. Đường cong Kaplan-Meier với log- rank test được sử dụng để so sánh tỷ lệ sống sót của bệnh nhân vào ngày thứ 28 ở hai nhóm nghiên cứu. Giá trị P hai đuôi ˂ 0,05 thể hiện ý nghĩa thống kê.
Kết quả
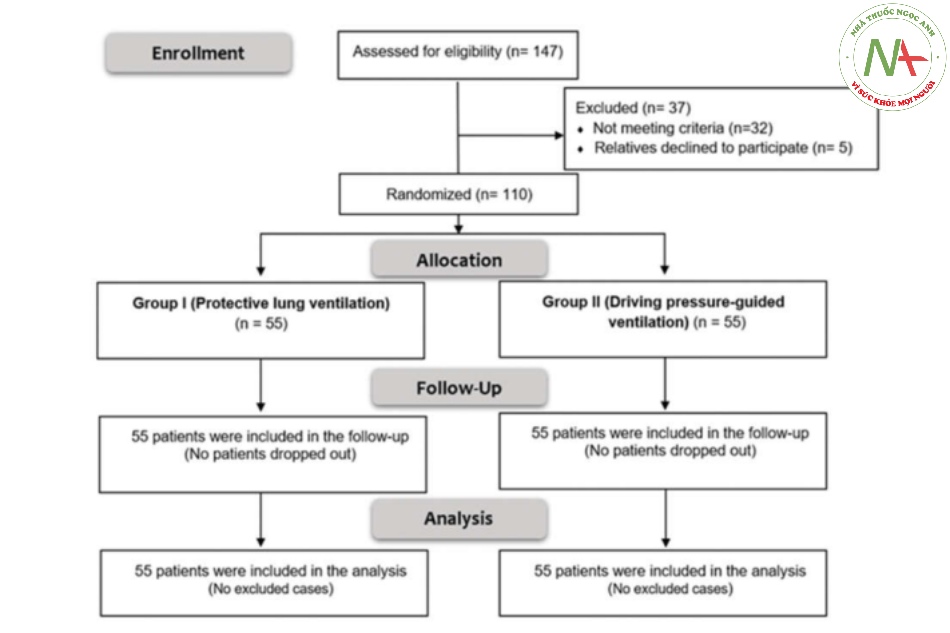
Trong nghiên cứu này, 147 bệnh nhân được đánh giá đủ điều kiện; 32 bệnh nhân không đủ tiêu
chuẩn đưa vào nghiên cứu, 5 người thân từ chối tham gia nghiên cứu. 110 bệnh nhân còn lại được phân ngẫu nhiên thành hai nhóm (55 bệnh nhân trong mỗi nhóm) (Hình 1). Về bệnh nhân, đặc điểm (tuổi, giới tính và cân nặng), nguyên nhân và mức độ nghiêm trọng của ARDS, không có sự khác biệt đáng kể giữa cả hai nhóm (giá trị P lần lượt = 0,396, 0,872, 0,095, 0,925 và 0,608) (Bảng 2).
Tỷ lệ tử vong vào ngày thứ 28 đã giảm ở nhóm thở máy theo hướng dẫn của DP so với nhóm chứng (20% so với 5,45%); tỷ lệ nguy cơ thấp hơn ở nhóm thông khí theo hướng dẫn của DP (0,26 lần; 95% CI: 0,09 đến 0,73). Thời gian nằm ICU, thời gian MV, số bệnh nhân bị rối loạn chức năng cơ quan và số bệnh nhân có biểu hiện huyết động không ổn định (MAP ˂ 65 mmHg), ở nhóm thở máy theo hướng dẫn của DP thấp hơn đáng kể so với nhóm đối chứng (giá trị P = 0,004, 0,023, 0,010 và 0,041 tương ứng) (Bảng 3). Chỉ số PaO2/FiO2 và Cstat tốt hơn đáng kể ở nhóm thở máy theo hướng dẫn của DP so với nhóm đối chứng (Hình 2, 3).
Bảng 2. Đặc điểm bệnh nhân, nguyên nhân và mức độ nghiêm trọng của ARDS
| PLV group (n = 55) | DP-guided ventilation group (n = 55) | p value | ||
| Age (years) | 42.91 ± 12.96 | 40.91 ±11.62 | 0.396 | |
| Sex | Male | 33 (60%) | 29 (52.7%) | 0.872 |
| Female | 22 (40%) | 26 (47.3%) | ||
| Weight (Kg) | 69.95 ± 7.46 | 72.18 ±6.44 | 0.095 | |
| Causes of ARDS | Pneumonia | 26 (47.3%) | 27 (49.1%) | 0.925 |
| Sepsis | 17 (30.9%) | 15 (27.3%) | ||
| Aspiration | 5 (9.1%) | 4 (7.3%) | ||
| Lung contusions | 4 (7.3%) | 4 (7.3%) | ||
| TRALI | 3 (5.5%) | 4 (7.3%) | ||
| Near drowning | 0(0%) | 1 (1.8%) | ||
| Seventy of ARDS | Mild | 20 (36.4%) | 25 (45.5%) | 0.608 |
| Moderate | 22 (40.0%) | 18 (32.7%) | ||
| Severe | 13 (23.6%) | 12 (21.8%) | ||
Data presented as mean ± SD or number (percent), TRALI: Transfusion related acute lung injury
Bảng 3. Kết quả lâm sàng ở 2 nhóm nghiên cứu
| PLV group (n = 55) | DP-guided ventilation group (n = 55) | p value | ||
| 28th day mortality | 11 (20%) | 3 (5.45%) | 0.042 | |
| Weaning | Simple | 8(14.55%) | 19 (34.55%) | 0.004 |
| categories | Difficult | 6(10.91%) | 13 (23.64%) | |
| Prolonged | 30 (54.55%) | 20 (36.36%) | ||
| No weaning (Died) | 11 (20%) | 3 (5.45%) | ||
| ICU stay (days) | 17(10-21) | 13(10-16) | 0.004 | |
| Duration of mechanical ventilation (days) | 11 (7-16) | 10(6-13) | 0.023 | |
| Mechanical ventilation free days | 13(8.5-19) | 18(15-22) | <0.001 | |
| Adverse | Barotrauma | 2 (3.6%) | 3 (5.5%) | 1 |
| events | Hemodynamic instability | 17 (30.9%) | 8 (14.5%) | 0.041 |
| (MAP <65 mmHg)
Organ/s dysfunction |
15 (27.3%) | 4 (7.3%) | 0.010 | |
| Organ/s dysfunction free days | 28 (5.5-28) | 28 (28-28) | 0.045 | |
Data presented as mean ± SD, median (IQR) or number (%), ICU: Intensive care unit, MAP: Mean arterial blood pressure, ’significant as p value < 0.05
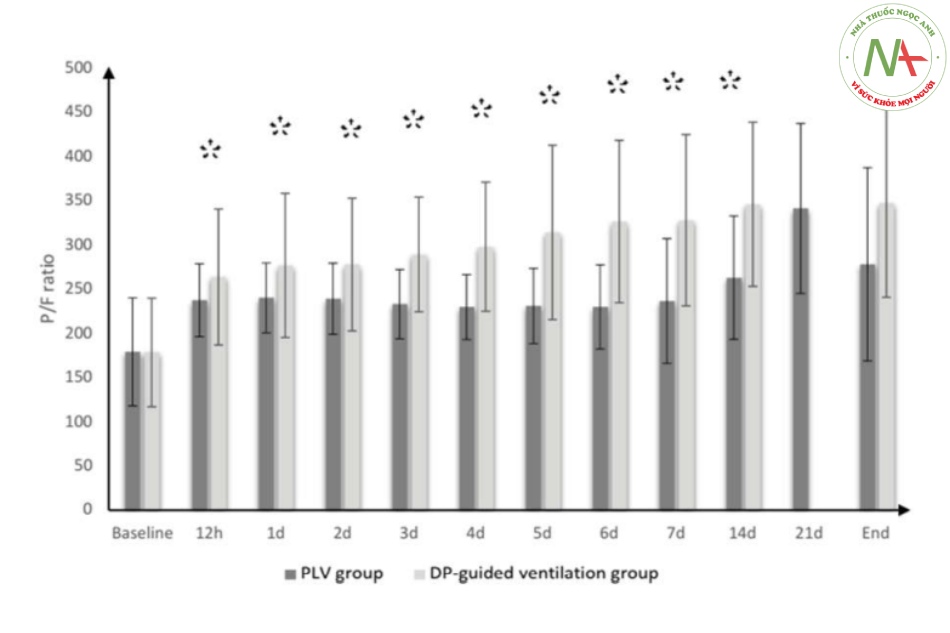
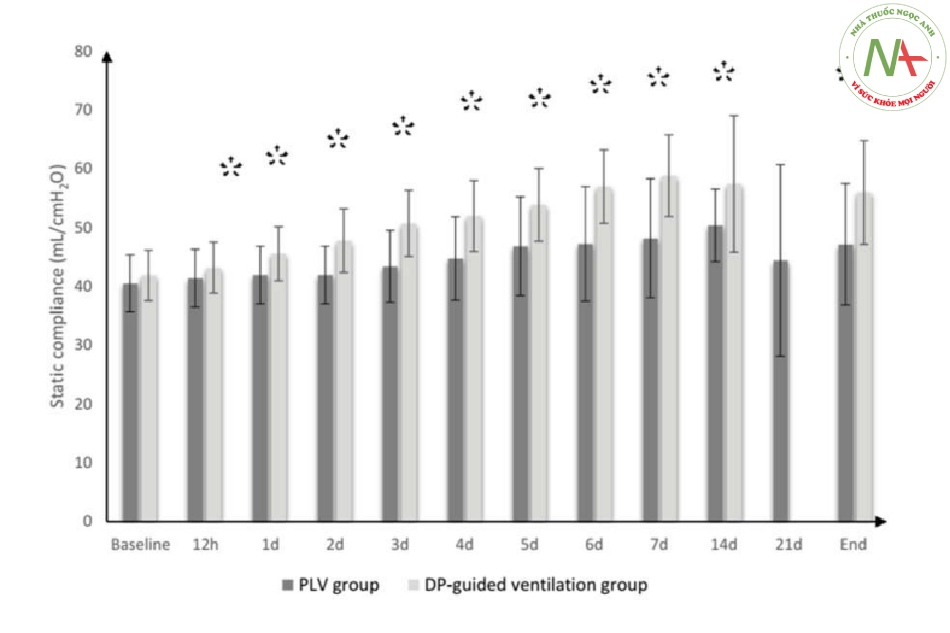
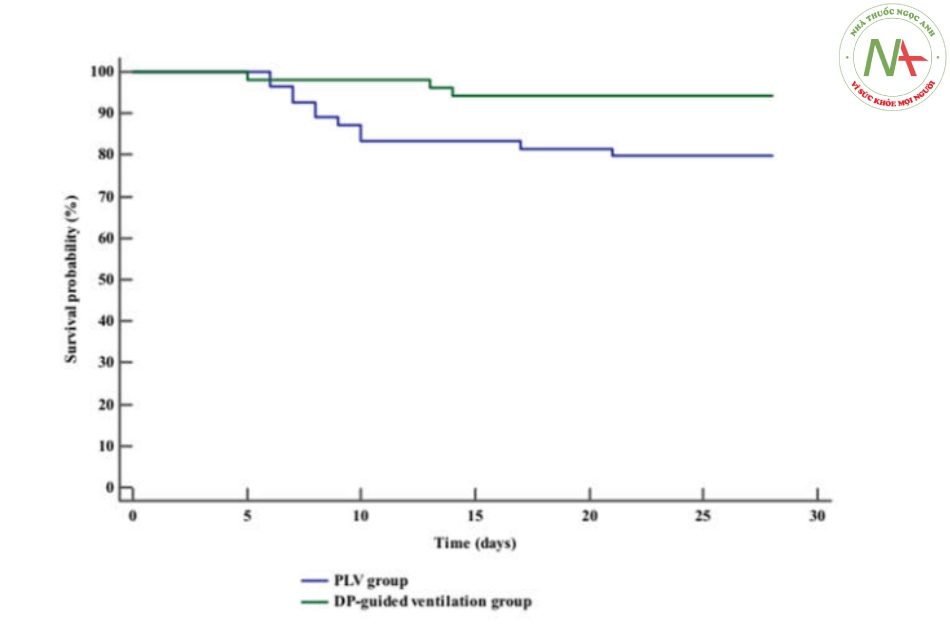
Số ngày không có MV vào ngày thứ 28, số ngày không bị rối loạn chức năng cơ quan/các cơ quan vào ngày thứ 28 và bệnh nhân cai máy thành công ở nhóm thở máy theo hướng dẫn của DP cao hơn đáng kể so với nhóm chứng (giá trị P <0,001, 0,045 và 0,004, tương ứng), (Bảng 3). Tỷ lệ và thời gian sống sót cao hơn đáng kể ở nhóm thở máy theo hướng dẫn của DP so với nhóm kiểm soát (Hình 4).
Thảo luận
Trong nghiên cứu hiện tại, tỷ lệ tử vong vào ngày thứ 28 và rối loạn chức năng/các cơ quan đã giảm trong chiến lược thở máy theo hướng dẫn của DP. Ngoài ra, thông khí theo hướng dẫn của DP đã cải thiện quá trình oxygen hóa, độ giãn nở của phổi và kết quả cai máy. Hơn nữa, nó làm giảm thời gian nằm ICU và thời lượng MV. DP 14 cm H2O là biến số liên quan đến khả năng sống sót trong bệnh viện được cải thiện ở bệnh nhân ARDS, theo báo cáo của Amato và cộng sự [10] và Laffey và cộng sự [12]. Amato và cộng sự, trong một phân tích hồi cứu dữ liệu từ một số RCT, đã kết luận rằng DP là một yếu tố dự đoán tử vong tốt hơn so với Cstat hoặc thể tích khí lưu thông. Họ giải thích lợi ích của biến DP máy thở đối với việc tối ưu hóa MV ở bệnh nhân ARDS bằng cách chỉ áp dụng thông khí cho các đơn vị phổi được sục khí. Laffey và các đồng nghiệp của ông, trong nghiên cứu Lung Safe, đã phát hiện ra rằng DP ≤ 14 cmH2O có liên quan đến kết quả sống sót tốt hơn ở những bệnh nhân mắc ARDS từ trung bình đến nặng.
Hơn nữa, kết quả của nghiên cứu này phù hợp với kết quả của các nghiên cứu khác [13, 14]. Kasis và cộng sự [15] báo cáo tỷ lệ tử vong vào ngày thứ 28 được cải thiện, oxygen hóa và độ giãn nở hệ thống hô hấp được cải thiện trong chiến lược máy thở dẫn đến giảm DP. Guerin và cộng sự [16] nói rằng DP là một tham số nguy cơ về tỷ lệ tử vong, cùng với Pplat và Cstat. Họ nhận thấy rằng những bệnh nhân có giá trị DP thấp hơn có kết quả sống sót tốt hơn (giảm tỷ lệ tử vong ở ngày thứ 90) với điểm số SOFA giảm đáng kể ở những người sống sót so với những người có giá trị DP cao hơn.
Tác dụng có lợi của thông khí hướng dẫn DP so với PLV ở bệnh nhân ARDS có thể được giải thích bằng sự phân bố bệnh lý phổi không đồng nhất trong ARDS [17]. Các đơn vị không được sục khí của phổi chịu trách nhiệm cho việc giảm Cstat [18], phản ánh thể tích phổi cuối thì thở ra. Đổi lại, tỷ lệ thể tích khí lưu thông/thể tích phổi cuối thì thở ra đại diện cho strain của phổi. Do đó, tỷ lệ này, còn được gọi là DP, có thể được coi là thay thế cho strain của phổi. Việc sử dụng thể tích khí lưu thông theo PBW trong chiến lược PLV khiến phổi bị kéo căng và căng phồng theo chu kỳ, giải phóng các chất trung gian gây viêm vào tuần hoàn hệ thống, từ đó có tác động tiêu cực đến chức năng của/các cơ quan. Mặt khác, trong thông khí được hướng dẫn bởi DP, thao tác điều chỉnh thể tích khí lưu thông phù hợp với kích thước của phổi được sục khí, giúp ngăn ngừa strain theo chu kỳ hoặc động của phổi [19].
Serpa Neto và cộng sự [20] đã thực hiện một nghiên cứu phân tích tổng hợp, bao gồm 9 nghiên cứu về những bệnh nhân bị thiếu oxy dai dẳng nhận ECMO. Họ phát hiện ra rằng việc giảm đáng kể thể tích khí lưu thông và DP đi kèm với việc bắt đầu ECMO, dẫn đến cải thiện quá trình oxygen hóa. Họ kết luận rằng DP là thông số máy thở độc lập duy nhất có liên quan đến tỷ lệ tử vong trong ECMO. Ngoài ra, họ phát hiện ra rằng các giá trị DP thấp hơn có liên quan đến kết quả sống sót tốt hơn. Aoyama và cộng sự [21], trong một phân tích tổng hợp khác, đã kết luận rằng giá trị DP cao hơn có liên quan đến kết quả sống sót thấp hơn trong MV của bệnh nhân ARDS.
Xem xét chỉ số P/F và Cstat, thông khí hướng dẫn theo DP đã cải thiện cả hai chỉ số này so với PLV. Những phát hiện này có cùng bối cảnh với Etenssoro và cộng sự [22], De Jong và cộng sự [23], và Kacmarek và cộng sự [24].
Không đồng ý với nghiên cứu này, Villar và cộng sự [25] tuyên bố rằng Pplat tốt hơn DP trong việc dự đoán tỷ lệ tử vong tại bệnh viện. Họ phát hiện ra rằng trong một phân tích thứ cấp của các nghiên cứu quan sát, bao gồm cả những bệnh nhân mắc ARDS từ trung bình đến nặng được quản lý bằng chiến lược PLV, so sánh hiệu quả của Pplat so với DP đối với dự đoán tỷ lệ tử vong. Họ phát hiện ra rằng có sự khác biệt không đáng kể giữa cả hai nhóm về quá trình oxygen hóa, Cstat và rối loạn chức năng cơ quan. Sự bất đồng này có thể được giải thích bằng giá trị giới hạn cao hơn của DP (19 cmH2O) trong nghiên cứu Villar và cộng sự. Cavalcanti và cộng sự [26] đã nghiên cứu ảnh hưởng của chiến lược PLV so với huy động phổi bằng chuẩn độ PEEP. Họ kết luận rằng việc sử dụng PLV với thể tích khí lưu thông 4–6 ml/kg đã cải thiện khả năng sống sót với việc giảm thời gian MV và thời gian nằm ICU so với huy động phổi bằng cách sử dụng PEEP chuẩn độ, mặc dù giá trị DP thấp vào ngày thứ 7 trong phổi nhóm huy động. Sự bất đồng này có thể được giải thích bằng khả năng căng quá mức phế nang ở nhóm huy động phổi.
Hạn chế: a) Đây không phải là thử nghiệm đa trung tâm b) Nghiên cứu không mù c) Phần lớn các trường hợp ARDS ở mức độ nhẹ đến trung bình.
Kết Luận
Ở những bệnh nhân mắc ARDS, thở máy theo hướng dẫn của DP cho thấy khả năng sống sót, Cstat và oxygen hóa được cải thiện và tỷ lệ rối loạn chức năng cơ quan, thời gian MV và thời gian nằm ICU thấp hơn so với PLV.
References
- Holman RR, Bethel, Mentz RJ, et Effects of once-weekly exenatide on cardiovascular outcomes in type 2 diabetes. N Engl J Med. 2017;377(13):1228–1239. [Crossref], [Web of Science ®], [Google Scholar]
- Gattinoni L, Carlesso E, Brazzi L, et al. Positive end-expiratory Curr Opin Crit Care. 2010;16:39–44. [Crossref], [Web of Science ®], [Google Scholar]
- The Acute Respiratory Distress Syndrome Ventilation with low tidal volumes as compared with traditional tidal volumes for acute respiratory distress syndrome. N Eng J Med. 2000;243(18):1301–1308. [Google Scholar]
- Valentini R, Aquino-Esperanza J, Bonelli I, et Gas exchange and lung mechanics in patients with acute respiratory distress syndrome: comparison of three different strategies of positive end expiratory pressure selection. J Crit Care. 2015;30(2):334–340. [Crossref], [Web of Science ®], [Google Scholar]
- Hager DN, Krishnan JA, Hayden DL, et Tidal volume reduction in patients with acute lung injury when plateau pressures are not high. Am J Respir Crit Care Med. 2005;172:1241–1245. [Crossref], [Web of Science®], [Google Scholar]
- Malhotra Low-tidal-volume ventilation in the acute respiratory distress syndrome. N Engl J Med. 2007;357:1113–1120. [Crossref], [Web of Science ®], [Google Scholar]
- Tonelli AR, Zein J, Adams J, et Effects of interventions on survival in acute respiratory distress syndrome: an umbrella review of 159 published randomized trials and 29 meta-analyses. Intensive Care Med. 2014;40(6):769–787. [Crossref], [Web of Science ®], [Google Scholar]
- Staffieri F, Stripoli T, De Monte V, et Physiological effects of an open lung ventilator strategy titrated on elastance-derived end-inspiratory trans-pulmonary pressure: study in a pig model. Crit Care Med. 2012;40(7):2124–2131. [Crossref], [Web of Science ®], [Google Scholar]
- Loring SH, Malhotra Driving pressure and respiratory mechanics in ARDS. N Engl J Med. 2015;372(8):776– 777. [Crossref], [Web of Science ®], [Google Scholar]
- Amato MB, Meade MO, Slutsky AS, et Driving pressure and survival in the acute respiratory distress syndrome. N Engl J Med. 2015;372(8):747–755. [Crossref], [Web of Science ®], [Google Scholar]
- Ranieri VM, Rubenfeld GD, Thompson BT, ARDS definition Task Acute respiratory distress syndromr: the Berlin definition. JAMA. 2012;307(23):2526–2533. [Web of Science ®], [Google Scholar]
- Laffey J, Bellani G, Pham T, et Potential modifiable factors contributing to outcome from acute respiratory distress syndrome: theLUNG SAFE study. Intensive Care Med. 2016;42(12):1865–1876. [Crossref], [Web of Science ®], [Google Scholar]
- Borges JB, Hedenstierna G, Larsson A, et Altering the mechanical scenario to decrease the driving pressure. Crit Care. 2015;19:342. [Crossref], [Web of Science ®], [Google Scholar]
- Grieco DL, Chen L, Dres M, et Should we use driving pressure to set tidal volume? Curr Opin Crit Care. 2017;23(1):38–44. [Crossref], [Web of Science ®], [Google Scholar]
- Kassis EB, Loring SH, Tamlor Mortality and pulmonary mechanics in relation to respiratory system and transpulmonary driving pressure in ARDS. Intensive Care Med. 2016;42:1206–1213. [Crossref], [Web of Science ®], [Google Scholar]
- Guerin C, Papazian I, Reignier J, et Effect of driving pressure on mortality in ARDS patients during lung protective mechanical ventilation in two randomized controlled trials. Crit Care. 2016;20:384. [Crossref], [Web of Science ®], [Google Scholar]
- Gattinoni L, Pesenti The concept of “baby lung”. Intensive Care Med. 2005;31:776–784. [Crossref], [Web of Science ®], [Google Scholar]
- Girard TD, Bernard GR. Mechanical ventilation in ARDS: a state-of-the-art review. Chest. 2007;131:921–929. [Crossref], [Web of Science ®], [Google Scholar]
- Arnal J-M, Saoli M, Garnero “Airway and transpulmonary driving pressures and mechanical powers selected by INTELLiVENT-ASV in passive, mechanically ventilated ICU patients. Heart Lung. 2020;49(4):427–434. [Crossref], [Web of Science ®], [Google Scholar]
- Serpa Neto A, Schmidt M, Azevedo LC, et Association between ventilator settings during extracorporeal membrane oxygenation for refractory hypoxemia and outcome in patients with acute respiratory distress syndrome: a pooled individual patient data analysis: mechanical ventilation during ECMO. Intensive Care Med. 2016;42:1672–1684. [Crossref], [Web of Science ®], [Google Scholar]
- Aoyama H, Pettenuzzo T, Aoyama K, et Association of driving pressure with mortality among ventilated patients with acute respiratory distress syndrome: a Systematic review and Meta-analysis. Crit Care Med. 2018;46(2):300–306. [Crossref], [Web of Science ®], [Google Scholar]
- Estenssoro E, Dubin A, Laffaire E, et Incidence, clinical course, and outcome in 217 patients with acute respiratory distress syndrome. Crit Care Med. 2002;30(11):2450–2456. [Crossref], [Web of Science ®], [Google Scholar]
- De Jong A, Cossic J, Verzilli D, et Impact of the driving pressure on mortality in obese and non-obese ARDS patients: a retrospective study of 362 case. Intensive Care Med. 2018;44(7):1106–1114. [Crossref], [Web of Science ®], [Google Scholar]
- Kacmarck RM, Villar J, Sulemanji D, et Open lung approach for the acure respiratory distress syndrome: a pilot, randomizex controlled trial. Crit Care Care Med. 2016;44(1):32–42. [Crossref], [Web of Science ®], [Google Scholar]
- Villar J, Martin-Rodriguez C, Domingues-Berrot AM, et Analysis of plateau and driving pressures: effects on mortality in patients with acute respiratory distress syndrome receiving lung-protective ventilation. Crit Care Med. 2017;17(5):843–850. [Crossref], [Google Scholar]
- Cavalcanti AB, Suzumura EA, Laranjeira LN, et al. Effect of lung recruitment and titrated positive end- expiratory pressure Low PEEP o mortality in patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2017;318(14):1335–1345. [Crossref], [Web of Science ®], [Google Scholar]
