Bệnh huyết học
Thay Huyết Tương Cho Tăng Độ Nhớt Liên Quan Đến Covid-19
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Để tải file PDF bài viết Thay Huyết Tương Cho Tăng Độ Nhớt Liên Quan Đến Covid-19 mời các bạn click vào link tại đây
Bài Dịch Của Bác Sĩ Trần Minh Thành- Khoa HSTC-CĐ
Tóm tắt
Cơ sở
Dữ liệu gần đây cho thấy mối liên quan giữa tăng độ nhớt của máu và xu hướng hình thành huyết khối và mức độ nghiêm trọng của bệnh ở bệnh nhân COVID-19. Điều này làm tăng khả năng tăng độ nhớt máu có thể góp phần gây tổn thương nội mô và suy đa cơ quan trong COVID-19, và thay huyết tương (TPE) để giảm độ nhớt máu có thể cải thiện dự hậu của bệnh nhân.
Tại đây, chúng tôi đã tìm cách chia sẻ kinh nghiệm sử dụng TPE ở 6 bệnh nhân đầu tiên được điều trị tăng độ nhớt máu liên quan đến COVID-19.
Thiết kế và Phương pháp Nghiên cứu
Sáu bệnh nhân COVID-19 nguy kịch có độ nhớt huyết tương ngưỡng dao động từ 2,6 đến 4,2 centipoise (cP; phạm vi bình thường, 1,4-1,8 cP) đã được TPE hàng ngày, trong 2-3 ngày điều trị.
Kết quả
TPE giúp giảm độ nhớt huyết tương ở cả sáu bệnh nhân (trung bình trước TPE 3,75 cP, ngưỡng 2,6-4,2 cP; trung bình sau TPE 1,6 cP, ngưỡng 1,5-1,9 cP). TPE cũng làm giảm mức fibrinogen ở tất cả năm bệnh nhân có kết quả (trung bình trước TPE 739 mg / dL, khoảng 601-1188 mg / dL; trung bình sau TPE 359 mg / dL, khoảng 235-461 mg / dL); Mức D-dimer ở tất cả sáu bệnh nhân (trung bình trước TPE 5921 ng / mL, khoảng 1134-60 000 ng / mL; trung bình sau TPE 4893 ng / mL, khoảng 620-7518 ng / mL); và mức CRP ở năm trong số sáu bệnh nhân (trung bình trước TPE 292 mg / L, khoảng 136- 329 mg / L; trung bình sau TPE 84 mg / L, khoảng 31-211 mg / L). Trong khi hai bệnh nhân nặng nhất đã tử vong, sự cải thiện đáng kể về tình trạng lâm sàng đã được quan sát thấy ngay sau khi TPE ở bốn trong số sáu bệnh nhân còn lại.
Kết luận
Loạt bài này chứng minh TPE điều chỉnh độ nhớt máu nhanh chóng ở những bệnh nhân tăng độ nhớt máu liên quan đến COVID-19. Tuy nhiên cần có thêm các nghiên cứu ngẫu nhiên lớn để xác định liệu TPE có thể cải thiện dự hậu lâm sàng cho bệnh nhân COVID-19 hay không.
GIỚI THIỆU
Tình trạng tăng đông ngày càng được công nhận là một yếu tố góp phần đáng kể vào tỷ lệ mắc bệnh và tử vong ở những bệnh nhân COVID-19 mức độ nguy kịch. Các nghiên cứu ban đầu báo cáo tỷ lệ huyết khối tĩnh mạch sâu (DVT) là 20% -46% ở bệnh nhân COVID-19,1,2 . Một nghiên cứu khác cho thấy tỷ lệ thuyên tắc phổi (PE) tăng gấp 5 lần ở những bệnh nhân COVID-19 phải nhập ICU so với những lần nhập viện trước đây vì ARDS . 3 Hàng loạt bài báo cáo khám nghiệm tử thi đã xác nhận sự hiện diện của cả huyết khối vi mạch và mạch máu lớn, bao gồm cả ở những bệnh nhân đang điều trị chống đông, với một loạt bài báo cáo huyết khối mao mạch phế nang ở bệnh nhân tử vong do COVID19 nhiều gấp 9 lần so với bệnh nhân tử vong do cúm H1N1.
Trong nỗ lực tìm hiểu nguyên nhân của tình trạng tăng đông ở bệnh nhân COVID19, chúng tôi đã đo độ nhớt huyết tương ở những bệnh nhân COVID-19 mức độ nguy kịch được nhập vào ICU.8 Đáng chú ý, tất cả mười lăm bệnh nhân đầu tiên được xét nghiệm đều có độ nhớt huyết tương tăng cao; và những người có mức độ tăng cao nhất thì có điểm SOFA, điểm dự đoán tử vong dựa trên các đo lường khách quan của 6 hệ thống cơ quan,và đang trải qua biến chứng huyết khối cấp tính, cũng cao nhất. 9 Cho rằng liệu pháp thay huyết tương (TPE) là một phương pháp điều trị được thiết lập cho các tình trạng khác được đặc trưng bởi tăng độ nhớt, bao gồm Bệnh đại phân tử globulin nguyên phát và tăng gamma globulin huyết do đa u tủy xương, chúng tôi đã thực hiện TPE ở sáu bệnh nhân nguy kịch có tăng độ nhớt máu liên quan đến COVID-19.10
BÁO CÁO CA LÂM SÀNG
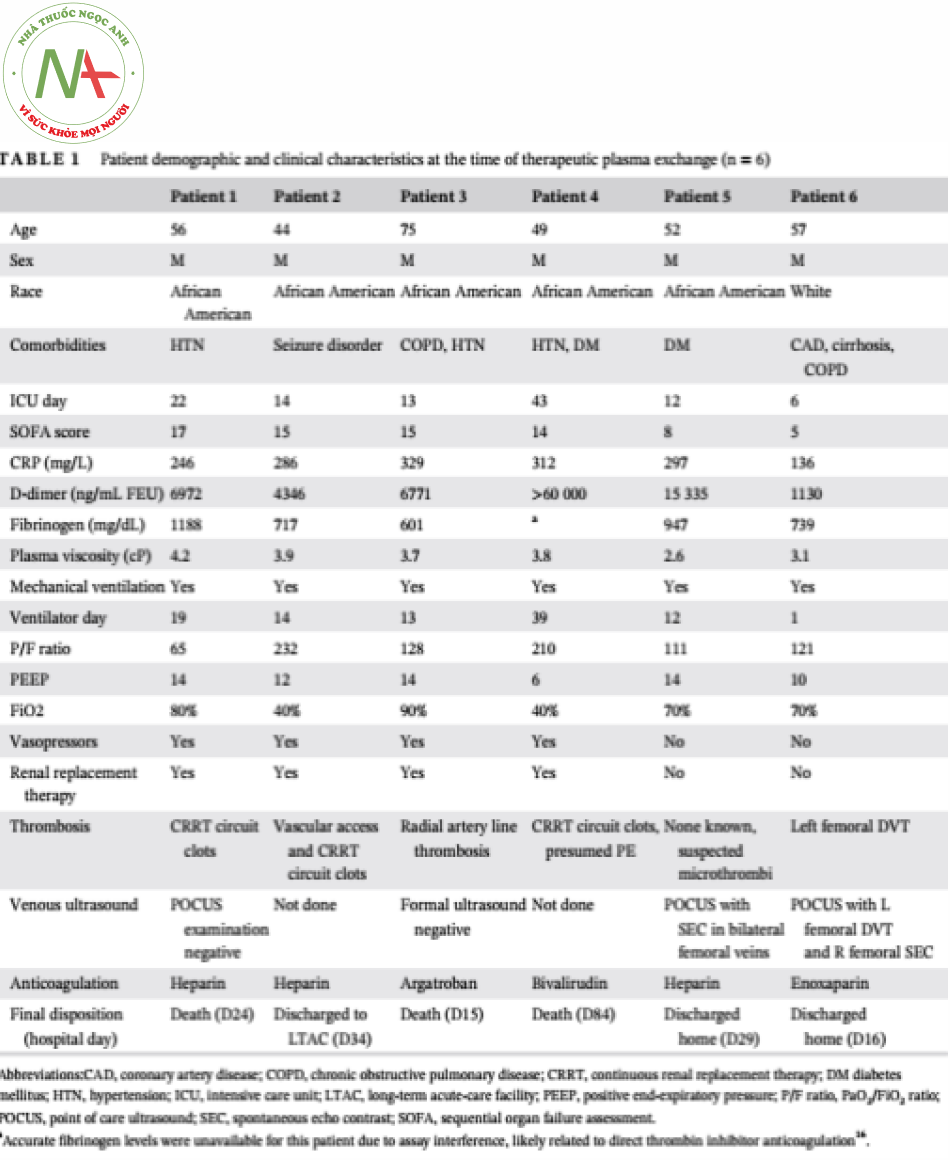
Tất cả sáu bệnh nhân đều là nam giới, trong độ tuổi từ 44 đến 75 tuổi, và thời gian nằm viện trung bình 17 ngày (khoảng 6-43 ngày) trước khi TPE. Điều quan trọng là tất cả các bệnh nhân không cải thiện mặc dù được điều trị chăm sóc tích cực và được đội bác sĩ điều trị xác định là có triệu chứng tăng độ nhớt, với sự xuất hiện các biến chứng đông máu mặc dù đã được sử dụng kháng đông. Bảng 1 tóm tắt các đặc điểm của bệnh nhân và điểm SOFA ngay trước khi bắt đầu TPE.
Bệnh nhân số 1 là một người đàn ông 56 tuổi nhập viện với tiền căn khó thở (SOB) đã 7 ngày. Anh ta được chuyển đến ICU vào ngày nhập viện thứ 4, anh ta được đặt nội khí quản vì suy hô hấp giảm oxy máu. Bệnh diễn tiến xấu dần, tiến triển tổn thương thận cấp tính (AKI) cần điều trị thay thế thận liên tục (CRRT), bệnh não gan, sốc nhiễm trùng cần dùng thuốc vận mạch và ARDS với viêm phổi liên quan đến thở máy do Klebsiella. Hệ thống màng dây CRRT của bệnh nhân có cục máu đông tái lập mặc dù đã truyền heparin liều cao (liều khởi đầu 18 đơn vị / kg / giờ, theo dõi nồng độ anti-Xa, khoảng mục tiêu chuẩn độ 0,5-0,7 đơn vị / mL) và sử dụng chống đông citrate 2,2% (tốc độ 280 mL / h). Ngày thứ 22, độ nhớt huyết tương tăng cao nghiêm trọng ở mức 4,2 cP và Liệu pháp TPE được bắt đầu tiến hành 2 lần. Mặc dù giảm độ nhớt huyết tương, nồng độ fibrinogen, Ddimer và CRP sau liệu pháp TPE, cũng như giải quyết được vấn đề huyết khối liên quan đến CRRT, bệnh nhân vẫn tiếp tục diễn tiến xấu dần. Ngày thứ 24, tình trạng toan axit lactic, tụt huyết áp kháng trị tiến triển trầm trọng hơn và bệnh nhân ngừng tim.
Bệnh nhân số 2 là một người đàn ông 44 tuổi được nhập vào ICU với tiền sử sốt và khó thở đã 12 ngày. Ông ta được đặt nội khí quản vì suy hô hấp giảm oxy máu. Bệnh nhân tiến triển AKI cần CRRT, sốc nhiễm trùng cần dùng thuốc vận mạch, bệnh não gan, viêm phổi do do tụ cầu vàng nhạy methicillin liên quan thở máy, và ARDS. Diễn biến của anh ấy còn phức tạp hơn do cục máu đông tái lập ở đường vào mạch máu và hệ thống dây lọc CRRT mặc dù đã sử dụng kháng đông citrate 2,2% ở liều thấp (liều khởi đầu 15 đơn vị / kg / h, theo dõi với nồng độ anti-Xa, được chuẩn độ cho khoảng mục tiêu 0,3-0,5 đơn vị / mL) và truyền nhỏ giọt heparin liều cao. Ngày thứ 14, độ nhớt huyết tương là 3,9 cP và tiến hành TPE 3 lần. Sau khi TPE, bệnh nhân không có biến chứng huyết khối nào nữa. Tình trạng của anh ta dần được cải thiện, bao gồm cải thiện chức năng thận và phổi, được mở khí quản ngày 26. Anh ta được chuyển đến một cơ sở chăm sóc cấp tính dài hạn vào ngày thứ 34.
Bệnh nhân số 3 là một người đàn ông 75 tuổi được nhập vào ICU với tiền sử 3 ngày trước đó khó thở và khó thở ngày càng nặng dần. Anh ta đã được đặt nội khí quản vì suy hô hấp giảm oxy máu. Tại ICU, bệnh nhân tiến triển AKI cần CRRT, sốc nhiễm trùng cần dùng thuốc vận mạch, rối loạn nhịp tim và tăng men gan rõ rệt. Diễn tiến của ông ta còn phức tạp hơn do thiếu máu cục bộ ở chi trên bên trái liên quan đến huyết khối ở đường động mạch vẫn tồn tại sau khi đã được rút bỏ và truyền nhỏ giọt argatroban liên tục (liều khởi đầu 0,5 mcg / kg / phút, được theo dõi bằng aPTT, được chuẩn độ cho khoảng mục tiêu 60-89 giây). Độ nhớt huyết tương ngày thứ 12 là 3,7 cP và TPE được thực hiện vào ngày 13 và 14. Thật không may, tình trạng lâm sàng của anh ta ngày càng xấu dần và anh ta tử vong vào ngày thứ 15.
Bệnh nhân 4 là một người đàn ông 49 tuổi được đưa vào ICU với tiền sử ho và khó thở đã 10 ngày. Vào ngày thứ 4, anh ta được đặt nội khí quản vì suy hô hấp giảm oxy máu. Diễn tiến của anh ấy rất phức tạp do AKI cần CRRT, sốc nhiễm trùng cần dùng thuốc vận mạch, bệnh não gan, và suy hô hấp kéo dài cần phải mở khí quản vào ngày thứ 33. Ngày thứ 37, mặc dù được truyền bivalirudin liên tục (liều khởi đầu 0,05 mg / kg / giờ, theo dõi bằng aPTT, chuẩn độ cho khoảng mục tiêu 60-80 giây), một Thuyên Tắc Phổi mức độ rất lớn đã xuất hiện và anh ta được điều trị tiêu sợi huyết alteplase. Ngày thứ 43, độ nhớt huyết tương là 3,8 cP và ông ta được TPE 2 lần. Sau khi TPE, tình trạng tri giác của ông ấy được cải thiện nhanh chóng và ông ấy được cai máy thở và chuyển ra khỏi ICU. Đến ngày thứ 78, bệnh nhân đã ổn định về mặt lâm sàng và chuẩn bị đưa vào cơ sở chăm sóc cấp tính dài hạn. Thật không may, trước khi chuyển viện, anh ta đã bị nhiễm trùng huyết do vi khuẩn, có khả năng liên quan đến một vết loét hoại tử, và diễn tiến ngừng tim và tử vong ngày thứ 84.
Bệnh nhân thứ 5 là một người đàn ông 52 tuổi được đưa vào ICU với tiền sử sốt và khó thở 9 ngày. Anh ta đã được đặt nội khí quản khi nhập viện. Tại ICU, anh ấy đã tiến triển AKI và ARDS mức độ nặng. Ngày thứ 11, mặc dù truyền nhỏ giọt heparin liều cao, siêu âm cho thấy có dòng chảy xoáy (spontaneous echo contrast) gợi ý tình trạng lưu lượng máu bị thay đổi.11 Xét nghiệm độ nhớt được chỉ định do lo ngại về tình trạng suy đa cơ quan liên quan đến vi huyết khối và tăng đông máu. Kiểm tra độ nhớt lần đầu làm tắc nhớt kế; thử nghiệm lặp lại là 2,6 cP và TPE được tiến hành 2 lần vào ngày thứ 12. Sau khi TPE, bệnh nhân cải thiện và hồi phục chức năng thận và phổi, được rút nội khí quản ngày thứ 17. Anh ấy được xuất viện về nhà mà không liệu pháp oxy hỗ trợ vào ngày 29.
Bệnh nhân số 6 là một người đàn ông 57 tuổi nhập viện sau 5 ngày với sốt, tiêu chảy và ngất. Anh ta được chuyển đến ICU và đặt nội khí quản vào ngày thứ 6 vì suy hô hấp giảm oxy máu. Mặc dù đã dùng kháng đông dự phòng chuẩn với enoxaparin 0,5 mg / kg / ngày, bệnh nhân vẫn phát triển huyết khối tĩnh mạch sâu chi dưới. Độ nhớt huyết tương là 3,1 cP và TPE được thực hiện vào ngày thứ 6 và 7. Sau khi TPE, nhu cầu liệu pháp oxy của bệnh nhân giảm dần và anh ta được rút nội khí quản vào ngày thứ 9. Anh ấy đã được xuất viện về nhà vào ngày thứ 16 và vẫn cần hỗ trợ oxy.
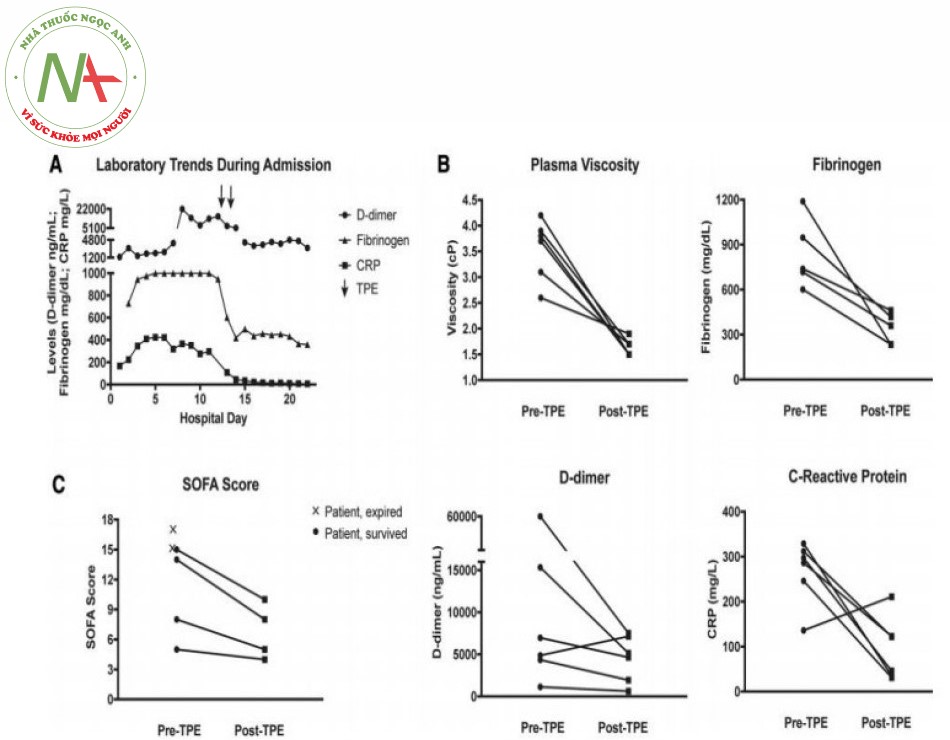
Động học fibrinogen, D-dimer và CRP liên quan đến các liệu pháp TPE được của một bệnh nhân đại diện (bệnh nhân 5) được thể hiện trong Hình 1A. TPE làm giảm độ nhớt huyết tương ở tất cả sáu bệnh nhân (trung bình trước TPE 3,75 cp, khoảng 2,6-4,2 cP; trung bình sau TPE 1,6 cP, khoảng 1,5-1,9 cP); mức độ fibrinogen sẵn có ở tất cả năm bệnh nhân (trung bình trước TPE 739 mg / dL, khoảng 601-1188 mg / dL; trung bình sau TPE 359 mg / dL, khoảng 235-461 mg / dL); Mức độ D-dimer ở tất cả sáu bệnh nhân (trung bình trước TPE 5921 ng / mL, khoảng 1134-60 000 ng / mL; trung bình sau TPE 4893 ng / mL, khoảng 620-7518 ng / mL); và mức CRP ở năm trong số sáu bệnh nhân (trung bình trước TPE 292 mg / L, khoảng 136-329 mg / L; trung bình sau TPE 84 mg / L, khoảng 31-211 mg / L) (Hình 1B). Tình trạng lâm sàng được cải thiện ở bốn trong số sáu bệnh nhân, có điểm SOFA ban đầu từ 15, 14, 8 và 5 trước khi TPE, lần lượt còn 10, 8, 5 và 4, sau TPE (Hình 1C).
PHƯƠNG PHÁP VÀ CHỌN MẪU
6 bệnh nhân đại diện đầu tiên được báo cáo bị tăng độ nhớt liên quan đến COVID19 đã trải qua TPE trong quá trình nhập ICU tại cơ sở Chăm sóc sức khỏe Emory. Xét nghiệm được thực hiện trong phòng xét nghiệm lâm sàng. Tất cả bệnh nhân đều dương tính với SARS-CoV-2 RNA bằng RT-PCR trên bệnh phẩm mũi họng. Các nhóm chăm sóc lâm sàng đưa ra các quyết định về chăm sóc lâm sàng, bao gồm cả việc có thực hiện siêu âm point-of-care để đánh giá spontaneous echo contrast như một chỉ dấu của lưu lượng máu thấp. 11 Không có tiêu chuẩn loại trừ xác định cho TPE và bốn trong số bệnh nhân có điểm SOFA ≥14, cho thấy khả năng tử vong cao. Độ nhớt huyết tương được đo bằng phương pháp đo độ nhớt mao mạch truyền thống (khoảng tham chiếu 1,4-1,8 centipoise, cP). Sau khi có sự đồng thuận, TPE được thực hiện trong hai ngày liên tiếp theo phác đồ của tổ chức với liều 1 thể tích, bằng huyết tương tươi đông lạnh, ngoại trừ một bệnh nhân được thay huyết tương 3 lần.
Ở tất cả các bệnh nhân, độ nhớt huyết tương, fibrinogen, Ddimer và CRP được đo trong vòng 24 giờ trước khi bắt đầu TPE và một lần nữa trong vòng 24 giờ sau TPE lần cuối. Dữ liệu lâm sàng và xét nghiệm đã được tóm tắt từ hồ sơ y tế điện tử theo quyết định của Institutional Review Board.
THẢO LUẬN
Ở đây, chúng tôi báo cáo kinh nghiệm ban đầu của mình khi sử dụng TPE để làm giảm độ nhớt huyết tương ở sáu bệnh nhân nguy kịch có tăng độ nhớt máu liên quan đến COVID-19. Chúng tôi giả thuyết bằng cách giảm độ nhớt máu – làm thay đổi lưu lượng máu, và giảm fibrinogen – một chất trung gian chính của huyết khối, TPE có thể giúp giảm thiểu xu hướng hình thành huyết khối được quan sát thấy ở bệnh nhân COVID-19, đặc biệt ở những bệnh nhân bị tăng đông máu mặc dù đã điều trị chống đông. Hai bệnh nhân bị bệnh nặng nhất tại thời điểm bắt đầu TPE đã tử vong trong vòng 48 giờ sau khi tiến hành thủ thuật. Tuy nhiên, sự cải thiện lâm sàng nhanh chóng sau TPE cùng với việc không có thêm bất kỳ biến chứng đông máu nào ở những bệnh nhân còn lại là đầy hứa hẹn. Những kết quả này cho thấy rằng bất kỳ lợi ích nào của TPE trong việc điều trị bệnh nhân COVID19 nguy kịch đều có thể đến sớm trong quá trình diễn tiến bệnh và các nghiên cứu bổ sung đánh giá thời điểm can thiệp tối ưu cần được đảm bảo.
TPE đã được sử dụng trong nhiều thập kỷ để điều trị bệnh nhân có triệu chứng tăng độ nhớt do sản xuất quá nhiều globulin miễn dịch. 10 Tuy nhiên, không giống như các bệnh được đánh dấu bằng chứng tăng gamma globulin huyết, các nguyên nhân gây tăng độ nhớt huyết tương trong COVID-19 vẫn chưa được biết rõ. Các protein phản ứng pha cấp, được kích thích bởi các chất trung gian gây viêm hệ thống, có thể là những ứng viên. Fibrinogen, tăng đáng kể ở một số bệnh nhân có COVID-19, dường như độc lập góp phần tăng nguy cơ huyết khối một cách mạnh mẽ bởi làm tăng độ nhớt và cung cấp chất nền cho sự hình thành cục máu đông. 12 Tình trạng tăng độ nhớt là đặc trưng do COVID-19 hoặc chỉ xảy ra tương tự như trong các tình trạng viêm hoặc nhiễm khuẩn cần được nghiên cứu thêm.
Trong khi những người khác đề xuất vai trò về lợi ích của TPE trong COVID-19 bằng cách giảm các cytokine và chất trung gian gây viêm, thì đây là báo cáo đầu tiên mô tả TPE trong COVID-19 với mục tiêu chính là giảm độ nhớt huyết tương. 13,14 Chúng tôi đề xuất rằng bình thường hóa độ nhớt, cùng với việc loại bỏ fibrinogen, cytokine và các protein phản ứng pha cấp sau TPE, có thể tăng cường sự phục hồi của bệnh nhân bằng cách cải thiện lưu lượng máu, giảm nguy cơ huyết khối và giảm tổn thương cơ quan đích gây ra bởi viêm nhiễm. Tuy nhiên, một hạn chế đáng kể của TPE là khả năng loại bỏ đồng thời các kháng thể đặc hiệu chống SARS-CoV-2 và có thể trì hoãn hoặc cản trở việc giải quyết tình trạng nhiễm virus. Do đó, các phương pháp tiếp cận tối ưu đối với TPE có thể bao gồm thử nghiệm hiệu giá kháng thể đặc hiệu SARS-CoV-2 trước và sau thủ thuật và sử dụng huyết tương thay thế của người khỏi bệnh trong lần thay huyết tương cuối cùng để cung cấp các kháng thể trung hòa hiệu giá cao.15 Tuy nhiên, TPE thường được coi là liệu pháp an toàn và dung nạp tốt, và không bệnh nhân nào của chúng tôi gặp phải bất kỳ tác dụng phụ nào liên quan đến thủ thuật.
Điều quan trọng cần lưu ý là báo cáo này, với tư cách là một loạt ca lâm sàng, bị hạn chế đáng kể bởi cả số lượng bệnh nhân nhỏ và thiếu các tiêu chí thu nhận và loại trừ. Ở đây, chúng tôi báo cáo kinh nghiệm của mình khi sử dụng TPE ở 6 bệnh nhân đầu tiên được nhóm chăm sóc chính của họ xác định là có triệu chứng tăng độ nhớt liên quan đến COVID-19, bao gồm 2 bệnh nhân đã cố gắng TPE mặc dù tiên lượng tử vong. Các nghiên cứu trong tương lai với số lượng bệnh nhân lớn hơn sẽ là cần thiết để chứng minh hiệu quả điều trị của TPE trong COVID-19 và nhóm bệnh nhân cụ thể có nhiều khả năng được hưởng lợi từ điều trị. Một thử nghiệm ngẫu nhiên có đối chứng (RCT) được thiết kế để xác định tính an toàn và hiệu quả của TPE trong việc giảm độ nhớt huyết tương và tác động đến dự hậu của bệnh nhân COVID-19 đang được tiến hành (NCT04441996).
Tóm lại, loạt bài của chúng tôi chứng minh rằng TPE có thể điều chỉnh tình trạng tăng độ nhớt huyết tương liên quan đến COVID-19 và gợi ý lợi ích tiềm năng trong dự hậu bệnh nhân khi được sử dụng sớm hơn ở những bệnh nhân nặng, trước khi bắt đầu suy đa cơ quan. Nghiên cứu có hệ thống về TPE thông qua RCTs là cần thiết để thiết lập các Phác Đồ tốt nhất và xác định bất kỳ lợi ích thực sự nào của sự can thiệp thay huyết tương trong điều trị COVID-19.
TÀI LIỆU THAM KHẢO
- Zhang L, Feng X, Zhang D, et al. Deep vein thrombosis in hospitalized patients with coronavirus disease 2019 (COVID-19) in Wuhan, China: Prevalence, risk factors, and outcome. Circulation. 2020;142(2):114–128.
- Middeldorp S, Coppens M, van Haaps T, et al. Incidence of venous thromboembolism in hospitalized patients with COVID-19. J Thromb Haem. 2020;18(8):1995–2002.
- Helms J, Tacquard C, Severac F, et al. High risk of thrombosis in patients with severe SARSCoV-2 infection: A multicenter prospective cohort study. Intensive Care Med. 2020;46(6): 1089–1098.
- Wichmann D, Sperhake J, Lutgehetmann M, et al. Autopsy findings and venous thromboembolism in patients with COVID-19. Ann Int Med. 2020;173(4):268–277.
- Lax S, Skok K, Zechner P, et al. Pulmonary arterial thrombosis in COVID-19 with fatal outcome: Results from a prospective, single-center, clinicopathologic case series. Ann Int Med. 2020; 173(5):350–361.
- Fox S, Akmatbekov A, Harbet J, et al. Pulmonary and cardiac pathology in African American patients with COVID-19: An autopsy series from New Orleans. Lancet Resp Med. 2020;8(7): 681–686.
- Ackermann M, Verleden S, Kuehnel M, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in COVID-10. NEJM. 2020;383(2):120–128.
- Maier C, Truong A, Auld S, et al. COVID-19-associated hyperviscosity: A link between inflammation and thrombophilia? Lancet. 2020;395(10239):1758–1759.
- Vincent J, Moreno R, Takala J, et al. The SOFA score to describe organ dysfunction/failure. Intensive Care Med. 1996; 22:707–710.
- Padmanabhan A, Connelly-Smith L, Aqui N, et al. Guidelines on the use of therapeutic apheresis in clinical practice – evidence-based approach from the Writing Committee of the American Society for Apheresis: The eighth special issue. J Clin Apher. 2019;34:171–354.
- Black I. Spontaneous echo contrast: Where thereʼs smoke thereʼs fire. Echocardiography. 2000;17(4):373–382.
- Ranucci M, Ballotta A, Di Dedda U, et al. The procoagulant pattern of patients with COVID 19 acute respiratory distress syndrome. J Thromb Haem. 2020;18(7):1747–1751.
- Keith P, Day M, Perkins L, et al. A novel treatment approach to the novel coronavirus: An argument for the use of therapeutic plasma exchange for fulminant COVID-19. Crit Care. 2020; 24:128. https://doi.org/10.1186/s13054-020-2836-4.
- Kesici S, Yavuz S, Bayrakci B. Get rid of the bad first: Therapeutic plasma exchange with convalescent plasma for severe COVID-19. Proc Natl Acad Sci USA. 2020;117(23): 12526–12527. https://doi.org/10.1073/pnas.2006691117.
- Shen C, Wang Z, Zhao F, et al. Treatment of 5 critically ill patients with COVID-19 with convalescent plasma. JAMA. 2020;323(16):1582–1589.
- Maier C, Barker N, Sniecinski R. Falsely low fibrinogen levels in COVID-19 patients on direct thrombin inhibitors. Anesth Analg. 2020;131(2):e117–e119. https://doi.org/10.1213/ANE. 0000000000004949.