Sản xuất Dược phẩm
THẨM ĐỊNH PHƯƠNG PHÁP THỬ NGHIỆM ĐỘC TÍNH TẾ BÀO IN VITRO
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
LÊ VĂN ĐẠT, NGUYỄN THỊ LIÊN*
1. Đặt vấn đề
Độc tính tế bào là một trong những phép thử quan trọng để đánh giá tính tương thích sinh học của các trang thiết bị y tế, thiết bị cấy ghép và bao bì đựng thuốc [1, 5].
Quy trình thử nghiệm dựa trên việc đánh giá khả năng sống của tế bào thông qua hoạt động trao đổi chất. MTT(3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyltetrazoliumbromid) màu vàng tan trong nước khi vào tế bào bị khử chuyển hóa trong tế bào thành formazan màu xanh tím, không tan trong nước. Số lượng tế bào sống tương quan với cường độ màu được xác định bằng phép đo quang sau khi hòa tan formazan trong isopropanol [3].
Tế bào Vero là dòng tế bào được phân lập lần đầu năm 1962 từ các tế bào biểu mô thận của khỉ xanh châu phi. Hiện nay dòng tế bào Vero 76 được sử dụng rộng rãi trong nghiên cứu và sản xuất các sản phẩm y sinh học, dược phẩm và vắc xin do nó dễ xây dựng ngân hàng tế bào, cấu trúc nhân và hình dạng ổn định, ít thay đổi qua các lần cấy chuyền và khả năng bị nhiễm các yếu tố ngoại lai thấp trong quá trình nuôi cấy [6].
Theo ISO 10993-5:2009 (E) phụ lục C hướng dẫn về thử nghiệm độc tính tế bào bằng thuốc thử MTT thực hiện trên tế bào L929. Tuy nhiên, hiện nay ở Việt Nam dòng tế bào này chưa được sử dụng phổ biến. Để mở rộng phạm vi phép thử trên các dòng tế bào khác nhau chúng tôi đã tiến hành nghiên cứu thẩm định phương pháp thử nghiệm độc tính tế bào in vitro bằng thuốc thử MTT trên tế bào Vero 76 thay thế cho tế bào L929.
2. Thực nghiệm
2.1. Thiết bị, hóa chất, chất chuẩn
2.1.1. Thiết bị, dụng cụ
Đã được hiệu chuẩn theo ISO/IEC 17025 và GLP.
| STT | Tên thiết bị, dụng cụ | Nơi sản xuất |
| 1 | Bể ổn nhiệt | Memmert, Đức |
| 2 | Nồi hấp tiệt trùng | Hirayama, Nhật Bản |
| 3 | Tủ sấy | Memmert, Đức |
| 4 | Tủ ấm CO2 | Memmert, Đức |
| 5 | Tủ an toàn sinh học cấp II | Azbil Telstar, TBN |
| 6 | Máy đọc đĩa Varioskan Lux | Thermo, Singapore |
| 7 | Máy ly tâm | Eppendorf, Đức |
| 8 | Máy lắc đĩa | USA Scientific, Mỹ |
| 9 | Cân phân tích | Mettler, Trung Quốc |
| 10 | Máy đếm tế bào | Logos, Hàn Quốc |
| 11 | Kính hiển vi soi ngược | Olympus, Nhật Bản |
| 12 | Micropipet | Eppendorf, Nhật Bản |
| 13 | Bình nuôi cấy | Corning, Trung Quốc |
| 14 | Đĩa 96 giếng | Corning, Trung Quốc |
| 15 | Bình nón có nút mài | Duran, Đức |
| 16 | Kìm cắt mẫu | Fujiya, Nhật Bản |
2.1.2. Hóa chất, dung môi, chất chuẩn
- Môi trường MEM (Gibco, Mỹ)
- Huyết thanh bò (FBS), (Gibco, Mỹ)
- Dung dịch Trypsin/EDTA (Gibco, Mỹ)
- Dung dịch PBS (Gibco, Mỹ)
- MTT (3-(4,5-dimethylthiazol-2-yl)-2,5 diphenyltetrazoliumbromid), (Thermo, Mỹ)
- Isopropanol (Merk, Đức)
- Penicillin/streptomycin (Gibco, Mỹ)
- Nước BET( Lonza, Mỹ)
- Đối chứng dương 0,1% ZDEC polyurethane Film (Hatano Research Institute, Nhật Bản)
- Đối chứng âm HDPE (Hatano Research Institute, Nhật Bản)
2.2. Đối tượng và phương pháp nghiên cứu
2.2.1. Đối tượng nghiên cứu
- Tế bào Vero 76 do Viện Kiểm định Quốc gia Vắc xin và Sinh phẩm y tế (NICB) cung cấp, số lô NICB/ MCB01-18
- Mẫu thử:
- Mẫu thử 1: Dây dẫn đường mạch máu (RF*GA38263M), nơi sản xuất Công ty TNHH Terumo Việt Nam, số lô 200624V.
- Mẫu thử 2: Ống thông mạch máu (RH*4MP3520M), nơi sản xuất Công ty TNHH Terumo Việt Nam, số lô
- Mẫu thử 3: Bơm tiêm 10 ml sử dụng 1 lần, nơi sản xuất Công ty Cổ phần TBYT Vinahankook, số lô
- Mẫu thử 4: Dụng cụ mở đường mạch máu (RS*A60G16SQZ), nơi sản xuất Công ty TNHH Terumo Việt Nam.
- Phương pháp nghiên cứu
- Chuẩn bị thuốc thử
- Môi trường nuôi cấy: Môi trường MEM bổ sung 10 % FBS, 10 % DMSO, 4 mM glutamin, 100 IU/ml penicillin và 100 μg/ml
- Dung dịch MTT : MTT được hòa tan trong môi trường MEM không có chất bổ sung và không có đỏ phenol để được nồng độ 1 mg/ml. Dung dịch được lọc qua màng lọc vô trùng (kích thước ≤ 0,22 µm).
- Chuẩn bị huyền phù tế bào: Tế bào được cấy chuyền 2 đến 3 lần từ khi rã đông trước khi đưa vào thử nghiệm. Chuẩn bị dịch huyền phù tế bào có nồng độ khoảng 1,0 x 105 tế bào/ml.
2.2.2. Phương pháp xử lý mẫu
Chuẩn bị mẫu thử
+ Tùy theo hình dạng, kích thước mẫu thử, mẫu thử được chiết theo ISO-10993-12:2009 nhưng không ít hơn 03 đơn vị mẫu thử trong một bình chiết. Đối với các mẫu thử có hình dạng không xác định tỷ lệ mẫu thử và dung môi là 0,2 g mẫu thử/ml môi trường nuôi cấy. Mẫu thử dạng xy lanh tính theo diện tích tiếp xúc [4].
+ Ủ các bình chiết ở nhiệt độ (37 ± 1) oC trong (24 ± 2) giờ để thu được dung dịch thử 1 (dịch chiết mẫu thử 100 %). Từ dung dịch thử 100 % pha loãng thành các dung dịch thử 2 (50 %), thử 3 (25 %) và thử 4 (12,5 %) bằng môi trường nuôi cấy [2, 4].
Chuẩn bị mẫu đối chứng dương
+ Chiết mẫu đối chứng dương (0,1 % ZDEC polyurethane Film, lô A-191K, Hatano Research Instute, Nhật Bản) với tỷ lệ 0,1 g mẫu thử/ml bằng môi trường nuôi cấy [3, 4]. Tiến hành các bước tiếp theo tương mẫu thử.
– Chuẩn bị mẫu đối chứng âm
+ Chiết mẫu đối chứng âm (HDPE, lô C-161, Hatano Research Instute, Nhật Bản) với tỷ lệ 0,1 g mẫu thử/ml bằng môi trường nuôi cấy [3, 4].
+ Ủ các bình chiết ở nhiệt độ (37 ± 1) oC trong (24 ± 2) giờ để thu được dung dịch đối chứng âm (dịch chiết đối chứng âm 100 %).
– Chuẩn bị mẫu trắng kiểm soát: Sử dụng môi trường nuôi cấy ủ ở nhiệt độ (37 ± 1) oC trong (24 ± 2) giờ làm mẫu trắng kiểm soát.
2.2.3. Quy trình phân tích
| Thời gian (giờ) | Quy trình phân tích |
|
00:00 |
– Hút 100 µl huyền phù tế bào (105 tế bào/ml) vào đĩa 96 giếng
– Ủ (37 oC/5 % CO2/22-26 giờ) |
|
24:00 |
– Đánh giá hình thái tế bào bằng kính hiển vi phản pha, loại bỏ các giếng bất thường
– Loại bỏ môi trường nuôi cấy – Hút 100 µl các mẫu sau vào các giếng: + Dịch chiết mẫu thử, mẫu đối chứng dương ít nhất 4 nồng độ bắt đầu từ nồng độ 100 %, mỗi nồng độ lặp lại 3 lần. + Mẫu đối chứng âm nồng độ 100 % + Mẫu trắng kiểm soát – Ủ (37 oC/5 % CO2/24 giờ) |
|
48:00 |
– Đánh giá hình thái tế bào bằng kính hiển vi phản pha
– Loại bỏ môi trường nuôi cấy – Rửa bằng 100 µl dung dịch PBS 1X – Thêm 50 µl môi trường MTT – Ủ (37 oC/5 % CO2/2 giờ) |
|
51:00 |
– Loại bỏ dung dịch MTT
– Thêm 100 µl isopropanol vào mỗi giếng – Lắc đĩa 10 phút |
| 51:30 | Đo độ hấp thụ quang tại bước sóng 570 nm (bước sóng tham chiếu 650 nm) |
Các bước tiến hành theo sơ đồ sau:
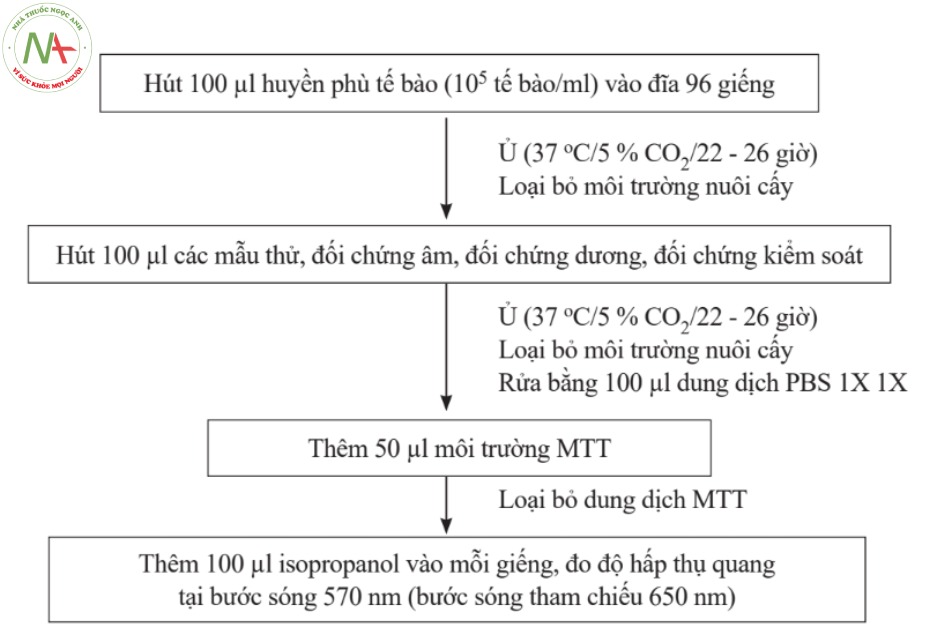
2.2.2.4. Tính kết quả
Giá trị % khả năng sống của tế bào của mỗi mẫu thử được tính theo công thức:
% khả năng sống của tế bào = (OD570T/ OD57B)/100
OD570T: Độ hấp thụ của giếng chứa mẫu thử.
OD570B: Độ hấp thụ trung bình của các giếng chứa mẫu trắng kiểm soát.
2.2.5.Đánh giá kết quả
Phép thử có hiệu lực khi
+ Giá trị OD570 trung bình của tất cả mẫu trắng kiểm soát ≥ 0,2;
+ Giá trị OD570 trung bình của mẫu trắng kiểm soát ở bên trái và ở bên phải đĩa 96 giếng phải không lệnh quá 15 % so với giá trị OD570 trung bình của tất cả mẫu trắng kiểm soát;
+ % khả năng sống của tế bào ở các giếng chứa dịch chiết mẫu thử 50 % phải bằng hoặc cao hơn ở các giếng chứa dịch chiết mẫu thử 100 %.
Nhận định kết quả
+ Mẫu thử được xem là không gây độc tính tế bào khi: % khả năng sống trung bình của tế bào ở các giếng chứa dịch chiết mẫu thử 100 % ≥ 70 %.
+ Mẫu thử được xem là gây độc tế bào khi: % khả năng sống trung bình của tế bào ở các giếng chứa dịch chiết mẫu thử 100 % < 70 %.
3. Kết quả và bàn luận
3.1. Tính thích hợp hệ thống
Sử dụng mẫu trắng kiểm soát để kiểm tra tính thích hợp hệ thống. Bố trí các mẫu trắng kiểm soát trên đĩa 96 giếng ở vị trí bên trái (từ B2 đến G2) và bên phải (từ B11 đến G11). Tiến hành theo qui trình phân tích mục 2.2.3. trên tế bào Vero 76, ghi lại độ hấp thụ tại bước sóng 570 nm. Kết quả thể hiện ở Bảng 1.
Bảng 1. Khảo sát tính thích hợp của hệ thống
| STT | OD Mẫu trắng KS trái | OD Mẫu trắng KS phải |
| 1 | 0,5452 | 0,5209 |
| 2 | 0,5347 | 0,5550 |
| 3 | 0,5411 | 0,5419 |
| 4 | 0,5248 | 0,5591 |
| 5 | 0,5402 | 0,5564 |
| 6 | 0,5267 | 0,5030 |
| TB trái/phải | 0,5355 | 0,5394 |
| TB chung | 0,5374 | |
| Chênh lệch (%) | -0,37 | 0,37 |
Kết quả thu được ở Bảng 1 cho thấy giá trị OD570 trung bình của tất cả mẫu trắng kiểm soát (0,5374) ≥ 0,2 và chênh lệch giá trị OD570 trung bình của mẫu trắng kiểm soát ở các giếng bên trái và bên phải đĩa 96 giếng (0,37 %) < 15 % so với giá trị OD570 trung bình của tất cả các giếng mẫu trắng kiểm soát. Như vậy, phương pháp thử nghiệm độc tính tế bào in vitro bằng thuốc thử MTT trên tế bào Vero 76 đạt yêu cầu về tính thích hợp của hệ thống.
3.2. Tính phù hợp của phương pháp
3.2.1. Tính phù hợp trên mẫu đối chứng dương và mẫu đối chứng âm.
- Mẫu đối chứng dương: Cắt tấm đối chứng dương có trọng lượng 0,7799 g vào bình chiết, hấp tiệt trùng ở 121 ºC trong 15 phút. Thêm 3,90 ml môi trường nuôi cấy vào bình, ủ ở 37 ºC trong 24 giờ thu được dung dịch đối chứng dương 200 %. Từ dung dịch đối chứng dương 200 % pha loãng thành các dung dịch đối chứng dương 100 %, 50 %, 25 % và 12,5 % bằng môi trường nuôi cấy.
- Mẫu đối chứng âm: Cắt tấm đối chứng âm có trọng lượng 0,3952 g vào bình chiết, hấp tiệt trùng ở 121 ºC trong 15 phút. Thêm 3,95 ml môi trường nuôi cấy vào bình, ủ ở 37 ºC trong 24 giờ thu được dung dịch đối chứng âm 100 %.
- Mẫu trắng kiểm soát: Là môi trường nuôi cấy ủ ở 37 ºC trong 24 giờ.
Tiến hành song song theo qui trình phân tích mục 2.2.3. trên tế bào Vero 76 và tế bào L929 ghi lại độ hấp thụ tại bước sóng 570 nm, từ đó tính khả năng sống của tế bào ở từng nồng độ thử nghiệm. Kết quả thể hiện ở Hình 1 và Hình 2.
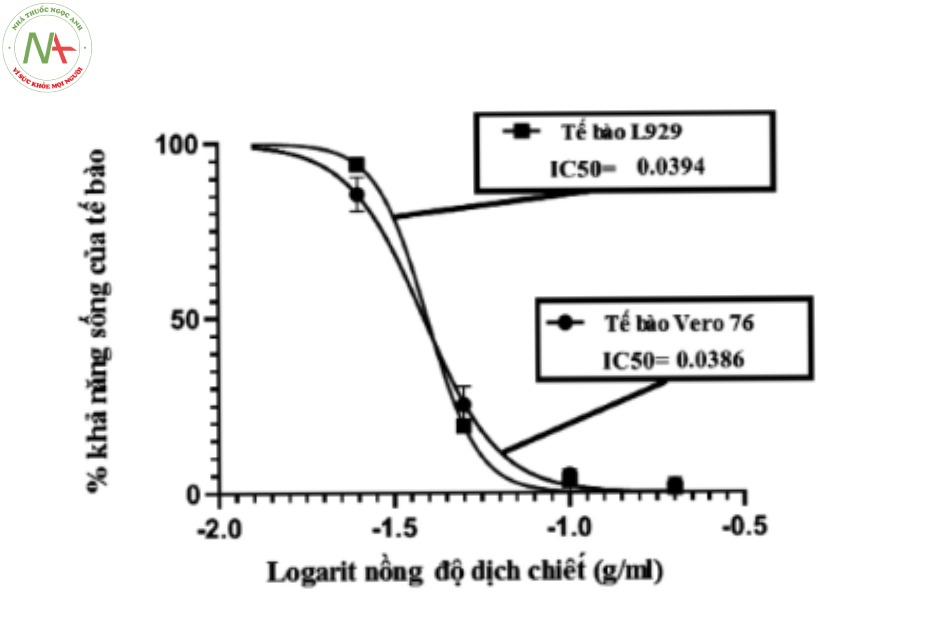
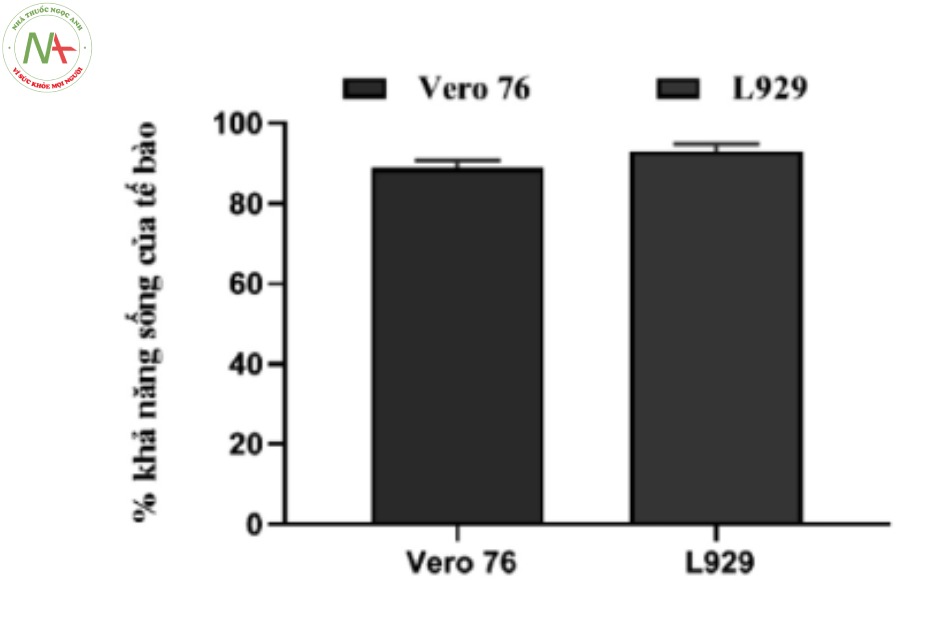
Kết quả cho thấy giá trị IC50 của mẫu đối chứng dương trên tế bào Vero 76 (0,0386 g/ml) và của tế bào L929 (0,0394 g/ml). Chênh lệch về độc tính tế bào của mẫu đối chứng âm trên tế bào Vero 76 (89,01 %) và tế bào L929 (93,32 %) là 4,3 %. Như vậy, có sự tương đồng về độc tính tế bào gây ra bởi mẫu đối chứng dương và đối chứng âm trên tế bào Vero 76 và L929.
3.2.2. Tính phù hợp trên mẫu thử
Các mẫu thử được chuẩn bị theo Bảng 2.
Bảng 2. Chuẩn bị mẫu thử
| Mẫu thử | Khối lượng (g) | Môi trường nuôi cấy (ml) | Ghi chú |
| Mẫu thử 1 | 0,8164 | 4,08 | |
| Mẫu thử 2 | 0,9864 | 4,93 | |
| Mẫu thử 3 | 1 xy lanh | 10 | Hút 10 ml môi trường nuôi
cấy vào 1 xy lanh |
| Mẫu thử 4 | 1,8639 | 9,32 |
Ủ bình chiết mẫu thử ở 37 ºC trong 24 giờ thu được dung dịch mẫu thử 100%. Từ dung dịch mẫu thử 100% pha loãng thành các dung dịch mẫu thử 50 %, 25 % và 12,5 % bằng môi trường nuôi cấy.
Tiến hành song song theo qui trình phân tích mục 2.2.3. trên tế bào Vero 76 và tế bào L929 ghi lại độ hấp thụ tại bước sóng 570 nm, từ đó tính khả năng sống của tế bào ở từng nồng độ thử nghiệm.
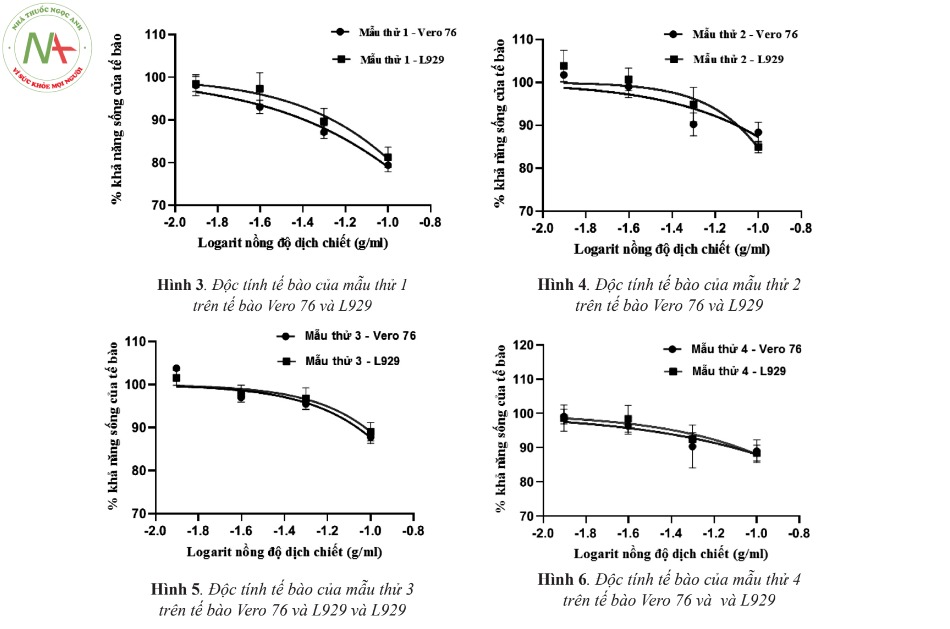
Từ kết quả trên cho thấy chênh lệch phần trăm khả năng sống của tế bào ở các mẫu thử nồng độ 100 % trên tế bào Vero 76 và L929: mẫu dây dẫn đường mạch máu -1,8 %, mẫu ống thông mạch máu 5,3 %, mẫu bơm tiêm -1,2 % và mẫu dụng cụ mở đường mạch máu 0,6%. Như vậy, có sự tương đồng về độc tính tế bào gây ra bởi 4 nền mẫu thử khác nhau trên tế bào vero 76 và tế bào L929.
3.3. Độ đặc hiệu
– Đối chứng âm: Sử dụng dung dịch đối chứng âm phần tính phù hợp của phương pháp.
– Đối chứng dương: Sử dụng mẫu đối chứng dương 100 % phần tính phù hợp của phương pháp.
– Mẫu trắng kiểm soát: Là môi trường nuôi cấy ủ ở 37 ºC trong 24 giờ.
- Mẫu thử: Sử dụng mẫu thử 2 (nồng độ 100 %) ở phần tính phù hợp của phương pháp.
- Mẫu Blank: Không chứa tế bào, mẫu thử chỉ có dung dịch MTT.
Tiến hành theo qui trình phân tích mục 2.2.2.3. trên tế bào Vero 76, ghi lại độ hấp thụ tại bước sóng 570 nm, từ đó tính % tế bào sống của các mẫu đỗi chứng âm, đối chứng dương và mẫu thử. Kết quả thể hiện ở Bảng 3.
Bảng 3. Khảo sát độ đặc hiệu của phương pháp
| STT | Độ hấp thụ (OD) | % khả năng sống của tế bào sống (%) | |||
| Blank | Mẫu trắng kiểm soát | ĐC âm | ĐC dương 100 % | Mẫu thử 100 % | |
| 1 | 0,0421 | 0,5452 | 90,05 | 4,58 | 85,00 |
| 2 | 0,0453 | 0,5347 | 86,88 | 6,97 | 85,16 |
| 3 | 0,0436 | 0,5411 | 90,09 | 3,83 | 84,82 |
| TB | 0,0437 | 0,5403 | 89,01 | 5,13 | 84,99 |
Kết quả cho thấy có sự chênh lệch đáng kể độ hấp thụ của mẫu trắng kiểm soát (0,5403) và mẫu Blank (0,0437). Ngoài ra, phần trăm khả năng sống của tế bào của mẫu đối chứng âm (89,91 %) và mẫu thử (84,99 %) > 70 %. Phần trăm khả năng sống của tế bào của mẫu đối chứng dương 100 % (3,49 %) < 70 %. Như vậy, phương pháp thử nghiệm độc tính tế bào bằng thuốc thử MTT trên tế bào Vero 76 đạt yêu cầu về tính đặc hiệu.
3.4. Độ lặp lại
– Chuẩn bị mẫu thử: Sử dụng các mẫu thử 100 % ở phần tính thích phù hợp của phương pháp. Mỗi mẫu thử tiến hành lặp lại 6 lần.
Tiến hành theo qui trình phân tích mục 2.2.2.3. trên tế bào Vero 76, ghi lại độ hấp thụ tại bước sóng 570 nm. Kết quả thể hiện ở Bảng 4.
Bảng 4. Khảo sát độ lặp lại của phương pháp
| STT | OD Thử 1 | OD Thử 2 | OD Thử 3 | OD Thử 4 |
| 1 | 0,4205 | 0,4634 | 0,4857 | 0,5016 |
| 2 | 0,4552 | 0,4642 | 0,4731 | 0,5145 |
| 3 | 0,4537 | 0,4625 | 0,4633 | 0,5019 |
| 4 | 0,4287 | 0,4895 | 0,4632 | 0,4900 |
| 5 | 0,4486 | 0,4722 | 0,5098 | 0,4959 |
| 6 | 0,4300 | 0,4931 | 0,4975 | 0,4851 |
| TB | 0,4395 | 0,4742 | 0,4821 | 0,4982 |
| RSD (%) | 3,37 | 2,91 | 3,95 | 2,08 |
Từ kết quả trên cho thấy phương pháp thử nghiệm độc tính tế bào bằng thuốc thử MTT trên tế bào Vero 76 đạt yêu cầu về độ lặp lại phù hợp với phép thử sinh học.
4. Kết luận
Qua khảo sát chúng tôi đã thẩm định được phương pháp thử nghiệm độc tính tế bào in vitro bằng thuốc thử MTT trên tế bào Vero 76 bao gồm tính thích hợp của hệ thống, tính phù hợp của phương pháp, độ đặc hiệu và độ lặp lại. Kết quả thẩm định cho thấy phương pháp phù hợp cho việc thử nghiệm độc tính tế bào n vitro bằng thuốc thử MTT trên tế bào Vero 76 trên các nền mẫu trang thiết bị y tế như ống thông mạch, ống dẫn đường, bơm tiêm và dụng cụ mở đường.
Tài liệu tham khảo
- Nghị định 98/2021/NĐ-CP (2021), Nghị định về quản lý trang thiết bị y tế, trang 1-25.
- TCVN 7391 – 5 – 2005, Đánh giá sinh học trang thiết bị y tế – Phần 5: Phép thử độc tính tế bào in vitro, trang 7 –
- ISO 10993-5:2009 (E), Annex C, pages 24 – 28.
- ISO 10993-12: 2021, pages 6 – 8.
- United states Pharmacopoeia 44, <1031> The biocompatibility of materials used in drug containers, medical devices, and implants.
- ATCC (American Type Culture Collection), Vero 76, https:// atcc.org/products/crl-1587.
