Bệnh Học, Bệnh hô hấp
Tezepelumab ở người lớn và thanh thiếu niên bị hen suyễn nặng, không kiểm soát được
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tóm tắt
ĐẶT VẤN ĐỀ
Tezepelumab là một kháng thể đơn dòng của người có tác dụng ngăn chặn lymphopoietin mô đệm, một cytokine có nguồn gốc từ tế bào biểu mô có liên quan đến bệnh sinh của bệnh hen suyễn. Hiệu quả và độ an toàn của tezepelumab ở bệnh nhân hen suyễn nặng, không kiểm soát được cần được đánh giá thêm.
PHƯƠNG PHÁP
Chúng tôi đã tiến hành thử nghiệm pha 3, đa trung tâm, ngẫu nhiên, mù đôi, có đối chứng với giả dược. Bệnh nhân (12 đến 80 tuổi) được chỉ định ngẫu nhiên để nhận tezepelumab (210 mg) hoặc giả dược tiêm dưới da 4 tuần một lần trong 52 tuần. Điểm kết thúc chính là tỷ lệ cơn hen kịch phát được công nhận hàng năm trong khoảng thời gian 52 tuần. Điểm cuối này cũng được đánh giá ở những bệnh nhân có số lượng bạch cầu ái toan trong máu cơ bản dưới 300 tế bào trên mỗi microlit. Điểm cuối phụ bao gồm thể tích thở ra cưỡng bức trong 1 giây (FEV 1 ) và điểm trên Bảng câu hỏi kiểm soát bệnh hen suyễn – 6 (ACQ-6; phạm vi, 0 [không bị suy giảm] đến 6 [mức độ suy giảm tối đa]), Bảng câu hỏi về chất lượng cuộc sống của bệnh hen suyễn ( AQLQ; phạm vi, 1 [suy giảm tối đa] đến 7 [không suy giảm]), và Nhật ký triệu chứng hen suyễn (ASD; phạm vi, 0 [không có triệu chứng] đến 4 [triệu chứng tồi tệ nhất có thể]).
KẾT QUẢ
Nhìn chung, 1061 bệnh nhân được phân nhóm ngẫu nhiên (529 người được chỉ định dùng tezepelumab và 532 người được dùng giả dược). Tỷ lệ cơn hen kịch phát hàng năm là 0,93 (khoảng tin cậy 95% [CI], 0,80 đến 1,07) với tezepelumab và 2,10 (95% CI, 1,84 đến 2,39) với giả dược (tỷ lệ 0,44; 95% CI, 0,37 đến 0,53; P <0,001). Ở những bệnh nhân có số lượng bạch cầu ái toan trong máu dưới 300 tế bào trên mỗi microlít, tỷ lệ hàng năm là 1,02 (KTC 95%, 0,84-1,23) với tezepelumab và 1,73 (KTC 95%, 1,46 đến 2,05) với giả dược (tỷ lệ 0,59; KTC 95%, 0,46 đến 0,75; P <0,001). Ở tuần 52, sự cải thiện lớn hơn với tezepelumab so với giả dược đối với thuốc giãn phế quản FEV 1(0,23 so với 0,09 lít; chênh lệch, 0,13 lít; KTC 95%, 0,08 đến 0,18; P <0,001) và điểm trên ACQ-6 (−1,55 so với −1,22; chênh lệch, −0,33; 95% CI, −0,46 đến −0,20; P <0,001), AQLQ (1,49 so với 1,15; chênh lệch, 0,34; KTC 95%, 0,20 đến 0,47; P <0,001) và ASD (−0,71 so với −0,59; chênh lệch, −0,12; 95% CI, −0,19 đến −0,04; P = 0,002). Các tần suất và loại sự kiện bất lợi không có sự khác biệt có ý nghĩa giữa hai nhóm.
KẾT LUẬN
Những bệnh nhân bị hen suyễn nặng, không kiểm soát được dùng tezepelumab có ít đợt kịch phát hơn và chức năng phổi, kiểm soát hen suyễn tốt hơn và chất lượng cuộc sống liên quan đến sức khỏe hơn những người dùng giả dược.
Khoảng 10% bệnh nhân hen suyễn bị bệnh nặng và có các triệu chứng và đợt cấp mặc dù đã được điều trị bằng liệu pháp kiểm soát chăm sóc tiêu chuẩn tối đa. Bệnh hen suyễn nặng, không kiểm soát được đóng góp một cách không tương xứng vào gánh nặng và chi phí chung của bệnh hen suyễn. Các kháng thể đơn dòng nhắm mục tiêu IgE hoặc các cytokine loại 2 (T2) (interleukin-4, -5 và -13) và các thụ thể của chúng cải thiện khả năng kiểm soát bệnh cho nhiều bệnh nhân hen suyễn nặng và được đưa vào hướng dẫn quản lý. Tuy nhiên, các tác nhân sinh học hiện tại không phù hợp với nhiều bệnh nhân bị hen suyễn nặng, đặc biệt là những người có kiểu hình không dị ứng hoặc không có bạch cầu ái toan. Do đó, vẫn còn một nhu cầu chưa được đáp ứng về các liệu pháp điều trị mới có hiệu quả trên một lượng lớn bệnh nhân.
Lympho mô đệm tuyến ức (TSLP) là một cytokine có nguồn gốc từ tế bào biểu mô liên quan đến nhiều quá trình xuôi chiều liên quan đến sinh lý bệnh hen suyễn. Ở bệnh nhân hen suyễn, nồng độ TSLP có tương quan với tắc nghẽn đường thở, mức độ nghiêm trọng của bệnh và tình trạng kháng glucocorticoid. Ngoài tác dụng thúc đẩy quá trình viêm T2 của đường thở, TSLP đã được chứng minh là làm trung gian tương tác giữa các tế bào cấu trúc đường thở và các tế bào miễn dịch, không chỉ gây ra viêm T2.
Tezepelumab là một kháng thể đơn dòng của người (IgG2λ) liên kết đặc biệt với TSLP, ngăn chặn nó tương tác với thụ thể dị phân tử của nó. Trong thử nghiệm PATHWAY pha 2b, tỷ lệ cơn hen kịch phát hàng năm được sử dụng tezepelumab thấp hơn tới 71% so với giả dược ở những bệnh nhân bị hen suyễn nặng, không kiểm soát được. Các đợt cấp giảm bất kể mức độ cơ bản của dấu ấn sinh học viêm (bao gồm một phần oxit nitric [F eno ] thở ra, bạch cầu ái toan trong máu và IgE) và tình trạng dị ứng. Chúng tôi đã tiến hành thử nghiệm NAVIGATOR để điều tra thêm những phát hiện trước đó ở những bệnh nhân bị hen suyễn nặng, không kiểm soát được.
Phương pháp
NGƯỜI BỆNH
Bệnh nhân từ 12 đến 80 tuổi mắc bệnh hen suyễn do bác sĩ chẩn đoán, đã dùng glucocorticoid dạng hít liều trung bình hoặc cao (liều hàng ngày ≥500 μg fluticasone propionate hoặc tương đương) trong ít nhất 12 tháng trước khi khám sàng lọc và ít nhất một lần bổ sung thuốc kiểm soát, có hoặc không có glucocorticoid đường uống, ít nhất 3 tháng trước ngày được thông báo. Bệnh hen suyễn do bác sĩ chẩn đoán phải được ghi lại ít nhất 12 tháng trước khi khám sàng lọc. Thể tích thở ra bắt buộc của thuốc giãn phế quản buổi sáng trong 1 giây (FEV 1 ) phải nhỏ hơn 80% giá trị bình thường dự đoán (<90% đối với bệnh nhân từ 12 đến 17 tuổi) trong thời gian chạy máy. Thuốc giãn phế quản (albuterol) FEV 1khả năng đảo ngược ít nhất 12% và ít nhất 200 ml phải được ghi lại trong 12 tháng trước khi sàng lọc hoặc trong thời gian chạy thử. Bệnh nhân phải có ít nhất hai đợt cấp hen (được định nghĩa để đủ điều kiện thử nghiệm và các biện pháp kết thúc khi các triệu chứng hen tồi tệ hơn dẫn đến nhập viện, một cuộc khám cấp cứu dẫn đến việc sử dụng glucocorticoid toàn thân trong 3 ngày liên tục, hoặc sử dụng glucocorticoid toàn thân trong 3 ngày liên tục) trong 12 tháng trước ngày được thông báo. Những bệnh nhân đã được điều trị bằng phương pháp sinh học tiếp thị hoặc không có tác dụng phụ được phép tham gia thử nghiệm nếu liều cuối cùng được thực hiện hơn 4 tháng, hoặc hơn năm thời gian bán hủy, trước khi sàng lọc (tùy theo liều nào lâu hơn).
THIẾT KẾ THỬ NGHIỆM
Đây là một thử nghiệm giai đoạn 3, đa trung tâm, mù đôi, ngẫu nhiên, có đối chứng với giả dược, được thực hiện từ ngày 23 tháng 11 năm 2017 đến ngày 8 tháng 9 năm 2020, tại 297 địa điểm ở 18 quốc gia. Chi tiết đầy đủ về thiết kế đã được công bố trước đây. Sau thời gian sàng lọc và chạy thử kéo dài từ 5 đến 6 tuần (để xác nhận tính đủ điều kiện), bệnh nhân được chỉ định ngẫu nhiên theo tỷ lệ 1: 1 để nhận tezepelumab với liều 210 mg hoặc giả dược (dùng với một lọ dùng một lần và ống tiêm) tiêm dưới da 4 tuần một lần trong 52 tuần. Bệnh nhân được phân tầng theo khu vực địa lý (Châu Á – Thái Bình Dương, Trung và Đông Âu, Tây Âu và Úc, Bắc Mỹ, Nam Mỹ, hoặc phần còn lại của thế giới) và độ tuổi (người lớn hoặc thanh thiếu niên). Liều tezepelumab được chọn trên cơ sở mô hình dược động học và phân tích phản ứng phơi nhiễm với việc sử dụng dữ liệu từ các nghiên cứu lâm sàng trước đó. Vào tuần 52, bệnh nhân bước vào giai đoạn theo dõi sau điều trị 12 tuần hoặc nghiên cứu kéo dài dài hạn (DESTINATION; ClinicalTrials.gov number, NCT03706079).
Dân số thử nghiệm được theo dõi để đảm bảo phân bố bệnh nhân theo ba đặc điểm: khoảng 20% bệnh nhân đã được dùng glucocorticoid dạng hít liều trung bình ổn định trong 3 tháng trước đó, khoảng 40% đã có ít nhất ba đợt cấp trong 12 lần trước đó. tháng, và khoảng 50% có số lượng bạch cầu ái toan trong máu ít nhất là 300 tế bào trên mỗi microlit. Trong quá trình thử nghiệm, tất cả các bệnh nhân tiếp tục nhận được glucocorticoid dạng hít được kê đơn trước đó cộng với các thuốc kiểm soát bổ sung, có hoặc không có glucocorticoid đường uống, mà không thay đổi. Bệnh nhân được phép sử dụng thuốc kháng β 2 tác dụng ngắn để giảm triệu chứng khi cần thiết.
GIÁM SÁT THỬ NGHIỆM
Thiết kế thử nghiệm đã được phê duyệt bởi các cơ quan quản lý quốc gia và thể chế và các ủy ban đạo đức, và tất cả bệnh nhân hoặc người giám hộ của họ đã đồng ý bằng văn bản.
Một ban giám sát an toàn và dữ liệu độc lập đã xem xét dữ liệu không bị ràng buộc 6 tháng một lần (và theo yêu cầu) để giám sát các khía cạnh an toàn của thử nghiệm. AstraZeneca phối hợp quản lý dữ liệu và thực hiện phân tích thống kê với sự cộng tác của các tác giả, tất cả đều có quyền truy cập vào dữ liệu thử nghiệm cuối cùng. Một tổ chức nghiên cứu hợp đồng (IQVIA) đã tham gia vào việc quản lý dữ liệu, do AstraZeneca điều phối. Tất cả các tác giả đã đóng góp vào việc thiết kế thử nghiệm, giải thích dữ liệu, soạn thảo bản thảo (với sự hỗ trợ của một nhà văn y tế được tài trợ bởi các nhà tài trợ), cung cấp phản hồi quan trọng và phê duyệt cuối cùng để đệ trình. Tất cả các tác giả đều đảm bảo về tính đầy đủ và chính xác của dữ liệu cũng như tuân thủ quy trình thử nghiệm.
ĐIỂM KẾT THÚC
Điểm cuối chính là tỷ lệ cơn hen kịch phát hàng năm (biến cố mỗi bệnh nhân / năm) trong thời gian điều trị 52 tuần trong dân số nói chung. Điểm cuối này cũng được đánh giá ở những bệnh nhân có số lượng bạch cầu ái toan trong máu cơ bản dưới 300 tế bào trên mỗi microlit. Các điểm cuối phụ chính là sự thay đổi so với ban đầu trong thuốc giãn phế quản FEV 1 (chênh lệch quan trọng về mặt lâm sàng tối thiểu [MCID], 0,1 lít), điểm của Bảng câu hỏi kiểm soát hen suyễn – 6 (ACQ-6) (phạm vi, 0 [không suy giảm] đến 6 [mức độ suy giảm tối đa]; MCID, 0,5 điểm), Bảng câu hỏi chất lượng cuộc sống do bệnh hen suyễn (tiêu chuẩn hóa) cho bệnh nhân từ 12 tuổi trở lên (AQLQ [S] +12) điểm tổng thể (phạm vi, 1 [mức độ suy giảm tối đa] đến 7 [ không suy giảm]; MCID, 0,5 điểm), và điểm trung bình hàng tuần của Nhật ký triệu chứng hen suyễn (ASD) (phạm vi, 0 [không có triệu chứng] đến 4 [triệu chứng tồi tệ nhất có thể xảy ra]; MCID, 0,5 điểm).
Là một phần của các phân tích chỉ định trước, tỷ lệ cơn hen kịch phát hàng năm trong khoảng thời gian 52 tuần được đánh giá ở những bệnh nhân được phân nhóm theo số lượng bạch cầu ái toan trong máu cơ bản, mức eno F , tình trạng IgE đặc hiệu trong huyết thanh (dương tính hoặc âm tính đối với độ nhạy cảm với chất gây dị ứng lâu năm), tuổi. , khu vực địa lý, liều lượng glucocorticoid dạng hít, sử dụng hoặc không sử dụng glucocorticoid đường uống, và tuổi khởi phát cơn hen (hậu học). Các điểm cuối phụ chính cũng được đánh giá ở những bệnh nhân được phân nhóm theo số lượng bạch cầu ái toan trong máu ban đầu. Các sự kiện bất lợi và các sự kiện bất lợi nghiêm trọng xảy ra trong quá trình thử nghiệm (từ lần nhận tezepelumab hoặc giả dược đầu tiên đến khi kết thúc thử nghiệm hoặc ngày thu hồi) đã được ghi lại.
PHÂN TÍCH THỐNG KÊ
Để kiểm soát lỗi loại I cho các điểm cuối chính và điểm cuối phụ chính, một trình tự kiểm tra phân cấp đã được sử dụng. Điểm kết thúc chính lần đầu tiên được kiểm tra trong dân số tổng thể và sau đó ở phân nhóm bệnh nhân có số lượng bạch cầu ái toan trong máu cơ bản dưới 300 tế bào trên mỗi microlit, tiếp theo là các điểm kết thúc thứ cấp quan trọng.
Người ta ước tính rằng khoảng 530 bệnh nhân cho mỗi nhóm thử nghiệm sẽ mang lại nhiều hơn 99% sức mạnh để phát hiện sự khác biệt giữa các nhóm về tỷ lệ cơn hen kịch phát hàng năm là 50% với mức ý nghĩa hai phía là 1% trong dân số tổng thể ( điểm cuối), với giả định về tỷ lệ với giả dược là 0,9 mỗi năm và thông số hình dạng là 2,4 (phân tán quá mức) và sẽ cung cấp ít nhất 90% công suất với mức ý nghĩa hai phía là 5% cho các điểm cuối phụ quan trọng . Đối với tỷ lệ hàng năm của các đợt cấp hen suyễn ở những bệnh nhân có số lượng bạch cầu ái toan trong máu dưới 300 tế bào trên mỗi microlít, người ta cho rằng tỷ lệ với giả dược sẽ là 0,6 và một nửa dân số bệnh nhân nói chung sẽ thuộc nhóm này (tức là 265 bệnh nhân mỗi nhóm thử nghiệm),
Tỷ lệ đợt cấp hen suyễn hàng năm và tỷ lệ đợt cấp liên quan đến nhập viện hoặc đến khám tại khoa cấp cứu trong khoảng thời gian 52 tuần được phân tích bằng cách sử dụng mô hình hồi quy nhị thức âm, với tổng số đợt cấp hen suyễn ở một bệnh nhân trên 52 -thời gian dùng thử tuần được sử dụng làm biến phản hồi. Phân công nhóm thử nghiệm, khu vực địa lý, tuổi và lịch sử các đợt cấp được bao gồm dưới dạng hiệp biến. Lôgarit của thời gian có nguy cơ xảy ra đợt kịch phát trong quá trình thử nghiệm được sử dụng như một biến số bù.
Ảnh hưởng của tezepelumab hoặc giả dược đối với tỷ lệ cơn hen kịch phát hàng năm trong khoảng thời gian 52 tuần trong liên tục các mức dấu ấn sinh học cơ bản đã được hình dung khi sử dụng hồi quy có trọng số cục bộ và làm mịn biểu đồ phân tán cho hai nhóm thử nghiệm. Dữ liệu bị thiếu được cho là bị thiếu ngẫu nhiên và được mô hình hóa dựa trên những gì quan sát được trong quá trình thử nghiệm với việc sử dụng các phương pháp tiếp cận khả năng tối đa trực tiếp. Phương pháp thống kê đầy đủ được cung cấp trong kế hoạch phân tích thống kê. Những thay đổi từ thời điểm ban đầu đến tuần thứ 52 đối với các điểm cuối phụ quan trọng trong hai nhóm thử nghiệm được so sánh với việc sử dụng mô hình đo lường lặp lại, sau nhiều lần áp đặt để hoàn thành việc theo dõi với giả định rằng dữ liệu bị thiếu một cách ngẫu nhiên. Tất cả các quan sát được đưa vào phân tích, bao gồm cả những quan sát sau khi ngừng tezepelumab hoặc giả dược.
Kết quả
NGƯỜI BỆNH
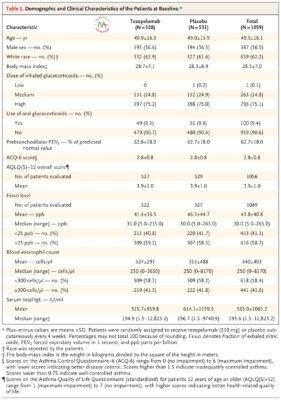
Nhìn chung, 2420 bệnh nhân được sàng lọc và 1061 người được phân nhóm ngẫu nhiên: 529 người được chỉ định dùng tezepelumab và 532 người được dùng giả dược. Trong số những bệnh nhân này, 528 và 531 được dùng tezepelumab và giả dược, và được đánh giá về hiệu quả và điểm kết thúc an toàn (tổng thể) (Hình S1). Các đặc điểm nhân khẩu học và lâm sàng của bệnh nhân tại thời điểm ban đầu được cân bằng giữa các nhóm thử nghiệm ( Bảng 1 và Bảng S1).
ĐIỂM CUỐI CHÍNH
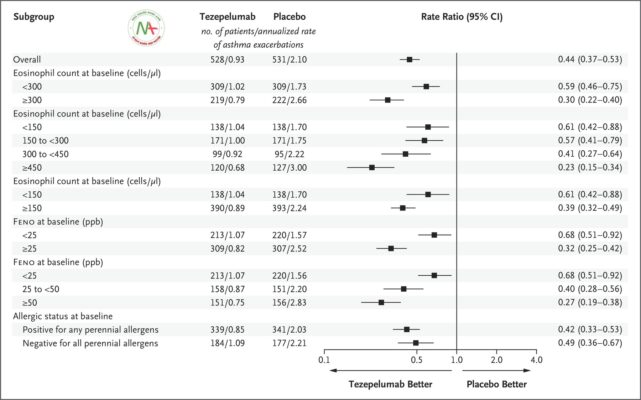
Trong dân số tổng thể, điều trị tezepelumab dẫn đến tỷ lệ cơn hen kịch phát hàng năm là 0,93 (khoảng tin cậy 95% [CI], 0,80 đến 1,07), so với 2,10 (95% CI, 1,84 đến 2,39) ở nhóm giả dược (tỷ lệ tỷ lệ, 0,44; KTC 95%, 0,37 đến 0,53; P <0,001). Ở những bệnh nhân có số lượng bạch cầu ái toan trong máu dưới 300 tế bào trên mỗi microlit, tỷ lệ cơn hen kịch phát hàng năm là 1,02 (KTC 95%, 0,84-1,23) ở nhóm tezepelumab và 1,73 (KTC 95%, 1,46 đến 2,05) ở nhóm giả dược nhóm (tỷ lệ tỷ lệ, 0,59; KTC 95%, 0,46 đến 0,75; P <0,001) ( Hình 1 và Hình S2). Các đợt cấp của bệnh hen suyễn được sử dụng để phân tích chính được tóm tắt trong Bảng S2.
ĐIỂM CUỐI PHỤ
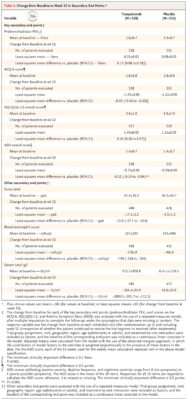
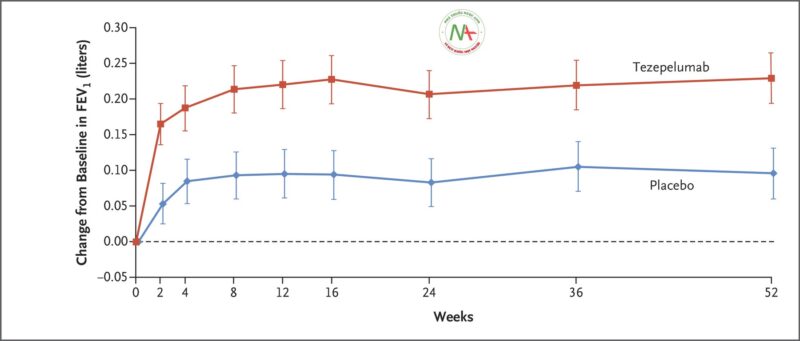
Ở tuần thứ 52, sự thay đổi so với ban đầu trong thuốc giãn phế quản FEV 1 là 0,23 lít ở nhóm tezepelumab và 0,09 lít ở nhóm giả dược (chênh lệch, 0,13 lít; KTC 95%, 0,08 đến 0,18; P <0,001) ( Bảng 2 ). Hiệu quả điều trị được quan sát thấy sớm nhất là vào tuần thứ 2 (thời điểm đầu tiên được đánh giá) và được duy trì trong suốt thời gian điều trị ( Hình 2). Đối với nhóm tezepelumab và giả dược, sự thay đổi so với ban đầu trong điểm ACQ-6 lần lượt là −1,55 và −1,22 (sự khác biệt, −0,33; KTC 95%, −0,46 đến −0,20; P <0,001); trong điểm AQLQ (S) +12, thay đổi so với ban đầu lần lượt là 1,49 và 1,15 (chênh lệch, 0,34; KTC 95%, 0,20 đến 0,47; P <0,001); và trong điểm ASD, sự thay đổi so với ban đầu lần lượt là −0,71 và −0,59 (chênh lệch, −0,12; KTC 95%, −0,19 đến −0,04; P = 0,002) ( Bảng 2). Những cải thiện đã được quan sát thấy từ đánh giá sau cơ sở đầu tiên và được duy trì trong suốt thời gian điều trị (Hình S3). Kết quả cho các điểm kết thúc thứ cấp và khám phá bổ sung được thể hiện trong Bảng S3. Tỷ lệ đợt cấp liên quan đến nhập viện hoặc đến khám tại khoa cấp cứu trong khoảng thời gian 52 tuần là 0,06 với tezepelumab và 0,28 với giả dược (tỷ lệ 0,21; KTC 95%, 0,12 đến 0,37) (Hình S4). Thời gian đến đợt cấp đầu tiên ở nhóm tezepelumab lâu hơn so với nhóm giả dược (Hình. S5).
Số lượng bạch cầu ái toan trong máu và nồng độ F eosin giảm so với ban đầu ở những bệnh nhân dùng tezepelumab được quan sát thấy ở tuần thứ 2 và được duy trì trong suốt thời gian điều trị ( Bảng 2 và Hình S6A và S6B). Nồng độ IgE toàn phần trong huyết thanh giảm dần trong khoảng thời gian 52 tuần ở nhóm tezepelumab ( Bảng 2 và Hình S6C).
CÁC ĐIỂM KẾT THÚC KHÁM PHÁ ĐƯỢC CHỈ ĐỊNH TRƯỚC KHÁC
Số đợt cấp tích lũy trong khoảng thời gian 52 tuần ở những bệnh nhân được dùng tezepelumab thấp hơn ở những bệnh nhân được dùng giả dược (Hình S7). Nhìn chung, 43,8% bệnh nhân dùng tezepelumab và 60,1% bệnh nhân dùng giả dược có ít nhất một đợt cấp (Bảng S4).
Điều trị bằng Tezepelumab dẫn đến tỷ lệ cơn hen kịch phát hàng năm là 0,79, 1,04 và 0,89 ở những bệnh nhân có số lượng bạch cầu ái toan trong máu ban đầu ít nhất là 300, dưới 150 và ít nhất 150 tế bào trên mỗi microlit, tương ứng so với 2,66, 1,70, và 2,24 trong các nhóm giả dược tương ứng ( Hình 1 ). Điều này tương ứng với các tỷ lệ lần lượt là 0,30 (95% CI, 0,22 đến 0,40), 0,61 (95% CI, 0,42 đến 0,88) và 0,39 (95% CI, 0,32 đến 0,49). Tỷ lệ cơn hen kịch phát hàng năm theo mức F eno ban đầu , tình trạng dị ứng lâu năm, mức IgE toàn phần trong huyết thanh và số lượng bạch cầu ái toan trong máu được thể hiện trong Hình 1và Hình S8 và S9. Một số khác biệt đã được quan sát thấy giữa các vùng địa lý liên quan đến hiệu quả điều trị đối với tỷ lệ cơn hen kịch phát hàng năm trong khoảng thời gian 52 tuần (Hình S10). Các nhóm con bổ sung đã được đánh giá được thể hiện trong Hình S10. Khi FEV 1 và điểm số trên ACQ-6, AQLQ (S) +12 và ASD được phân tích theo số lượng bạch cầu ái toan trong máu ban đầu, những cải thiện lớn nhất ở những bệnh nhân dùng tezepelumab đã được quan sát thấy ở những người có số lượng ít nhất 300 tế bào mỗi microliter (Bảng S5).
SỰ AN TOÀN
Tổng cộng 77,1% bệnh nhân trong nhóm tezepelumab và 80,8% bệnh nhân trong nhóm giả dược báo cáo tác dụng phụ, và 9,8% và 13,7% báo cáo tác dụng phụ nghiêm trọng tương ứng. Tỷ lệ bệnh nhân ngừng phác đồ thử nghiệm là 6,8% ở nhóm tezepelumab và 10,7% ở nhóm giả dược. Tỷ lệ bệnh nhân ngừng do các tác dụng phụ là 2,1% ở nhóm tezepelumab và 3,6% ở nhóm giả dược. Các tác dụng ngoại ý thường gặp nhất là viêm mũi họng, nhiễm trùng đường hô hấp trên, nhức đầu và hen suyễn (thường thấy ở nhóm dùng giả dược hơn ở nhóm dùng tezepelumab). Tất cả các tác dụng phụ nghiêm trọng được báo cáo được trình bày trong.
Tỷ lệ nhiễm trùng nặng không có sự khác biệt giữa các nhóm thử nghiệm (46 bệnh nhân [8,7%] trong mỗi nhóm), cũng như tỷ lệ mắc bệnh ung thư (4 bệnh nhân [0,8%] trong mỗi nhóm). Hai trường hợp tử vong đã được báo cáo trong thời gian thử nghiệm (một do suy tim và một không rõ nguyên nhân); cả hai đều ở trong nhóm giả dược.
Phản ứng tại chỗ tiêm xảy ra ở 3,6% bệnh nhân trong nhóm tezepelumab và 2,6% ở nhóm giả dược. Không có phản ứng phản vệ liên quan đến điều trị hoặc trường hợp hội chứng Guillain-Barré được báo cáo.
Tại hoặc sau thời điểm ban đầu, 4,9% bệnh nhân trong nhóm tezepelumab và 8,3% bệnh nhân trong nhóm giả dược dương tính với kháng thể kháng thuốc. Các kháng thể trung hòa được phát hiện ở một bệnh nhân trong mỗi nhóm.
Thảo luận
Tỷ lệ cơn hen kịch phát hàng năm thấp hơn đáng kể với tezepelumab so với giả dược ở người lớn và thanh thiếu niên bị hen suyễn nặng, không kiểm soát được, bao gồm cả những người có số lượng bạch cầu ái toan trong máu thấp (<300 tế bào / microlit) lúc ban đầu. Cải thiện đáng kể trong FEV 1 và điểm số trên ACQ-6, AQLQ (S) +12, và ASD và giảm đáng kể các đợt cấp dẫn đến nhập viện hoặc đến phòng cấp cứu đã được quan sát với tezepelumab so với giả dược. Các tần suất và loại tác dụng ngoại ý không khác nhau có ý nghĩa giữa nhóm tezepelumab và giả dược.
Các đợt cấp giảm quan sát được bất kể số lượng bạch cầu ái toan trong máu ban đầu xác nhận những phát hiện trước đó từ thử nghiệm PATHWAY. Các sinh phẩm hiện có không được chứng minh là có thể làm giảm liên tục các đợt cấp ở những bệnh nhân có số lượng bạch cầu ái toan trong máu dưới 150 tế bào trên mỗi microlit.
Tezepelumab đồng thời làm giảm số lượng bạch cầu ái toan trong máu và mức F eno và IgE; những phát hiện này cho thấy rằng thuốc ngăn chặn nhiều con đường viêm. Tác động của tezepelumab lên các mức dấu ấn sinh học này có thể liên quan đến việc giảm mức interleukin-5 và interleukin-13. Sự giảm mức IgE toàn phần quan sát được có thể là do mức interleukin-4 và interleukin-13 giảm, gây ra sự giảm dần tế bào B khi chuyển từ sản xuất isotype IgM sang IgE. Những dữ liệu này ủng hộ khái niệm rằng sự ức chế TSLP có thể có tác dụng sinh lý rộng hơn so với việc nhắm mục tiêu vào các cytokine T2 riêng lẻ.
Vai trò của TSLP như một chất liên lạc ngược dòng giữa các tế bào cấu trúc đường thở và tế bào miễn dịch để phản ứng với các kích thích (ví dụ: chất gây dị ứng, vi rút, các hạt trong không khí và chấn thương) gợi ý cơ chế dị ứng và không dị ứng mà tezepelumab có thể bình thường hóa tình trạng viêm tại chỗ, bất kể bạch cầu ái toan trong máu đếm. Chặn TSLP được cho là sẽ làm giảm rõ rệt việc sản xuất cytokine T2 bởi tế bào nhớ T helper 2, tế bào lymphoid loại 2 bẩm sinh và tế bào mast trên một phổ viêm. Vai trò của TSLP trong việc trung gian đáp ứng T2 và T17 thông qua các tế bào đuôi gai, ngoài việc trao đổi chéo giữa các tế bào mast và tế bào cơ trơn đường thở, là các cơ chế có khả năng liên quan đến tình trạng viêm ở những quần thể có số lượng bạch cầu ái toan thấp.
Một điểm mạnh trong thử nghiệm của chúng tôi là những cải thiện đáng kể nhất quán với điều trị tezepelumab so với giả dược qua các biện pháp về đợt cấp, chức năng phổi, kiểm soát hen suyễn và chất lượng cuộc sống liên quan đến sức khỏe. Ngoài ra, đây là một thử nghiệm toàn cầu, lớn, bao gồm thanh thiếu niên và người lớn trên toàn bộ số lượng bạch cầu ái toan trong máu, những người bị hen suyễn nặng (≥2 đợt cấp trước đó). Việc giảm tỷ lệ cơn hen kịch phát hàng năm trong thử nghiệm PATHWAY lớn hơn so với thử nghiệm NAVIGATOR, có khả năng do số lượng bệnh nhân trong thử nghiệm PATHWAY nhỏ hơn. Thử nghiệm của chúng tôi bị giới hạn bởi thời lượng (52 tuần), tiêu chí đưa vào nghiêm ngặt (loại trừ các phân nhóm bệnh nhân có liên quan – ví dụ, những người hút thuốc và những người mắc một số bệnh đồng thời) và một số lượng nhỏ bệnh nhân vị thành niên.
Tezepelumab làm giảm đáng kể các đợt cấp ở người lớn và thanh thiếu niên bị hen suyễn nặng, không kiểm soát được, bao gồm cả những người có số lượng bạch cầu ái toan trong máu thấp, đồng thời cải thiện chức năng phổi, kiểm soát hen suyễn và chất lượng cuộc sống liên quan đến sức khỏe.
Nhóm tác giả
- Andrew Menzies-Gow, M.D.,
- Jonathan Corren, M.D.,
- Arnaud Bourdin, M.D.,
- Geoffrey Chupp, M.D.,
- Elliot Israel, M.D.,
- Michael E. Wechsler, M.D.,
- Christopher E. Brightling, F.Med.Sci.,
- Janet M. Griffiths, Ph.D.,
- Åsa Hellqvist, M.Sc.,
- Karin Bowen, M.Sc.,
- Primal Kaur, M.D.,
- Gun Almqvist, M.Sc
Link báo cáo:
N Engl J Med 2021; 384: 1800-1809
DOI: 10.1056 / NEJMoa2034975
