Oxyd sắt
Phân loại Oxyd Sắt
Oxyd sắt là dạng oxyd của sắt, nó sẽ cùng với các oxyd kim loại khác tạo ra những màu sắc khác nhau khi được nung ở điều kiện thích hợp:
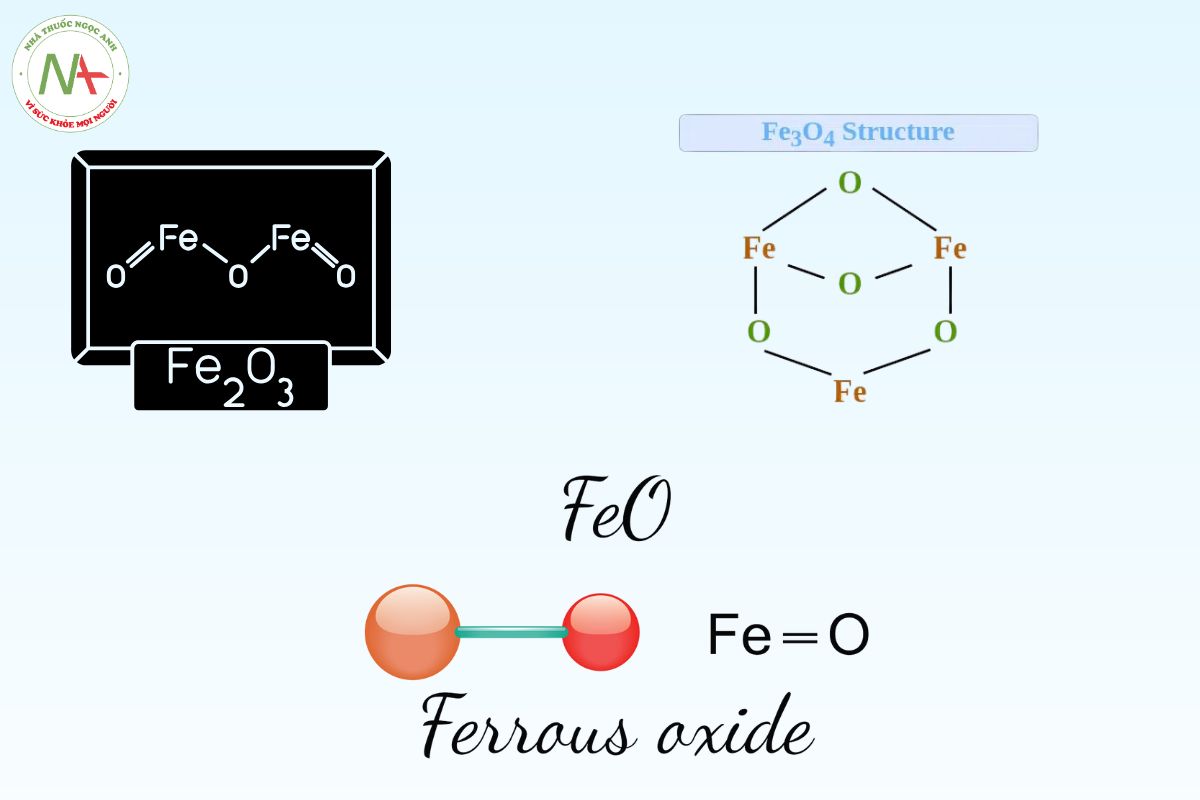
- Sắt (II) oxide (FeO) được tìm thấy dưới dạng bột màu đen và rất dễ gây nổ, bốc cháy.
- Sắt (III) oxide (Fe2O3) trong tự nhiên được biết đến với dạng hematit.
- Sắt (II,III) oxide hay oxide sắt từ (Fe3O4).
Đặc điểm của Oxy Sắt
FeO
Tên IUPAC
Sắt oxo
Công thức phân tử
FeO
Tính chất hóa học và vật lý
- Trọng lượng phân tử: 71,84 g/mol
- FeO tồn tại dưới dạng bột khô, chất rắn, viên hoặc tinh thể lớn có màu đen, không có mùi và không tan trong nước.
- Điểm nóng chảy: 1377 °C
- Độ hòa tan: Không tan trong nước, dễ tan trong acid, không tan trong rượu.
- FeO mang đầy đủ tính chất của basic oxide, nó vừa là chất có tính oxi hóa, vừa có tính khử.
Fe2O3
Tên IUPAC
oxo(oxoferriooxy)sắt
Công thức phân tử
Fe2O3
Tính chất hóa học và vật lý
- Trọng lượng phân tử: 159,69 g/mol
- Fe2O3 tồn tại dưới dạng tinh thể hoặc bột có màu từ nâu đỏ đến đen.
- Điểm nóng chảy 1539 °C
- Độ hòa tan: có thể tan được trong acid; không tan trong rượu, nước, ete
- Fe2O3 có tính basic oxide và tính chất có tính oxi hóa.
Dược lý và Hóa sinh
- Bụi Fe2O3 có thể đi vào phổi, bám vào hệ hô hấp và được loại bỏ qua đờm. Oxyd sắt sẽ được chuyển hóa thành ferritin và hemosiderin trong tất cả các tế bào biểu mô ngoại trừ các tế bào niêm mạc. Hàm lượng Fe tăng theo thời gian. Chất chuyển hóa Ferritin và hemosiderin, được tìm thấy trong các tế bào mô liên kết ở dưới niêm mạc. Fe2O3 có thời gian bán hủy khoảng 33 ngày.
- Fe2O3 làm chậm quá trình thanh thải các chất gây ung thư hít phải hoặc gây ra những thay đổi về tế bào khiến các tế bào đường hô hấp dễ mắc ung thư hơn khi tiếp xúc với các chất gây ung thư. Chính vì điều này người ta cho rằng Fe2O3 là một đồng yếu tố gây ung thư khi hít phải.
Fe3O4
Tên IUPAC
sắt(2+);sắt(3+);oxy(2-)
Công thức phân tử
Fe3O4
Tính chất hóa học và vật lý
- Trọng lượng phân tử: 231,53 g/mol
- Fe3O4 tồn tại dưới dạng chất lỏng màu đen đến nâu đỏ.
Dược lý và Hóa sinh
Fe3O4 khi được đưa vào cơ thể theo đường tiêm tuyền tĩnh mạch sẽ được đào thải khỏi máu sau 25 giờ dùng thuốc. Dưới 2% thuốc được thải trừ qua nước tiểu. sau 24 giờ, sắt trong huyết thanh sẽ tăng lên, sau đó trở dần lại bình thường trong 7 ngày. Sắt trong Fe3O4 sẽ đi vào chu trình chuyển hóa sắt bình thường của cơ thể.
Oxyd Sắt có công dụng gì?
FeO
- FeO được sử dụng như một chất xúc tác và để sản xuất thép, men và thủy tinh hấp thụ nhiệt.
- Trong công nghiệp, FeO là hợp chất quan trọng trong việc sản xuất ra sắt nhờ vai trò là chất oxy hóa.
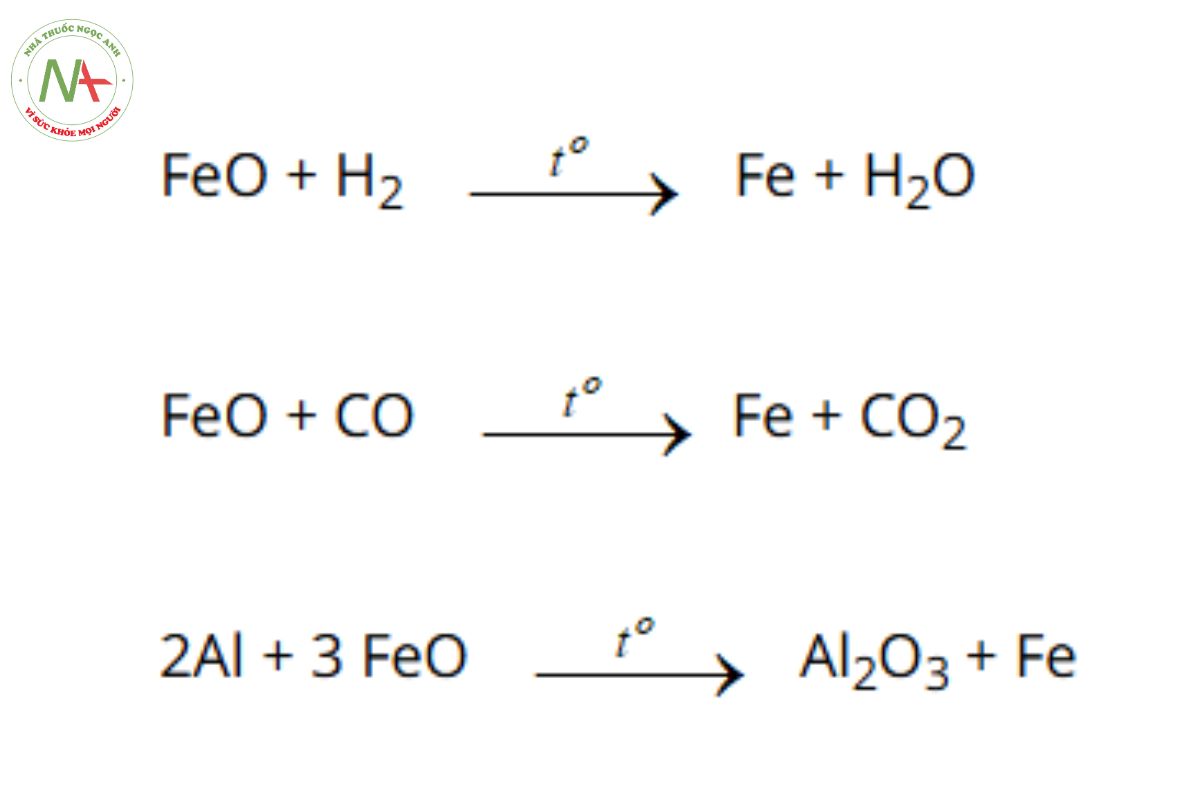
- FeO được sử dụng rộng rãi trong công nghiệp tạo màu trong sơn, lớp phủ, vật liệu xây dựng, gồm sứ, thủy tinh, giấy, nhựa và hàng hóa cao su.
- Ngoài ra, oxyd sắt được sử dụng làm chất xúc tác trong quá trình xử lý hóa học và là nguồn cung cấp sắt vi lượng trong thức ăn chăn nuôi và phân bón.
- Các oxyd sắt chuyên dụng có độ tinh khiết cao và độ đồng nhất được kiểm soát được sử dụng trong sản xuất ferit (nam châm gốm) có ứng dụng trong lõi bộ nhớ máy tính, loa hi-fi, TV màu và các sản phẩm điện và điện tử khác.
- Trong công nghiệp Dược Mỹ phẩm, FeO được ứng dụng để làm chất tạo màu.
Fe2O3
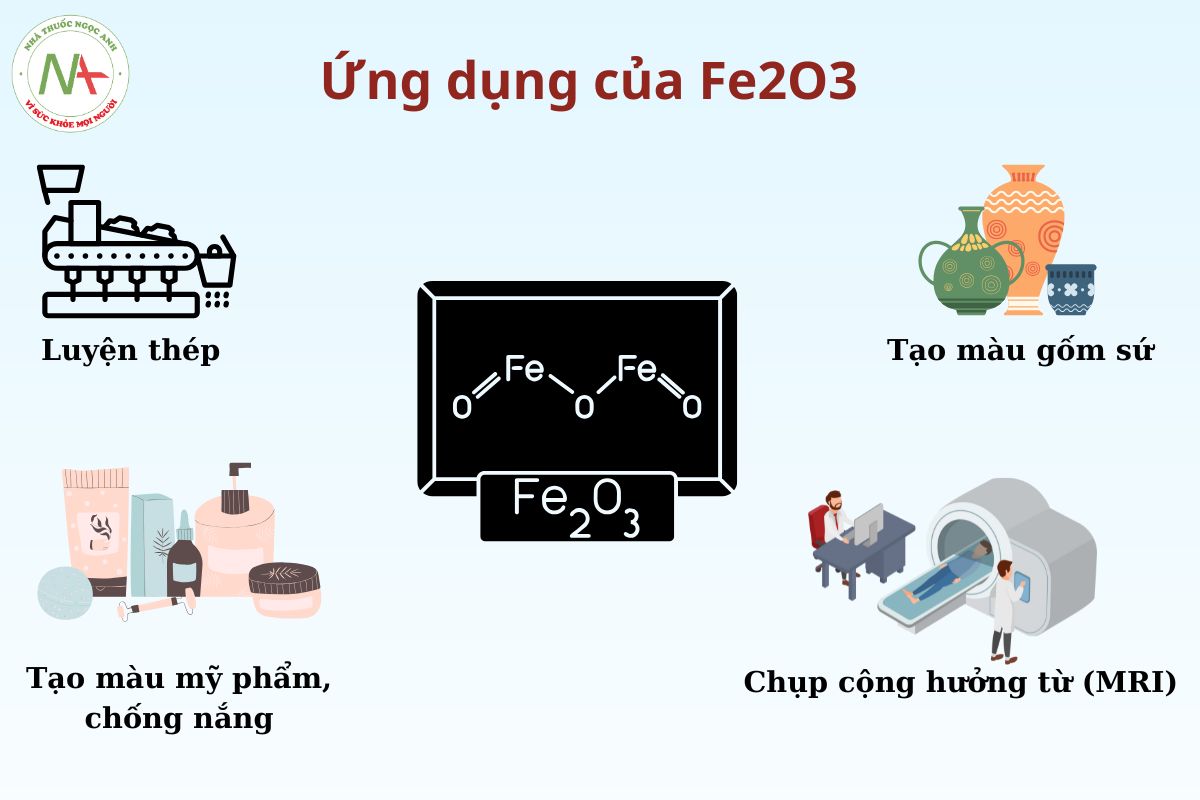
- Fe2O3 có vai trò quan trọng trong tạo màu cho các loại men gốm sứ và có công dụng giúp làm giảm tình trạng rạn men. Tùy thuộc vào môi trường lò, nhiệt độ, thời gian nung, thành phần hóa học của men mà sắt sẽ có những màu sắc khác biệt.
- Đây cũng là một chất tạo màu phổ biến trong công nghiệp sơn và mỹ phẩm nhờ khả năng bền màu và tính chất ổn định của nó.
- Nhờ vào khả năng hấp thụ các tia cực tím mà Fe2O3 có thể sử dụng để sẵn xuất các sản phẩm chống nắng, các lớp bao phủ bảo vệ vật liệu khỏi tác hại của mặt trời.
- Fe2O3 cũng tham gia vào việc sản xuất thép trong ngành công nghiệp thép.
- Fe2O3 có từ tính mạnh nên còn được sử dụng để sản xuất nam châm.
- Trong y học, Fe2O3 được dùng trong công nghệ chụp cộng hưởng từ (MRI) để cải thiện chất lượng hình ảnh.
- Ngoài ra, Fe2O3 có khả năng hấp thụ khí H2S tốt nên có thẻ ứng dụng trong công nghệ xử lý nước hoặc xử lý khí bioga.
Fe3O4
- Fe3O4 có hàm lượng sắt cao, được ứng dùng trong ngành luyện gang, thép.
- Fe3O4 dạng hạt nano được sử dụng trong đánh dấu tế bào và xử lý nước bị nhiễm bẩn.
- Fe3O4 cũng được ứng dụng làm chất tạo màu trong dược mỹ phẩm.
Phương pháp sản xuất
FeO
- Sản xuất FeO bằng phương pháp nhiệt phân Fe(OH)2 trong môi trường không có không khí: Fe(OH)2 → FeO + H2O
- Nung FeCO3 trong điều kiện không có không khí để sản xuất FeO: FeCO3 → FeO + CO2
Fe2O3
Fe2O3 được sản xuất bằng quá trình oxy hóa quặng sắt trong không khí (quặng hematite): 4FeCO3+O2→2Fe2O3+4CO2
Ngoài ra, có thể sản xuất Fe2O3 từ sắt bằng phản ứng oxy hóa (nung nóng trong không khi hoặc oxy nguyên chất): 4Fe+3O2→2Fe2O3
Fe3O4
Trong tự nhiên, Fe3O4 là thành phần của quặng manhetit.
Fe3O4 còn được bào chế bằng các phương pháp:
- Đốt cháy sắt trong oxi không khí: 3Fe + 2O2 → Fe3O4
- Nung nóng Sắt trong nước dạng hơi ở nhiệt độ dưới 570 độ C: 3Fe + 4H2O → Fe3O4 + 4H2
Tài liệu tham khảo
- Tác giả của PubChem, Iron Oxide Black, pubchem. Truy cập ngày 26 tháng 12 năm 2024
- Tác giả của PubChem, Ferric Oxide Red, pubchem. Truy cập ngày 26 tháng 12 năm 2024
- Tác giả của PubChem, Wustite, pubchem. Truy cập ngày 26 tháng 12 năm 2024
Xuất xứ: Anh
Xuất xứ: Úc
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Hungary
Xuất xứ: Hungary
Xuất xứ: Hà Lan
Xuất xứ: Việt Nam
Xuất xứ: Mỹ
Xuất xứ: Việt Nam
Xuất xứ: Ý
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam