Bệnh hô hấp
Sự phân chia cơ học hô hấp ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính và mối liên hệ với kết cục
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Sự phân chia cơ học hô hấp ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính và mối liên hệ với kết cục: một nghiên cứu lâm sàng đa trung tâm file pdf ở đây.
Dịch: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Mục đích. Trong hội chứng nguy kịch hô hấp cấp tính (ARDS), các thông số sinh lý liên quan đến kết quả có thể giúp xác định mục tiêu thở máy. Nghiên cứu này nhằm mục đích giải quyết liệu áp lực xuyên phổi (transpulmonary pressures − PL), bao gồm áp lực đẩy xuyên phổi (transpulmonary driving pressure − DPL), PL cao nguyên có nguồn gốc từ đàn hồi (elastance-derived) và PL đo trực tiếp cuối kỳ thở ra (directly-measured end- expiratory), có liên quan tốt hơn đến kết cục 60 ngày so với áp lực đẩy đường thở (DPaw). Chúng tôi cũng đã thử nghiệm sự kết hợp giữa oxygen hóa và chỉ số kéo căng (stretch index) [PaO2/(FiO2*DPaw)].
Phương pháp. Nghiên cứu tiền cứu, quan sát, đa trung tâm, được đăng ký của bệnh nhân ARDS. Cơ học hô hấp được đo sớm sau khi đặt nội khí quản ở thể tích khí lưu thông 6 kg/ml. Chúng tôi đã so sánh khả năng dự đoán của các tham số về tỷ lệ tử vong ở ngày 60 thông qua đường cong ROC (receiver operating characteristic) và đánh giá mối liên hệ của chúng với tỷ lệ tử vong trong 60 ngày thông qua hồi quy Cox chưa điều chỉnh và điều chỉnh. Cuối cùng, mỗi tham số được phân đôi và các đường cong sống sót (survival curves) của Kaplan–Meier được so sánh.
Kết quả. 385 bệnh nhân được ghi danh sau 2 [1– 4] ngày đặt nội khí quản (áp lực thực quản và khí máu động mạch ở 302 và 318 bệnh nhân). Là các biến liên tục, DPaw, DPL và chỉ số kéo căng oxygen hóa có liên quan đến tỷ lệ tử vong trong 60 ngày sau khi điều chỉnh theo tuổi và Đánh giá suy cơ quan tuần tự, trong khi PL cao nguyên có nguồn gốc từ đàn hồi thì không. DPaw và DPL thực hiện như nhau trong phân tích ROC (P = 0,0835). DPaw có mô hình hồi quy Cox phù hợp nhất. Khi phân đôi các biến, DPaw ≥ 15, DPL ≥ 12, PL cao nguyên ≥ 24 và chỉ số kéo căng oxygen hóa < 10 cho thấy xác suất sống sót sau 60 ngày thấp hơn. PL cuối kỳ thở ra được đo trực tiếp ≥ 0 có liên quan đến kết quả tốt hơn ở bệnh nhân béo phì.
Kết luận. DPL là yếu tố dự đoán kết quả tương đương so với DPaw. Nghiên cứu của chúng tôi ủng hộ tính hợp lý của việc hạn chế áp lực đẩy phổi và đường thở và duy trì PL cuối kỳ thở ra dương tính ở bệnh nhân béo phì.
Giới thiệu
Thông khí cơ học là cứu cánh nhưng có thể gây ra tổn thương phổi do máy thở (ventilator- induced lung injury − VILI) [1]. Chiến lược thông khí bảo vệ kết hợp thể tích khí lưu thông (tidal volume − VT) thấp hơn, bình thường hóa với trọng lượng cơ thể dự đoán (predicted body weight − PBW) và áp lực cao nguyên đường thở (airway plateau pressure − Pplat) ở bệnh nhân mắc hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome − ARDS) đã làm giảm tỷ lệ tử vong [2].
Một số thông số đã được đề xuất để theo dõi chiến lược thở máy. Amato và cộng sự [3] đề xuất rằng áp lực đẩy đường thở (airway driving pressure − DPaw) hợp lý hơn về mặt sinh lý so với sử dụng VT/PBW để hạn chế VILI. Phân tích hồi cứu của họ đã chứng minh rằng DPaw liên quan đến kết quả tốt hơn so với VT/PBW hoặc Pplat [3]. Các nghiên cứu quan sát lớn, tiền cứu xa hơn cũng xác nhận mối liên hệ chặt chẽ này [4, 5]. Do đó, DPaw là một thông số theo dõi thiết yếu và là mục tiêu tiềm năng cho các chiến lược thông khí bảo vệ phổi [6].
VILI có liên quan đến mức độ căng của phổi (lung stretch), và do đó về mặt lý thuyết, áp lực đẩy xuyên phổi (DPL) hoặc stress phổi theo chu kỳ thở có thể là yếu tố quyết định tốt hơn VILI so với DPaw bằng cách loại bỏ sự đóng góp của thành ngực vào DPaw [7]. Các chỉ số tính toán khác liên quan đến áp lực xuyên phổi (PL) thể hiện ý nghĩa sinh lý có thể có để hạn chế VILI. Đặc biệt, do có sự chênh lệch áp lực màng phổi [8], PL ở phổi lưng khác với PL ở phổi bụng, có thể có ý nghĩa khác nhau để theo dõi VILI. Ví dụ, do vị trí của thực quản gần với phổi lưng, nên PL cuối thì thở ra được đo trực tiếp thông qua áp lực thực quản (Pes) cung cấp PL ở phổi lưng, đại diện cho mức độ xẹp [9 – 11]. Mặt khác, sự thay đổi theo chu kỳ thở của áp lực màng phổi tương đối đồng đều. Nói cách khác, delta Pes (nghĩa là delta áp lực màng phổi ở phổi lưng) tương tự như delta áp lực màng phổi ở phổi bụng [10]. Nhờ tính năng này, áp lực xuyên phổi cao nguyên có nguồn gốc đàn hồi (elastance-derived) [12] được tính toán thông qua delta Pes (xem Phụ lục), do đó đại diện cho tổng stress phổi (total lung stress) của “phổi em bé” (baby lung) được thông khí, đặc biệt là ở phổi bụng, dễ bị căng quá mức (overdistension) hơn [10, 13]. Tất cả các giá trị áp lực xuyên phổi này đều yêu cầu đo Pes [14], hiếm khi được theo dõi trong thực hành lâm sàng thông thường. Một nghiên cứu trước từ trung tâm của chúng tôi đã chứng minh tính khả thi của việc áp dụng kỹ thuật này vào lâm sàng [15], cung cấp nền tảng cho nghiên cứu hiện tại.
Mục tiêu cuối cùng của chúng tôi là tìm ra các biến số quan trọng nhất có thể được sử dụng làm mục tiêu thông khí để hạn chế nguy cơ VILI. Tuy nhiên, vì không có cách tiếp cận trực tiếp, đáng tin cậy (bao gồm cả dấu ấn sinh học) để đánh giá VILI tại giường bệnh nên chúng tôi quyết định xem xét mối liên quan giữa cơ học và tỷ lệ tử vong như một cách tiếp cận gián tiếp. Chắc chắn, tỷ lệ tử vong không chỉ được xác định bởi VILI nhưng chúng tôi nghĩ rằng, nếu một biến số trong cơ học có thể đại diện tốt cho nguy cơ VILI, thì nó phải liên quan đến tỷ lệ tử vong.
Nghiên cứu hiện tại mô tả một nghiên cứu đa trung tâm để kiểm tra tầm quan trọng tương đối đối với kết quả của cơ học hô hấp toàn cục và phân vùng ở bệnh nhân ARDS. Giả thuyết chính của chúng tôi là áp lực đẩy xuyên phổi (DPL) là một yếu tố dự đoán kết quả tốt hơn so với DPaw. Giả thuyết thứ cấp là chỉ số kéo căng oxygen hóa (oxygenation stretch index), một biến tổng hợp sử dụng PaO2/FiO2 chia cho DPaw [15], có thể nâng cao khả năng dự đoán của DPaw.
Phương pháp
Thiết kế và cài đặt
Đây là một nghiên cứu tiến cứu, quan sát, đa trung tâm. Các trung tâm tham gia được liệt kê trong tệp bổ sung. Nghiên cứu đã được phê duyệt bởi các hội đồng đạo đức nghiên cứu từ mỗi trung tâm. Sự đồng ý có hiểu biết đã được miễn tại trung tâm từ Canada vì phép đo cơ học là một phần của tiêu chuẩn chăm sóc ở những bệnh nhân mắc ARDS trung bình và nặng [15].
Người bệnh
Các tiêu chí thu nhận như sau: (1) tuổi > 18 tuổi;
(2) ARDS theo định nghĩa của Berlin [16]; (3) nhận thông khí hỗ trợ/kiểm soát với thuốc an
thần; (4) trong tuần đầu tiên đặt nội khí quản. Các tiêu chí loại trừ như sau: (1) bệnh lý thực quản đã biết, chảy máu đường tiêu hóa trên đang hoạt động hoặc các chống chỉ định khác đối với việc đặt ống thông dạ dày; (2) huyết động không ổn định nghiêm trọng (tăng > 30% thuốc vận mạch trong 6 giờ trước, hoặc norepinephrine > 0,5 mcg/kg/phút).
Đo đạc
Cơ học hô hấp được đo theo cách tiêu chuẩn hóa như đã mô tả trước đây [15]. Tóm lại, chúng tôi đã nghiên cứu những bệnh nhân ở tư thế nửa nằm ngửa [17], những người không tạo ra nhịp thở tự nhiên (không kích hoạt và không nỗ lực trong quá trình tắc nghẽn cuối thì thở ra) trong quá trình đo. Để đạt được điều này, bệnh nhân được dùng thuốc an thần sâu có hoặc không có phong bế thần kinh cơ (đôi khi dưới dạng bolus). Bệnh nhân không được hỗ trợ sự sống ngoài cơ thể và được thở máy với các cài đặt sau: điều khiển thể tích với VT 6 ml/kg trọng lượng cơ thể dự đoán (PBW), lưu lượng hít vào không đổi 50– 60 L/phút, khoảng dừng cuối thì hít vào 0,3 giây và áp lực dương cuối thì thở ra (PEEP) do bác sĩ lâm sàng điều trị thiết lập. Các phép đo Pes tuân theo một giao thức chuẩn hóa [15], được điều chỉnh từ các quy trình của nghiên cứu EPVent [9], ở tất cả các trung tâm. Tóm lại, đầu tiên, ống thông Pes được đưa vào dạ dày (độ sâu 60 cm và được xác nhận bằng cách ấn bụng nhẹ nhàng, nhanh chóng). Sau đó, ống thông được rút xuống độ sâu 40 cm. Vị trí thực quản đã được xác nhận bởi sự hiện diện của nhiễu động do tim và sự khác biệt rõ ràng giữa sự thay đổi theo chu kỳ thở của Pes và áp lực đẩy đường thở (để loại trừ việc đặt sai vị trí trong khí quản). Đối với mỗi bệnh nhân, vị trí của ống thông cũng được xác nhận thông qua việc thử nghiệm tắc nghẽn Baydur sửa đổi theo Lanteri tại giường bệnh [18,19]. Kiểm tra trung tâm các dạng sóng Pes (ví dụ: sự hiện diện của yếu tố tim, không có dao động Pes âm tính, tính hợp lệ của xét nghiệm tắc nghẽn) cũng được thực hiện bởi tác giả LC. Pes chỉ được đo ở những bệnh nhân mắc ARDS trung bình hoặc nặng và không có nỗ lực thở tự phát. Cơ học và khí máu động mạch được đo ở mức PEEP lâm sàng và được lặp lại 10 phút sau khi PEEP được điều chỉnh thêm 5 cmH2O (tăng trong hầu hết các trường hợp mà không thay đổi bất kỳ cài đặt nào khác). Việc PEEP tăng (tùy chọn thích hợp hơn) hay giảm so với mức PEEP lâm sàng được quyết định bởi các nhà điều tra và bác sĩ lâm sàng. Nguyên tắc là duy trì Pplat ≤ 35 cmH2O và giữ cho bệnh nhân ổn định huyết động. Lưu ý rằng giới hạn Pplat chỉ dành cho sự an toàn của phép đo, không dành cho thực hành lâm sàng. Các phép đo được lặp lại ở một mức PEEP khác để quan sát phản ứng với PEEP.
Các định nghĩa trong cơ học hô hấp
Tính toán chi tiết trong cơ học được cung cấp trong Phụ lục (xem phần bổ sung). Chúng tôi đề cập đến cơ học toàn cục để tính toán dựa trên áp lực đường thở, chẳng hạn như DPaw. Chúng tôi đã tính DPaw là sự khác biệt giữa Pplat và PEEP tổng, không phải PEEP cài đặt. Chúng tôi đề cập đến cơ học phổi và thành ngực khi Pes và PL được sử dụng. Chúng tôi đã phân chia DPaw thành DPL và áp lực đẩy thành ngực (tức là ∆Pes trong nhịp thở theo chu kỳ thông thường). Vì vị trí của thực quản gần với phổi lưng, chúng tôi tiếp tục phân chia PL cụ thể cho phổi bụng hoặc phổi lưng. Cụ thể, PL được đo trực tiếp đại diện cho PL cuối kỳ thở ra qua vùng phổi lưng, trong khi PL có nguồn gốc đàn hồi đại diện cho PL cuối thì hít vào qua phổi bụng [10, 11]. Chúng tôi cũng đã tính toán chỉ số kéo căng oxygen hóa [(PaO2/(FiO2 × DPaw)] một chỉ số tổng hợp về oxygen hóa và cơ học được mô tả trước đây [15]. Công suất cơ học
được tính bằng công thức: 0,098 × RR × [VT2 × [0,5 × Ers + RR × (1 + I:E)/(60 × I:E) × Rrs] + VT × PEEP] [20].
Ước lượng cỡ mẫu
Nghiên cứu nhằm mục đích chỉ ra rằng khả năng phân biệt để dự đoán tỷ lệ tử vong, được đo bằng diện tích dưới đường cong (area under curve − AUC) của đường cong đặc tính vận hành máy thu (receiver operating characteristic − ROC), của DPaw và DPL là khác nhau. Sử dụng phương pháp của Hanley và McNeils [21], một mẫu gồm 64 người không sống sót và 160 người sống sót sau 60 ngày đạt được 95% khả năng phát hiện sự khác biệt 0,092 giữa DPaw với AUC là 0,590 và DPL với AUC là 0,498, sử dụng một z hai mặt- Kiểm định với mức ý nghĩa 0,05. Mối tương quan giữa hai xét nghiệm chẩn đoán được giả định là 0,834 đối với nhóm sống sót và 0,870 đối với nhóm không sống sót. Giả sử tỷ lệ bỏ cuộc là 20%, cỡ mẫu đăng ký bỏ cuộc tăng cao là 280 bệnh nhân (200 người sống sót và 80 người không sống sót) được đo Pes. Các giả định và dữ liệu để tính cỡ mẫu dựa trên nghiên cứu EPVent [9].
Phân tích thống kê
Tất cả các phân tích đều tiền cứu trừ khi được chỉ định rõ ràng là hậu kiểm. Đối với phân tích mô tả, dữ liệu được trình bày dưới dạng trung bình ± đạo hàm chuẩn hoặc trung vị [phạm vi liên vùng thứ 25–75 (interquartile range − IQR)] theo độ lệch và tính quy tắc của dữ liệu được kiểm tra thông qua thử nghiệm Shapiro–Wilk. Các đặc điểm và cơ chế giữa những người sống sót và những người không sống sót được so sánh bằng cách sử dụng t -test hoặc Mann–Whitney U -test, tùy thuộc vào tính quy tắc, mà không cần hiệu chỉnh giá trị P cho nhiều lần so sánh.
Để so sánh khả năng dự đoán của cơ học, chúng tôi đã sử dụng tỷ lệ tử vong ở ngày thứ 60 làm kết quả nhị phân và ước tính các đường cong ROC cho cơ học dưới dạng các biến liên tục. Các AUC sau đó được so sánh bằng cách sử dụng thử nghiệm bootstrap cho hai đường cong ROC tương quan. Để kiểm tra mối liên hệ giữa kết quả và cơ học, các mô hình hồi quy nguy cơ theo tỷ lệ Cox đã được thực hiện bằng cách sử dụng cơ học làm yếu tố dự báo liên tục. Mối liên hệ giữa từng hiệp phương sai và kết quả được định lượng bằng tỷ lệ nguy cơ (hazard ratio − HR) và khoảng tin cậy (confidence interval − CI) 95%. Các mô hình hồi quy Cox đã điều chỉnh đã được thực hiện để điều chỉnh ước tính HR cho các đặc điểm cơ bản—tuổi và điểm Đánh giá Thất bại Cơ quan Tuần tự (Sequential Organ Failure Assessment − SOFA). Giả định nguy cơ theo tỷ lệ đã được thử nghiệm cho tất cả các mô hình Cox (dựa trên phần dư Schoenfeld được chia tỷ lệ). Các mô hình đã điều chỉnh được xếp hạng theo tiêu chí thông tin Akaike (Akaike information criterion − AIC) của chúng. AIC đề cập đến cả mức độ phù hợp và tính đơn giản của một mô hình. Vì chúng tôi đã so sánh các mô hình có cùng số lượng biến độc lập cho cùng một nhóm bệnh nhân, nên AIC thấp nhất đại diện cho mô hình phù hợp nhất.
Hơn nữa, đối với mỗi tham số cơ học, chúng tôi đã nhóm bệnh nhân vào nhóm phân đôi thấp hơn hoặc cao hơn (hoặc bằng) theo các ngưỡng được đề xuất trong các nghiên cứu trước đây: 12 cmH2O đối với DPL, 15 cmH2O đối với DPaw, 24 cmH2O đối với PL cao nguyên có nguồn gốc từ đàn hồi, 0 cmH2O đối với PL cuối thì thở ra được đo trực tiếp và 10 mmHg/cmH2O đối với chỉ số kéo căng oxygen hóa [3, 5, 14, 15]. Phương pháp Kaplan–Meier được sử dụng để ước tính các chức năng sinh tồn (survival functions) trong mỗi nhóm và kiểm tra thứ hạng log chưa điều chỉnh được sử dụng để so sánh chúng.
Chúng tôi không cho rằng dữ liệu bị thiếu, cho rằng việc mất dữ liệu là ngẫu nhiên; khi giải quyết các câu hỏi nghiên cứu khác nhau, chúng tôi đã sử dụng các tập hợp con với thông tin đầy đủ.
Tất cả các giá trị p đều có tính hai mặt, với giá trị p < 0,05 được coi là có ý nghĩa thống kê. Phân tích thống kê được thực hiện bằng R phiên bản 3.5.2 [22] với gói survminer phiên bản 0.4.9.
Kết quả
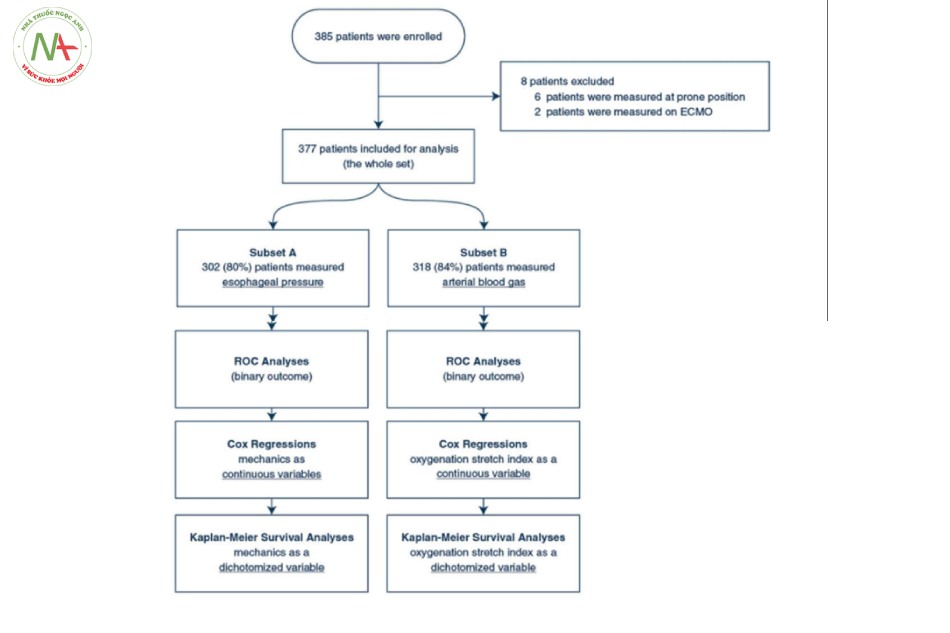
Như được minh họa trong lưu đồ (Hình 1), 385 bệnh nhân đã được ghi danh; 8 bệnh nhân bị loại khỏi phân tích do các phép đo được thực hiện ở tư thế nằm sấp hoặc trong điều kiện oxygen hóa qua màng ngoài cơ thể (extracorporeal membrane oxygenation − ECMO). 377 bệnh nhân còn lại đã thành lập đoàn hệ nghiên cứu.
Các đặc điểm của đoàn hệ được cung cấp trong Bảng 1. Tỷ lệ tử vong ở ngày 60 là 37,7%. Các phép đo được thực hiện trong vòng 2 [IQR 1–4] ngày kể từ khi đặt nội khí quản với PEEP lâm sàng trung bình là 12 [IQR 10–14] cmH2O. Trong phân tích đơn biến, những người không sống sót có tuổi cao hơn, APACHE II khi nhập viện ICU, SOFA cao hơn và giảm PaO2/FiO2 khi nhập viện. Cơ học hô hấp được báo cáo trong Bảng 1. Phân tích đơn biến cho thấy những người không sống sót có Pplat, DPaw, DPL cao hơn, PL cao nguyên có nguồn gốc từ đàn hồi, nhịp hô hấp và chỉ số kéo căng oxygen hóa thấp hơn. Chúng tôi không tìm thấy bất kỳ sự khác biệt thống kê nào về oxygen hóa, huyết áp và phản ứng DPaw đối với PEEP cao hơn giữa những người sống sót và những người không sống sót.
Cơ học và kết quả
Pes được đo ở 302 bệnh nhân (tập hợp con A: 80% của đoàn hệ). Tỷ lệ kiểm tra khớp trung vị (∆Paw/∆Pes) để xác nhận số Pes đo được là 0,91 [IQR 0,84–1,00].
AUC của các đường cong ROC của DPaw, DPL, PL cao nguyên có nguồn gốc từ đàn hồi và PL cuối kỳ thở ra được đo trực tiếp để dự đoán tỷ lệ tử vong vào ngày 60 lần lượt là 0,62, 0,59, 0,58 và 0,53. Không có sự khác biệt về AUC giữa DPaw và DPL (P = 0,0835, Hình S1).
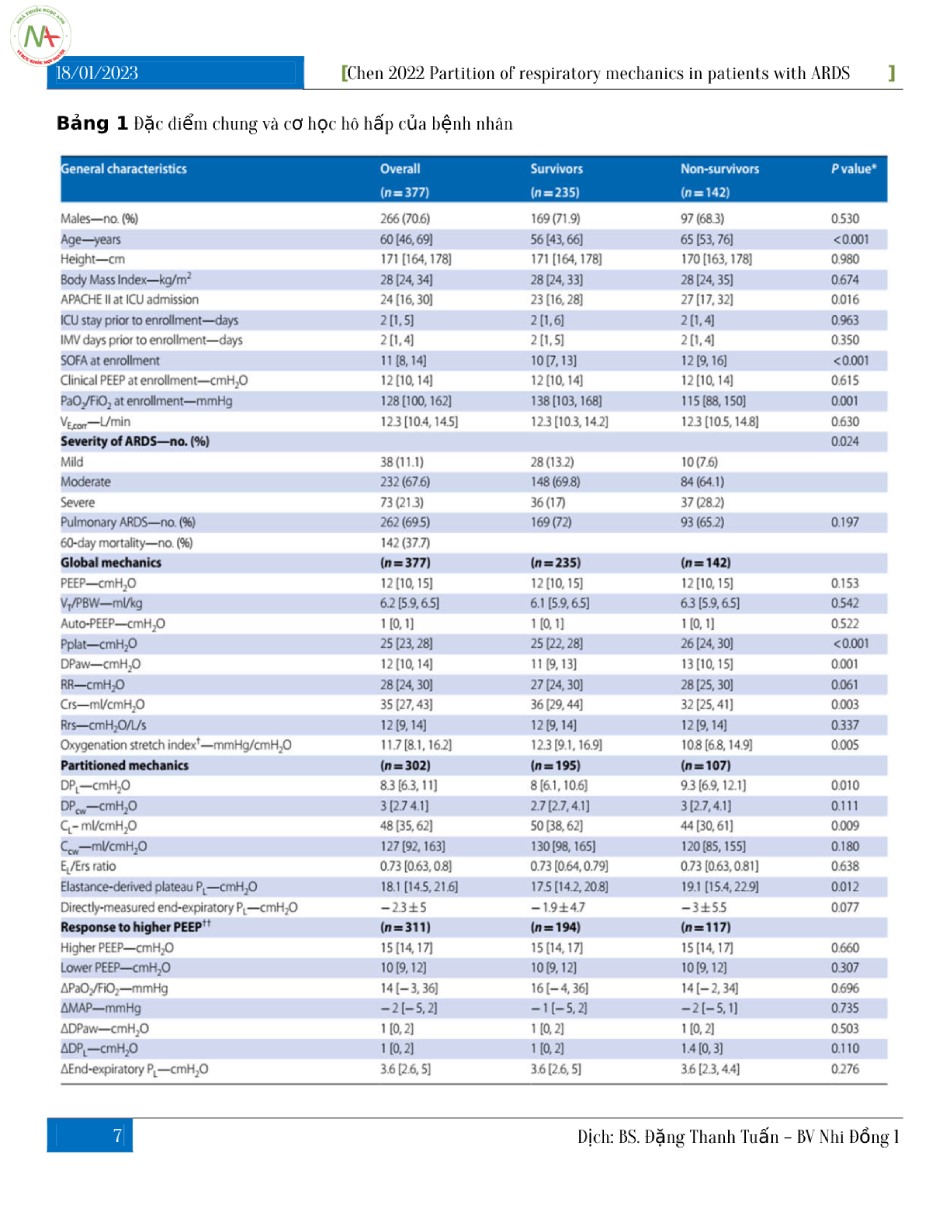
Các biến phân loại được mô tả bằng số (tỷ lệ phần trăm); các biến liên tục được mô tả là giá trị trung bình ± đạo hàm chuẩn hoặc trung vị [phạm vi liên vùng], nếu phù hợp
* So sánh những người sống sót với những người không sống sót bằng cách sử dụng t-test hoặc Mann– Whitney U-test hoặc chi-square, nếu phù hợp. Giá trị P không được sửa cho nhiều lần so sánh
+ Chỉ số kéo căng oxygen hóa được đo trên tổng số 318 bệnh nhân, trong đó 194 người sống sót và 124 người không sống sót
++ Các biến được đo ở PEEP cao hơn trừ đi các biến ở PEEP thấp hơn. Ví dụ: PaO2/FiO2 ở PEEP cao trừ PaO2 /FiO2 ở PEEP thấp hơn APACHE II: Điểm đánh giá sinh lý cấp tính và sức khỏe mãn tính II, IMV: thông khí cơ học xâm lấn, SOFA: điểm Đánh giá suy cơ quan tuần tự, PEEP: áp lực dương cuối kỳ thở ra, PaO2/FiO2: tỷ lệ giữa áp lực riêng phần của oxy động mạch và nồng độ oxy hít vào, VE: hiệu chỉnh thể tích thở ra mỗi phút được điều chỉnh bằng carbon dioxide động mạch, PEEP: áp lực dương cuối kỳ thở ra, VT/PBW: thể tích khí lưu thông trên mỗi trọng lượng cơ thể dự đoán, Pplat: áp lực cao nguyên đường thở, DPaw: áp lực đẩy đường thở là sự khác biệt giữa Pplat và PEEP tổng, RR: tần số hô hấp, Crs: độ giãn nở của hệ hô hấp, Rrs: sức cản của hệ hô hấp, chỉ số kéo căng-oxygen hóa PaO2/FiO2 chia cho DPaw, DPL: áp lực đẩy xuyên phổi là sự thay đổi áp lực xuyên phổi theo chu kỳ thở, DPcw: áp lực đẩy thành ngực là sự thay đổi của áp lực thực quản theo chu kỳ thở, CL: độ giãn nở phổi, Ccw: độ giãn nở thành ngực, tỷ lệ EL/Ers tỷ lệ độ đàn hồi của phổi so với độ đàn hồi của hệ hô hấp, PL: áp lực xuyên phổi, PaO2/FiO2 tỷ lệ áp lực riêng phần của oxy động mạch và nồng độ oxy hít vào, MAP: áp lực động mạch trung bình.
Hồi quy Cox chưa được điều chỉnh cho thấy DPaw cao hơn, DPL cao hơn và PL cao nguyên có nguồn gốc đàn hồi cao hơn có liên quan đến tỷ lệ tử vong cao hơn (Bảng 2). PL cuối thì thở ra được đo trực tiếp không liên quan về mặt thống kê với tỷ lệ tử vong trong 60 ngày trong tập hợp con này. DPaw và DPL vẫn liên quan đến tỷ lệ tử vong trong 60 ngày sau khi điều chỉnh theo tuổi và SOFA (Bảng 2), với sự suy giảm HR ở các giá trị thấp của DPaw và DPL (Hình S2 và S3).
So sánh các mô hình Cox đã điều chỉnh, DPaw có mức độ phù hợp tốt hơn một chút (AIC thấp hơn khi số lượng đồng biến giống nhau) so với DPL (Bảng 2). Chúng tôi đã thực hiện các phân tích giải thích hậu kỷ để hiểu kết quả này (Xem “Thảo luận”) và nhận thấy rằng áp lực đẩy thành ngực
có tương quan với SOFA không do phổi (hệ số tương quan Pearson = 0,150, P = 0,0090) và có liên quan đến tỷ lệ tử vong trong 60 ngày ở bệnh nhân hồi quy Cox chưa điều chỉnh (HR: 1,136, KTC 95% 1,018–1,268, P = 0,023).
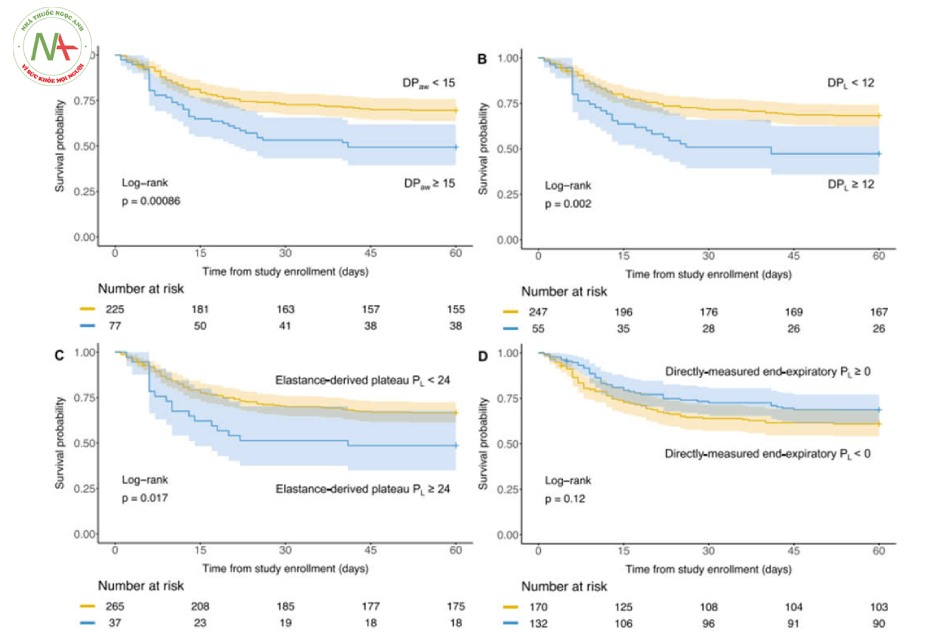
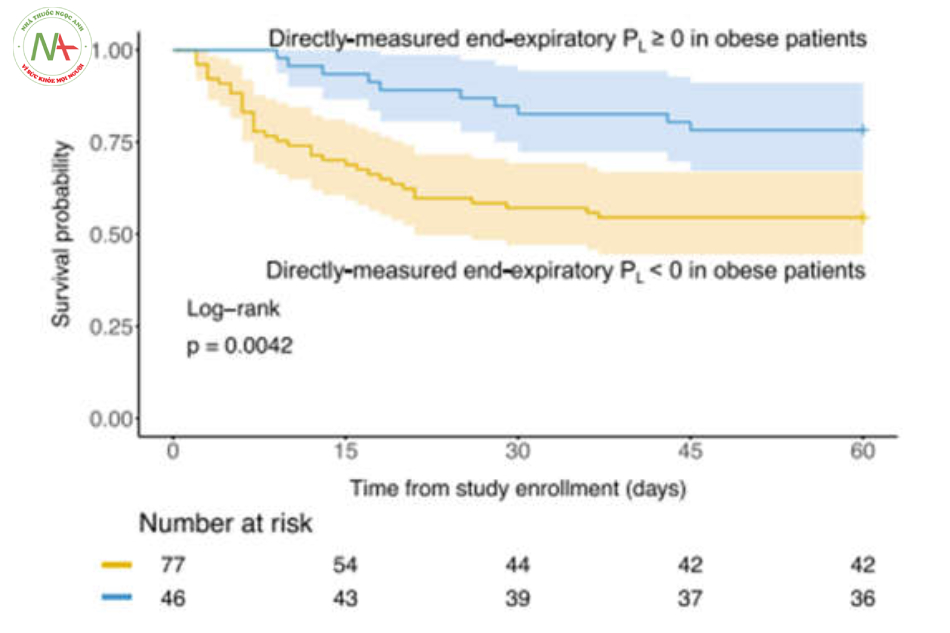
Bằng cách phân nhóm bệnh nhân sử dụng các ngưỡng được sử dụng trong các nghiên cứu trước đây, những bệnh nhân có DPaw cao (≥ 15 cmH2O), DPL cao (≥ 12 cmH2O) và PL cao nguyên có nguồn gốc từ đàn hồi (≥ 24 cmH2O) có kết quả thấp hơn. Xác suất sống sót sau 60 ngày (kiểm tra thứ hạng log, P <0,05) như được hiển thị với các đường cong sinh tồn của Kaplan–Meier (Hình 2). Không có sự khác biệt về xác suất sống sót khi so sánh PL cuối kỳ thở ra dương tính (≥ 0 cmH2O) với âm tính (Hình 2).
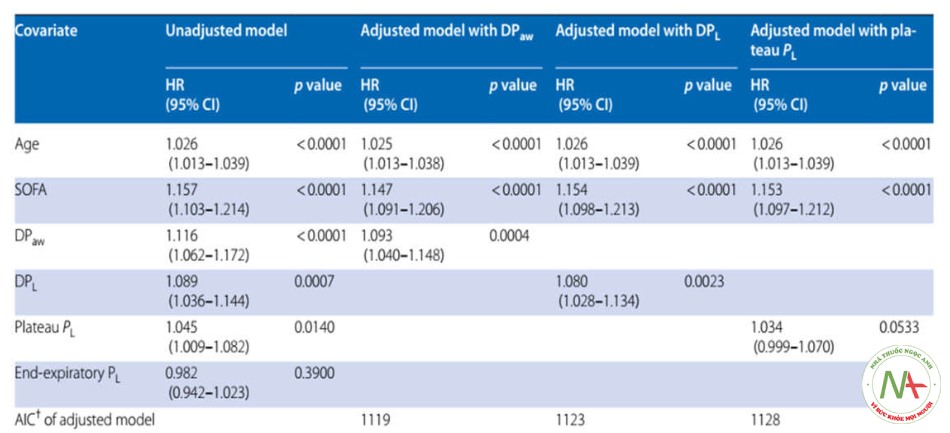
* Phân nhóm A bao gồm 302 bệnh nhân được đo áp lực thực quản. Số người chết là 107
+ Mô hình có AIC thấp nhất là mô hình giải thích lượng biến thiên lớn nhất bằng cách sử dụng ít biến độc lập nhất có thể. Nó đề cập đến sự phù hợp và đơn giản của mô hình. Do các mô hình trình bày trong Bảng có cùng số lượng biến độc lập và cùng một mẫu nên mô hình có AIC thấp nhất là mô hình phù hợp nhất
Tiêu chí thông tin AIC Akaike, điểm đánh giá suy cơ quan tuần tự SOFA, áp lực đẩy đường thở DPaw là sự khác biệt giữa Pplat và tổng PEEP, áp lực đẩy xuyên phổi DPL là thay đổi thủy triều trong áp lực xuyên phổi.
Phân tích hậu kỳ cho bệnh nhân béo phì
Nghiên cứu trước đây [23] cho thấy rằng chỉ số khối cơ thể cao hơn tương quan với PL cuối thì thở ra được đo trực tiếp cao hơn, ủng hộ giả thuyết rằng PEEP có thể đặc biệt hữu ích để duy trì dung tích cặn chức năng ở những bệnh nhân béo phì có nhiều tải (cân nặng) do chất béo. Một nghiên cứu gần đây [24] cũng chứng minh tính hữu ích của áp lực đường thở cao đối với nhóm bệnh nhân này. Do đó, chúng tôi tiến hành phân tích hậu kỳ ở những bệnh nhân đo Pes (n = 302) và tìm thấy sự tương tác giữa PL cuối thì thở ra được đo trực tiếp và bệnh béo phì (Chỉ số khối cơ thể ≥ 30 kg/m2) liên quan đến tỷ lệ tử vong trong 60 ngày trong mô hình hồi quy Cox đã điều chỉnh (HR cho thuật ngữ tương tác: 0,904, KTC 95%
0,832–0,982, P = 0,0175). Không tìm thấy tương tác đáng kể nào với bệnh béo phì đối với DPaw, DPL, PL cao nguyên có nguồn gốc từ đàn hồi. Có 123 bệnh nhân béo phì theo cách phân loại nêu trên. Trong số đó, những bệnh nhân béo phì có PL cuối kỳ thở ra dương tính có xác suất sống sót cao hơn so với những người có PL cuối kỳ thở ra âm tính (Hình 3, Kiểm tra thứ hạng log: 0,0042).
Chỉ số kéo căng oxygen hóa
Chúng tôi đã thu được khí máu động mạch ở 318 bệnh nhân (nhóm con B: 84% nhóm thuần tập). Chỉ số kéo căng oxygen hóa không thể hiện AUC cao hơn đáng kể để dự đoán tỷ lệ tử vong vào ngày 60 (kết quả nhị phân) so với DPaw (0,59 so với 0,58, P = 0,6483, xem Hình S4).
Hồi quy Cox chưa điều chỉnh (Bảng S1) cho thấy chỉ số kéo căng oxygen hóa cao hơn có liên quan đến tỷ lệ tử vong trong 60 ngày thấp hơn rõ rệt (HR: 0,959, KTC 95% 0,930–0,989, P = 0,0082).
Vì cả SOFA và chỉ số kéo căng oxygen hóa đều bao gồm PaO2/FiO2 như một thành phần, nên hiện tượng đa cộng tuyến sẽ tồn tại nếu chúng được cộng lại với nhau trong mô hình hồi quy Cox đa biến. Do đó, chúng tôi đã điều chỉnh mô hình Cox theo độ tuổi và SOFA không phổi thay vì SOFA. Sau khi điều chỉnh, chỉ số kéo căng oxygen hóa vẫn liên quan đến kết cục (HR: 0,969, KTC 95% 0,939–0,999, P = 0,0490).
Chúng tôi đã lặp lại mô hình cho DPaw trên cùng một nhóm bệnh nhân để so sánh AIC. Chỉ số kéo căng oxygen hóa không cải thiện AIC so với DPaw (Bảng S1). Để giải thích kết quả này, chúng tôi đã thực hiện một phân tích hậu kỳ để kiểm tra mối liên quan của oxygen hóa với kết cục. Oxygen hóa (PaO2/FiO2) không liên quan đáng kể đến kết cục trong mô hình hồi quy Cox sau khi điều chỉnh bằng DPaw (Bảng S2. HR: 0,998, KTC 95% 0,994– 1,001, P = 0,2161).
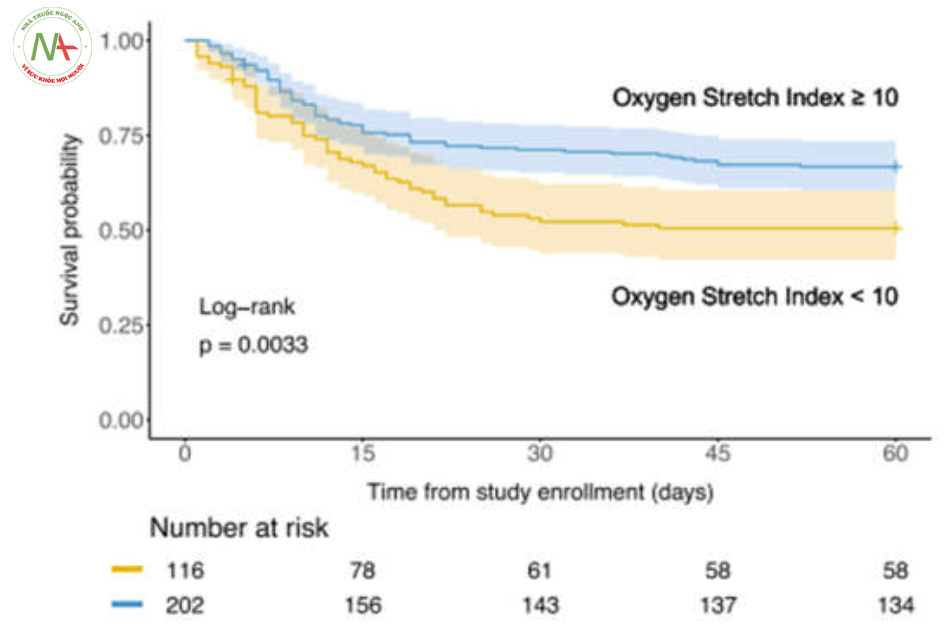
Bằng cách phân đôi chỉ số kéo căng oxygen hóa, những bệnh nhân có chỉ số kéo căng oxygen hóa cao (≥ 10 mmHg/cmH2O) có xác suất sống sót cao hơn những bệnh nhân có chỉ số kéo căng oxygen hóa thấp (< 10 mmHg/cmH2O) (Hình 4, kiểm tra thứ hạng log chưa điều chỉnh: P = 0,0033).
Các phân tích hậu kỳ về công suất cơ học và DPaw × 4 + RR
Mặc dù tần số hô hấp không đạt đến ý nghĩa thống kê khi so sánh đơn biến (P = 0,061) và hồi quy Cox chưa điều chỉnh (P = 0,084), các nghiên cứu gần đây đã chỉ ra tầm quan trọng của tần số hô hấp đối với VILI [25]. Do đó, chúng tôi đã thực hiện các phân tích hậu kỳ về công suất cơ học [20] và một chỉ số tổng hợp được đề xuất gần đây – DPaw × 4 + RR [26]. Các phân tích ROC cho thấy DPaw × 4 + RR và công suất cơ học không có AUC cao hơn đáng kể so với DPaw một mình để dự đoán kết quả nhị phân – tỷ lệ tử vong ở ngày thứ 60 (Hình S5). Sau khi điều chỉnh độ tuổi và SOFA, các mô hình hồi quy Cox cho thấy DPaw × 4 + RR có AIC thấp nhất (xem Bảng S3). Công suất cơ học chỉ liên quan đến tỷ lệ tử vong trong 60 ngày (kết quả phụ thuộc vào thời gian) khi nó được bình thường hóa bằng độ giãn nở của hệ hô hấp (Bảng S3).
Phân tích độ nhạy hậu kỳ cho thời gian đo
Để đánh giá tác động có thể có của thời gian đo đối với kết quả, chúng tôi đã thử nghiệm trong các mô hình hồi quy Cox đa biến, thuật ngữ tương tác giữa biến cơ học quan tâm và hiệp phương sai nhị phân biểu thị thời điểm đo [sớm (≤ 2 ngày); muộn (> 2 ngày)]. Chúng tôi chọn 2 ngày làm ngưỡng để xác định phép đo sớm và muộn vì nó đại diện cho giá trị trung bình của thời gian đo. Không có tương tác đáng kể giữa phép đo ban đầu và cơ học đối với tỷ lệ tử vong trong 60 ngày (Bảng S5).
Phân tích độ nhạy hậu kỳ để loại trừ những bệnh nhân vẫn được thở máy vào ngày thứ 60
Chúng tôi đã loại trừ 37 bệnh nhân có thể vẫn thở máy sau 60 ngày (trong đó 17 bệnh nhân thiếu dữ liệu về ngày ngừng thở máy) khỏi 302 bệnh nhân được đo Pes. Cuối cùng, 265 bệnh nhân đã tham gia vào phân tích độ nhạy này. DPaw, DPL, PL cao nguyên có nguồn gốc đàn hồi, vẫn liên quan đến tỷ lệ tử vong trong 60 ngày sau khi được điều chỉnh theo độ tuổi và SOFA. Và một lần nữa, mô hình hồi quy Cox DPaw cho thấy AIC thấp nhất (Bảng S6).
Thảo luận
Theo hiểu biết của chúng tôi, đây là nghiên cứu lâm sàng lớn nhất liên kết dữ liệu về cơ học hô hấp phân vùng với kết quả ở những bệnh nhân mắc ARDS đã nhận được 6 ml/kg PBW của VT. Dữ liệu của chúng tôi cho thấy DPaw và DPL có khả năng dự đoán tương tự về tỷ lệ tử vong vào ngày thứ 60 (kết quả nhị phân) trong phân tích ROC. Hồi quy Cox đã xác nhận rằng DPaw có mối liên hệ được xếp hạng cao nhất với tỷ lệ tử vong trong 60 ngày (kết quả phụ thuộc vào thời gian) sau khi điều chỉnh theo tuổi và SOFA (hoặc SOFA không do phổi), trong số DPL, PL cao nguyên có nguồn gốc từ đàn hồi, được đo trực tiếp PL cuối kỳ thở ra, và chỉ số kéo căng oxygen hóa. Các phân tích giải thích hậu kỳ của chúng tôi cho thấy những điều sau: (1) áp lực đẩy thành ngực (một thành phần của DPaw) cũng liên quan đến mức độ nghiêm trọng của bệnh và tỷ lệ sống sót; (2) PL dương tính cuối thì thở ra chỉ liên quan đến kết quả tốt hơn ở những bệnh nhân béo phì; (3) oxygen hóa không liên quan đáng kể đến kết quả sau khi điều chỉnh DPaw.
Dự đoán so với kết hợp
Cần nhấn mạnh rằng mục tiêu cuối cùng của chúng tôi không phải là dự đoán tỷ lệ tử vong mà là tìm kiếm biến số quan trọng nhất có thể được nhắm mục tiêu để hạn chế nguy cơ VILI. Do đó, chúng tôi đã thử nghiệm mối liên hệ giữa cơ học và kết cục như một cách tiếp cận gián tiếp.
Phương pháp chính của chúng tôi để kiểm tra mối liên hệ giữa kết cục và cơ học là hồi quy Cox bằng cách coi các biến sinh lý là biến liên tục. Sau đó, chúng tôi đã phân đôi các biến này trong phân tích tỷ lệ sống còn của Kaplan–Meier như một phương pháp thứ cấp để kiểm tra mối liên hệ. Bất kỳ loại phân đôi nào cũng có giới hạn, nhưng chúng tôi muốn xem liệu các ngưỡng được đề xuất trước đây có thể phân biệt tốt các kết quả hay không và liệu chúng có khả năng được sử dụng trong thực hành lâm sàng hay không. Về khả năng dự đoán thấp trong các phân tích ROC (xem phần bổ sung), chúng tôi muốn nhấn mạnh rằng giá trị tiên đoán về tỷ lệ tử vong của định nghĩa ARDS cũ của Hội nghị đồng thuận Mỹ- u (AECC) là 0,536, trong khi định nghĩa của Berlin được cải thiện một chút nhưng chỉ ở mức 0,577, về AUC [16]. Các định nghĩa này có một số tiêu chí, có thể được coi là các biến tổng hợp. Do đó, AUC là 0,62 đối với DPaw, với tư cách là một biến duy nhất, có thể là một tín hiệu chắc chắn.
Phổi so với hệ hô hấp
Quan sát rằng DPL không liên quan đến kết quả tốt hơn so với DPaw là điều bất ngờ [7]. Chúng tôi nghĩ rằng một lời giải thích là mối liên quan giữa áp lực đẩy thành ngực, mức độ nghiêm trọng của bệnh [27] và kết cục. Nó chỉ ra rằng DPaw có thể chứa thông tin về cả nguy cơ VILI thông qua chỉ số tốt nhất về độ căng của phổi, tức là DPL, và cả về mức độ nghiêm trọng chung của bệnh nhân dẫn đến thành ngực cứng hơn. Như vậy, có thể DPaw về cơ bản là một chỉ số tổng hợp và DPL có thể vẫn cụ thể hơn đối với VILI. Ngoài ra, phép đo Pes thay đổi theo VT thấp được sử dụng để đánh giá độ đàn hồi của thành ngực có thể không chính xác do độ lớn của nhiễu động tim. Chúng tôi đã triển khai đào tạo tiêu chuẩn hóa và một giao thức cụ thể để hỗ trợ đo lường Pes [15]. Tỷ lệ thử nghiệm tắc nghẽn, một chỉ số giải quyết tính hợp lệ của Pes, nằm trong phạm vi hợp lệ (0,8 đến 1,2) [14, 18, 28]. Ngoài ra, chúng tôi đã thực hiện phân tích tương tự bằng cách sử dụng Pes được điều chỉnh theo tỷ lệ thử nghiệm tắc nghẽn, giả sử mối quan hệ tuyến tính giữa ∆Paw và ∆Pes. Nó củng cố một chút mô hình hồi quy Cox đã điều chỉnh (AIC = 1122) nhưng không làm thay đổi kết luận.
Đặt PEEP để đảo ngược PL âm cuối thì thở ra, một chỉ số cho thấy xẹp phổi lưng, có ý nghĩa sinh lý [29] và đã được sử dụng trong các thử nghiệm lâm sàng ngẫu nhiên nhưng không ảnh hưởng đến kết quả [30]. Điều này phù hợp với dữ liệu của chúng tôi đã chứng minh rằng PL cuối kỳ thở ra không liên quan đến kết quả. Tuy nhiên, chúng ta cũng nên nhớ rằng mức PEEP lâm sàng trung bình là 12 [IQR 10–14] cmH2O. Nguy cơ “chấn thương do xẹp phổi” [31] ở phổi lưng có thể đã giảm nhờ PEEP lâm sàng. Nói cách khác, phương sai tương đối hẹp của mức PEEP có thể không đủ để phát hiện bất kỳ ý nghĩa nào của PL cuối thì thở ra.
Thật thú vị, PL cuối kỳ thở ra dường như có liên quan cao ở những bệnh nhân béo phì, những người có “tải” chất béo cao hơn những bệnh nhân không béo phì. Tải trọng này được đối trọng bởi lực co giãn ra ngoài của thành ngực. Nhưng khi các cơ hô hấp được thư giãn do thuốc an thần hoặc tê liệt, PEEP bên ngoài cao có thể cần thiết để đối trọng với tải trọng này và duy trì thể tích phổi cuối thì thở ra. Do đó, việc duy trì PL dương tính ở cuối thì thở ra ở người béo phì có liên quan đến kết quả thuận lợi hơn, như được đề xuất bởi dữ liệu của chúng tôi.
Chỉ số kéo căng oxygen hóa so với DPaw
Phát hiện của chúng tôi rằng chỉ số kéo căng oxygen hóa, chỉ số tổng hợp của oxygen hóa và DPaw, không thể tăng cường sức mạnh dự đoán là điều bất ngờ. Thật thú vị, mối liên hệ giữa oxygen hóa và kết quả “biến mất” sau khi nó được điều chỉnh bởi DPaw. Điều này thậm chí còn rõ ràng hơn khi được điều chỉnh theo độ tuổi, SOFA không do phổi và DPaw (Bảng S2. HR đối với oxygen hóa: 0,998, KTC 95% 0,994–1,001, P = 0,2161). Những kết quả này làm nổi bật ưu thế của DPaw so với oxygen hóa, hiện đang được sử dụng để phân loại mức độ nghiêm trọng của ARDS [16].
Hạn chế
Nghiên cứu của chúng tôi có một vài hạn chế. Một hạn chế là phép đo được thực hiện tại một thời điểm duy nhất khi bắt đầu thở máy sớm như các nghiên cứu trước đây nhằm liên kết cơ học phổi với kết cục [3]. Vì cơ học có thể thay đổi trong quá trình ARDS, lý tưởng nhất là các phép đo nên được lặp lại hàng ngày. Tuy nhiên, các phép đo lặp lại có thể là một thách thức thực tế vì bệnh nhân thường cố gắng tự thở sau một vài ngày đặt nội khí quản, điều này sẽ làm phức tạp rất nhiều việc diễn giải các phép đo. Thứ hai, chúng tôi sử dụng một thể tích bóng cố định (ví dụ: 1 ml cho ống thông Cooper), tương tự như các thử nghiệm khác vì đơn giản [9, 30]. Kết luận của chúng tôi không thay đổi sau khi điều chỉnh Pes theo tỷ lệ thử nghiệm tắc nghẽn. Thứ ba, việc đóng hoàn toàn đường thở xảy ra ở gần một phần ba số bệnh nhân ARDS, điều này có thể ảnh hưởng đến độ chính xác của phép đo độ đàn hồi, và do đó ảnh hưởng đến PL cao nguyên có nguồn gốc từ độ đàn hồi. Đăng ký hiện tại được thực hiện bằng cách đo cơ học ở mức PEEP lâm sàng. Trong nghiên cứu trước đây của chúng tôi [32], 15 trong số 45 (33,3%) bệnh nhân có biểu hiện đóng đường thở hoàn toàn, có nghĩa là chỉ 4 (8,8%) bệnh nhân nhận được PEEP lâm sàng dưới AOP. Chúng tôi lập luận rằng hầu hết bệnh nhân bị đóng đường thở nên nhận được PEEP lâm sàng cao hơn áp lực mở đường thở (AOP) của họ trong nghiên cứu hiện tại, và do đó, điều này sẽ không làm thay đổi đáng kể việc giải thích kết quả của chúng tôi. Hơn nữa, chúng tôi cũng lặp lại phân tích tỷ lệ sống bằng cách sử dụng cơ học được đo ở mức PEEP cao hơn (với khả năng PEEP lâm sàng thấp hơn AOP là thấp nhất) và các kết luận vẫn không thay đổi ngoại trừ PL cao nguyên có nguồn gốc từ đàn hồi trở nên không đáng kể (xem Hình S6 trong Phần bổ sung). Thứ tư, thời điểm đo không đồng nhất giữa các bệnh nhân. Tuy nhiên, phân tích độ nhạy của chúng tôi cho thấy thời gian đo không làm thay đổi tác động của các biến cơ học đối với kết cục. Thứ năm, chúng tôi thiếu dữ liệu như được chỉ ra trong Hình 1. Việc xử lý những dữ liệu bị thiếu này có thể khó khăn và cách tiếp cận tốt nhất vẫn còn gây tranh cãi. Mặc dù quy nạp đa biến là một lựa chọn thay thế có điểm mạnh và điểm yếu [33], chúng tôi quyết định sử dụng phương pháp thông thường—phân tích trường hợp hoàn chỉnh. Thứ sáu, có 54 bệnh nhân bị ảnh hưởng bởi bệnh vi-rút corona 2019 (COVID-19) đã đăng ký vào sổ đăng ký nhưng không có bệnh nhân COVID-19 nào trong số này được đo áp lực thực quản do các biện pháp phòng ngừa kiểm soát lây nhiễm. Nói cách khác, kết quả của chúng tôi cho thấy áp lực xuyên phổi không có mối liên hệ chặt chẽ hơn với kết quả so với DPaw, đã được tìm thấy ở những bệnh nhân không mắc COVID-19. Cuối cùng nhưng không kém phần quan trọng, chúng tôi đã không thu thập dữ liệu về các biện pháp can thiệp đồng thời chính đối với ARDS trong toàn bộ thời gian nằm viện, chẳng hạn như tư thế nằm sấp, liều lượng và thời gian phong bế thần kinh cơ, steroid và ECMO. Đặc biệt, tư thế nằm sấp trước khi đo có thể đã ảnh hưởng đến cơ học hô hấp.
Kết luận
Đáng ngạc nhiên là áp lực đẩy xuyên phổi không thể hiện mối liên hệ mạnh mẽ hơn với kết quả so với áp lực đẩy đường thở, điều này có thể được giải thích một phần bởi thực tế là áp lực đẩy thành ngực có liên quan đến mức độ nghiêm trọng và kết cục của bệnh. Chỉ số kéo căng oxygen hóa, một chỉ số tổng hợp của oxygen hóa và áp lực đẩy đường thở, không vượt trội so với áp lực đẩy đường thở đơn thuần. Thật vậy, oxygen hóa không còn liên quan đến kết quả sau khi điều chỉnh áp lực đẩy đường thở. Nghiên cứu của chúng tôi tăng cường cơ sở lý luận của việc hạn chế áp lực đẩy đường thở cũng như áp lực đẩy phổi trong quá trình thở máy. Ngoài ra, nhắm mục tiêu áp lực xuyên phổi cuối thì thở ra dương dường như có liên quan ở những bệnh nhân béo phì. Những dữ liệu này có thể giúp thiết kế các chiến lược thông khí mới dựa trên cơ học hô hấp.
Tài liệu tham khảo
- Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med. 2013;369:2126–2136. doi: 10.1056/NEJMra1208707. [PubMed] [CrossRef] [Google Scholar]
- Acute Respiratory Distress Syndrome N. Brower RG, Matthay MA, Morris A, Schoenfeld D, Thompson BT, Wheeler A. Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. N Engl J Med. 2000;342:1301–1308. doi: 10.1056/NEJM200005043421801. [PubMed] [CrossRef] [Google Scholar]
- Amato MB, Meade MO, Slutsky AS, Brochard L, Costa EL, Schoenfeld DA, Stewart TE, Briel M, Talmor D, Mercat A, Richard JC, Carvalho CR, Brower RG. Driving pressure and survival in the acute respiratory distress N Engl J Med. 2015;372:747–755. doi: 10.1056/NEJMsa1410639. [PubMed] [CrossRef] [Google Scholar]
- Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A, Investigators LS, Group Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. doi: 10.1001/jama.2016.0291. [PubMed] [CrossRef] [Google Scholar]
- Urner M, Juni P, Hansen B, Wettstein MS, Ferguson ND, Fan E. Time-varying intensity of mechanical ventilation and mortality in patients with acute respiratory failure: a registry-based, prospective cohort study. Lancet Respir Med. 2020;8:905–913. doi: 10.1016/S2213-2600(20)30325-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira Romano ML, Maia IS, Laranjeira LN, Damiani LP, Paisani DM, Borges MC, Dantas BG, Caser EB, Victorino JA, Filho WO, Amato MBP, Cavalcanti AB. Driving pressure-limited strategy for patients with acute respiratory distress syndrome. a pilot randomized clinical trial. Ann Am Thorac Soc. 2020;17:596–604. doi: 10.1513/AnnalsATS.201907-506OC. [PubMed] [CrossRef] [Google Scholar]
- Baedorf Kassis E, Loring SH, Talmor Mortality and pulmonary mechanics in relation to respiratory system and transpulmonary driving pressures in ARDS. Intensive Care Med. 2016;42:1206–1213. doi: 10.1007/s00134-016- 4403-7. [PubMed] [CrossRef] [Google Scholar]
- Loring SH, O’Donnell CR, Behazin N, Malhotra A, Sarge T, Ritz R, Novack V, Talmor D. (2010) Esophageal pressures in acute lung injury: do they represent artifact or useful information about transpulmonary pressure, chest wall mechanics, and lung stress? J Appl Physiol. 1985;108:515–522. doi: 10.1152/japplphysiol.00835.2009. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Talmor D, Sarge T, Malhotra A, O’Donnell CR, Ritz R, Lisbon A, Novack V, Loring SH. Mechanical ventilation guided by esophageal pressure in acute lung injury. N Engl J Med. 2008;359:2095–2104. doi: 1056/NEJMoa0708638. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Yoshida T, Amato MBP, Grieco DL, Chen L, Lima CAS, Roldan R, Morais CCA, Gomes S, Costa ELV, Cardoso PFG, Charbonney E, Richard JM, Brochard L, Kavanagh Esophageal manometry and regional transpulmonary pressure in lung injury. Am J Respir Crit Care Med. 2018;197:1018–1026. doi: 10.1164/rccm.201709-1806OC. [PubMed] [CrossRef] [Google Scholar]
- Tilmont A, Coiffard B, Yoshida T, Daviet F, Baumstarck K, Brioude G, Hraiech S, Forel JM, Roch A, Brochard L, Papazian L, Guervilly C. Oesophageal pressure as a surrogate of pleural pressure in mechanically ventilated patients. ERJ Open Res. 2021;7:2. doi: 10.1183/23120541.00646-2020. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gattinoni L, Carlesso E, Cadringher P, Valenza F, Vagginelli F, Chiumello Physical and biological triggers of ventilator-induced lung injury and its prevention. Eur Respir J Suppl. 2003;47:15s–25s. doi: 10.1183/09031936.03.00021303. [PubMed] [CrossRef] [Google Scholar]
- Grasso S, Terragni P, Birocco A, Urbino R, Del Sorbo L, Filippini C, Mascia L, Pesenti A, Zangrillo A, Gattinoni L, Ranieri VM. ECMO criteria for influenza A (H1N1)-associated ARDS: role of transpulmonary pressure. Intensive Care 2012;38:395–403. doi: 10.1007/s00134-012-2490-7. [PubMed] [CrossRef] [Google Scholar]
- Mauri T, Yoshida T, Bellani G, Goligher EC, Carteaux G, Rittayamai N, Mojoli F, Chiumello D, Piquilloud L, Grasso S, Jubran A, Laghi F, Magder S, Pesenti A, Loring S, Gattinoni L, Talmor D, Blanch L, Amato M, Chen L, Brochard L, Mancebo J, Group PL. Esophageal and transpulmonary pressure in the clinical setting: meaning, usefulness and perspectives. Intensive Care Med. 2016;42:1360–1373. doi: 10.1007/s00134-016-4400-x. [PubMed] [CrossRef] [Google Scholar]
- Chen L, Chen GQ, Shore K, Shklar O, Martins C, Devenyi B, Lindsay P, McPhail H, Lanys A, Soliman I, Tuma M, Kim M, Porretta K, Greco P, Every H, Hayes C, Baker A, Friedrich JO, Brochard L. Implementing a bedside assessment of respiratory mechanics in patients with acute respiratory distress syndrome. Crit Care. 2017;21:84. doi: 1186/s13054-017-1671-8. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. Acute respiratory distress syndrome: the berlin JAMA. 2012;307:2526–2533. [PubMed] [Google Scholar]
- Washko GR, O’Donnell CR, Loring SH. (2006) Volume-related and volume-independent effects of posture on esophageal and transpulmonary pressures in healthy subjects. J Appl Physiol. 1985;100:753–758. doi: 10.1152/japplphysiol.00697.2005. [PubMed] [CrossRef] [Google Scholar]
- Lanteri CJ, Kano S, Sly PD. Validation of esophageal pressure occlusion test after paralysis. Pediatr Pulmonol. 1994;17:56–62. doi: 1002/ppul.1950170110. [PubMed] [CrossRef] [Google Scholar]
- Baydur A, Behrakis PK, Zin WA, Jaeger M, Milic-Emili J. A simple method for assessing the validity of the esophageal balloon Am Rev Respir Dis. 1982;126:788–791. [PubMed] [Google Scholar]
- Gattinoni L, Tonetti T, Cressoni M, Cadringher P, Herrmann P, Moerer O, Protti A, Gotti M, Chiurazzi C, Carlesso E, Chiumello D, Quintel M. Ventilator-related causes of lung injury: the mechanical power. Intensive Care Med. 2016;42:1567–1575. doi: 1007/s00134-016-4505-2. [PubMed] [CrossRef] [Google Scholar]
- Hanley JA, McNeil A method of comparing the areas under receiver operating characteristic curves derived from the same cases. Radiology. 1983;148:839–843. doi: 10.1148/radiology.148.3.6878708. [PubMed] [CrossRef] [Google Scholar]
- R Core Team (2018) R: A Language and Environment for Statistical Computing. In: Book R: A Language and Environment for Statistical R Foundation for Statistical Computing, City
- Coudroy R, Vimpere D, Aissaoui N, Younan R, Bailleul C, Couteau-Chardon A, Lancelot A, Guerot E, Chen L, Brochard L, Diehl JL. Prevalence of complete airway closure according to body mass index in acute respiratory distress syndrome: pooled cohort Anesthesiology. 2020;2:2. [PubMed] [Google Scholar]
- De Santis SR, TeggiaDroghi M, Fumagalli J, Marrazzo F, Florio G, Grassi LG, Gomes S, Morais CCA, Ramos OPS, Bottiroli M, Pinciroli R, Imber DA, Bagchi A, Shelton K, Sonny A, Bittner EA, Amato MBP, Kacmarek RM, Berra L, Lung Rescue I. High pleural pressure prevents alveolar overdistension and hemodynamic collapse in ARDS with class III obesity. Am J Respir Crit Care Med. 2020;2:2. [PMC free article] [PubMed] [Google Scholar]
- Marini JJ, Rocco PRM, Gattinoni L. Static and dynamic contributors to ventilator-induced lung injury in clinical practice. pressure, energy, and power. Am J Respir Crit Care Med. 2020;201:767–774. doi: 10.1164/rccm.201908- 1545CI. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Costa ELV, Slutsky AS, Brochard LJ, Brower R, Serpa-Neto A, Cavalcanti AB, Mercat A, Meade M, Morais CCA, Goligher E, Carvalho CRR, Amato MBP. Ventilatory variables and mechanical power in patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2021;204:303–311. doi: 10.1164/rccm.202009-3467OC. [PubMed] [CrossRef] [Google Scholar]
- Jardin F, Genevray B, Brun-Ney D, Bourdarias Influence of lung and chest wall compliances on transmission of airway pressure to the pleural space in critically ill patients. Chest. 1985;88:653–658. doi: 10.1378/chest.88.5.653. [PubMed] [CrossRef] [Google Scholar]
- Akoumianaki E, Maggiore SM, Valenza F, Bellani G, Jubran A, Loring SH, Pelosi P, Talmor D, Grasso S, Chiumello D, Guerin C, Patroniti N, Ranieri VM, Gattinoni L, Nava S, Terragni PP, Pesenti A, Tobin M, Mancebo J, Brochard L, Group PW. The application of esophageal pressure measurement in patients with respiratory Am J Respir Crit Care Med. 2014;189:520–531. doi: 10.1164/rccm.201312-2193CI. [PubMed] [CrossRef] [Google Scholar]
- Cavalcanti AB, Amato MBP, Serpa-Neto The elusive search for “Best PEEP” and whether esophageal pressure monitoring helps. JAMA. 2019;321:839–841. doi: 10.1001/jama.2019.0267. [PubMed] [CrossRef] [Google Scholar]
- Beitler JR, Sarge T, Banner-Goodspeed VM, Gong MN, Cook D, Novack V, Loring SH, Talmor D, Group Effect of titrating positive end-expiratory pressure (PEEP) with an esophageal pressure-guided strategy vs an empirical high PEEP-Fio2 strategy on death and days free from mechanical ventilation among patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. 2019;321:846–857. doi: 10.1001/jama.2019.0555. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Muscedere JG, Mullen JB, Gan K, Slutsky Tidal ventilation at low airway pressures can augment lung injury. Am J Respir Crit Care Med. 1994;149:1327–1334. doi: 10.1164/ajrccm.149.5.8173774. [PubMed] [CrossRef] [Google Scholar]
- Chen L, Del Sorbo L, Grieco DL, Junhasavasdikul D, Rittayamai N, Soliman I, Sklar MC, Rauseo M, Ferguson ND, Fan E, Richard JM, Brochard L. Potential for lung recruitment estimated by the recruitment-to-inflation ratio in acute respiratory distress syndrome. a clinical trial. Am J Respir Crit Care Med. 2020;201:178–187. doi: 10.1164/rccm.201902-0334OC. [PubMed] [CrossRef] [Google Scholar]
- Sterne JA, White IR, Carlin JB, Spratt M, Royston P, Kenward MG, Wood AM, Carpenter Multiple imputation for missing data in epidemiological and clinical research: potential and pitfalls. BMJ. 2009;338:b2393. doi: 10.1136/bmj.b2393. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
