Bệnh hô hấp
Sử dụng ‘thử thách thể tích khí lưu thông’ để cải thiện độ tin cậy của sự thay đổi áp lực mạch
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
nhathuocngocanh.com – Để tải file PDF của bài viết Sử dụng ‘thử thách thể tích khí lưu thông’ để cải thiện độ tin cậy của sự thay đổi áp lực mạch, xin vui lòng click vào link ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Bối cảnh
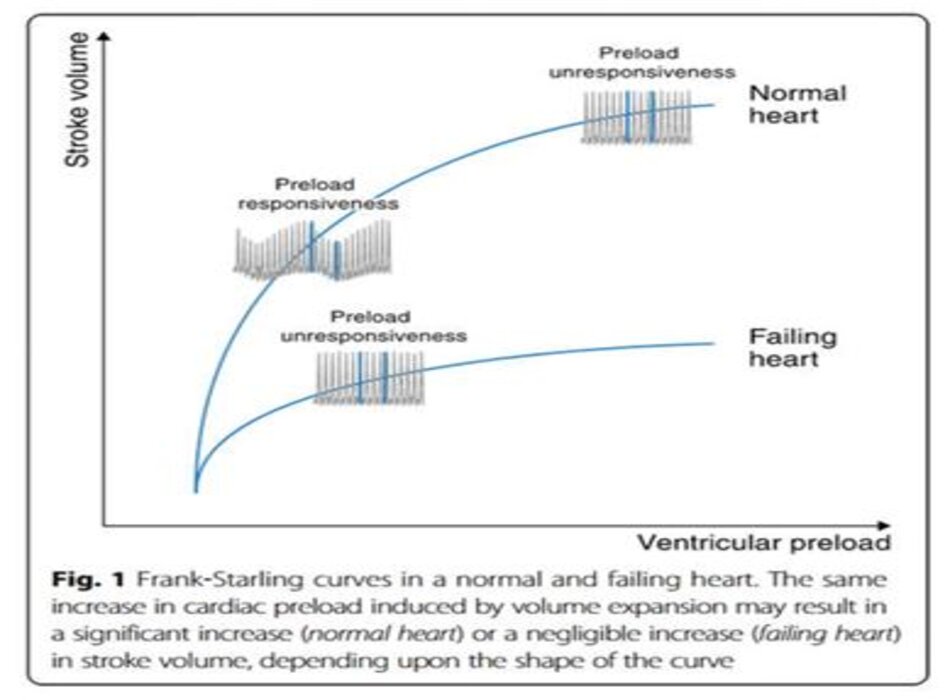
Truyền dịch thường là bước đầu tiên trong quá trình hồi sức của bệnh nhân suy tuần hoàn cấp. Khả năng đáp ứng với dịch truyền được định nghĩa là khả năng tâm thất trái tăng thể tích nhát bóp để đáp ứng với việc cung cấp dịch truyền [1]. Dịch truyền được truyền với mục đích tăng cung lượng tim và cung cấp oxy. Do đó, truyền dịch sẽ không có lợi nếu cung lượng tim không tăng. Theo nguyên lý Frank ‐ Starling, tăng tiền tải sẽ làm tăng thể tích nhát bóp thất trái (left ventricular − LV) nếu tâm thất hoạt động trên phần dốc của đường Frank ‐ Starling. Một khi tâm thất trái hoạt động trên phần phẳng của đường cong, việc truyền thêm dịch truyền sẽ ít ảnh hưởng đến thể tích nhát bóp. Trong một trái tim bình thường, cả hai tâm thất thường hoạt động trên phần dốc của đường cong Frank ‐ Starling và bệnh nhân đáp ứng với dịch truyền, trừ khi đã được truyền một lượng dịch truyền lớn (Hình 1). Trong trường hợp này, tâm thất có thể hoạt động trên phần phẳng của đường cong (Hình 1). Suy tim hoạt động trên phần phẳng của đường cong, ngoại trừ giá trị tiền tải rất thấp và do đó cùng một mức tăng tiền tải tim do giãn nở thể tích có thể dẫn đến tăng thể tích nhát bóp không đáng kể (Hình 1).
Các nghiên cứu đã chỉ ra rằng chỉ có khoảng 50% bệnh nhân bị bệnh nặng không ổn định sẽ thực sự đáp ứng dương tính với thử thách dịch truyền [1]. Tình trạng giảm thể tích tuần hoàn không được điều chỉnh có thể dẫn đến việc truyền thuốc vận mạch không thích hợp, do đó có thể ảnh hưởng đến quá trình oxy hóa mô, dẫn đến rối loạn chức năng cơ quan và tử vong [2, 3]. Mặt khác, việc truyền quá nhiều dịch truyền có liên quan đến việc gia tăng các biến chứng, tỷ lệ tử vong và thời gian nằm tại đơn vị chăm sóc đặc biệt (intensive care unit − ICU) [4, 5]. Vì vậy, điều quan trọng là phải xác định những người đáp ứng với dịch truyền để biết ai có thể được lợi từ việc truyền dịch truyền và tránh tình trạng quá tải dịch truyền ở những người không đáp ứng với dịch truyền. Tuy nhiên, việc xác định bệnh nhân nào sẽ đáp ứng với việc mở rộng thể tích là một thử thách hàng ngày trong các ICU ngày nay.
Những thay đổi động trong dạng sóng động mạch ‐ các biến có nguồn gốc trong quá trình thở máy, chẳng hạn như biến thiên huyết áp tâm thu (systolic pressure variation − SPV), biến thiên áp lực mạch (pulse pressure variation – PPV) và biến thiên thể tích nhát bóp (stroke volume variation − SVV), đã được chứng minh là vượt trội hơn so với các chỉ số tĩnh được sử dụng truyền thống, chẳng hạn như tĩnh mạch trung tâm áp lực (central venous pressure − CVP) và áp lực tắc động mạch phổi (pulmonary artery occlusion pressure − PAOP), để dự đoán khả năng đáp ứng dịch [1, 6‐8]. Trong số các chỉ số này, PPV và SVV thường được sử dụng trong thực hành lâm sàng, trong đó PPV đáng tin cậy hơn và có mức độ bằng chứng cao hơn [7, 9, 10].
Tương tác tim – phổi khi thở máy: các nguyên tắc sinh lý cơ bản của PPV và SVV
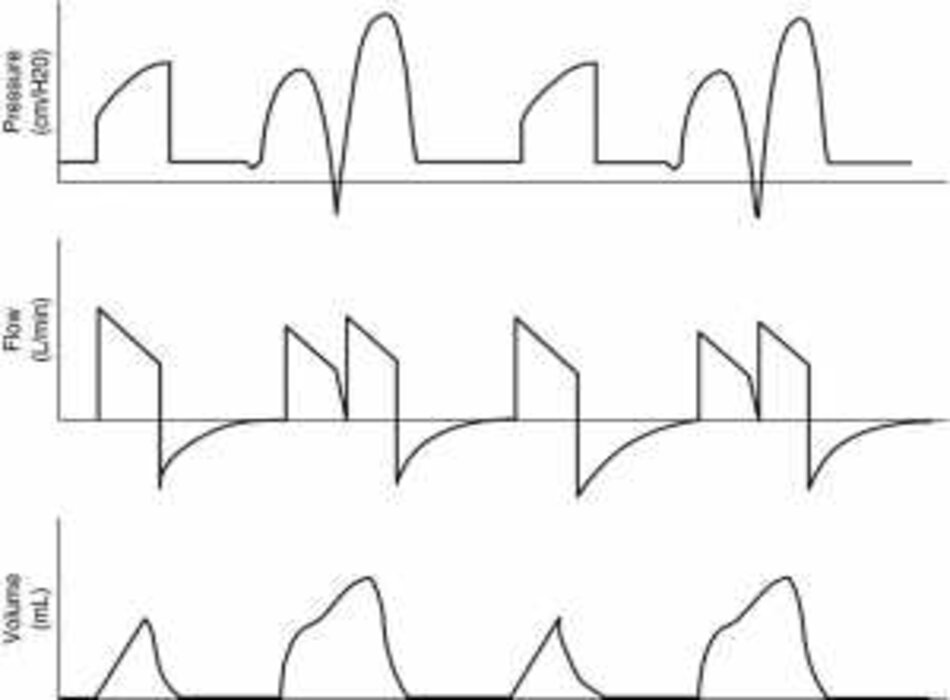
PPV được tính bằng hiệu số giữa giá trị áp lực mạch cực đại và cực tiểu trong một chu kỳ thở máy chia cho giá trị trung bình của chúng [6]. Nó có thể được tính toán tự động bằng các máy theo dõi huyết động mới hơn. SVV có nguồn gốc từ phân tích dạng sóng áp lực động mạch và được tính toán tự động bằng máy theo dõi cung lượng tim phân tích đường viền xung (pulse contour analysis) đã hiệu chỉnh và chưa hiệu chỉnh. Cơ chế nguyên tắc cơ bản cách thức hoạt động của các thông số này dựa trên tương tác giữa tim và phổi trong quá trình thở máy [11].
Thông khí áp lực dương ngắt quãng tạo ra những thay đổi theo chu kỳ trong điều kiện tải của cả hai tâm thất. Áp lực trong lồng ngực và trong phổi tăng lên trong quá trình hít vào dẫn đến những thay đổi khác nhau trong điều kiện tải của cả hai tâm thất. Tăng áp lực trong lồng ngực khi bơm phồng cơ học làm giảm hồi lưu tĩnh mạch và đến lượt nó làm giảm tiền tải thất phải (right ventricular − RV), trong khi tăng áp lực xuyên phổi làm tăng hậu tải RV dẫn đến giảm thể tích nhát bóp RV, sẽ ở mức thấp nhất khi kết thúc hít vào [11‐16]. Đồng thời, sự gia tăng áp lực trong lồng ngực và trong phổi dẫn đến giảm hậu tải LV và tăng tạm thời hậu tải LV do ép ra khỏi máu phế nang, dẫn đến tăng thể tích nhát bóp LV, sẽ đạt mức tối đa vào cuối hít vào [11]. Việc giảm thể tích nhát bóp RV trong khi hít vào dẫn đến giảm đổ đầy LV sau một khoảng thời gian trễ từ hai đến ba nhịp tim do thời gian vận chuyển qua phổi [17]. Điều này dẫn đến giảm thể tích nhát bóp LV, sẽ là mức thấp nhất trong thời gian thở ra.
Do đó, thông khí áp lực dương ngắt quãng tạo ra những thay đổi theo chu kỳ trong thể tích nhát bóp LV, là mức tối đa trong thời gian hít vào và thấp nhất trong thời gian thở ra. Độ lớn của sự thay đổi thể tích nhát bóp LV, hoặc các đại diện của nó, chẳng hạn như áp lực mạch, sẽ được phóng đại khi bệnh nhân phụ thuộc vào tiền tải. Do đó, giá trị PPV cao nên được liên kết với khả năng đáp ứng tiền tải và giá trị PPV thấp với khả năng không đáp ứng tiền tải (Hình 1). Giá trị ngưỡng lớn hơn 12–13% đã được báo cáo là có khả năng dự đoán cao về khả năng đáp ứng thể tích [7, 9, 10].
So sánh sự thay đổi động lực học của các biến số bắt nguồn từ dạng sóng động mạch trong quá trình thở máy (SPV, PPV và SVV)
Kể từ những nghiên cứu sớm nhất về PPV và SVV [6, 17], cả hai chỉ số đều được chứng minh là những yếu tố dự báo đáng tin cậy về khả năng đáp ứng dịch truyền. Đánh giá có hệ thống đầu tiên của Marik et al. [7] so sánh PPV, SPV và SVV để dự đoán khả năng đáp ứng dịch ở bệnh nhân thở máy cho thấy đường cong (AUROC) lần lượt là 0,94, 0,84 và 0,86.
Bảng 1 So sánh giá trị tiên đoán của các biến được sử dụng để xác định khả năng đáp ứng dịch ở bệnh nhân thở máy trong ba tổng quan hệ thống
| Tổng quan hệ thống | Năm | Loại nghiên cứu | Loại bệnh nhân | Thông số | AUC (95% CI) |
| Marik et al. [7] | 2009 | 29 nghiên cứu
685 bệnh nhân thể tích khí lưu thông thay đổi |
Bệnh nhân ICU và phòng mổ | PPV | 0.94 (0.93–0.95) |
| SPV | 0.86 (0.82–0.90) | ||||
| SVV | 0.84 (0.78–0.88) | ||||
| LVEDA | 0.64 (0.53–0.74) | ||||
| GEDV | 0.56 (0.37–0.67) | ||||
| CVP | 0.55 (0.48–0.62) | ||||
| Hong et al. [9] | 2014 | 19 nghiên cứu
850 bệnh nhân thể tích khí lưu thông thay đổi |
Chỉ bệnh nhân ICU | PPV | 0.88 (0.84–0.92) |
| SVV | 0.84 (0.79–0.89) | ||||
| Yang and Du [10] | 2014 | 22 nghiên cứu
807 bệnh nhân thể tích khí lưu thông > 8 ml/kg |
Chỉ bệnh nhân ICU | PPV | 0.94 (0.91–0.95) |
AUC: Vùng dưới đường cong, ICU: đơn vị chăm sóc đặc biệt, OR: phòng mổ, PPV: biến thiên áp lực mạch, SPV: biến thiên huyết áp tâm thu, SVV: biến thiên thể tích nhát bóp, LVEDA: diện tích cuối tâm trương thất trái, GEDV: thể tích cuối tâm trương toàn cục, CVP: áp lực tĩnh mạch trung tâm
AUROC cho PPV lớn hơn đáng kể so với SPV hoặc SVV (p < 0,001). Một phân tích tổng hợp khác [9] so sánh SVV và PPV như các chỉ số chẩn đoán về khả năng đáp ứng dịch ở bệnh nhân nặng thở máy cho thấy giá trị AUROC là 0,84 đối với SVV và 0,88 đối với PPV. Một phân tích tổng hợp gần đây [10] chỉ bao gồm các bệnh nhân ICU được thở máy với thể tích khí lưu thông > 8 ml/kg, cho thấy PPV dự đoán chính xác khả năng đáp ứng dịch với AUC là 0,94. So sánh giá trị dự đoán của các biến được sử dụng để xác định khả năng đáp ứng dịch truyền trong ba bài tổng quan hệ thống này [7, 9, 10] được đưa ra trong Bảng 1. Trong số PPV, SVV và SPV, PPV được nghiên cứu rộng rãi nhất và đáng tin cậy hơn.
Hạn chế của việc sử dụng PPV để dự đoán khả năng đáp ứng dịch truyền
PPV hoạt động dựa trên các tương tác giữa tim và phổi và có một số hạn chế để sử dụng trong việc dự đoán khả năng đáp ứng dịch truyền, được liệt kê trong Bảng 2. Các nghiên cứu gần đây [18‐20] đã đặt câu hỏi về khả năng ứng dụng của PPV và SVV trong ICU. Các xét nghiệm như nâng chân thụ động (passive leg raising − PLR) [21‐23] và tắc nghẽn cuối thì thở ra (end‐ expiratory occlusion) [24‐26] có thể dự đoán một cách đáng tin cậy khả năng đáp ứng dịch truyền và đã được đề xuất như là những lựa chọn thay thế được thực hiện trong những tình huống này. PLR có thể giúp khắc phục hầu hết các hạn chế của PPV. Tuy nhiên, nó đòi hỏi phải theo dõi cung lượng tim liên tục và không thể sử dụng cho những bệnh nhân bị chấn thương thần kinh hoặc những người cần bất động [27, 28]. Thử nghiệm tắc nghẽn cuối thì thở ra không thích hợp cho những bệnh nhân không được đặt nội khí quản, trong khi PLR có thể được sử dụng một cách đáng tin cậy cho những bệnh nhân này.
Thử thách truyền dịch thể tích nhỏ (mini‐fluid challenge) [29] cũng có thể được sử dụng thay thế cho PPV, nhưng đòi hỏi một kỹ thuật rất chính xác để theo dõi cung lượng tim. Sử dụng các biến thể hô hấp trong đường kính của đường kính tĩnh mạch chủ trên [30] và dưới [31] thu được từ siêu âm tim qua thực quản hoặc xuyên lồng ngực để dự đoán khả năng đáp ứng với dịch truyền có cùng những hạn chế như PPV, ngoại trừ việc chúng có thể được sử dụng ở bệnh nhân rối loạn nhịp tim. Mặc dù các thử nghiệm thay thế đã được đề xuất, nhưng ít nỗ lực đã được thực hiện để cải thiện độ tin cậy của chính PPV trong các tình huống mà nó hiện không được khuyến khích sử dụng [32].
Sử dụng ‘thử thách thể tích khí lưu thông’ để khắc phục những hạn chế liên quan đến PPV trong quá trình thông khí thể tích khí lưu thông thấp
Một số nghiên cứu đã chỉ ra rằng PPV không dự đoán một cách đáng tin cậy khả năng đáp ứng của dịch truyền khi thông khí thể tích khí lưu thông thấp [25, 33–37]. De Backer và cộng sự [33] cho thấy PPV là một yếu tố dự đoán đáng tin cậy về khả năng đáp ứng dịch truyền, miễn là thể tích khí lưu thông ít nhất là 8 ml/kg trọng lượng cơ thể dự đoán (predicted body weight − PBW). Trong quá trình thông khí thể tích khí lưu thông thấp, PPV có thể chỉ ra tình trạng không đáp ứng ngay cả ở những người đáp ứng vì thể tích khí lưu thông có thể không đủ để tạo ra sự thay đổi đáng kể áp lực trong lồng ngực [38, 39]. Tuy nhiên, Freitas et al. [40] cho thấy PPV là một dấu hiệu đáng tin cậy về khả năng đáp ứng dịch truyền ở bệnh nhân có hội chứng suy hô hấp cấp (ARDS) khi thông khí thể tích khí lưu thông thấp sử dụng giá trị cắt giảm thấp hơn là 6,5%.
Bảng 2 Những hạn chế khi sử dụng biến thiên áp lực mạch (PPV) để dự đoán khả năng đáp ứng của dịch truyền
| Hạn chế | Cơ chế thất bại | Loại nguy cơ | |
| 1 | Hoạt động thở tự phát | Sự thay đổi bất thường của áp lực trong lồng ngực và do đó sự thay đổi về thể tích nhát bóp không thể tương quan với sự phụ thuộc của tiền tải | Dương tính giả (đôi khi có thể âm tính giả tùy thuộc vào kiểu thở) |
| 2 | Rối loạn nhịp tim | Sự thay đổi thể tích nhát bóp liên quan nhiều đến sự bất thường trong tâm trương hơn là tương tác tim phổi. | Dương tính giả |
| 3 | Thở máy sử dụng thể tích khí lưu thông thấp (< 8 ml/kg) | Sự thay đổi nhỏ của áp lực trong lồng ngực do thể tích khí lưu thông thấp không đủ để tạo ra những thay đổi đáng kể trong áp lực trong lồng ngực | Âm tính giả |
| 4 | Độ giãn nở của phổi thấp | Sự truyền những thay đổi của áp lực phế nang đến các cấu trúc trong lồng ngực bị giảm | Âm tính giả |
| 5 | Mở ngực | Không thay đổi áp lực trong lồng ngực trong chu kỳ hô hấp | Âm tính giả |
| 6 | Tăng áp lực trong ổ bụng | Giá trị ngưỡng của PPV sẽ được nâng cao | Dương tính giả |
| 7 | Tỷ lệ HR/RR thấp < 3,6 (nhịp tim chậm nghiêm trọng hoặc thông khí tần số cao) | Nếu RR rất cao, số chu kỳ tim mỗi chu kỳ hô hấp có thể quá thấp để cho phép thay đổi thể tích nhát bóp | Âm tính giả |
HR: nhịp tim, RR: nhịp thở
Trong số những hạn chế khi sử dụng PPV trong quá trình thở máy có kiểm soát trong ICU, việc sử dụng thể tích khí lưu thông thấp là phổ biến nhất. Ngày nay, các chỉ định sử dụng thể tích khí lưu thông thấp trong ICU đang được mở rộng [41, 42]. Hai nghiên cứu đa trung tâm [18, 19] cho thấy rằng số lượng bệnh nhân ICU mà PPV thích hợp để sử dụng là rất thấp, có tới 72–87% bệnh nhân thở máy có kiểm soát không thích hợp để sử dụng thông số này, bởi vì sử dụng hệ thống thông khí thể tích khí lưu thông thấp. Hai nghiên cứu gần đây [43, 44] sử dụng phương pháp ‘vùng xám’ để khảo sát giá trị lâm sàng của PPV, bao gồm một số bệnh nhân được thở máy với thể tích khí lưu thông thấp. Biais và cộng sự [44], trong một phân tích dưới nhóm, cho thấy vùng xám lớn hơn ở những bệnh nhân được thở máy với thể tích khí lưu thông thấp hơn ở những bệnh nhân có thể tích khí lưu thông ít nhất là 8 ml/kg PBW. Những nghiên cứu này có thể gây hiểu lầm khi kết luận rằng PPV có giá trị lâm sàng hạn chế [32].
Thử thách thể tích khí lưu thông’ là một thử nghiệm mới được đề xuất để cải thiện độ tin cậy của PPV trong quá trình thông khí thể tích khí lưu thông thấp [45]. Thử nghiệm liên quan đến việc tăng tạm thời thể tích khí lưu thông từ 6 ml/kg PBW lên 8 ml/kg PBW trong một phút và quan sát sự thay đổi của PPV (∆PPV 6–8) từ mức ban đầu (PPV 6) đến mức 8 ml/kg PBW (PPV 8). Trong một nghiên cứu gần đây kiểm tra thử thách thể tích khí lưu thông [45], 30 bộ phép đo đã được ghi nhận ở 20 bệnh nhân suy tuần hoàn cấp được thông khí thể tích khí lưu thông thấp sử dụng thông khí hỗ trợ kiểm soát thể tích và không có hoạt động thở tự phát. Khả năng đáp ứng với dịch truyền được định nghĩa là sự gia tăng cung lượng tim do pha loãng nhiệt > 15% sau khi truyền dịch sau khi giảm thể tích khí lưu thông trở lại 6 m/kg PBW. Đúng như dự đoán, PPV 6 không thể dự đoán khả năng đáp ứng dịch truyền, với AUROC là 0,69. Điều quan trọng là đã có sự gia tăng đáng kể PPV (∆PPV 6–8), sau thử thách thể tích khí lưu thông chỉ ở các người đáp ứng dịch truyền. Những người đáp ứng phân biệt ∆PPV6–8 từ những người không đáp ứng với AUROC là 0,99 (độ nhạy 94% và độ đặc hiệu 100%) với giá trị cắt là 3,5% [45]. Do đó, thử thách thể tích khí lưu thông đã cải thiện độ tin cậy của PPV trong việc dự đoán khả năng đáp ứng dịch ở những bệnh nhân được thông khí thể tích khí lưu thông thấp. Kết quả tương tự cũng được thấy khi sử dụng SVV (∆SVV 6–8) thu được từ thiết bị phân tích đường viền xung nhịp với AUROC là 0,97 (độ nhạy 88% và độ đặc hiệu 100%) với giá trị cắt 2,5% [45]. Sự thay đổi PPV sau khi cho một liều dịch (∆PPV fb) cũng xác nhận chính xác khả năng đáp ứng của dịch truyền với AUROC là 0,98 (độ nhạy 94% và độ đặc hiệu 100%) với giá trị cắt là 1,5%.
Cách thực hiện và giải thích thử thách thể tích khí lưu thông
Thử nghiệm này được thực hiện để đánh giá khả năng đáp ứng dịch truyền trong tình trạng sốc, được thở máy bằng cách sử dụng thể tích khí lưu thông thấp mà không có hoạt động thở tự phát. PPV được ghi nhận từ máy theo dõi tại giường
lúc ban đầu (thể tích khí lưu thông 6 ml/kg PBW). Sau đó, thể tích khí lưu thông tăng nhanh chóng từ 6 ml/kg PBW lên 8 ml/kg PBW trong một phút. PPV được ghi lại ở mức 8 ml/kg PBW và thể tích khí lưu thông giảm trở lại 6 ml/kg PBW. ∆PPV 6–8 sau khi thực hiện thử thách thể tích khí lưu thông được ghi lại. ∆PPV 6–8 lớn hơn 3,5% dự đoán khả năng đáp ứng dịch truyền với độ chính xác cao.
PPV không đáng tin cậy ở những bệnh nhân có độ giãn nở của phổi thấp, đặc biệt là ở những bệnh nhân ARDS [38]. Ở những bệnh nhân này, sự dẫn truyền áp lực đường thở bị giảm, do đó những thay đổi theo chu kỳ của áp lực trong lồng ngực có thể bị giảm đi ngay cả khi có những thay đổi rõ rệt về áp lực phế nang [46]. Monnet và cộng sự [25] cho thấy giá trị dự đoán của PPV liên quan đến độ giãn nở của hệ thống hô hấp và nếu độ giãn nở < 30 ml/cmH2O, PPV kém chính xác hơn trong việc dự đoán khả năng đáp ứng dịch. Trong nghiên cứu của chúng tôi, mặc dù mức độ tuân thủ trung bình của hệ hô hấp là < 30 ml/cmH2O (25 [23‐33]) khi thông khí thể tích khí lưu thông thấp, nó tăng lên > 30 ml/cmH2O (32 [24‐40]) sau thử thách thể tích khí lưu thông. Do đó, thử thách thể tích khí lưu thông có thể giúp xác định người đáp ứng ngay cả khi độ giãn nở của hệ thống hô hấp thấp ở những bệnh nhân được thông khí thể tích khí lưu thông thấp với phổi có thể huy động được. Điều này cần được xác nhận trong một nghiên cứu được cung cấp đầy đủ. Liệu phương pháp này có hiệu quả ở những bệnh nhân không tăng độ giãn nở của hệ thống hô hấp sau khi đưa ra thử thách thể tích khí lưu thông hay không cần phải được kiểm tra. Liệu PPV có đáng tin cậy trong các lần cố gắng thở tự phát sau khi thử thách thể tích khí lưu thông hay không hoặc trong các tình huống khác mà việc sử dụng PPV bị hạn chế cũng cần được kiểm tra.
Ưu điểm của việc sử dụng thử thách thể tích khí lưu thông
Sử dụng một thử thách thể tích khí lưu thông làm tăng độ tin cậy của PPV để dự đoán khả năng đáp ứng của dịch truyền trong quá trình thông khí thể tích khí lưu thông thấp, hiện đang là phương pháp phổ biến trong ICU. Đây là một bài kiểm tra đơn giản có thể thực hiện dễ dàng ngay tại giường bệnh. Quan trọng là, việc quan sát những thay đổi trong PPV (thu được từ một máy theo dõi huyết động đơn giản bên cạnh giường bệnh) trong quá trình thử nghiệm này không yêu cầu máy theo dõi cung lượng tim, làm cho thử nghiệm này có thể áp dụng được ngay cả trong những điều kiện hạn chế về nguồn lực. ∆PPV fb xác nhận chính xác khả năng đáp ứng dịch truyền. Do đó, sự kết hợp của ∆PPV 6–8 với ∆PPV fb có thể giúp dự đoán và sau đó xác nhận khả năng đáp ứng dịch khi không có theo dõi cung lượng tim liên tục.
Hạn chế của thử thách khối lượng thủy triều
Thử thách thể tích khí lưu thông có thể không khắc phục được những hạn chế khác liên quan đến việc sử dụng PPV, chẳng hạn như thở tự phát, loạn nhịp tim, lồng ngực mở và tăng áp lực trong ổ bụng và cần được đánh giá ở những cơ sở này. Các kỹ thuật thay thế, chẳng hạn như PLR hoặc tắc nghẽn cuối thì thở ra, khi có thể áp dụng, có thể được xem xét trong những tình huống này.
Kết luận
PPV là một thông số động có thể dễ dàng ghi lại từ máy theo dõi tại giường và dự đoán đáng tin cậy khả năng đáp ứng tiền tải. Ngoài ra, nó không yêu cầu theo dõi cung lượng tim liên tục hoặc bất kỳ công cụ hoặc thao tác nào khác được thực hiện. Một trong những hạn chế chính của việc sử dụng nó ở bệnh nhân thở máy có kiểm soát là nó không đáng tin cậy trong quá trình thông khí thể tích khí lưu thông thấp, hiện đang được thực hiện rộng rãi ở bệnh nhân ICU. Tuy nhiên, việc loại bỏ thông số hữu ích này sẽ giống như ném em bé ra ngoài với nước tắm. Có thể dễ dàng khắc phục hạn chế lớn này bằng cách sử dụng ‘thử thách thể tích khí lưu thông’, một bài kiểm tra đơn giản tại giường, sau đó PPV có thể dự đoán một cách đáng tin cậy khả năng đáp ứng dịch truyền. Việc thử nghiệm này cũng có thể có tiềm năng để khắc phục những hạn chế khác liên quan đến việc sử dụng PPV hay không cần được nghiên cứu thêm. Các phương pháp thay thế để đánh giá khả năng đáp ứng tiền tải có thể được yêu cầu để khắc phục các hạn chế khác khi sử dụng PPV.
References
- Michard F, Teboul Predicting fluid responsiveness in ICU patients: a critical analysis of the evidence. Chest. 2002;121:2000–8.
- Murakawa K, Kobayashi Effects of vasopressors on renal tissue gas tensions during hemorrhagic shock in dogs. Crit Care Med. 1998;16:789–92.
- Pinsky MR, Brophy P, Padilla J, Paganini E, Pannu Fluid and volume monitoring. Int J Artif Organs. 2008;31:111–26.
- Wiedemann HP, Wheeler AP, Bernard GR, et al. Comparison of two fluid‐management strategies in acute lung N Engl J Med. 2006;354:2564–75.
- Acheampong A, Vincent JL. A positive fluid balance is an independent prognostic factor in patients with sepsis. Crit 2015;19:251.
- Michard F, Boussat S, Chemla D, et al. Relation between respiratory changes in arterial pulse pressure and fluid responsiveness in septic patients with acute circulatory Am J Respir Crit Care Med. 2000;162:134–8.
- Marik PE, Cavallazzi R, Vasu T, Hirani A. Dynamic changes in arterial waveform derived variables and fluid responsiveness in mechanically ventilated A systematic review of the literature. Crit Care Med. 2009;37:2642–7.
- Perel A, Pizov R, Cotev S. Respiratory variations in the arterial pressure during mechanical ventilation reflect volume status and fluid Intensive Care Med. 2014;40:798–807.
- Hong JQ, He HF, Chen ZY, et al. Comparison of stroke volume variation with pulse pressure variation as a diagnostic indicator of fluid responsiveness in mechanically ventilated critically ill Saudi Med J. 2014;35:261–8.
- Yang X, Du B. Does pulse pressure variation predicts fluid responsiveness in critically ill patients: a critical review and meta‐analysis. Crit 2014;18:650.
- Michard F, Teboul Using heart lung interactions to assess fluid responsiveness during mechanical ventilation. Crit Care. 2000;4:282–9.
- Morgan BC, Martin WE, Hornbein TF, Crawford EW, Guntheroth WG. Hemodynamic effects of intermittent positive pressure ventilation. 1966;27:584–90.
- Jardin F, Delorme G, Hardy A, Auvert B, Beauchet A, Bourdarias JP. Reevaluation of hemodynamic consequences of positive pressure ventilation: emphasis on cyclic right ventricular afterloading by mechanical lung inflation. 1990;72:966–70.
- Permutt S, Wise RA, Brower RG. How changes in pleural and alveolar pressure cause changes in afterload and In: Scharf SM, Cassidy SS, editors. Heart‐Lung Interactions in Health and Disease. New York: Marcel Dekker; 1989. p. 243–50.
- Jardin F, Farcot JC, Gueret P, Prost JF, Ozier Y, Bourdarias JP. Cyclic changes in arterial pulse during respiratory Circulation. 1983;68:266–74.
- Scharf SM, Brown R, Saunders N, Green LH. Hemodynamic effects of positive‐pressure inflation. J Appl Physiol. 1980;49:124–31.
- Berkenstadt H, Margalit N, Hadani M, et al. Stroke volume variation as a predictor of fluid responsiveness in patients undergoing brain Anesth Analg. 2001;92:984–9.
- Mahjoub Y, Lejeune V, Muller L, et al. Evaluation of pulse pressure variation validity criteria in critically ill patients: a prospective observational multicentre point prevalence study. Br J 2014;112:681–5.
- Fischer MO, Mahjoub Y, Boisselier C, et al. Arterial pulse pressure variation suitability in critical care: A French national Anaesth Crit Care Pain Med. 2015;34:23–8.
- Benes J, Zatloukal J, Kletecka J, Simanova A, Haidingerova L, Pradl R. Respiratory induced dynamic variations of stroke volume and its surrogates as predictors of fluid responsiveness: applicability in the early stages of specific critical J Clin Monit Comput. 2013;28:225–31.
- Monnet X, Marik P, Teboul JL. Passive leg raising for predicting fluid responsiveness: a systematic review and meta‐analysis. Intensive Care 2016;42:1935–47.
- Monnet X, Teboul Passive leg raising. Intensive Care Med. 2008;34:659–63.
- Monnet X, Teboul Passive leg raising: five rules, not a drop of fluid! Crit Care. 2015;19:18.
- Monnet X, Osman D, Ridel C, Lamia B, Richard C, Teboul JL. Predicting volume responsiveness by using the end‐ expiratory occlusion in mechanically ventilated intensive care unit Crit Care Med. 2009;37:951–6.
- Monnet X, Bleibtreu A, Ferré A, et al. Passive leg‐raising and end‐expiratory occlusion tests perform better than pulse pressure variation in patients with low respiratory system Crit Care Med. 2012;40:152–7.
- Silva S, Jozwiak M, Teboul JL, Persichini R, Richard C, Monnet X. End‐expiratory occlusion test predicts preload responsiveness independently of positive end‐expiratory pressure during acute respiratory distress syndrome. Crit Care 2013;41:1692–701.
- Guerin L, Monnet X, Teboul JL. Monitoring volume and fluid responsiveness: From static to dynamic indicators. Best Pract Res Clin Anaesthesiol. 2013;27:177–85.
- De Backer D, Pinsky MR. Can one predict fluid responsiveness in spontaneously breathing patients? Intensive Care 2007;33:1111–3.
- Muller L, Toumi M, Bousquet PJ, et al. An increase in aortic blood flow after an infusion of 100 ml colloid over 1 minute can predict fluid responsiveness: the mini‐fluid challenge study. 2011;115:541–7.
- Vieillard‐Baron A, Chergui K, Rabiller A, et al. Superior vena caval collapsibility as a gauge of volume status in ventilated septic patients. Intensive Care 2004;30:1734–9.
- Feissel M, Michard F, Faller JP, Teboul JL. The respiratory variation in inferior vena cava diameter as a guide to fluid Intensive Care Med. 2004;30:1834–7.
- Michard F, Chemla D, Teboul JL. Applicability of pulse pressure variation: how many shades of grey? Crit Care. 2015;19:144.
- De Backer D, Heenen S, Piagnerelli M, Koch M, Vincent Pulse pressure variations to predict fluid responsiveness: influence of tidal volume. Intensive Care Med. 2005;31:517–23.
- Vallée F, Richard JC, Mari A, et al. Pulse pressure variations adjusted by alveolar driving pressure to assess fluid Intensive Care Med. 2009;35:1004–10.
- Lakhal K, Ehrmann S, Benzekri‐Lefèvre D, et al. Respiratory pulse pressure variation fails to predict fluid responsiveness in acute respiratory distress syndrome. Crit 2011;15:R85.
- Lansdorp B, Lemson J, vanPutten MJ, de Keijzer A, van der Hoeven JG, Pickkers P. Dynamic indices do not predict volume responsiveness in routine clinical Br J Anaesth. 2012;108:395–401.
- Reuter DA, Bayerlein J, Goepfert MS, et al. Influence of tidal volume on left ventricular stroke volume variation measured by pulse contour analysis in mechanically ventilated Intensive Care Med. 2003;29:476–80.
- Teboul JL, Monnet Pulse pressure variation and ARDS. Minerva Anestesiol. 2013;79:398–407.
- Pinsky MR. Using ventilation‐induced aortic pressure and flow variation to diagnose preload responsiveness. Intensive Care Med. 2004;30:1008–10.
- Freitas FG, Bafi AT, Nascente AP, et al. Predictive value of pulse pressure variation for fluid responsiveness in septic patients using lung‐protective ventilation strategies. Br J 2013;110:402–8.
- Serpa Neto A, Cardoso SO, Manetta JA, et al. Association between use of lung‐protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta‐ JAMA. 2012;308:1651–9.
- Futier E, Pereira B, Jaber Intraoperative low‐tidal‐volume ventilation. N Engl J Med. 2013;369:1862–3.
- Cannesson M, Le Manach Y, Hofer C, et al. Assessing the diagnostic accuracy of pulse pressure variations for the prediction of fluid responsiveness: a “gray zone” Anesthesiology. 2011;115:231–41.
- Biais M, Ehrmann S, Mari A, et Clinical relevance of pulse pressure variations for predicting fluid responsiveness in mechanically ventilated intensive care unit patients: the grey zone approach. Crit Care. 2014;18:587.
- Myatra SN, Prabu NR, Divatia JV, Monnet X, Kulkarni AP, Teboul JL. The changes in pulse pressure variation or stroke volume variation after a “tidal volume challenge” reliably predict fluid responsiveness during low tidal volume Crit Care Med. 2017;45:415–21.
- Teboul JL, Pinsky MR, Mercat A, et al. Estimating cardiac filling pressure in mechanically ventilated patients with Crit Care Med. 2000;28:3631–6.