Bệnh hô hấp
So sánh cách chuẩn độ PEEP bằng EIT so với Crs trong ARDS trẻ em
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Hong Ren, Li Xie, Zhulin Wang, Xiaoliao Tang, Botao Ning, Teng Teng, Juan Qian, Ying Wang, Lijun Fu, Zhanqi Zhao and Long Xiang
Front. Med., 23 May 2022. Https://doi.org/10.3389/fmed.2022.805680
So sánh chuẩn độ áp lực dương cuối kỳ thở ra theo hướng dẫn toàn cục và khu vực đối với thông khí phổi khu vực trong hội chứng suy hô hấp cấp tính ở trẻ em từ trung bình đến nặng tải về file pdf ở đây.
Dịch bài: BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Mục đích
Để điều tra sự khác biệt về áp lực dương cuối thì thở ra (PEEP) được chọn với chụp cắt lớp trở kháng điện ngực (EIT) và với độ giãn nở của hệ thống hô hấp động toàn cục (Crs) trong hội chứng suy hô hấp cấp tính ở trẻ em từ trung bình đến nặng (pARDS).
Phương pháp
Bệnh nhân có pARDS từ trung bình đến nặng (PaO2/FiO2 < 200 mmHg) được đưa vào hồi cứu. Vào ngày chẩn đoán pARDS, hai mức PEEP đã được xác định trong quá trình chuẩn độ PEEP giảm dần cho từng cá nhân bằng phương pháp độ giãn nở tốt nhất (PEEPC) và độ giãn nở khu vực dựa trên EIT (PEEPEIT). Sự khác biệt về độ giãn nở toàn cục và khu vực (đối với cả khu vực phụ thuộc vào trọng lực và không phụ thuộc vào trọng lực) trong hai điều kiện PEEP đã được so sánh. Ngoài ra, chỉ số không đồng nhất toàn cục dựa trên EIT (GI), trung tâm thông khí (CoV) và độ lệch chuẩn của thông khí trì hoãn khu vực (RVDSD) cũng được tính toán và so sánh.
Kết quả
Tổng cộng có 12 trẻ mắc pARDS (5 trẻ mắc pARDS nặng và 7 trẻ mắc pARDS trung bình) được đưa vào. PEEPC và PEEPEIT giống hệt nhau ở 6 bệnh nhân. Ở những bệnh nhân khác, sự khác biệt chỉ là ± 2 cm H2O (một bước PEEP). Không có sự khác biệt thống kê về mức độ độ giãn nở toàn cục ở PEEPC và PEEPEIT [28,7 (2,84–33,15) so với 29,74 (2,84–33,47) ml/cm H2O trung vị (IQR), p = 0,028 (mức ý nghĩa sau khi điều chỉnh cho nhiều so sánh là 0,017)]. Hơn nữa, không có sự khác biệt nào được tìm thấy trong độ giãn nở khu vực và các thông số dựa trên EIT khác đo lường sự phân bố thông khí theo không gian và thời gian.
Kết luận
Mặc dù EIT cung cấp thông tin về phân phối thông khí, PEEP được chọn với Crs tốt nhất có thể không thua kém thông khí khu vực do EIT hướng dẫn trong pARDS từ trung bình đến nặng. Nghiên cứu sâu hơn với cỡ mẫu lớn là cần thiết để xác nhận phát hiện này.
Giới thiệu
Hội chứng suy hô hấp cấp tính ở trẻ em (Pediatric acute respiratory distress syndrome − pARDS) đã được đề xuất bởi Hội nghị đồng thuận về tổn thương phổi cấp tính ở trẻ em (Pediatric Acute Lung Injury Consensus Conference − PALICC) năm 2015 (1). Dữ liệu khảo sát đa quốc gia của các nhà điều tra nhiễm trùng và tổn thương phổi cấp tính ở trẻ em (pediatric acute lung injury and sepsis investigators − PALISI) đã chỉ ra rằng tỷ lệ tử vong của pARDS là khoảng 22–40% và tỷ lệ tử vong liên quan đến pARDS có thể lên tới hơn 30% trong đơn vị chăm sóc đặc biệt dành cho trẻ em (pediatric intensive care unit − PICU) (2).
Tương tự như ARDS ở người trưởng thành, các đặc điểm sinh lý bệnh của pARDS bao gồm tính không đồng nhất của các tổn thương phổi và sự hình thành xẹp phổi ở vùng phụ thuộc trọng lực. Hiện tại, thở máy vẫn là phương pháp duy trì sự sống chính trong điều trị ARDS. Trong quá trình thở máy, việc cài đặt áp lực dương cuối thì thở ra (positive end-expiratory pressure − PEEP) không hợp lý có thể gây căng phế nang quá mức và xẹp–mở theo chu kỳ và giải phóng các chất trung gian gây viêm, dẫn đến tổn thương phổi do máy thở (ventilator-induced lung injury − VILI). Nó cũng có thể dẫn đến tình trạng huyết động không ổn định thứ phát sau rối loạn chức năng tâm thất phải (3, 4). PALICC khuyến nghị huy động phổi và chuẩn độ PEEP tối ưu trong pARDS (1). PEEP tối ưu giữ cho phế nang không bị mất huy động ở những vùng phụ thuộc vào trọng lực và chỉ gây ra tình trạng quá căng phế nang có giới hạn ở những vùng không phụ thuộc vào trọng lực. Trong pARDS, câu hỏi làm thế nào để chuẩn độ PEEP vẫn đang được tranh luận.
Chụp cắt lớp trở kháng điện (Electrical impedance tomography − EIT) là một công nghệ theo dõi thông khí không xâm lấn tiên tiến tại giường bệnh (5, 6). Nó có thể hình dung trực tiếp liệu các vùng phổi bị xẹp có thể được mở ra sau thao tác huy động phổi hay không, hướng dẫn cài đặt thông số máy thở và giảm thiểu VILI. Một số đánh giá gần đây đã tóm tắt các ứng dụng của EIT trong điều trị ARDS ở người trưởng thành (7, 8). Hai nghiên cứu ngẫu nhiên có đối chứng chỉ ra rằng chuẩn độ PEEP theo hướng dẫn của EIT có thể làm giảm tỷ lệ tử vong do ARDS (9, 10). Về trẻ em, Rosemeier và cộng sự báo cáo rằng trong quá trình huy động phổi và chuẩn độ PEEP, EIT có thể giúp giảm thiểu tình trạng căng quá mức và xẹp phế nang khu vực, đồng thời cải thiện quá trình oxy hóa (11). Tuy nhiên, EIT không được sử dụng rộng rãi trong PICU. Chúng tôi đã đưa ra giả thuyết rằng phương pháp chuẩn độ PEEP truyền thống sử dụng độ giãn nở của hệ thống hô hấp động (dynamic respiratory system compliance − Crs) có thể dẫn đến PEEP tương tự và thông khí khu vực để bảo vệ phổi trong pARDS.
Nguyên liệu và phương pháp
Thiết kế nghiên cứu
Nghiên cứu này là quan sát hồi cứu và được thực hiện tại PICU của Trung tâm Y tế Nhi đồng Thượng Hải từ ngày 1 tháng 1 năm 2020 đến ngày 31 tháng 12 năm 2020. Ủy ban Đạo đức của Trung tâm Y tế Nhi đồng Thượng Hải đã phê duyệt nghiên cứu này (SCMCIRB-Y20200087). Đối với tất cả những đứa trẻ được bao gồm, đã có sự đồng ý bằng văn bản từ những người giám hộ hợp pháp của chúng.
Người bệnh
Trẻ em bị pARDS vừa và nặng được chẩn đoán theo PALICC 2015 (1) và được điều trị bằng đặt nội khí quản xâm lấn và thông khí bảo vệ phổi. Các tiêu chí loại trừ như sau: (1) tuổi > 18 tuổi hoặc cân nặng < 7 kg; (2) huyết động không ổn định hoặc sốc mất bù chưa được điều chỉnh; (3) tổn thương và chấn thương nghiêm trọng ở ngực và cột sống, vết mổ do phẫu thuật và tổn thương ở các bộ phận liên quan của da, biến dạng nghiêm trọng ở ngực và không thể cố định băng EIT; (4) béo phì nghiêm trọng và Chỉ số khối cơ thể > 50; (5) các thiết bị cấy ghép trong lồng ngực, chẳng hạn như máy tạo nhịp tim, máy khử rung tim hoặc bất kỳ thiết bị cấy ghép phẫu thuật nào khác; (6) khử rung tim đang diễn ra; (7) bệnh tim bẩm sinh, thoát vị hoành bẩm sinh, bệnh tắc nghẽn đường thở nặng; (8) sildenafil hoặc oxit nitric dạng hít được sử dụng để điều trị tăng áp phổi vì nhiều lý do; (9) chấn thương sọ não nặng, theo dõi áp lực nội sọ hoặc dẫn lưu não thất; và (10) thông khí tần số cao.
Tất cả trẻ tiếp tục được dùng midazolam, an thần fentanyl, giảm đau và phong bế thần kinh cơ rocuronium mà không tự thở. Việc lựa chọn thuốc, liều lượng và thời gian dùng thuốc được xác định bởi các bác sĩ điều trị của PICU. Tất cả các bệnh nhân được điều trị bằng thông khí bảo vệ phổi thể tích khí lưu thông thấp ở tư thế nằm ngửa. Chế độ kiểm soát áp lực được áp dụng cho thở máy, với thể tích khí lưu thông mục tiêu là 4– 6 ml/trọng lượng cơ thể dự đoán và FiO2 được chuẩn độ để đạt được độ bão hòa oxy trong máu ngoại vi từ 92 đến 100%.
Giám sát chụp cắt lớp trở kháng điện
Phép đo chụp cắt lớp trở kháng điện được thực hiện để theo dõi sự phân bố thông khí ở đầu giường (Pulmovita 500, Dräger Medical, Lübeck, Đức). Một đai với mười sáu điện cực được đặt trên mặt cắt ngang quanh ngực bệnh nhân. Một điện cực tham chiếu được đặt trên bụng. Hình ảnh EIT liên tục được ghi lại và lưu trữ ở tần số 20 Hz. Dữ liệu hô hấp của máy thở được truyền đến thiết bị EIT và được ghi lại thông qua kết nối MEDIBUS. Hình ảnh thông khí bình thường được chia thành vùng bụng và vùng lưng.
Quy trình chuẩn độ PEEP
Chuẩn độ áp lực dương cuối thì thở ra được thực hiện trong vòng 6 giờ sau khi chẩn đoán pARDS. Không có thao tác huy động phổi nào được thực hiện trước khi chuẩn độ PEEP. PEEP ban đầu được đặt ở mức 15 cm H2O. PEEP được giảm theo từng bước 2 cm H2O và kéo dài 2 phút cho đến khi PEEP đạt 5 cm H2O.
PEEP “tối ưu” được xác định bằng EIT (PEEPEIT) và Crs (PEEPC). PEEPEIT đã được chọn để giảm thiểu sự căng quá mức của khu vực và bị xẹp dựa trên độ giãn nở của khu vực (12). PEEPC được chọn khi Crs đạt mức tối đa trong quá trình thử nghiệm PEEP giảm dần (13) (Hình 1).
Các thay đổi trở kháng tương đối theo chu kỳ thở được chuẩn hóa thành thể tích khí lưu thông tính bằng mililit. Crs khu vực cho vùng bụng và vùng lưng được tính toán khi trở kháng theo chu kỳ thở thay đổi ở vùng bụng và vùng lưng theo áp lực đẩy, tương ứng. Một số tham số dựa trên EIT đã được tính toán để đánh giá sự phân bố thông khí khu vực theo không gian và thời gian. Chúng là chỉ số không đồng nhất toàn cục (global inhomogeneity − GI) (14), trung tâm thông khí (center of ventilation − CoV), (15) và độ lệch chuẩn của thông khí trì hoãn thông khí khu vực (standard deviation of regional ventilation delayed ventilation − RVDSD) (16).
Quá trình tái tạo dữ liệu được thực hiện bằng phương pháp tái tạo Draeger thông qua Công cụ phân tích dữ liệu Draeger EIT (phiên bản 63, Dräger Medical, Lübeck, Đức) và dữ liệu được phân tích bằng phần mềm tùy chỉnh sử dụng Matlab (The Math-Works, Natick, MA, United States).
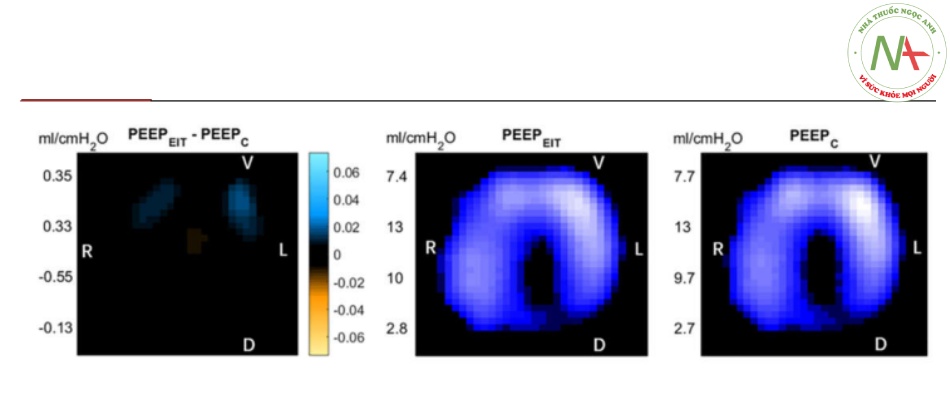
Hình 1 Bên trái: Sau khi chuẩn độ áp lực dương cuối thì thở ra (PEEP) bằng hai phương pháp, sự khác biệt của trở kháng điện được hiển thị trên sơ đồ chụp cắt lớp trở kháng điện (EIT). Màu xanh lam: tăng độ giãn nở; Cam: mất độ giãn nở. Giữa: PEEP chuẩn độ theo phương pháp độ giãn nở khu vực. Bên phải: PEEP được chuẩn độ theo độ giãn nở của hệ thống hô hấp động toàn cục. R, phải; L, trái; V, bụng; D, lưng
Phân tích thống kê
Dữ liệu độ giãn nở phân phối bình thường được trình bày dưới dạng trung bình ± SD. Các tham số giám sát giữa hai phương pháp được so sánh với t-test mẫu ghép đôi. Dữ liệu không được phân phối thông thường được biểu thị bằng trung vị (phạm vi liên vùng) và được so sánh với thử nghiệm Wilcoxon signed-rank test. Gói phần mềm SPSS 24.0 (SPSS, Chicago, Illinois, Hoa Kỳ) và phần mềm MedCalc 11.4.3.0 (Mariakel, Bỉ) đã được sử dụng để phân tích thống kê. Các giá trị p thấp hơn 0,05 được coi là có ý nghĩa thống kê. Phương pháp Holm-Bonferroni được sử dụng để điều chỉnh mức ý nghĩa cho nhiều lần so sánh.
Kết quả
Năm 2020, khoa chúng tôi có 312 bệnh nhi thở máy. Trong số đó, chỉ có 54 bệnh nhân mắc pARDS và chỉ 17 bệnh nhân ở mức độ trung bình đến nặng. Chúng tôi đã minh họa quy trình đăng ký bệnh nhân bằng sơ đồ sau (Hình 2).
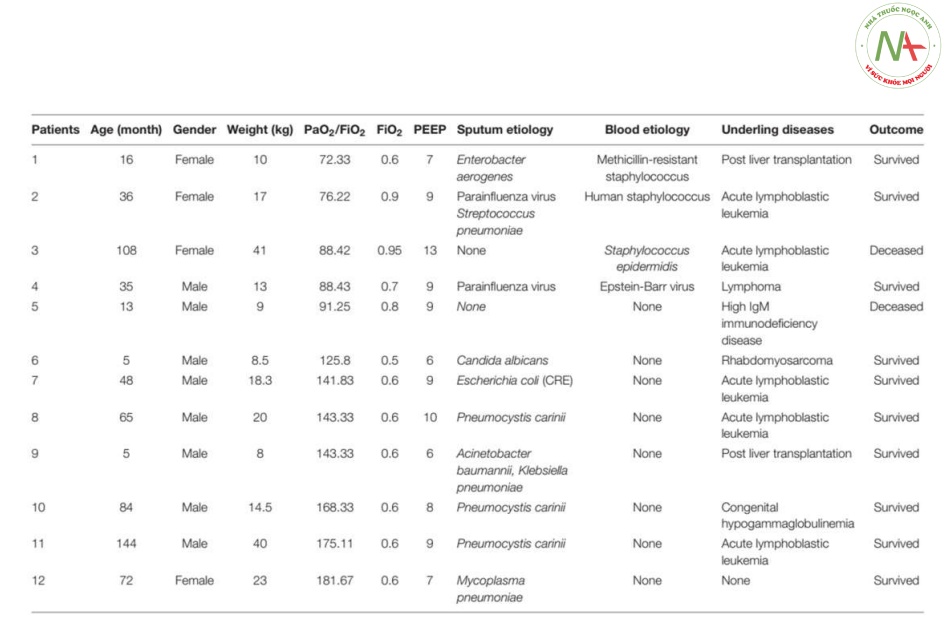
Chúng tôi bao gồm tổng cộng 12 trẻ mắc pARDS, trong đó có 5 trẻ mắc pARDS nặng và 7 trẻ mắc pARDS trung bình. Các đặc điểm lâm sàng của 12 trẻ được trình bày trong Bảng 1.
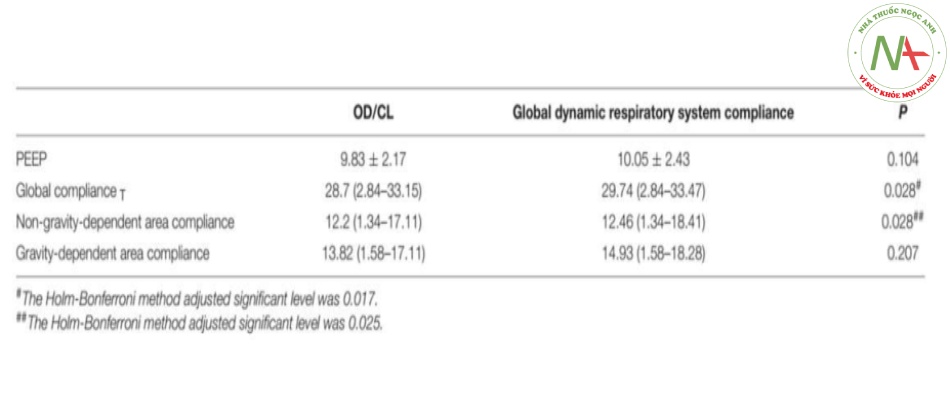
Không có sự khác biệt về độ độ giãn nở toàn cục ở PEEPC và ở PEEPEIT [28,7 (2,84– 33,15) so với 29,74 (2,84–33,47)] ml/cm H2O, p = 0,028 (phương pháp Holm-Bonferroni đã điều chỉnh mức ý nghĩa là 0,017). Không có sự khác biệt nào được tìm thấy ở khu vực không phụ thuộc (p = 0,028 mức điều chỉnh 0,025) và khu vực phụ thuộc vào trọng lực (p = 0,207) (Bảng 2).
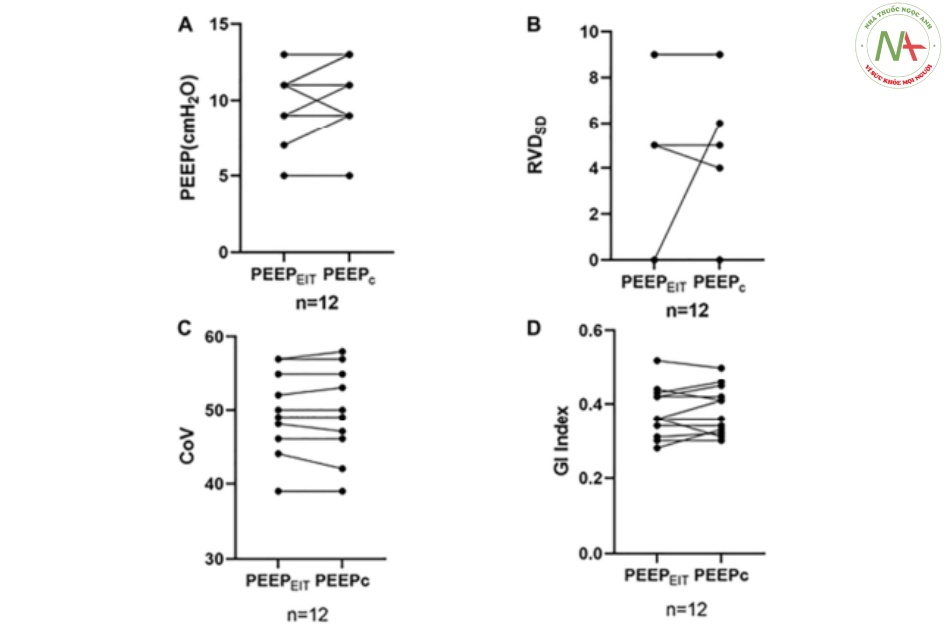
Không tìm thấy sự khác biệt về RVDSD, GI và CoV giữa PEEPEIT và PEEPC (RVDSD: 2,33 ± 3,65 so với 2,75 ± 3,67, p = 0,435; GI: 0,378 ± 0,693 so với 0,384 ± 0,663, p = 0,522; CoV: 48,75 ± 6,09 so với 48,67 ± 6,45, p = 0,723) (Hình 3).
Bảng 1. Đặc điểm lâm sàng của 12 trẻ mắc pARDS.
Bảng 2. So sánh giữa độ giãn nở toàn cục và độ giãn nở khu vực tại PEEPEIT và PEEPC.
Thảo luận
Trong nghiên cứu hiện tại, chúng tôi đã so sánh PEEP được chọn với Crs toàn cục tối đa và phương pháp Crs khu vực dựa trên EIT trong pARDS. Các mức PEEP được chọn với hai phương pháp này không khác nhau. Cả Crs toàn cục và khu vực cũng như phân bố thông khí theo không gian và thời gian đều có thể so sánh được. PEEP được chọn với Crs tốt nhất có thể không thua kém so với PEEP hướng dẫn bằng EIT về thông khí khu vực. Khi không có Crs khu vực, Crs toàn cục có thể là một đại diện thực tế để hướng dẫn chuẩn độ PEEP.
Hình 3 (A) Không có sự khác biệt nào được tìm thấy ở PEEP giữa PEEPEIT và PEEPC. (B) Không tìm thấy sự khác biệt về độ lệch chuẩn của thông khí trì hoãn khu vực (RVDSD) giữa PEEPEIT và PEEPC. (C) Không tìm thấy sự khác biệt về CoV giữa PEEPEIT và PEEPC. và (D) Không có sự khác biệt nào được tìm thấy trong Chỉ số GI giữa PEEPEIT và PEEPC.
Phương pháp chuẩn độ PEEP truyền thống dựa trên các tham số của các tham số chung, bao gồm các điểm uốn của đường cong PV trong vòng lặp PV và kết quả phân tích khí máu tối ưu (PaO2, PaCO2 và tỷ lệ khoảng chết) (13, 17). Phương pháp quét chụp cắt lớp vi tính có thể cung cấp thông tin khu vực (18) nhưng không thực tế do nhu cầu vận chuyển bệnh nhân và tiếp xúc với bức xạ. Chuẩn độ PEEP với chuẩn độ áp lực phổi qua thực quản có thể hứa hẹn. Tuy nhiên, trong một nghiên cứu trên 200 bệnh nhân mắc ARDS từ trung bình đến nặng, Beitler và cộng sự (19) nhận thấy rằng, khi so sánh với PEEP-FiO2 theo kinh nghiệm, phương pháp PEEP tối ưu bằng chuẩn độ áp lực phổi qua thực quản không cải thiện tiên lượng (p =0,88) và thời gian thở máy (p =0,85). Nghiên cứu này cho thấy do tính không đồng nhất của các tổn thương ARDS, các thông số chỉ phản ánh thông khí phổi toàn thể có thể không đại diện cho các tổn thương phổi khu vực. Giá trị PEEP tối ưu không chỉ khác nhau trước và sau chấn thương phổi mà còn khác nhau giữa vùng lưng và vùng bụng. Do đó, cần phải theo dõi độ giãn nở của các khu vực khác nhau. EIT cung cấp thông tin về thông khí khu vực ở đầu giường. Costa và cộng sự (12) và Meier và cộng sự (20) đã báo cáo rằng EIT có thể được sử dụng để giám sát độ giãn nở của khu vực. Lowhagen và cộng sự (21) đã đề xuất cái gọi là “phân phối khí theo chu kỳ thở”, phân chia tác động theo chu kỳ thở trong khu vực thành tám phần đồng thể tích, để xác định những thay đổi theo chu kỳ thở và căng quá mức ở các vùng phổi. Zhao và cộng sự (22) đã báo cáo giá trị độ giãn nở và chỉ số oxy hóa (PaO2/FiO2) tốt hơn ở những bệnh nhân mắc ARDS mà PEEP được chuẩn độ theo phương pháp OD/CL so với những người được chuẩn độ bằng PEEP sử dụng đường cong PV. Họ cũng kết luận rằng nếu dân số nghiên cứu tăng gấp đôi và tỷ lệ tử vong giữa các nhóm không thay đổi, thì tỷ lệ tử vong của nhóm PEEP được chuẩn độ theo mức độ độ giãn nở của khu vực sẽ thấp hơn đáng kể. Gần đây, Hsu và cộng sự (9) và He và cộng sự (10) đã báo cáo rằng PEEP được chuẩn độ bởi Crs khu vực phương pháp này có thể làm giảm tỷ lệ tử vong khi so sánh với các phương pháp truyền thống ở bệnh nhân trưởng thành mắc ARDS.
Mặc dù pARDS và ARDS người lớn có chung đặc điểm bệnh lý và sinh lý bệnh, nhưng dữ liệu của các nghiên cứu lâm sàng ARDS người lớn không phải lúc nào cũng áp dụng được cho pARDS. Bệnh nhi và bệnh nhân người lớn khác nhau ít nhất ở các khía cạnh sau: (1) định nghĩa về pARDS trong PALICC khác với ARDS người lớn theo định nghĩa của Berlin: (a) định nghĩa về pARDS loại bỏ yêu cầu thâm nhiễm hai bên trong chụp ảnh ngực; (b) sử dụng chỉ số oxygen hóa (oxygenation index − OI) và chỉ số độ bão hòa oxy (oxygen saturation index − OSI) thay cho tỷ lệ PaO2/FiO2 với mức PEEP tối thiểu; (c) pARDS được xác định cho những trẻ đặc biệt mắc bệnh phổi mãn tính hoặc bệnh tim bẩm sinh tím tái (23). (2) So với ARDS người lớn, định nghĩa pARDS có yêu cầu thấp hơn đối với các thông số cơ học hô hấp. Lấy độ giãn nở làm ví dụ, độ đàn hồi của thành ngực ở trẻ em giảm đáng kể và các thành phần elastin và collagen của phổi thay đổi theo tuổi tác (24). Ngoài ra, không thể tính toán chính xác độ giãn nở của hệ hô hấp vì thể tích khí lưu thông đến phổi không được đo chính xác ở trẻ em: (a) có sự rò rỉ không khí nghiêm trọng xung quanh ống nội khí quản, điều này có thể được giảm thiểu ở những bệnh nhân mắc bệnh pARDS nặng do ống nội khí quản có bóng chèn; (b) số đo cân nặng lý tưởng của trẻ phức tạp hơn, đặc biệt là những trẻ bị vẹo cột sống nặng; (c) thiết bị và vị trí của thiết bị (đường thở gần so với tại máy thở) để đo thể tích khí lưu thông có thể dẫn đến các giá trị khác nhau cho thể tích khí lưu thông, dựa trên loại máy thở, bộ dây máy thở được sử dụng, mức độ độ giãn nở của bệnh nhân, mức độ độ giãn nở của ống, và kích thước của bệnh nhân. Vì những lý do này, PALICC không khuyến nghị sử dụng độ giãn nở trong định nghĩa của pARDS. (3) Có một số nghiên cứu tiến cứu về mức PEEP tối ưu của pARDS, dẫn đến không có phương pháp khuyến nghị thống nhất để chuẩn độ PEEP trong điều trị pARDS bằng thở máy. Nguy cơ PEEP cao có thể liên quan đến kết quả bất lợi của tương tác tim phổi do độ đàn hồi của thành ngực thấp ở trẻ em hoặc trẻ sơ sinh (25, 26). Khemani và cộng sự (27) đã báo cáo rằng cài đặt PEEP thấp hơn cài đặt PEEP khuyến nghị của ARDSNet sẽ làm tăng tỷ lệ tử vong của pARDS. Nghiên cứu từ Khemani và cộng sự xác nhận rằng PEEP có liên quan độc lập với tỷ lệ tử vong của pARDS và chỉ ra rõ ràng sự cần thiết của nghiên cứu tiền cứu về việc tối ưu hóa PEEP trong pARDS.
Do tính độc đáo của trẻ em và những hạn chế của các công cụ giám sát, những phát hiện nêu trên ở ARDS người lớn có thể không được áp dụng trực tiếp cho pARDS. Các điện cực dành cho trẻ em của EIT vẫn đang được phát triển. Vì Crs toàn cục được theo dõi trong toàn bộ thời gian thở máy, nên nó có thể được sử dụng để chuẩn độ PEEP khi không có EIT.
Cần lưu ý rằng độ giãn nở hô hấp động toàn cục được sử dụng trong nghiên cứu của chúng tôi có thể khác với độ giãn nở tĩnh được đo trong quá trình kiểm soát thể tích và giữ thì hít vào. Stahl và cộng sự (28) gợi ý rằng việc áp dụng cơ học hô hấp động như một công cụ chẩn đoán ở bệnh nhân thở máy sẽ phù hợp hơn so với sử dụng cơ học phổi tĩnh.
Một số nghiên cứu đã báo cáo rằng có mối tương quan giữa phương pháp OD/CL và phương pháp độ giãn nở hệ thống hô hấp toàn cục. Su và cộng sự (29) cho thấy ở 18 bệnh nhân mắc ARDS rằng trong quá trình giảm PEEP, PEEP được chuẩn độ bằng phương pháp OD/CL tương quan với PEEP được chọn để hệ hô hấp độ giãn nở tốt nhất. Trong một nghiên cứu trên động vật, Bikker và cộng sự (30) đã tìm thấy mối tương quan giữa PEEP tối ưu dựa trên độ giãn nở EIT khu vực và PEEP được chuẩn độ theo độ giãn nở toàn cục trong tám mô hình ALI của lợn do axit oleic gây ra. Ngoài ra, Puel và cộng sự (31) đã báo cáo rằng ở những bệnh nhân mắc ARDS nặng trải qua quá trình oxy hóa qua màng ngoài cơ thể tĩnh mạch-tĩnh mạch (VV ECMO), OD/CL phù hợp với mức độ độ giãn nở PEEP (PEEPcomp) được chuẩn độ theo mức độ độ giãn nở toàn cục. Tuy nhiên, dựa trên thực tế là OD có hại cho bệnh nhân hơn CL, một số nhà nghiên cứu đã sửa đổi sơ đồ cân bằng OD/CL và đề xuất “OD/CL15” cho phép 15% CL. Định nghĩa tỷ lệ giảm thiểu OD phế nang (32, 33). OD/CL15 dẫn đến giảm PEEP tối ưu và tăng nguy cơ xẹp phổi. Franchineau và cộng sự (34) đã kiểm tra 15 bệnh nhân mắc ARDS và phát hiện ra rằng PEEP tối ưu được đặt theo OD/CL 15 khác với PEEP được ước tính bởi độ giãn nở tối ưu của phổi. Nó cho thấy rằng chuẩn độ PEEP dựa trên EIT không chỉ xem xét mức độ độ giãn nở toàn cục mà còn cân bằng giữa căng quá mức và xẹp phổi ở các khu vực khác nhau, trong khi chuẩn độ PEEP theo mức độ giãn nở tối ưu toàn cục có thể không đại diện cho các thông số thông khí tối ưu của máy thở.
Trong nghiên cứu hiện tại, chúng tôi đã đánh giá ba tham số dựa trên EIT để đánh giá sự phân bố thông khí theo không gian và khu vực, đó là các chỉ số GI, CoV và RVDSD. Frerichs và cộng sự (35) báo cáo rằng trong hội chứng suy hô hấp ở trẻ sơ sinh (NRDS), việc sử dụng chất hoạt động bề mặt phổi có thể chuyển CoV của trẻ từ khu vực không phụ thuộc vào trọng lực sang khu vực phụ thuộc vào trọng lực. Một nghiên cứu khác cho thấy sự khác biệt đáng kể giữa PEEP được đo theo GI và giá trị được khuyến nghị theo hướng dẫn của ARDSnet và giá trị PEEP không tương quan với PaO2/FiO2 (36). RVD có thể tiết lộ mức độ huy động theo chu kỳ thở nếu PEEP không đủ (16). Nó cũng có thể được sử dụng để đánh giá hoạt động của cơ hoành trong quá trình kiểm tra hơi thở tự nhiên (37).
Trong nghiên cứu hiện tại, không tìm thấy sự khác biệt đáng kể nào về CoV, GI hoặc RVDSD giữa PEEPEIT và PEEPC, điều này cho thấy rằng sự không đồng nhất về thông khí của pARDS có thể không lớn bằng của ARDS người trưởng thành.
Kết quả nghiên cứu này có một số hạn chế. Đầu tiên, kích thước mẫu rất nhỏ đã hạn chế các kết luận. Sự khác biệt lớn về độ tuổi (từ 5 đến 144 tháng) và do đó chiều cao cơ thể có thể là một hạn chế lớn khác của nghiên cứu này. Karsten và cộng sự (38) cho thấy tính khả dụng và tính hợp lý của phép đo EIT trên lâm sàng phụ thuộc vào vị trí đai thích hợp, trực quan hóa trở kháng, phân tích chính xác và diễn giải dữ liệu. Khi EIT được sử dụng để ước tính các thông số tổng thể, chẳng hạn như thể tích khí lưu thông hoặc thay đổi thể tích phổi cuối thì thở ra, mặt phẳng điện cực tối ưu nằm giữa khoang liên sườn thứ 4 và thứ 5. Trong nghiên cứu của chúng tôi, do độ tuổi và cân nặng của trẻ khác nhau nên đai EIT được đặt đồng đều ở đường nối ngang núm vú. Brabant và cộng sự (39) cho thấy tỷ lệ thể tích-trở kháng (volume-impedance ratio) có thể khác nhau tùy thuộc vào các mức PEEP. Để đảm bảo rằng vị trí đai là phù hợp và tỷ lệ thể tích-trở kháng phụ thuộc vào PEEP không ảnh hưởng đáng kể đến kết quả, trước tiên chúng tôi đánh giá xem tỷ lệ thể tích-trở kháng ở các PEEP khác nhau có khác nhau đáng kể hay không. Với việc định vị đai phù hợp, không tìm thấy sự khác biệt về tỷ lệ thể tích-trở kháng ở các mức PEEP khác nhau. Sau đó, tỷ lệ trung bình của tỷ lệ thể tích-trở kháng ở tất cả PEEP đã được sử dụng. Bikker và cộng sự. (40) cho thấy rằng sự dịch chuyển đầu-đuôi gây ra của mô phổi có thể làm thay đổi tỷ lệ phổi được giữ lại trong vùng nhạy cảm EIT ở bệnh nhân trưởng thành mắc ARDS. Trong nghiên cứu của chúng tôi, tác động của việc dịch chuyển đầu-đuôi do PEEP gây ra thậm chí có thể rõ rệt hơn ở những bệnh nhân có phổi nhỏ hơn (ví dụ: 4 tháng) so với trẻ lớn hơn/cao hơn. Kích thước mẫu nhỏ và sự thay đổi lớn về kích thước phổi trong đoàn hệ này có thể dẫn đến kết quả không đáng kể. Theo kết quả nghiên cứu hiện tại, các thử nghiệm lâm sàng trong tương lai nên tập trung vào việc tăng số ca mắc pARDS, khám phá EIT về thông khí toàn cục và khu vực của pARDS, đồng thời hướng dẫn triển khai chiến lược thông khí bảo vệ phổi của pARDS.
Kết luận
Trong quá trình điều trị thông khí bảo vệ phổi ở pARDS từ trung bình đến nặng, mặc dù EIT cung cấp thông tin về phân phối thông khí, PEEP được chọn với Crs tốt nhất có thể không thua kém so với điều trị do EIT hướng dẫn về thông khí khu vực ở pARDS từ trung bình đến nặng. EIT có thể theo dõi độ giãn nở của khu vực phổi và nâng cao hiểu biết về thông khí bảo vệ phổi pARDS bằng cách theo dõi GI, CoV, RVD và các thông số khác. Nhiều bệnh nhân hơn nên được đưa vào các thử nghiệm lâm sàng lớn hơn, có thể là đa trung tâm trong tương lai để khám phá hiệu quả lâm sàng của EIT đối với thông khí bảo vệ phổi trong pARDS
References
- Pediatric Acute Lung Injury Consensus Conference Group [PALICCG]. Pediatric acute respiratory distress syndrome: consensus recommendations from the Pediatric Acute Lung Injury Consensus Pediatr Crit Care Med. (2015) 16:428–39. doi: 10.1097/PCC.0000000000000350
- Cheifetz Pediatric ARDS. Respir Care. (2017) 62:718–31. doi: 10.4187/respcare.05591
- Terragni PP, Rosboch G, Tealdi A, Corno E, Menaldo E, Davini O, et Tidal hyperinflation during low tidal volume ventilation in acute respiratory distress syndrome. Am J Respir Crit Care Med. (2007) 175:160–6. doi: 10.1164/rccm.200607-915OC
- Vieillard-Baron A, Price LC, Matthay Acute cor pulmonale in ARDS. Intensive Care Med. (2013) 39:1836–8. doi: 10.1007/s00134-013-3045-2
- Frerichs I, Amato MB, van Kaam AH, Tingay DG, Zhao Z, Grychtol B, et Chest electrical impedance tomography examination, data analysis, terminology, clinical use and recommendations: consensus statement of the TRanslational EIT development study group. Thorax. (2017) 72:83–93. doi: 10.1136/thoraxjnl-2016-208357
- Kobylianskii J, Murray A, Brace D, Goligher E, Fan Electrical impedance tomography in adult patients undergoing mechanical ventilation: a systematic review. J Crit Care. (2016) 35:33–50. doi: 10.1016/j.jcrc.2016.04.028
- Maciejewski D, Putowski Z, Czok M, Krzych ŁJ. Electrical impedance tomography as a tool for monitoring mechanical ventilation. An introduction to the technique. Adv Med Sci. (2021) 66:388–95. doi: 10.1016/j.advms.2021.07.010
- Bachmann MC, Morais C, Bugedo G, Bruhn A, Morales A, Borges JB, et Electrical impedance tomography in acute respiratory distress syndrome. Crit Care. (2018) 22:263. doi: 10.1186/s13054-018-2195-6
- Hsu HJ, Chang HT, Zhao Z, Wang PH, Zhang JH, Chen YS, et Positive end-expiratory pressure titration with electrical impedance tomography and pressure-volume curve: a randomized trial in moderate to severe ARDS. Physiol Meas. (2021) 42:014002. doi: 10.1088/1361-6579/abd679
- He H, Chi Y, Yang Y, Yuan S, Long Y, Zhao P, et Early individualized positive end-expiratory pressure guided by electrical impedance tomography in acute respiratory distress syndrome: a randomized controlled clinical trial. Crit Care. (2021) 25:230. doi: 10.1186/s13054-021-03645-y
- Rosemeier I, Reiter K, Obermeier V, Wolf Mechanical ventilation guided by electrical impedance tomography in children with acute lung injury. Crit Care Explor. (2019) 1:e0020. doi: 10.1097/CCE.0000000000000020
- Costa EL, Borges JB, Melo A, Suarez-Sipmann F, Toufen C , Bohm SH, et al. Bedside estimation of recruitable alveolar collapse and hyperdistension by electrical impedance tomography. Intensive Care Med. (2009) 35:1132–7. doi: 10.1007/s00134-009-1447-y
- Suarez-Sipmann F, Böhm SH, Tusman G, Pesch T, Thamm O, Reissmann H, et Use of dynamic compliance for open lung positive end-expiratory pressure titration in an experimental study. Crit Care Med. (2007) 35:214–21. doi: 10.1097/01
- Zhao Z, Möller K, Steinmann D, Frerichs I, Guttmann Evaluation of an electrical impedance tomography-based Global Inhomogeneity Index for pulmonary ventilation distribution. Intensive Care Med. (2009) 35:1900–6. doi: 10.1007/s00134-009-1589-y
- Auer U, Schramel JP, Moens YP, Mosing M, Braun C. Monitoring perioperative changes in distribution of pulmonary ventilation by functional electrical impedance tomography. Acta Anaesthesiol Scand. (1998) 42:721–6. doi: 1111/j.1399-6576.1998.tb05308.x
- Muders T, Luepschen H, Zinserling J, Greschus S, Fimmers R, Guenther U, et Tidal recruitment assessed by electrical impedance tomography and computed tomography in a porcine model of lung injury*. Crit Care Med. (2012) 40:903–11. doi: 10.1097/CCM.0b013e318236f452
- Maisch S, Reissmann H, Fuellekrug B, Weismann D, Rutkowski T, Tusman G, et Compliance and dead space fraction indicate an optimal level of positive end-expiratory pressure after recruitment in anesthetized patients. Anesth Analg. (2008) 106:175–81. doi: 10.1213/01.ane.0000287684.74505.49
- Gattinoni L, Caironi P, Cressoni M, Chiumello D, Ranieri VM, Quintel M, et Lung recruitment in patients with the acute respiratory distress syndrome. N Engl J Med. (2006) 354:1775–86. doi: 10.1056/NEJMoa052052
- Beitler JR, Sarge T, Banner-Goodspeed VM, Gong MN, Cook D, Novack V, et Effect of Titrating Positive End- Expiratory Pressure (PEEP) with an esophageal pressure-guided strategy vs an empirical high PEEP-FiO2 strategy on death and days free from mechanical ventilation among patients with acute respiratory distress syndrome: a randomized clinical trial. JAMA. (2019) 321:846–57. doi: 10.1001/jama.2019.0555
- Meier T, Luepschen H, Karsten J, Leibecke T, Grossherr M, Gehring H, et al. Assessment of regional lung recruitment and derecruitment during a PEEP trial based on electrical impedance tomography. Intensive Care Med. (2008) 34:543–50. doi: 1007/s00134-007-0786-9
- Lowhagen K, Lundin S, Stenqvist Regional intratidal gas distribution in acute lung injury and acute respiratory distress syndrome assessed by electric impedance tomography. Minerva Anestesiol. (2010) 76:1024– 35.
- Zhao Z, Chang MY, Chang MY, Gow CH, Zhang JH, Hsu YL, et Positive end-expiratory pressure titration with electrical impedance tomography and pressure-volume curve in severe acute respiratory distress syndrome. Ann Intensive Care. (2019) 9:7. doi: 10.1186/s13613-019-0484-0
- Khemani RG, Smith LS, Zimmerman JJ, Erickson S Pediatric Acute Lung Injury Consensus Conference Pediatric acute respiratory distress syndrome: definition, incidence, and epidemiology: proceedings from the Pediatric Acute Lung Injury Consensus Conference. Pediatr Crit Care Med. (2015) 16:S23–40. doi: 10.1097/PCC.0000000000000432
- Kneyber MC, Zhang H, Slutsky Ventilator-induced lung injury. Similarity and differences between children and adults. Am J Respir Crit Care Med. (2014) 190:258–65. doi: 10.1164/rccm.201401-0168CP
- Khemani RG, Newth The design of future pediatric mechanical ventilation trials for acute lung injury. Am J Respir Crit Care Med. (2010) 182:1465–74. doi: 10.1164/rccm.201004-0606CI
- Ingaramo OA, Ngo T, Khemani RG, Newth Impact of positive end-expiratory pressure on cardiac index measured by ultrasound cardiac output monitor. Pediatr Crit Care Med. (2014) 15:15–20. doi: 10.1097/PCC.0b013e3182976251
- Khemani RG, Parvathaneni K, Yehya N, Bhalla AK, Thomas NJ, Newth Positive end-expiratory pressure lower than the ARDS network protocol is associated with higher pediatric acute respiratory distress syndrome mortality. Am J Respir Crit Care Med. (2018) 198:77–89. doi: 10.1164/rccm.201707-1404OC
- Stahl CA, Möller K, Schumann S, Kuhlen R, Sydow M, Putensen C, et Dynamic versus static respiratory mechanics in acute lung injury and acute respiratory distress syndrome. Crit Care Med. (2006) 34:2090–8.
- Su PL, Lin WC, Ko YF, Su PF, Chen CW. Positive end-expiratory pressure selection based on best respiratory system compliance or collapse/hyperdistension curves in patients with acute respiratory distress syndrome: lack of correlation with alveolar Intensive Care Med. (2018) 44:389–91. doi: 10.1007/s00134-017-5022-7
- Bikker IG, Blankman P, Specht P, Bakker J, Gommers Global and regional parameters to visualize the ‘best’ PEEP during a PEEP trial in a porcine model with and without acute lung injury. Minerva Anestesiol. (2013) 79:983–92.
- Puel F, Crognier L, Soulé C, Vardon-Bounes F, Ruiz S, Seguin T, et al. Assessment of electrical impedance tomography to set optimal positive end-expiratory pressure for veno-venous ECMO-treated severe ARDS patients. J Crit (2020) 60:38–44. doi: 10.1016/j.jcrc.2020.06.017
- Pelosi P, Rocco PRM, Gama de Abreu Close down the lungs and keep them resting to minimize ventilator- induced lung injury. Crit Care. (2018) 22:72. doi: 10.1186/s13054-018-1991-3
- Gibot S, Conrad M, Courte G, Cravoisy Electrical impedance tomography for positive end-expiratory pressure titration in COVID-19-related acute respiratory distress syndrome. Am J Respir Crit Care Med. (2020) 202:280–4. doi: 10.1164/rccm.202003-0816LE
- Franchineau G, Bréchot N, Lebreton G, Hekimian G, Nieszkowska A, Trouillet JL, et Bedside contribution of electrical impedance tomography to setting positive end-expiratory pressure for extracorporeal membrane oxygenation-treated patients with severe acute respiratory distress syndrome. Am J Respir Crit Care Med. (2017) 196:447–57. doi: 10.1164/rccm.201605-1055OC
- Frerichs I, Dargaville PA, van Genderingen H, Morel DR, Rimensberger Lung volume recruitment after surfactant administration modifies spatial distribution of ventilation. Am J Respir Crit Care Med. (2006) 174:772–9. doi: 10.1164/rccm.200512-1942OC
- Hochhausen N, Biener I, Rossaint R, Follmann A, Bleilevens C, Braunschweig T, et Optimizing PEEP by electrical impedance tomography in a porcine animal model of ARDS. Respir Care. (2017) 62:340–9. doi: 10.4187/respcare.05060
- Bickenbach J, Czaplik M, Polier M, Marx G, Marx N, Dreher Electrical impedance tomography for predicting failure of spontaneous breathing trials in patients with prolonged weaning. Crit Care. (2017) 21:177. doi: 10.1186/s13054-017-1758-2
- Karsten J, Stueber T, Voigt N, Teschner E, Heinze Influence of different electrode belt positions on electrical impedance tomography imaging of regional ventilation: a prospective observational study. Crit Care. (2016) 20:3. doi: 10.1186/s13054-015-1161-9
- Brabant O, Crivellari B, Hosgood G, Raisis A, Waldmann AD, Auer U, et Effects of PEEP on the relationship between tidal volume and total impedance change measured via electrical impedance tomography (EIT). J Clin Monit Comput. (2021) 25:1–10. doi: 10.1007/s10877-021-00651-x
- Bikker IG, Preis C, Egal M, Bakker J, Gommers Electrical impedance tomography measured at two thoracic levels can visualize the ventilation distribution changes at the bedside during a decremental positive end- expiratory lung pressure trial. Crit Care. (2011) 15:R193. doi: 10.1186/cc10354