Kỹ thuật y khoa
So sánh các kỹ thuật khác nhau của cấy ghép mỡ
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Chương 9: So sánh các kỹ thuật khác nhau của cấy ghép mỡ
Tác giả: Dr.Mario Goisis, Sara Izzo, AndreaSbarbati, Giamaica Conti và Giovanni Francesco Nicoletti
Nguồn sách: Sách: Quy trình PRP và Tiêm cấy mỡ nâng cao -Tác giả: Dr: Mario Goisis
Tính tích hợp của các tế bào tạo mỡ
Ghép có số lượng tế bào mỡ nguyên vẹn lớn nhất sẽ có cơ hội bền lâu dài nhất.Chất lượng của quy trình ghép có thể được đánh giá theo nhiều quan điểm.Điểm đầu tiên là đảm bảo duy trì tính toàn vẹn và khả năng sống sót của tế bào mỡ được chuyển giao. Yếu tố này được Peer nhấn mạnh lần đầu tiên trong tác phẩm mang tính bước ngoặt của ông vào năm 1955, và lý thuyết của ông được gọi là “lý thuyết tồn tại của tế bào”. Theo lý thuyết này, mảnh ghép với số lượng tế bào mỡ nguyên vẹn nhất sẽ có cơ hội bền lâu dài nhất [1].Nhiều sự kiện xảy ra trong quá trình thu hoạch, xử lý và tiêm chất béo có thể phá vỡ các tế bào mỡ. Ví dụ, nó là bắt buộc để tránh có quá nhiều áp suất âm.
Đặc biệt, về ảnh hưởng của điều này đối với việc ghép mỡ, nhiều tác giả đã báo cáo rằng một lượng lớn sự phá hủy tế bào đã xảy ra khi áp suất âm vượt quá 700 mmHg. [2–4].Mặc dù vậy, để bảo tồn các tế bào mỡ, điều quan trọng là phải áp dụng một mức độ lực đứt gãy thấp.


Lực đứt gãy xảy ra khi một lực tác dụng song song với một bề mặt, bất chấp lực vuông góc chịu tác dụng của nó. Ví dụ: cọ xát hai bàn tay của một người với nhau gây ra lực đứt gãy, trong khi áp hai lòng bàn tay của một người vào nhau thì không.Đối với quá trình làm đầy mỡ, lực đứt gãy được áp dụng cho chất béo khi nó được đẩy qua các ống, giống như các cannula dùng để thu hoạch hoặc để tiêm.
Là một vật liệu dẻo, chất béo trải qua quá trình cắt mỏng. Điều này đơn giản có nghĩa là khi lực đứt gãy tăng lên, độ nhớt của vật liệu giảm.Một số vật liệu cắt mỏng có thể “tự phục hồi”, nghĩa là chúng phục hồi hoàn toàn độ nhớt ban đầu sau khi tiếp xúc với các lực như lực đứt gãy hoặc áp suất âm.Đây không phải là trường hợp của chất béo.
Trên thực tế, việc chất béo tiếp xúc với lực đứt gãy cao hoặc áp suất âm sẽ dẫn đến hư hỏng không thể phục hồi và tính toàn vẹn cơ học của chất béo không thể phục hồi hoàn toàn sau thiệt hại này.Để đánh giá lực đứt gãy được áp dụng bằng các phương pháp khác nhau, chúng tôi đo độ nhớt của mô sau khi thu hoạch, sau khi xử lý và sau khi tiêm.Mục đích của các quy trình khác nhau là làm giảm độ nhớt càng ít càng tốt trong tất cả các bước ghép mỡ.Ở đây, một máy đo động học được sử dụng để đo mô-đun lưu trữ và lực đứt gãy mà tại đó các mô bắt đầu mất các đặc tính giống như rắn của chúng (Hình 9.5).
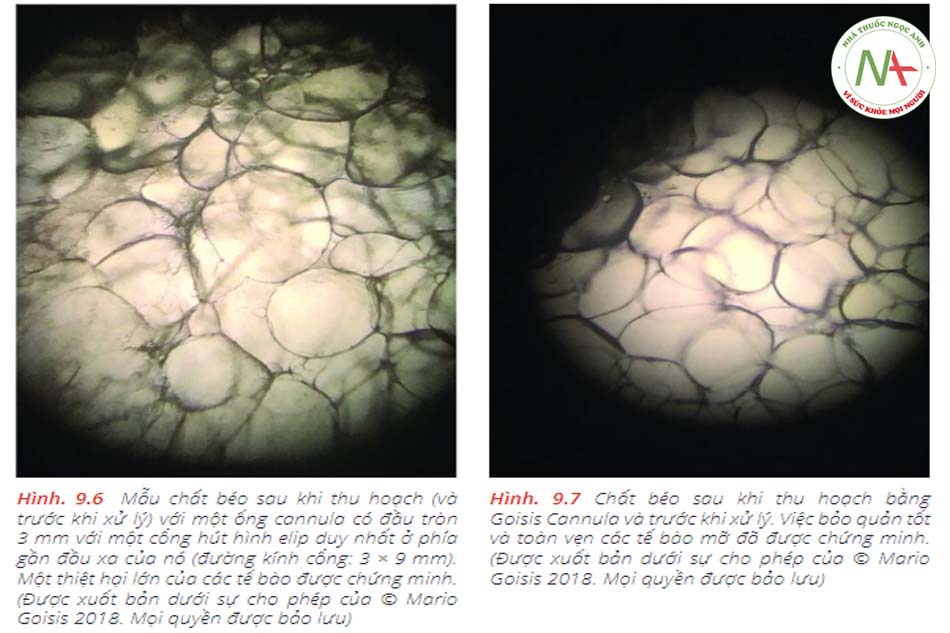
Độ nhớt cũng được đo lường và các đặc tính chung của các nhóm xử lý được đánh giá định tính bằng thử nghiệm lam kính (Hình 9.6 và 9.7).Mặc dù vậy, các mẫu mô mỡ được thu thập từ mỗi phương pháp đã được chuẩn bị để đánh giá bằng kính hiển vi bằng cách trải mô lên các lam kính hiển vi. Các mẫu được quan sát về sự hiện diện của lipid tự do và các tế bào máu. Hình ảnh mô tả được chụp ở độ phóng đại 100 bằng máy ảnh kỹ thuật số (Hình 9.8, 9.9 và 9.10
Phương pháp
Các mẫu hút mỡ được lấy từ 10 người hiến tặng khỏe mạnh sau khi có sự đồng ý đã được thông báo, theo hướng dẫn của AeQ (www.microfat.com). Các mẫu hút mẫu được thu bằng các kỹ thuật khác nhau.Độ nhớt của chất béo được thu hoạch bằng các kỹ thuật khác nhau được đo.
Cuối cùng, mỡ hút được đã qua xử lý được đưa qua ống cannula để tiêm. Sau khi đi vào ống này, độ hiển thị của chất béo được thu hoạch, xử lý và tiêm bằng các kỹ thuật khác nhau đã được đo lường.Đặc biệt, một máy đo độ nhớt đã được sử dụng để đo độ lưu trữ và lực đứt gãy tại các mô -được phân tích bắt đầu mất các đặc tính giống rắn của chúng (Hình 9.11).
Độ nhớt cũng được đo và các đặc tính chung của các nhóm xử lý được đánh giá định tính bằng thử nghiệm lam kính (Hình 9.12 và 9.13).Một phần nhỏ của mỗi mẫu được đặt trên một tấm kính phẳng. Sau đó, tấm kính được quay nhanh 60 độ và các mẫu khác nhau được quan sát bằng các hình ảnh tiêu chuẩn thu được bằng máy ảnh Canon kỹ thuật số.

Kết quả
Thu hoạch
Kích thước cổng cannulas ảnh hưởng trực tiếp đến độ nhớt của tế bào mỡ ghép. Đặc biệt, việc sử dụng kích thước cổng lớn hơn làm tăng độ nhớt của mảnh ghép.
Mức áp suất âm cao làm đứt gãy tế bào mỡ: tốt hơn nên sử dụng ống tiêm 10 cc hoặc VacLok để tránh quá áp suất âm.
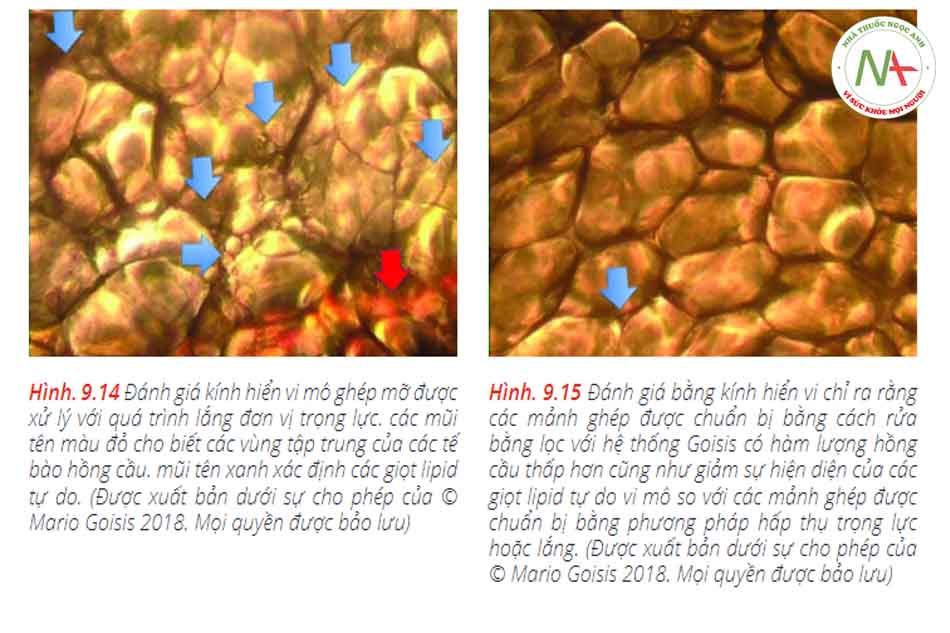
Ống cannula Goisis có liên quan đến việc bảo quản chất béo tốt hơn so với ống cannula có đầu tròn 3 mm với một cổng hút hình elip duy nhất ở phía gần đầu xa của nó (đường kính cổng: 3 × 9 mm) (Hình 9.14 và 9.15).9.1.
Xử lý
Sau khi gạn (Hình 9.16, 9.17 và9.18), lớp dưới của mẫu đã gạn là một mô lỏng có độ nhớt thấp, nhưng màu của nó là đỏ cam vì nó rất giàu tế bào đỏ (Hình 9.19, 9.20, 9.21 , 9.22, 9.23 và 9.24).Sau khi ly tâm, lớp giữa của mẫu ly tâm là một mô đặc có độ nhớt cao, tuy nhiên, rất giàu tế bào mỡ bị phá hủy, không thể sống được (Hình 9,25).Sau khi rửa và lọc, chất béo có độ nhớt rất thấp và màu vàng (Hình 9.26)
Tiêm chích
Tiêm chất béo có độ nhớt cao hoặc trung bình bằng cách sử dụng một ống cannula nhỏ (22 Gauge) làm giảm độ nhớt vì lực đứt gãy cao.Cần tính tổng các cân nhắc này








Loại bỏ các chất ô nhiễm và nước
Việc loại bỏ các chất gây ô nhiễm và nước là rất quan trọng để đánh giá chất lượng của quy trình ghép.
Trên thực tế, mục đích của tất cả các quy trình xử lý chất béo là loại bỏ ra khỏi chất béo các thành phần không thể sống được, tiền viêm và độc hại, bao gồm các tế bào máu, các chất thuốc tê tại chỗ được sử dụng để xâm nhập, tàn dư của các tế bào mỡ bị vỡ, bao gồm các giọt dầu và tế bào mảnh vụn.
Tất cả các thành phần này đều làm hỏng các tế bào mỡ.Hơn nữa, điều quan trọng là phải loại bỏ thành phần nước khỏi chất béo. Nước trộn với chất béo thực sự tạo ra thể tích giả, biến mất ngay sau khi ghép.Để đánh giá việc loại bỏ các chất gây ô nhiễm và nước theo các phương pháp khác nhau, chúng tôi đo mật độ khác nhau của các thành phần sau khi ly tâm.
Phương pháp
Mẫu mỡ hút được lấy từ 10 người hiến tặng khỏe mạnh với sự đồng ý được thông báo, phù hợp với hướng dẫn của AeQ. Tất cả các mẫu mỡ được thu hoạch bằng công nghệ tiêu chuẩn (ống cannula Coleman, ống tiêm 10 cc).
Sau đó mẫu mỡ được xử lý bằng các kỹ thuật khác nhau.Sau khi xử lý, các mẫu từ mỗi phương pháp xử lý ghép được ly tâm ở 400 g trong 6 phút ở nhiệt độ phòng. Sau khi ly tâm, các thành phần có mật độ khác nhau sẽ được đo.
Từ dưới lên trên: một thành phần bao gồm các tế bào gốc và phần mạch đệm, các mảnh vi mạch và chất nền ngoại bào, một lớp chất lỏng nước bao gồm dung dịch gây tê còn lại hoặc dung dịch rửa, mô mỡ, dầu và lớp lipid tự do. Các dữ liệu thể tích của các lớp khác nhau được ghi lại và báo cáo dưới dạng tỷ lệ tương đối của tổng thể tích tiền ly tâm của chúng.
Kết quả
Các mảnh ghép được làm bằng phương pháp lắng trọng lực có giá trị cao nhất hàm lượng nước tương đối, trong khi các mảnh ghép được chuẩn bị bằng cách ly tâm có hàm lượng nước thấp nhất. Các mảnh ghép được chuẩn bị bằng cách sử dụng hệ thống Puregraft và Goisis có mức chất lỏng vừa phải là nước; các mức này thấp hơn đáng kể so với các mức đối chứng và mảnh ghép trọng lực
Mức độ lipid – dầu tự do trong các mảnh ghép được chuẩn bị bằng cách rửa và lọc thấp hơn có ý nghĩa thống kê so với các mảnh ghép đối chứng, ghép trọng lực và ghép được chuẩn bị bằng phương pháp liên hợp. Phân tích các tế bào cho thấy rằng kỹ thuật ly tâm và lắng bằng trọng lực đã loại bỏ khoảng 50% hồng cầu và 60-70% bạch cầu có trong dịch hút ban đầu. Bằng cách ngược lại, rửa bằng lọc bằng hệ thống Goisis và Puregraft đã loại bỏ hơn 95% cả hai loại tế bào máu. Lăn Telfa loại bỏ nước, dầu và các chất bẩn. Tuy nhiên, kỹ thuật này khá lâu và tốn nhiều công sức.Kết quả được thể hiện trong Hình. 9.16–9.18.
Để tránh tiếp xúc trực tiếp giữa chất béo và không khí và giảm nguy cơ ô nhiễm
Không khí có tác động tiêu cực đến các tế bào mỡ, vì các thành phần gây cháy và quá trình oxy hóa sẽ kích hoạt nó. Điều quan trọng là tránh tiếp xúc với không khí [5].Nhiễm trùng là những biến chứng có thể xảy ra khi ghép mỡ. Các phương pháp khép kín được sử dụng để việc xử lý tránh tiếp xúc với chất béo, giảm nguy cơ tiếp xúc với vi khu-ẩn.
Bảo tồn số lượng tế bào gốc mỡ khả thi cao nhất (ASCs)
Để bảo tồn và tập trung số lượng tế bào gốc mô mỡ sống (ASC) cao nhất, điều quan trọng là phải đánh giá chất lượng của mô ghép mỡ. biện pháp phòng ngừa được thông báo bởi “lý thuyết thay thế vật chủ.”Lý thuyết này quy định rằng hầu hết các tế bào mỡ được ghép sẽ chết sau khi tiêm, và chất nền ngoại bào còn lại đóng vai trò như một giá đỡ cho các tế bào thay thế của người cho và người nhận, giúp tái tạo mô
Trong quá trình tái tạo này, ASC đóng một vai trò quan trọng. Do đó, việc lưu giữ nồng độ cao nhất của tế bào gốc mô mỡ (ASCs) được chứng minh để cải thiện khả năng duy trì chất béo, với tiềm năng phát triển của tế bào gốc trung mô có nguồn gốc từ mô mỡ được coi là một yếu tố góp phần chính. [6, 7].
Theo kết quả của Trevisonno và cộng sự, kích thước nhỏ của cannula có thể mang lại lợi thế trong việc giảm thu hoạch chất béo có tổ chức tốt, chủ yếu bao gồm các tế bào mỡ trưởng thành và cải thiện việc thu thập nhiều lớp mô mỡ bề mặt hơn, có liên quan đến tỷ lệ ADSC cao hơn [8].
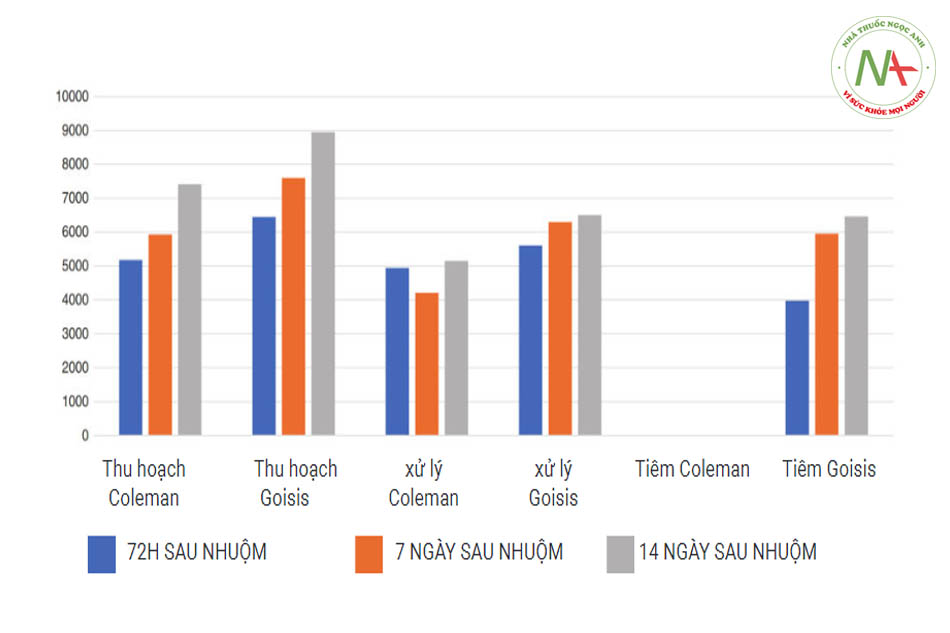
Đặc biệt, họ đã quan sát thấy sự gia tăng gấp 2 lần năng suất phục hồi của tế bào gốc trong chất béo được thu hoạch bằng cách sử dụng ống cannula nhỏ 2 mm (đường kính cổng 1 mm) so với chất béo được thu hoạch bằng ống cannula có đường kính 3 mm (đường kính cổng: 3 × 9 mm). Tầm quan trọng của mọi bước (thu hoạch, xử lý và tiêm) trong việc bảo tồn số lượng tế bào gốc Ad-ipose (ASC) có thể sống cao nhất đã được thảo luận bởi Goisis và cộng sự Imcas 2019 (Goisis và cộng sự, so sánh các giao thức, IMCAS 2019) tế bào gốc của 6 mẫu khác nhau được đo ở 72 giờ, 7 ngày và 14 ngày sau khi thu mẫu. Ba mẫu liên quan đến kỹ thuật
Goisis, với giá trị tế bào gốc cao ngay sau khi thu hoạch bằng Goisis Cannula (6443, 7596, 8950), sau khi xử lý bằng Hệ thống Go-isis (5601, 6300, 6500) và sau khi đi qua ống cannula 22G (3976 (5950, 6460). 3 mẫu cuối cùng có liên quan đến kỹ thuật Coleman với một sửa đổi rất đáng kể: chất béo Coleman được đưa qua ống cannula 22G. Giá trị của các tế bào gốc sau khi thu hoạch bằng can-nula Coleman là 5180, 5930 và 7410. Giá trị sau khi xử lý Coleman (ly tâm) là 4940, 4210 và 5140. Nhưng sau khi đi qua ống 22G, các tế bào gốc đã bị phá hủy bởi mức độ lực đứt gãy cao, với mức xung quanh bằng không.
Đạt được mức hiệu quả tốt
Hiệu quả của phương pháp có thể được đánh giá về thời gian tiêu thụ, chi phí của thủ tục và sự mất chất béo trong quá trình chuẩn bị.Về thời gian tiêu thụ, việc lựa chọn cannu-la thu hoạch rất quan trọng. Thông thường, việc sử dụng các ống cannula nhỏ có cổng nhỏ làm giảm độ nhớt của chất béo thu hoạch nhưng làm tăng thời gian của quy trình. Một ngoại lệ là ống Goisis. Trên thực tế, hút mỡ bằng ống cannula Goisis được thực hiện với một chuyển động quay. Cạnh lõm của các cổng thúc đẩy sự xâm nhập của chất béo vào lỗ. Gờ nhô lên tạo điều kiện thuận lợi cho việc tách các hạt mỡ. Bằng cách này, hình dạng của nhiều cổng tạo ra một lượng lớn mô được hút với mỗi vòng quay. Do đó, việc sử dụng cannula Goisis hiệu quả hơn nhiều lần so với cannula thu hoạch Coleman (nhanh hơn khoảng gấp đôi so với cannula 3 mm Coleman).Hiệu quả giảm béo là rất quan trọng trong các trường hợp điều trị xâm lấn nhỏ ở mặt cổ và tay. Trong những trường hợp này, bệnh nhân thường trải qua quá trình thu hoạch một lượng nhỏ chất béo, với mục đích tiêm 15-20 cc chất béo. Một số phương pháp hiệu quả thấp yêu cầu thu hoạch 100 cc chất béo trở lên để thu được 20 cc chất béo đã qua xử lý. 80 cc còn lại bị mất trong quá trình xử lý. Ở một số bệnh nhân, việc thu hoạch 100 cc là rất đơn giản, nhưng ở nhiều bệnh nhân khác thì khó hơn, và có thể cần một thời gian dài và thu hoạch từ một số khu vực hiến tặng khác nhau.
Kích thước của ống cannula
thu hoạchKích thước lớn của ống cannula thu hoạch có liên quan đến vết sẹo lớn hơn ở điểm chèn và thường gây đau và phù nề nghiêm trọng hơn ở vị trí hiến tặng
Ghi chú:
a, Cannula Coleman có đường kính tương đối lớn, tạo ra nhiều sẹo hơn ở các điểm chèn. Các cổng ở đầu ống cannula làm tăng nguy cơ tổn thương mạch máu
b: 13 Gauge Cannula của Lipogem là một ống cannula khá lớn với nhiều cổng
c: một ống cannula có đầu tròn 3 mm với một cổng hút hình elip duy nhất ở phía gần đầu xa của nó (đường kính cổng: 3 × 9 mm) là một ống cannula khá lớn. Áp lực và lực cao cần thiết để thu hoạch chất béo tạo ra nhiều tổn thương cho các tế bào mỡ
d: Ống cannula 3,5 mm được sử dụng cho hệ thống này là một ống cannula khá lớn
e: Goisis microcannula làm giảm tỷ lệ chấn thương của bệnh nhân, cảm giác khó chịu, các bất thường về da và giảm thiểu nguy cơ tổn thương mạch máu do nhiều cổng giảm kích thước. Bởi vì việc tiêm yêu cầu ít lực hơn và chính xác hơn, ống microcannula có khả năng điều khiển bằng tay vượt trội
f: trong quá trình thu hoạch, do ống cannula bị bám vào nên độ hút chân không kém. Nguy cơ nhiễm trùng cao và thời gian thu hoạch kéo dài
Kích thước của các hạt chất béo
Các hạt chất béo được định nghĩa là những hạt cầu nguyên vẹn của tế bào mỡ liên kết với nhau bằng mô trung mô. Khi đường kính của các hạt mỡ trở nên lớn hơn, vùng hoại tử trung tâm sẽ mở rộng theo các giới hạn sự khuếch tán
f: Coleman Cannula có các cổng hút lớn. Do đó, kích thước của các hạt chất béo là khá lớn
g: Lipogem Cannula có cổng hút có kích thước trung bình. Do đó, kích thước của các hạt chất béo là trung bình
h: một ống cannila có đầu tròn 3 mm với một cổng hút hình elip duy nhất ở phía gần đầu xa của nó có cổng lớn (đường kính cổng: 3 × 9 mm). Do đó, kích thước của các hạt chất béo là khá lớn
i: Gentile Cannula có cổng hút có kích thước trung bình. Do đó, kích thước của các hạt chất béo là trung bìnhl: Goisis cannula có cổng hút nhỏ. Do đó, kích thước của các hạt chất béo nhỏ lll: Ống thông Regenlab có cổng hút nhỏ. Do đó, kích thước của các hạt chất béo nhỏ
Số lượng các thành phần mô đệm và mạch máu
Kích thước nhỏ của ống cannula mang lại lợi thế trong việc giảm thu hoạch chất béo có tổ chức tốt, chủ yếu bao gồm các tế bào mỡ trưởng thành và cải thiện việc thu thập nhiều lớp mô mỡ bề ngoài hơn, có liên quan đến tỷ lệ ADSC cao hơn
m: kích thước lớn của cannula làm tăng thu hoạch chất béo có tổ chức tốt, chủ yếu bao gồm các tế bào mỡ trưởng thành và làm giảm sự tập trung của nhiều lớp mô mỡ bề ngoài hơn, có liên quan đến tỷ lệ ADSC cao hơn
n: kích thước trung bình của cannula làm tăng thu hoạch chất béo có tổ chức tốt, chủ yếu bao gồm các tế bào mỡ trưởng thành, và giảm tập hợp nhiều lớp mô mỡ nông hơn, có liên quan đến tỷ lệ ADSC cao hơn
o: mức áp suất âm cao phá hủy tế bào gốc
p: Kích thước giảm của ống cannula Goisis làm giảm việc thu hoạch chất béo có tổ chức tốt, chủ yếu bao gồm các tế bào mỡ trưởng thành và cải thiện việc thu thập nhiều lớp mô mỡ bề ngoài hơn, có liên quan đến tỷ lệ ADSC cao hơn trưởng thành và cải thiện việc thu thập nhiều lớp mô mỡ bề ngoài hơn, có liên quan đến tỷ lệ ADSC cao hơn.
Kiểm soát áp suất âm
Mức áp suất âm cao phá vỡ các tế bào mỡ
q: việc sử dụng ống tiêm 10 cc tránh được áp suất âm dư thừa mức áp suất âm cao phá vỡ các tế bào mỡ
s: việc sử dụng ống tiêm VackLok duy trì kiểm soát tốt áp suất âm
Bảo quản tế bào mỡ trong quá trình thu hoạch chất béo
Việc lựa chọn ống cannula và dụng cụ hút có thể bảo tồn tế bào mỡ
r: mức áp suất âm cao phá vỡ các tế bào mỡt: thu hoạch chất béo bằng ống cannula có đầu tròn 3 mm với một hình elip duy nhất cần phải tác động một lực lớn với sự phá vỡ các tế bào mỡ
u: Do việc đưa ống cannula vào với chuyển động quay cần ít lực hơn nên việc bảo tồn các tế bào mỡ được cải thiện.
Tham khảo thêm
1. Peer LA. Cell survival theory versus replacement theory. Plast Reconstr Surg. 1955;16:161–8.
2. Shiffman MA, Mirrafati S. Fat transfer techniques: the effect of harvest and transfer methods on adipocyte via- bility and review of the literature. Dermatol Surg. 2001;27:819–26.
3. Cheriyan T, Kao HK, Qiao X, Guo L. The effect of harvest pressure on adipose survival. Plast Reconstr Surg. 2014;133(6):1365–8.
4. Nguyen P, Desouches C, Gay A, Hautier A, Magalon G. Development of micro-injection as an innovative autolo- gous fat graft technique: the use of adipose tissue as dermal filler. J Plast Reconstr Aesthet Surg. 2012;65:1692–9.
5. Boschert MT, Beckert BW, Puckett CL, Concannon MJ. Analysis of lipocyte viability after liposuction. Plast Reconstr Surg. 2002;109:761–5. discussion 766
6. Eto H, Kato H, Suga H, Aoi N, Doi K, Kuno S, Yoshimura K. The fate of adipocytes after non-vascularized fat grafting: evidence of early death and replacement of adipocytes. Plast Reconstr Surg. 2012;129:1081–92.
7. Kølle SF, Fischer-Nielsen A, Mathiasen AB, et al. Enrichment of autologous fat grafts with ex-vivo expanded adipose tissue- derived stem cells for graft survival: a randomised place-bo-controlled trial. Lancet. 2013;382:1113–20.
8. Farr ST, Trivisonno A. Differential fat har-vesting. Plast Aesthet Res. 2014;1:103–7.
9. Kirkham JC, Lee JH, Medina MA 3rd, Mc-Cormack MC, Randolph MA, Austen WG Jr. The impact of liposuction cannula size on adi- pocyte viability. Ann Plast Surg. 2012;69:479–81