Hướng dẫn điều trị
Siêu âm Doppler động mạch cảnh trong – Bác sĩ Nguyễn Quang Trọng
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Siêu âm Doppler động mạch cảnh trong – Bác sĩ Nguyễn Quang Trọng của bác sĩ Nguyễn Quang Trọng, xin vui lòng click vào link ở đây.
1. Phân loại mảng vữa xương
1.1 Cơ chế hình thành mảng vỡ xương
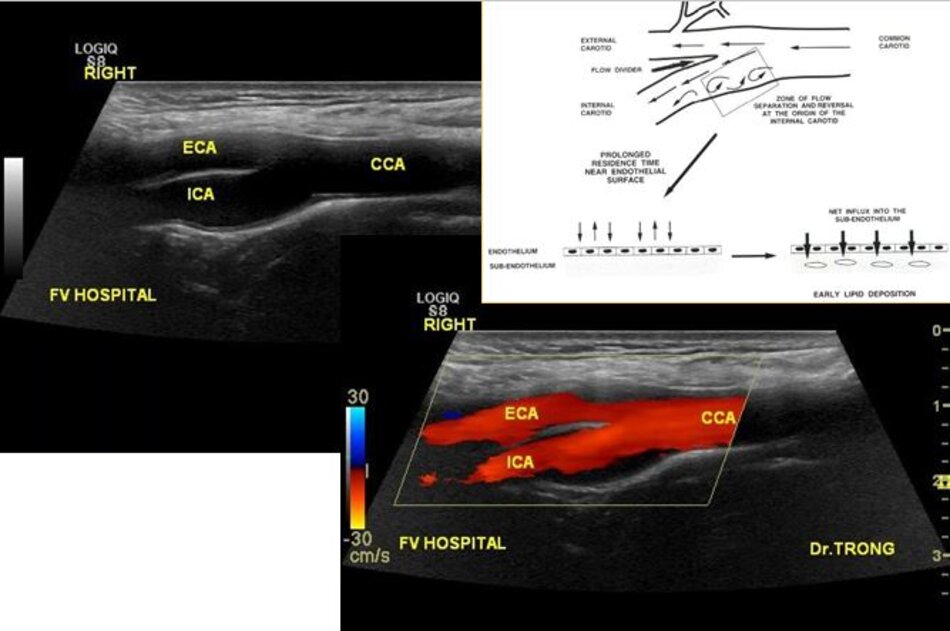
- Quá trình hình thành mảng vữa xơ là một quá trình lâu dài: Do tác động của dòng chảy lên thành mạch, nơi tiếp xúc với dòng chảy cuộn xoáy sẽ dễ bị tổn thương, hình thành mảng vữa xơ.
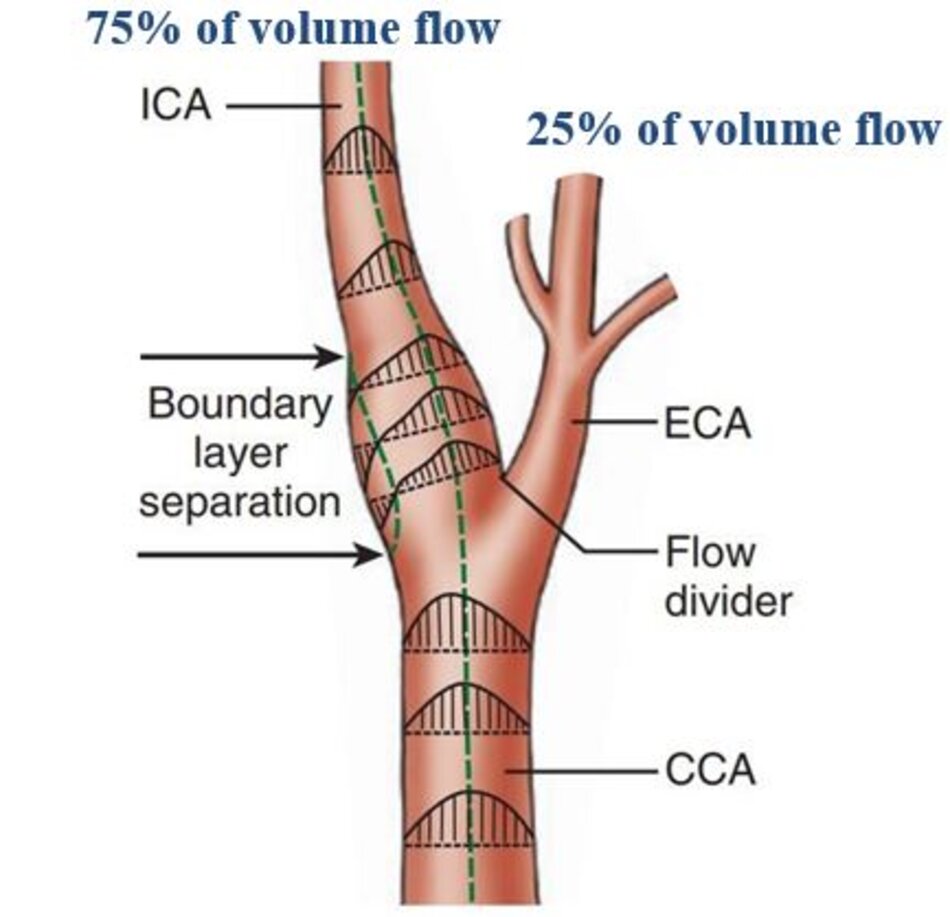
- Động mạch cảnh trong phình nhẹ tại gốc, hình thành một dòng chảy cuộn xoáy, tác động vào thành mạch. Đây chính là vị trí điển hình để hình thành mảng vữa xơ.
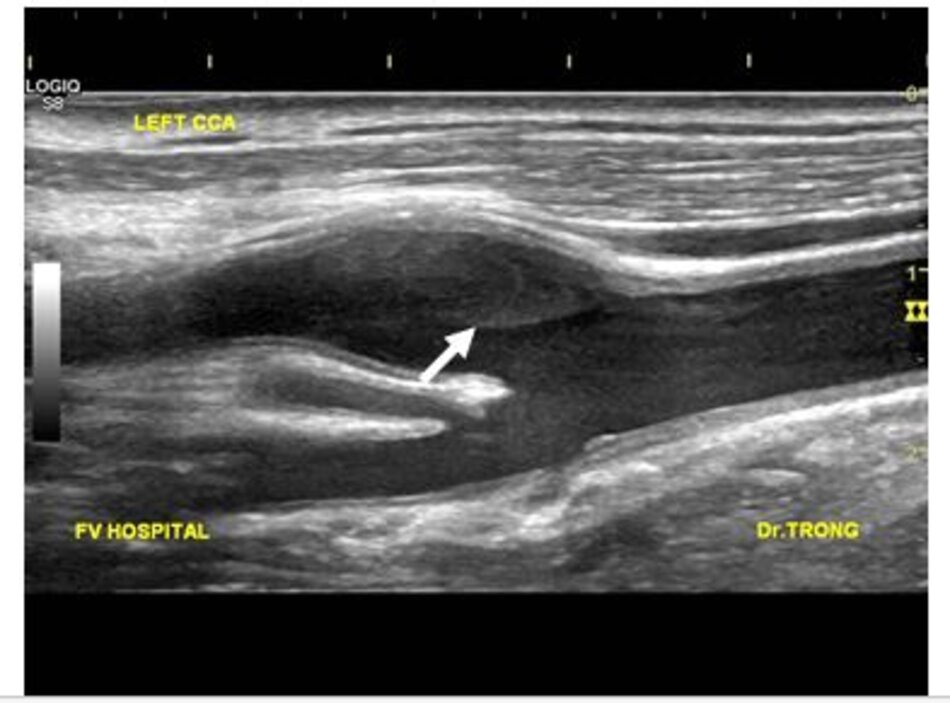
- Do chịu lực va đập của dòng chảy, thoạt đầu lõi lipid thoái hóa hình thành ngay dưới lớp nội mạc, lõi này theo thời gian sẽ to ra hình thành mảng vữa xơ.
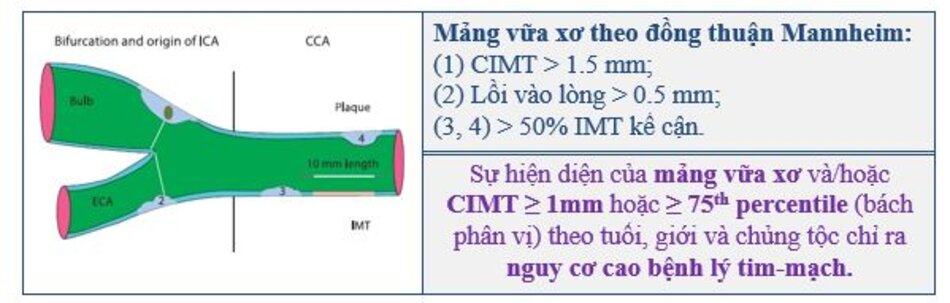
- Định nghĩa (đồng thuận Mannheim): Mảng vữa xơ động mạch là sự dày khu trú phức hợp nội – trung mạc lớn hơn ít nhất 50% thành mạch kế cận hoặc IMT > 1.5 mm lồi vào lòng mạch.
- Mảng vữa xơ theo đồng thuận Mannheim:
- (1) CIMT > 1.5 mm;
- (2) Lồi vào lòng > 0.5 mm;
- (3, 4) > 50% IMT kế cận.
- Sự hiện diện của mảng vữa xơ và/hoặc CIMT ≥ 1mm hoặc ≥ 75th percentile (bách phân vị) theo tuổi, giới và chủng tộc chỉ ra nguy cơ cao bệnh lý tim-mạch.
1.2 Phân loại quốc tế về mảng vữa xương
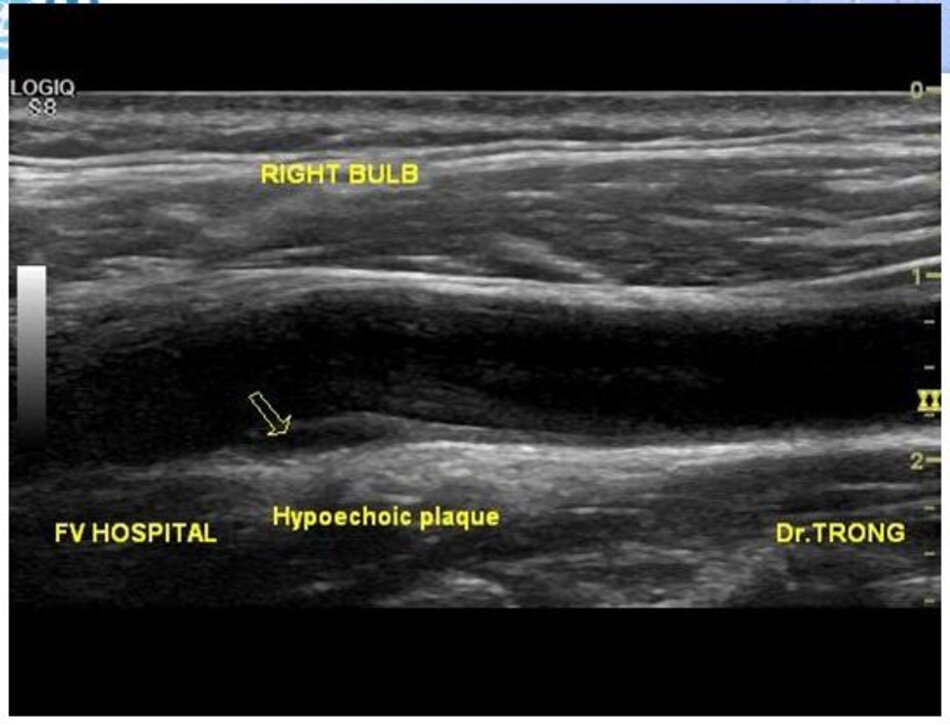
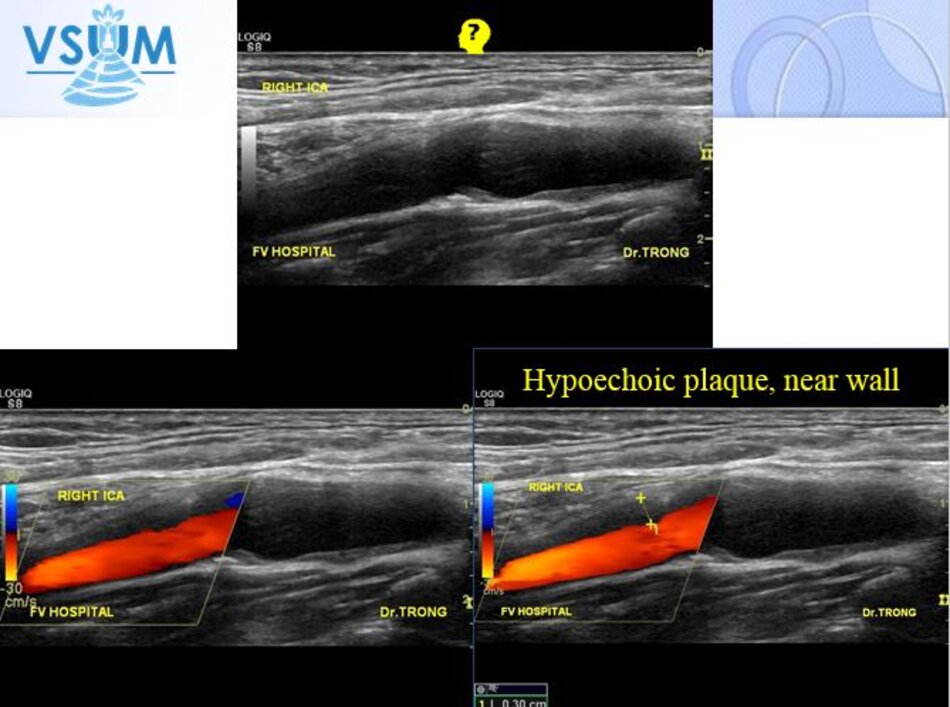
- Type 1: Hồi âm kém, đồng nhất.
- Type 2: Ưu thế hồi âm kém (> 50%).
- Type 3: Ưu thế hồi âm dày (> 50%).
- Type 4: Hồi âm dày, đồng nhất.
- Type 5: Không phân loại (unclassified) do vôi hóa tạo bóng lưng làm cho không khảo sát rõ.
- Type 1 và 2 thường thấy với xuất huyết trong mảng vữa xơ hoặc mảng vữa xơ có ổ loét, được xem là mảng vữa xơ có tiên lượng không tốt (unstable, vulnerable) hay tạo cục máu đông gây thuyên tắc mạch não.
- Type 3 và 4: thường do xơ và/hoặc vôi hóa, chúng thường lành tính, thường tiên lượng tốt, thấy ở bệnh nhân không triệu chứng. Các type này chiếm khoảng 80% bệnh nhân được khảo sát.
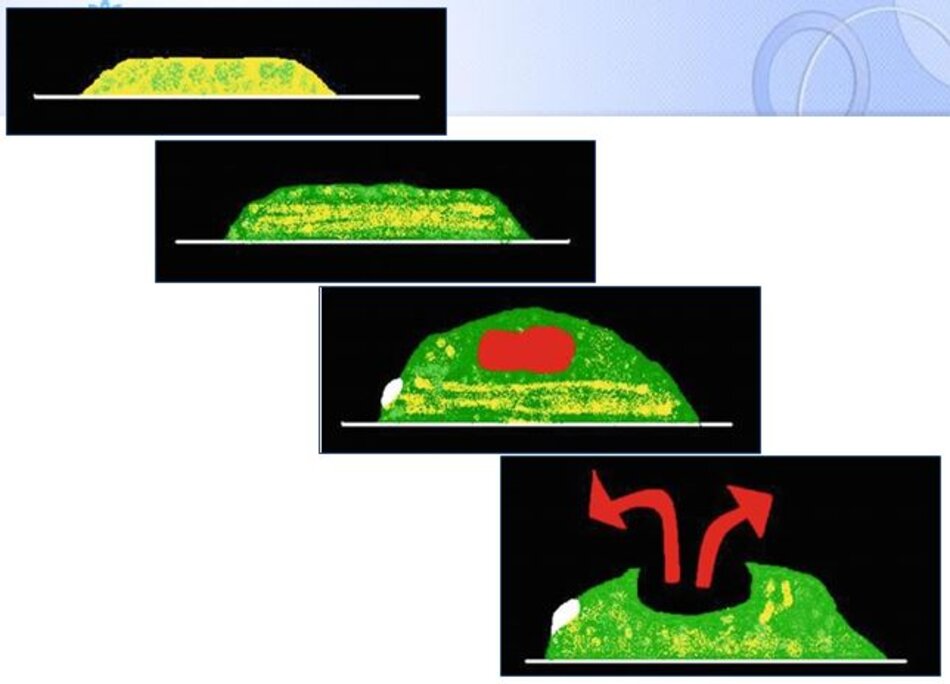
(b) Smooth muscle cell proliferation and collagen deposition. (c) Macrophages digest lipid causing cell destruction and the development of a necrotic lipid core.
(d) Plaque rupture through the thin fibrous cap.
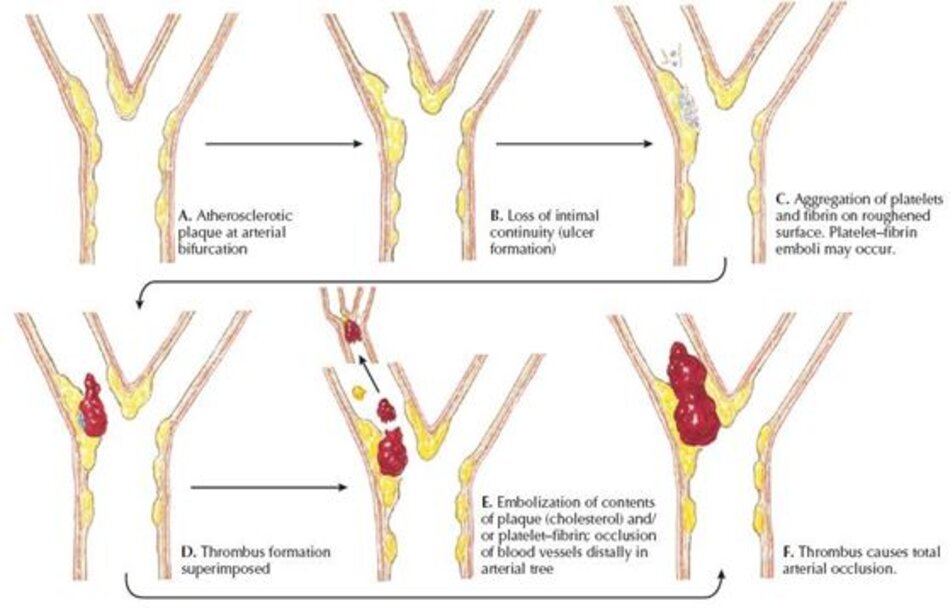
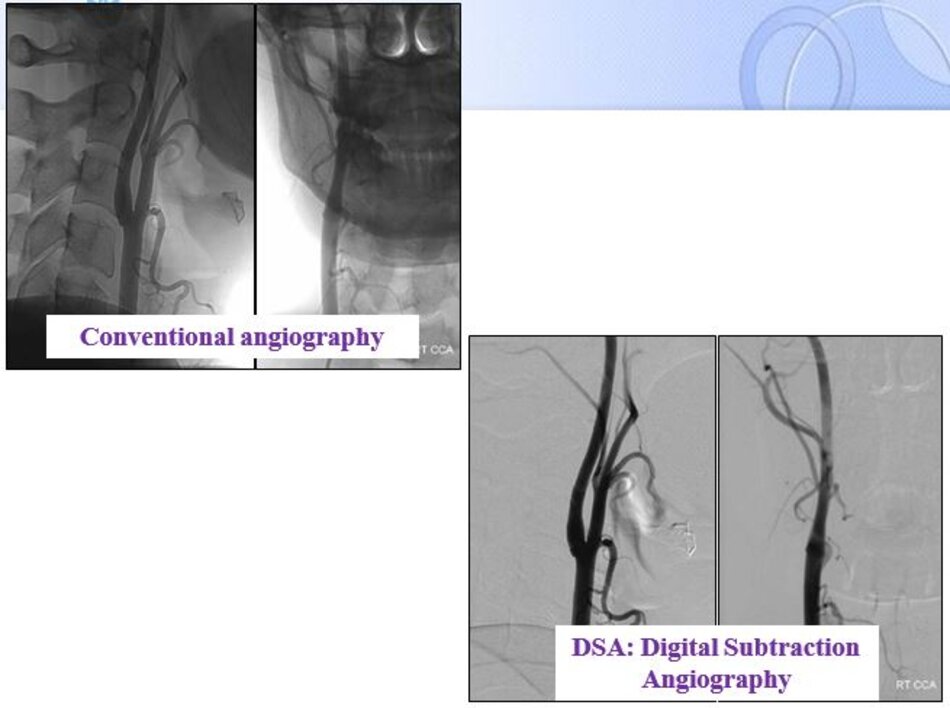
DSA: Digital Subtraction Angiography

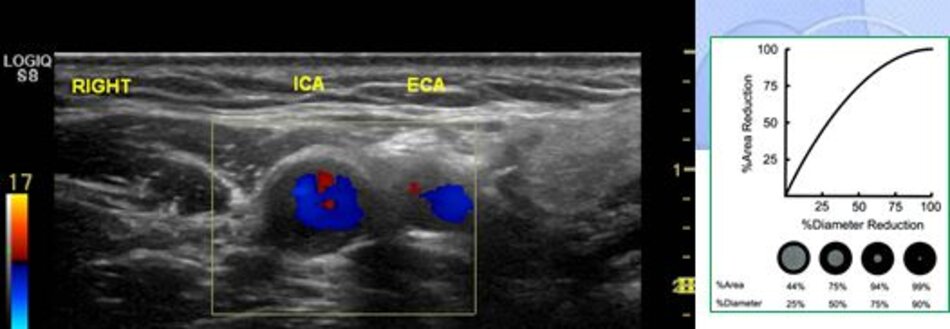
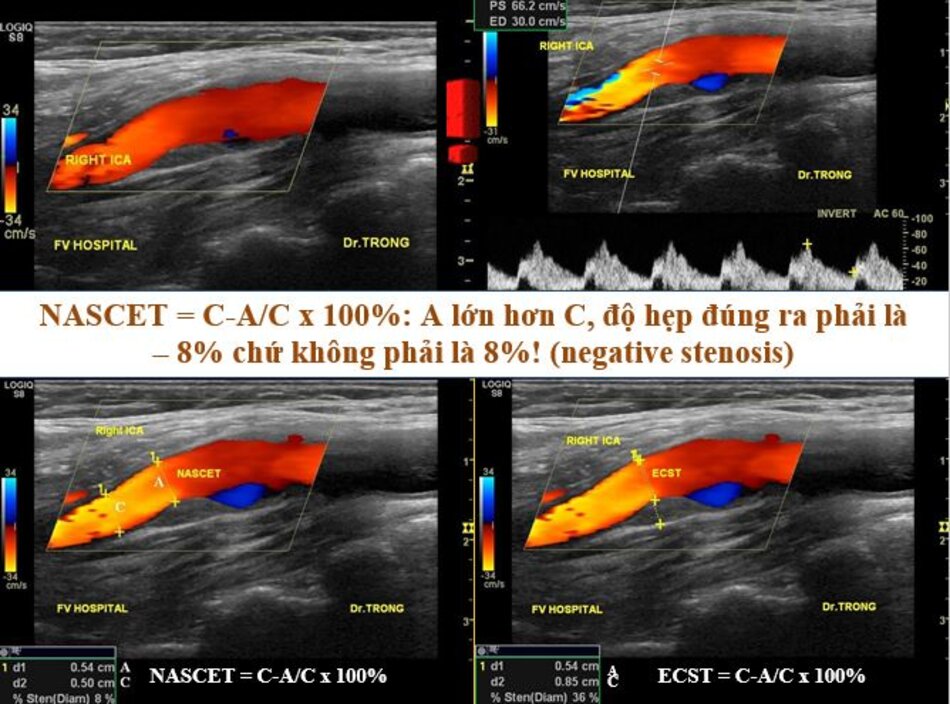
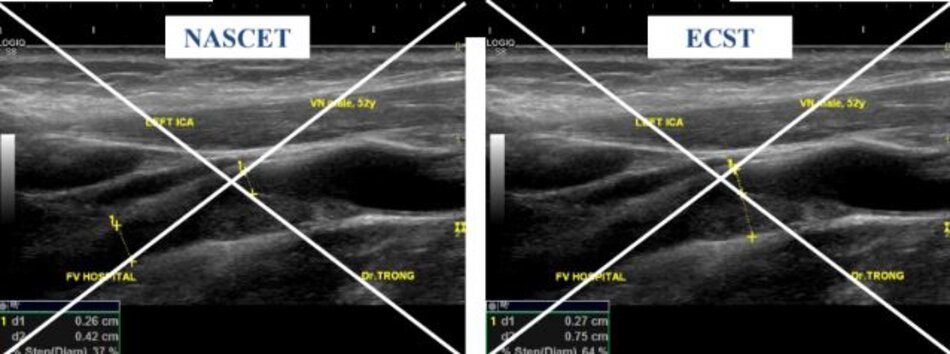
2. Phương pháp đo độ hẹp động mạch cảnh trong – NASCET với ECST
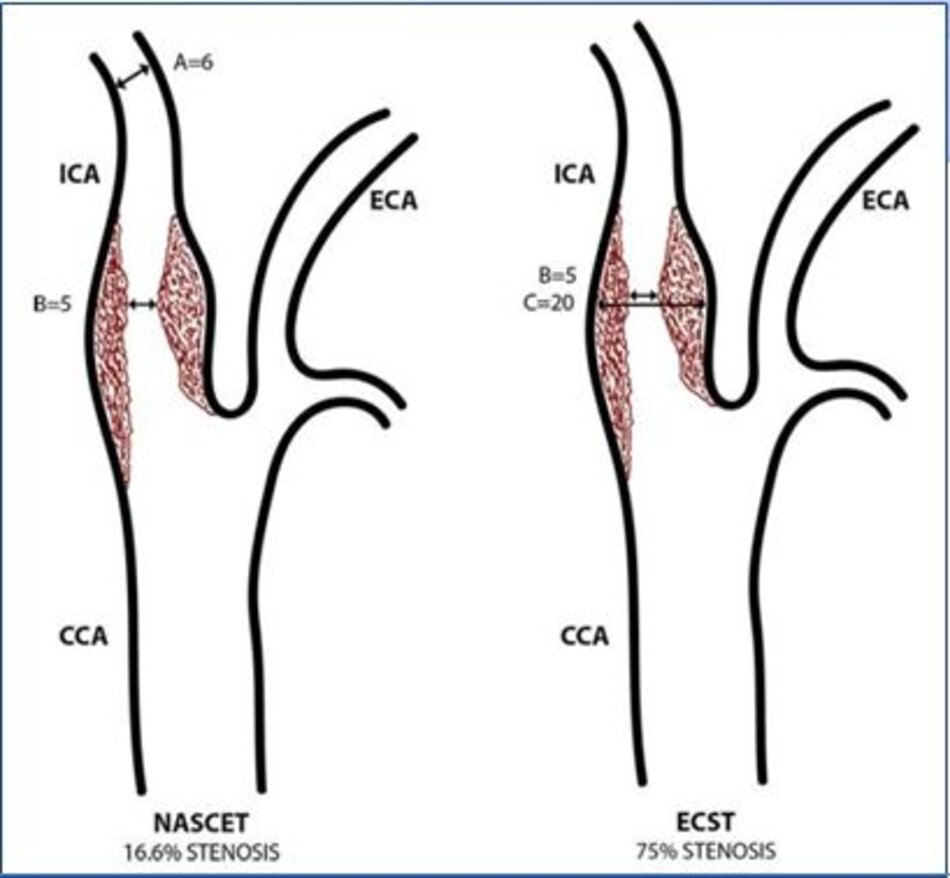
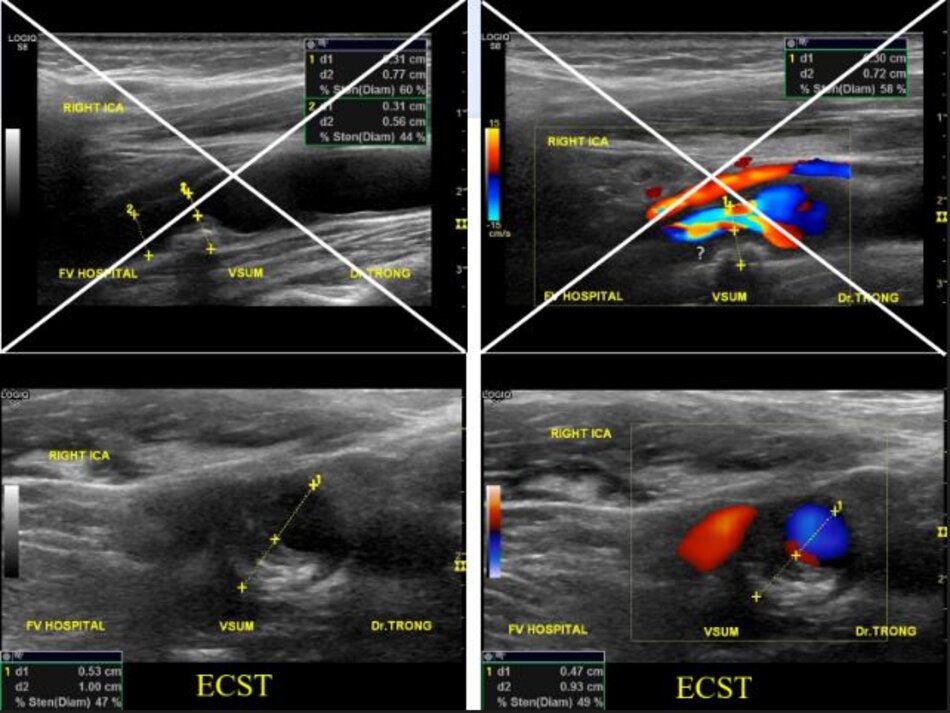
Sai sót trong đánh giá độ hẹp của động mạch cảnh trong khi đo theo phương pháp ECST:
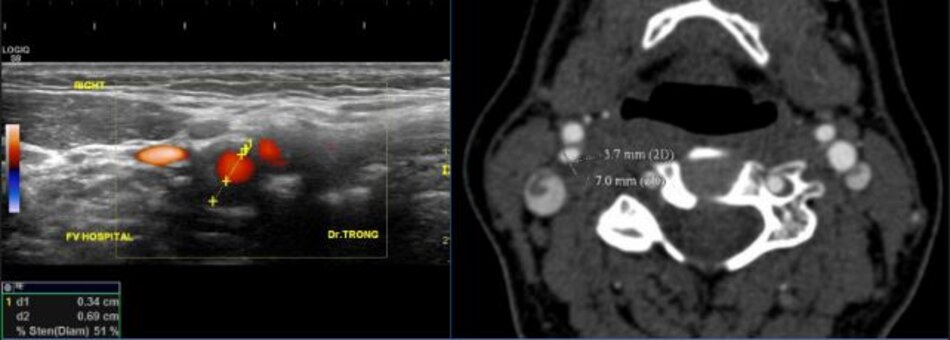
- Được biết đường kính tại chỗ hẹp là 3.3 mm. Đường kính hành cảnh đo bằng siêu âm là 9.2 mm. Kết qua số đo độ hẹp là 64% (ECST), tương ứng với ước lượng ở hình C.
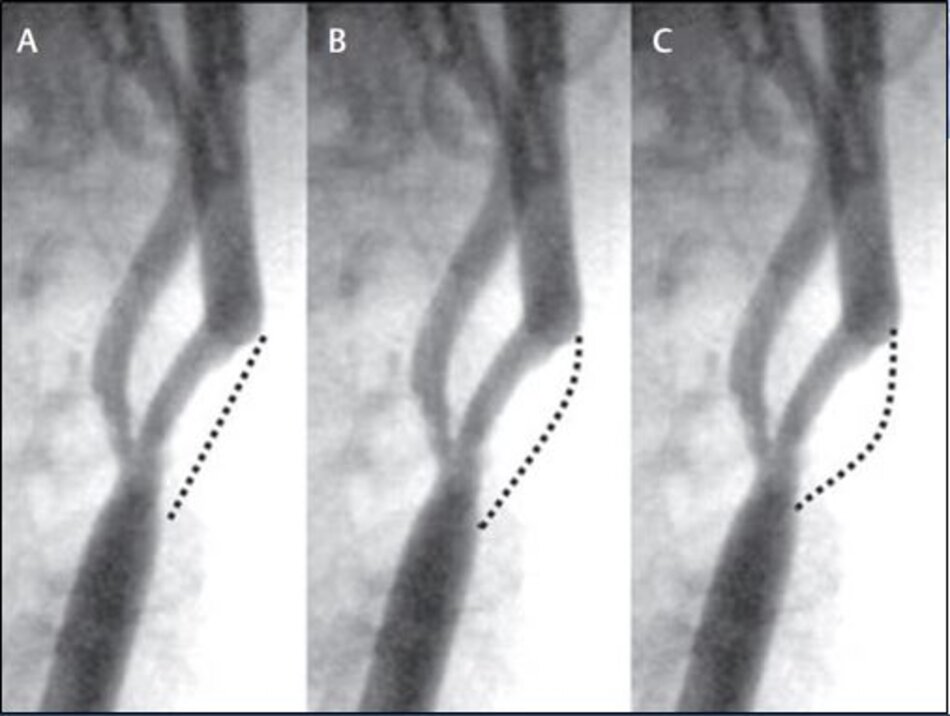
Với DSA, phương pháp Bắc Mỹ (NASCET) dễ đo đạc, chính xác và khách quan. Còn với phương pháp Châu Âu (ECST) thì sao? Trên DSA ta không thấy bờ ngoài của thành mạch, do vậy ta phải tưởng tượng ra đường kính lòng mạch ước lượng tại chỗ hẹp nhất (như hình chụp DSA minh họa ở trên), như vậy phương pháp Châu Âu khó đo đạc và kém chính xác với DSA.
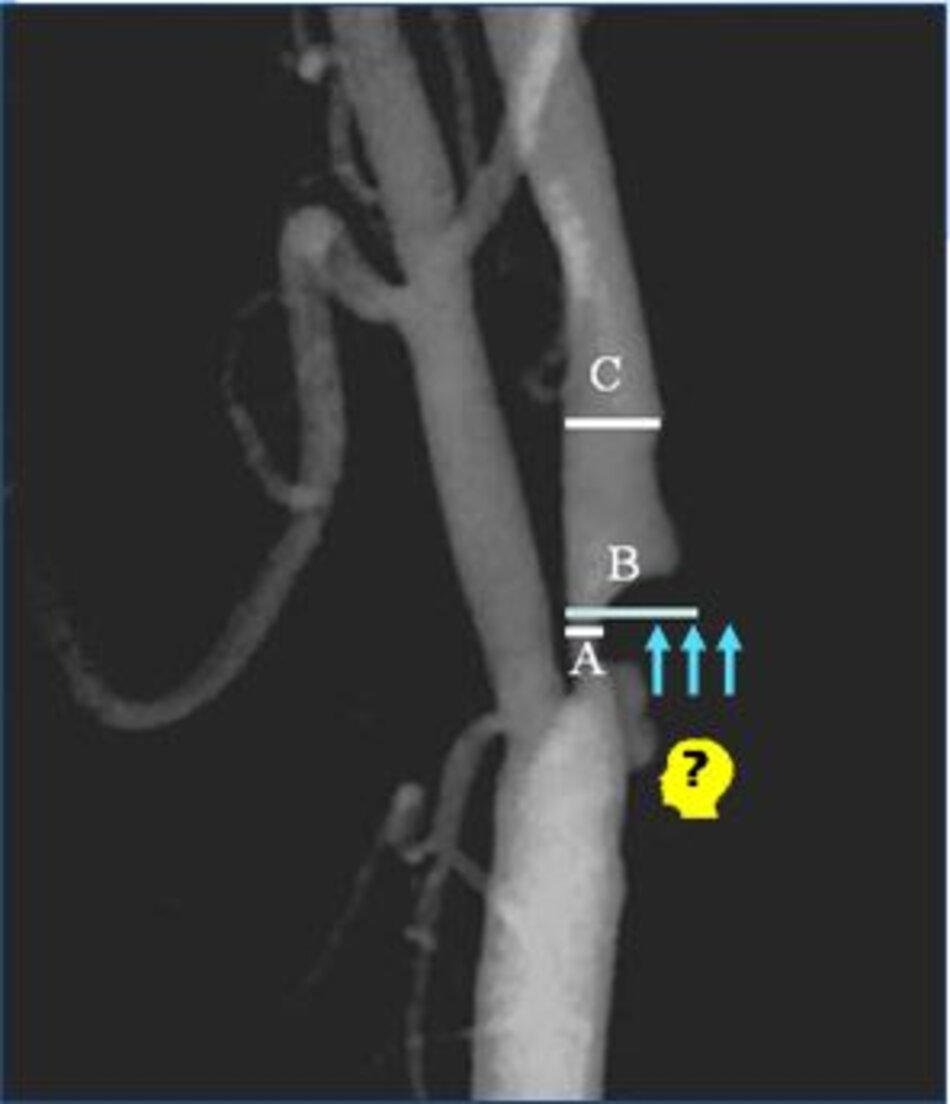
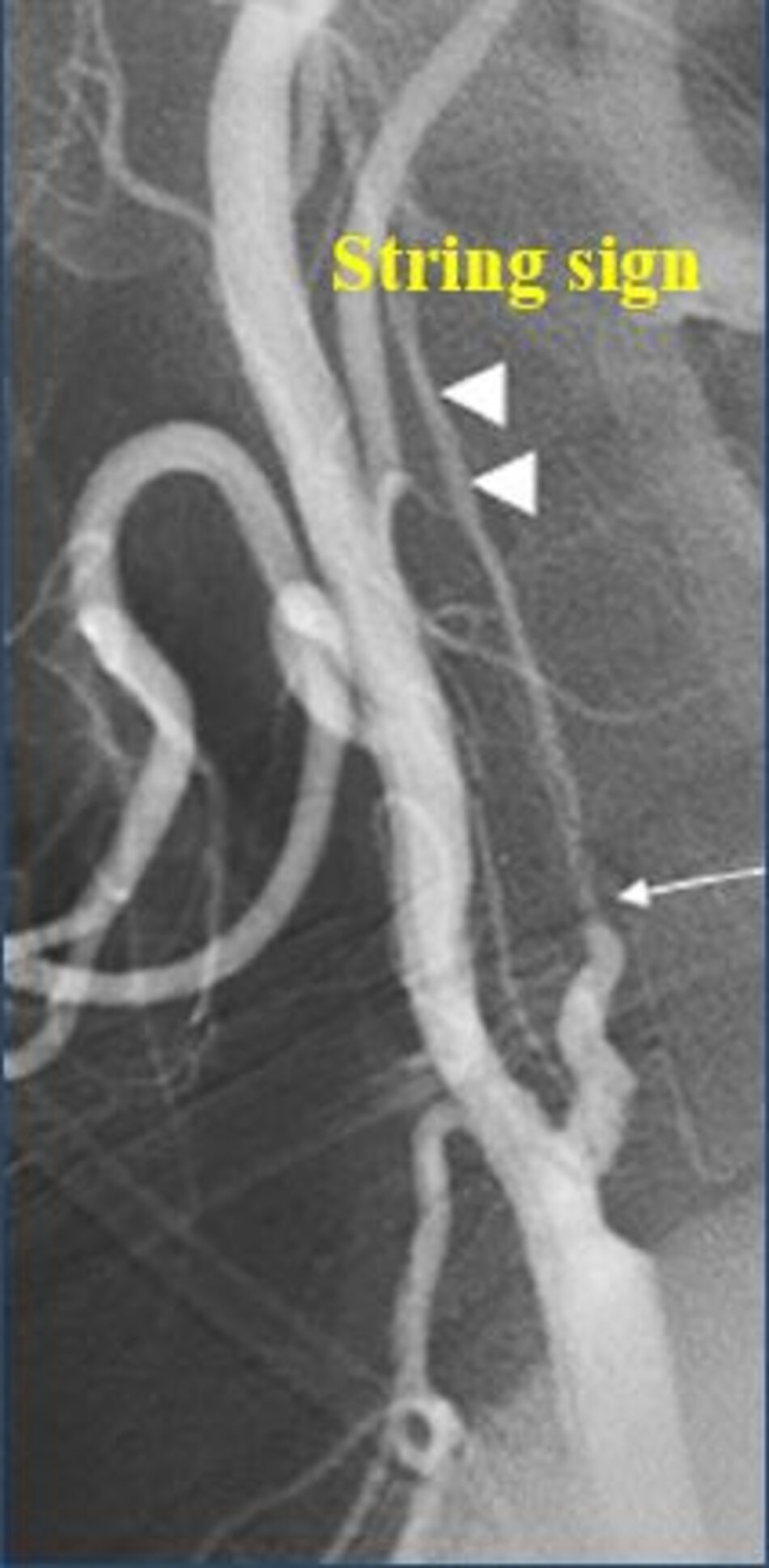
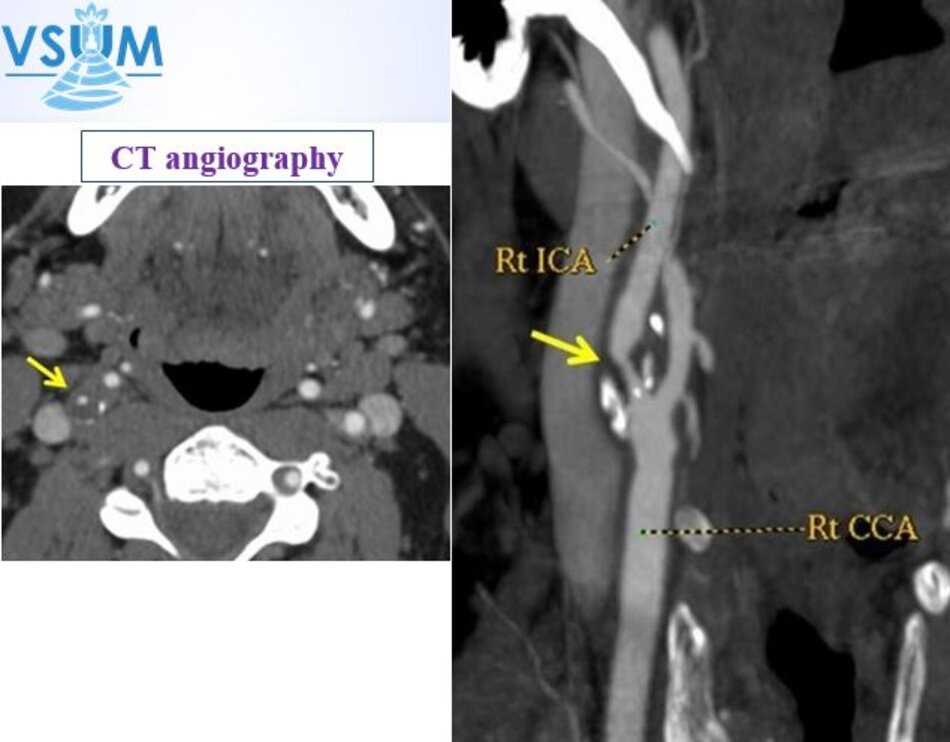
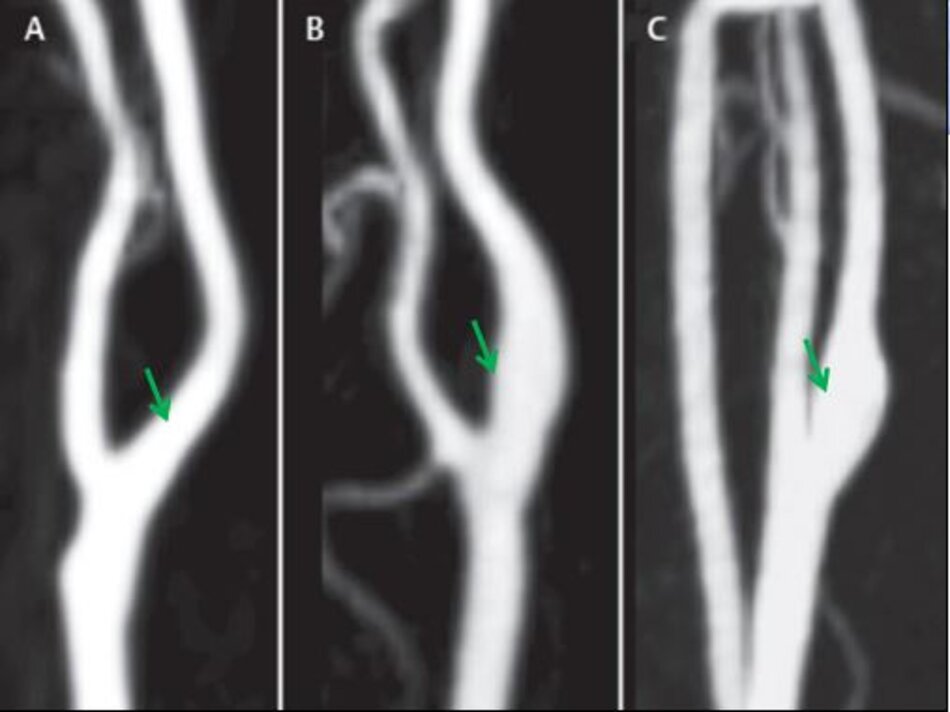
Một câu hỏi khá lý thú được đặt ra là ta đo độ hẹp trên lát cắt dọc hay trên lát cắt ngang?
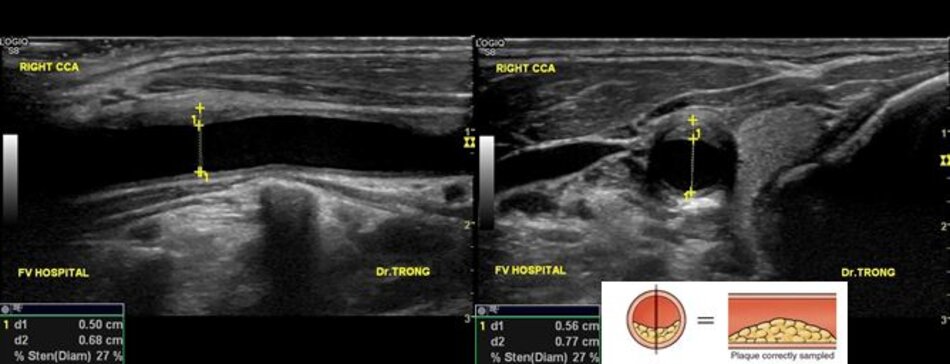
- Khi mảng vữa xơ nằm ở thành trước hoặc thành sau: Có thể đo trên lát cắt ngang hoặc dọc. Nếu đo trên lát cắt dọc, ta có thể đo theo ECST và NASCET (nếu thấy rõ đoạn mạch máu bình thường sau hẹp).
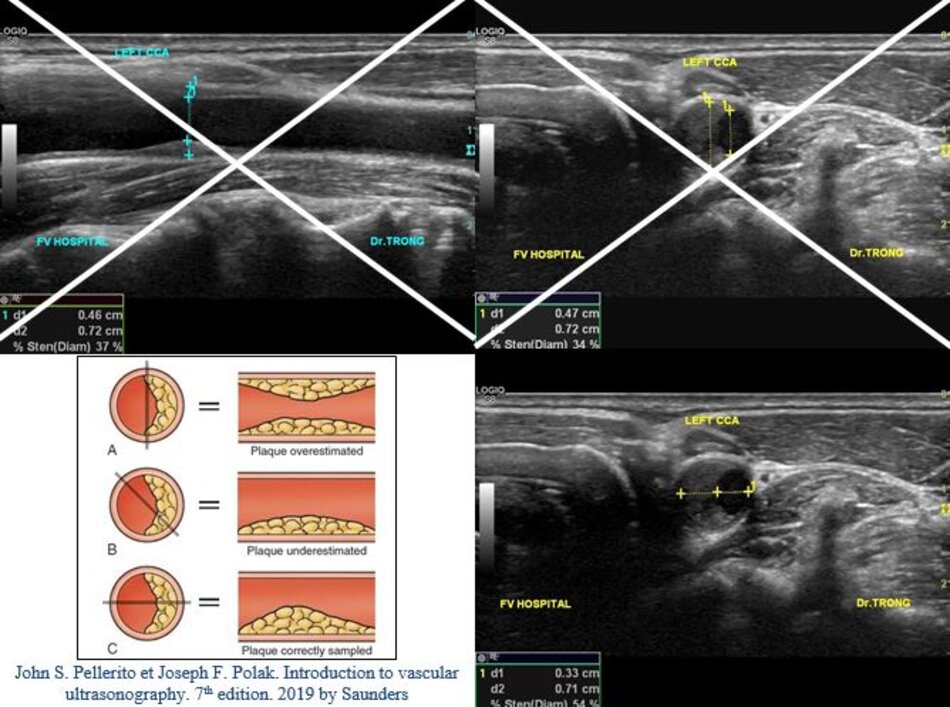
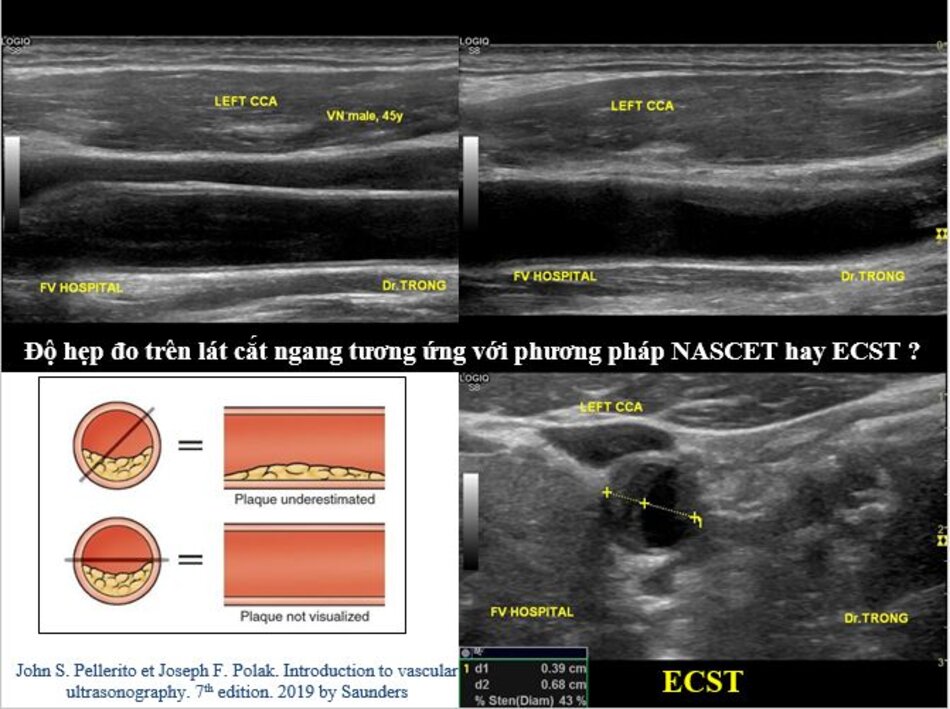
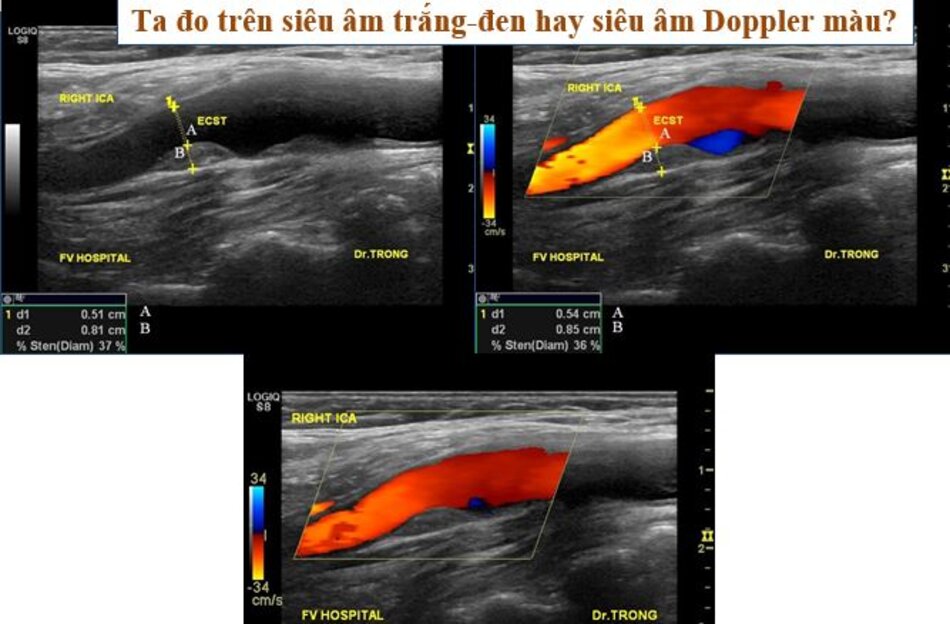
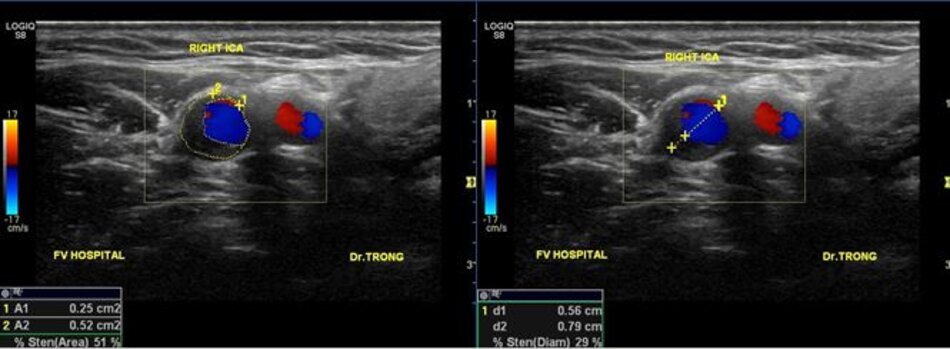
- Ta đo trên hình ảnh siêu âm 2D nếu thấy rõ ranh giới giữa thành mạch và lòng mạch, đo vào thì tâm trương.
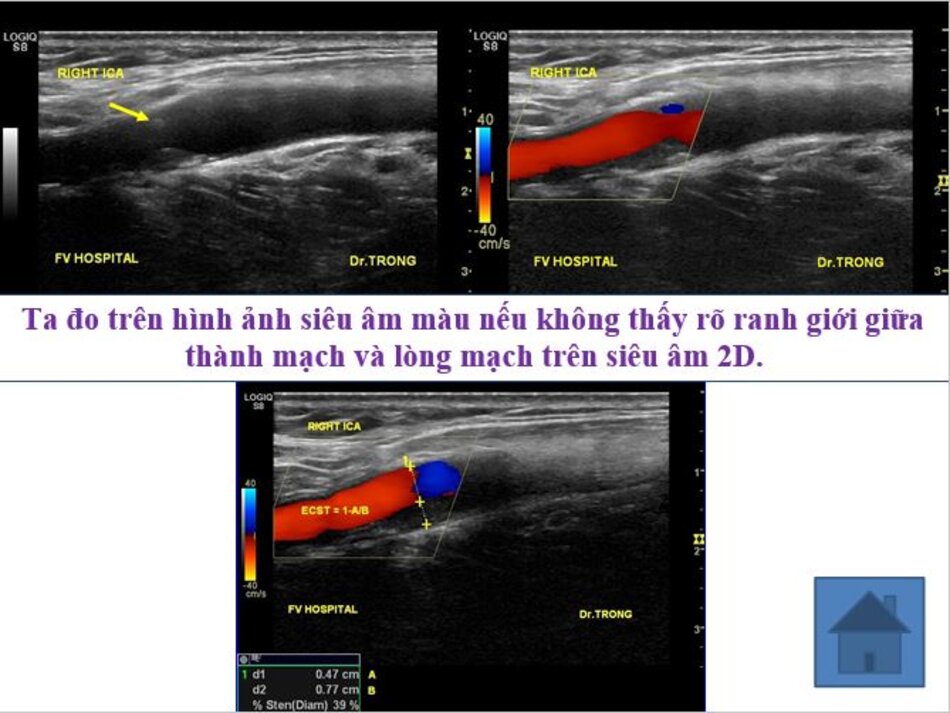
- Ta đo trên hình ảnh siêu âm màu nếu không thấy rõ ranh giới giữa thành mạch và lòng mạch trên siêu âm 2D.
Tóm tắt hướng điều trị hẹp hoặc tắc động mạch cảnh trong tại thời điểm hiện tại
- Bệnh nhân có hoặc không có triệu chứng: hẹp < 50% (NASCET) → Nội khoa.
- Bệnh nhân có triệu chứng:
- Cân nhắc giữa nội khoa hoặc phẫu thuật cắt bỏ nội mạc động mạch cảnh (CEA) khi động mạch cảnh trong hẹp 50-69% (NASCET).
- Phẫu thuật cắt bỏ nội mạc động mạch cảnh (CEA) khi động mạch cảnh trong hẹp ≥ 70% (NASCET). Đặt stent là chọn lựa thay thế khi các yếu tố bất lợi về giải phẫu vùng cổ và tổng trạng (tim, phổi) suy yếu.
- Bệnh nhân không triệu chứng: nên phẫu thuật cắt bỏ nội mạc động mạch cảnh (CEA) khi động mạch cảnh trong hẹp ≥ 70% (NASCET). Đặt stent là chọn lựa thay thế khi các yếu tố bất lợi về giải phẫu vùng cổ và tổng trạng (tim, phổi) suy yếu.
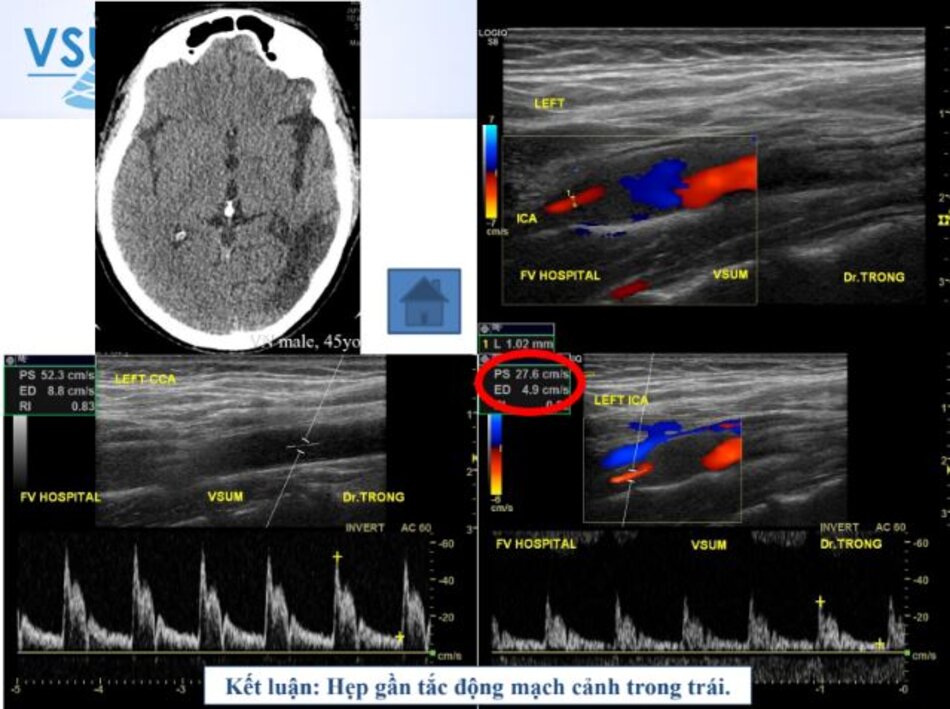
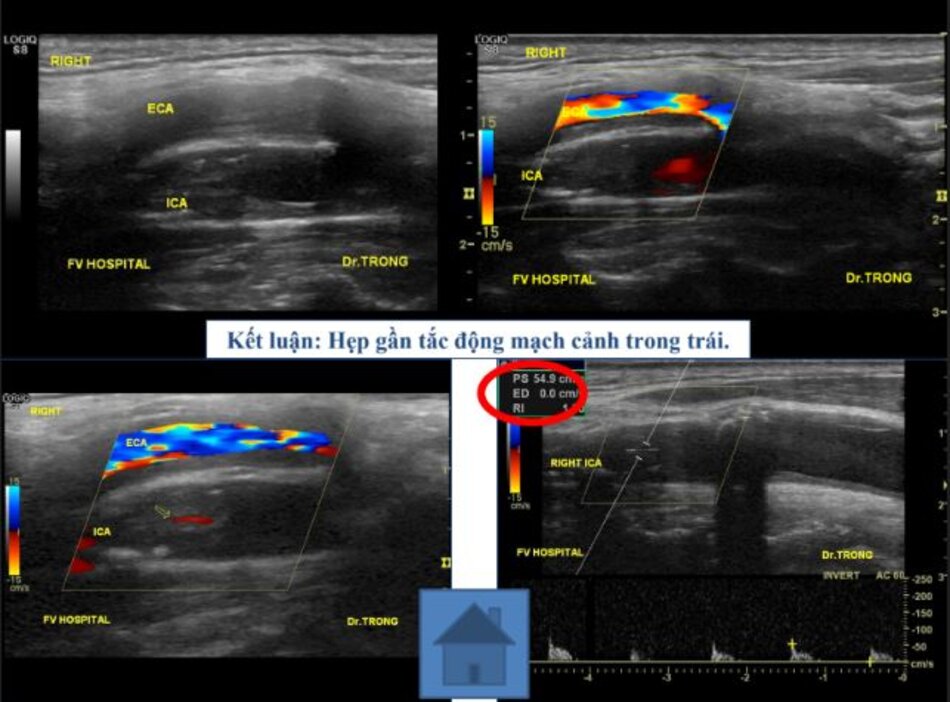
- Động mạch cảnh trong gần tắc (vận tốc dòng chảy qua chỗ hẹp giả bình thường hoặc thấp) không được hưởng lợi từ phẫu thuật → Nội khoa.
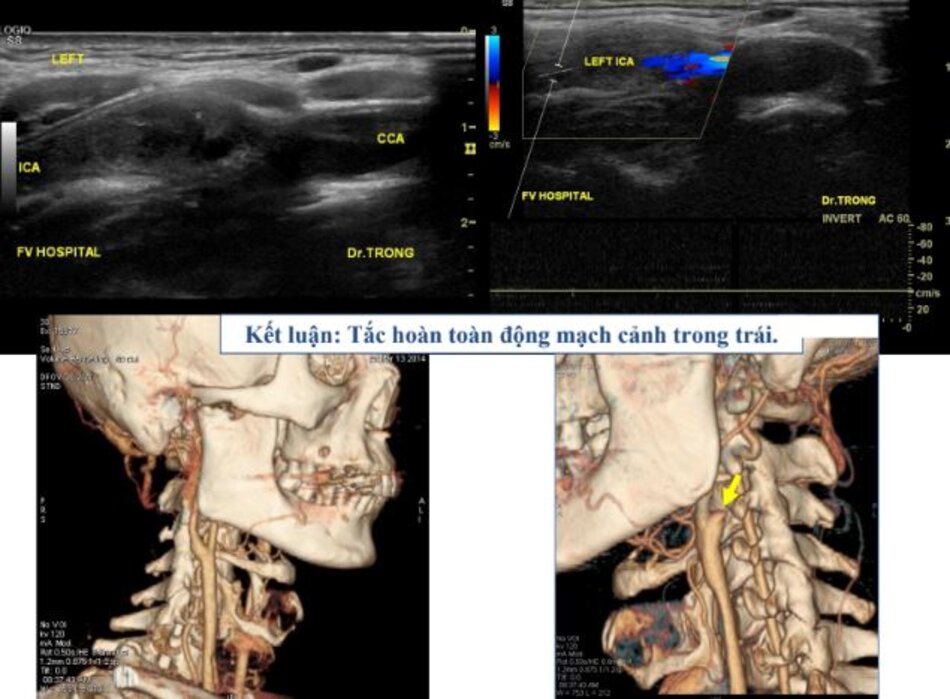
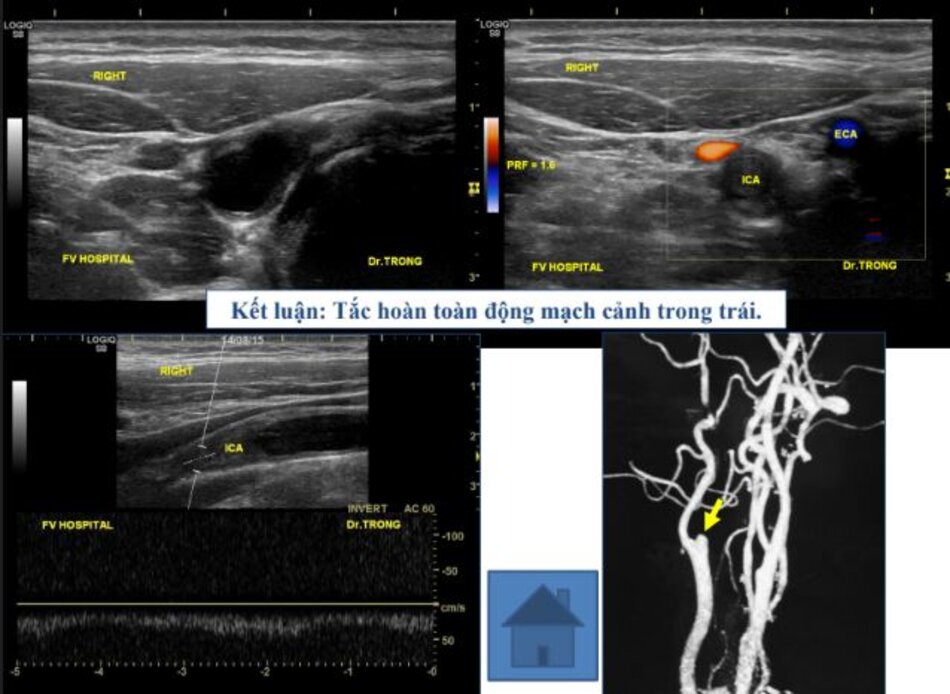
- Động mạch cảnh trong tắc hoàn toàn, bệnh nhân không còn bị nguy cơ thuyên tắc mạch não do cục máu đông từ động mạch cảnh trong đi lên → Nội khoa.
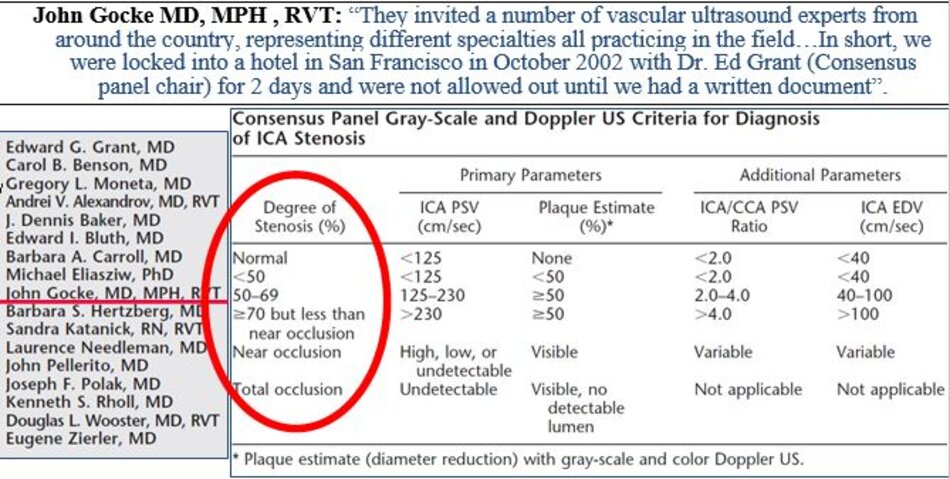
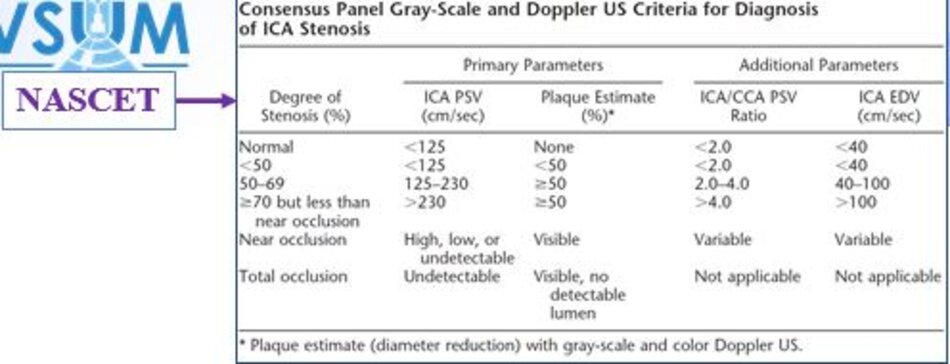
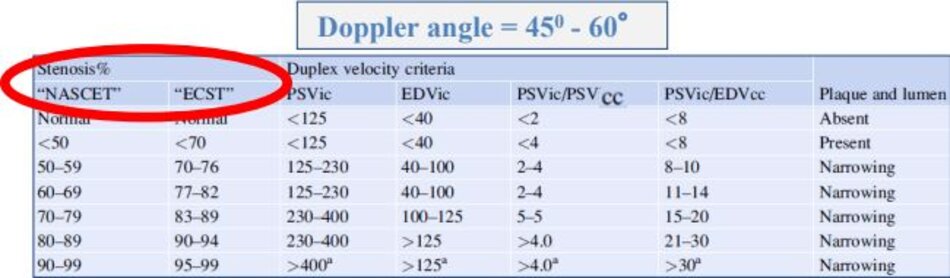
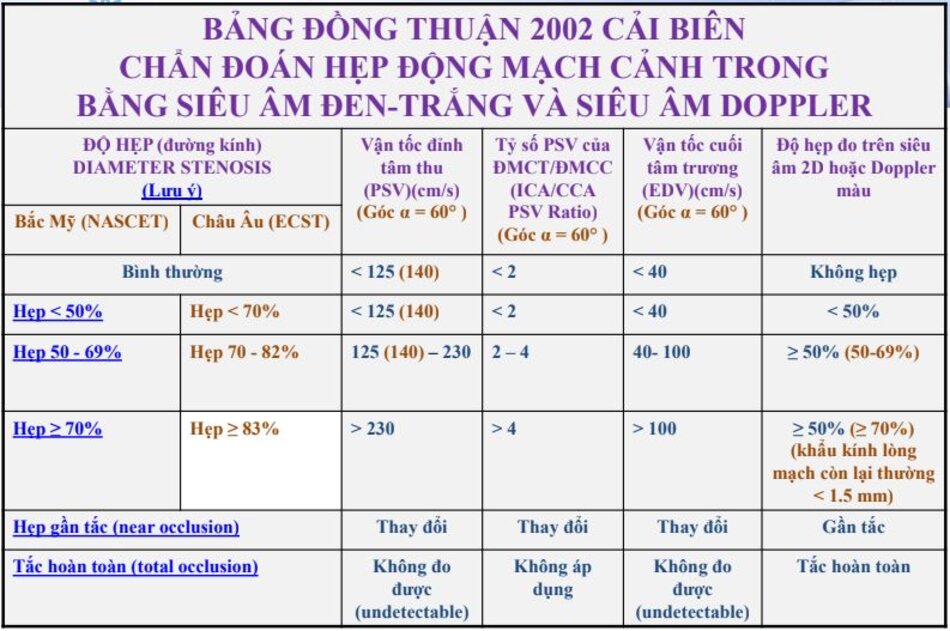
3. Hội nghị đồng thuận 2002 (Consensus conference)
3.1 Consensus Panel 2002 – Bảng đồng thuận 2002
3.2 Lưu ý
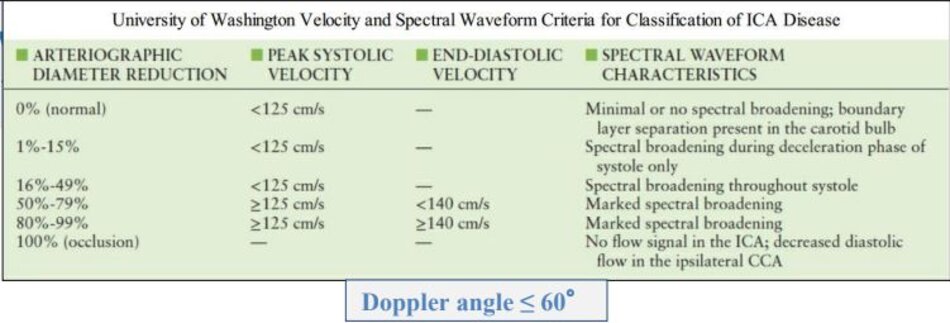
- Độ hẹp tính theo đường kính (diameter stenosis) và theo phương pháp NASCET.
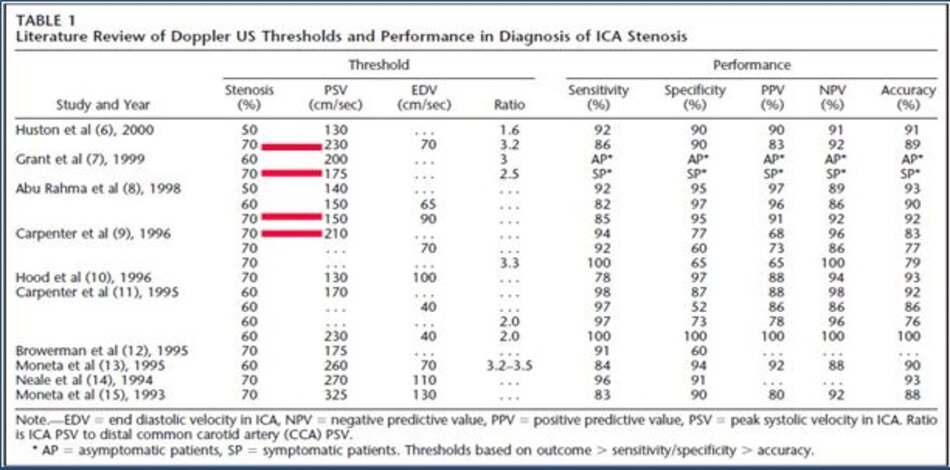
- PSV của ICA và Ứớc lượng độ hẹp trên siêu âm trắng-đen và/hoặc Doppler màu là các yếu tố chính trong phân chia của độ hẹp động mạch cảnh trong.
- Hai yếu tố phụ là tỷ số PSV của ICA/CCA và EDV của ICA.
- * “Độ hẹp ước lượng bằng Doppler xung và độ hẹp đo trực tiếp trên siêu âm 2D và/hoặc Doppler màu cần phải tương đương (should be similar)”.
- Kết luận cần phân độ hẹp vào 6 nhóm như trong bảng đồng thuận để Bác sĩ lâm sàng có hướng xử trí thích hợp.

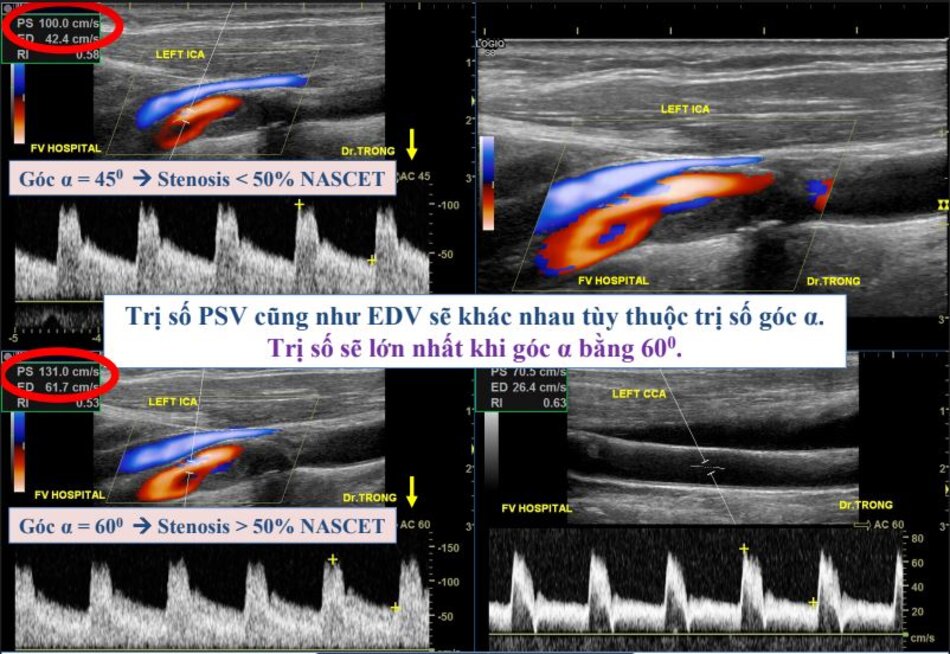
“Các quan điểm đối lập — Một số chuyên gia cho rằng góc Doppler cần phải chính xác là 60°. Một số chuyên gia khác không đồng ý, chỉ yêu cầu góc Doppler nhỏ hơn hay bằng 60°. Điều này cần được nghiên cứu thêm.”
- Vậy ta chọn góc Doppler như thế nào?
- Muharrem Tola và cs: nghiên cứu trên 87 BN hẹp động mạch cảnh trong. 19 động mạch cảnh bị loại trừ (12 bị tắc, 5 bị vôi hóa rộng, và 2 hẹp rất nặng với dấu hiệu sợi dây).
- Đo đạc vận tốc được thực hiện với góc Doppler cố định 60° và 45° .Trị số PSV và EDV với góc Doppler 60° cao hơn trị số PSV và EDV đo được với góc Doppler 45° (24.2% và 24.7%, theo thứ tự).
- Đo đạc vận tốc có thể thực hiện được ở tất cả các mạch máu với góc Doppler 60°. Tuy nhiên, ở 5 ICAs và ở 11 CCAs, không thể thực hiện đo đạc vận tốc với góc Doppler 45°.
- “Vì việc đo đạc vận tốc có thể dễ dàng thực hiện ở động mạch cảnh với góc Doppler 60° và cũng vì một góc Doppler cố định 60° được sử dụng rộng rãi ngày nay, việc sử dụng góc Doppler 60° có thể trở thành tiêu chuẩn kỹ thuật trong khảo sát Doppler động mạch cảnh”.
- Còn tác giả John S. Pellerito, trong bài giảng trình bày tại Los Angeles Radiological Society 2013 với tựa đề “Pitfalls of Carotid Doppler Evaluation” đã khuyến cáo: “Use consistent Doppler angle (usually 600) (sử dụng góc Doppler hằng định, thường là 600) và nhấn mạnh rằng “the key is consistency…for all patients on every scan” (chìa khóa là sự hằng định…cho tất cả các bệnh nhân cho các lần siêu âm) (slide 37).
4. Kỹ thuật siêu âm Doppler chuẩn
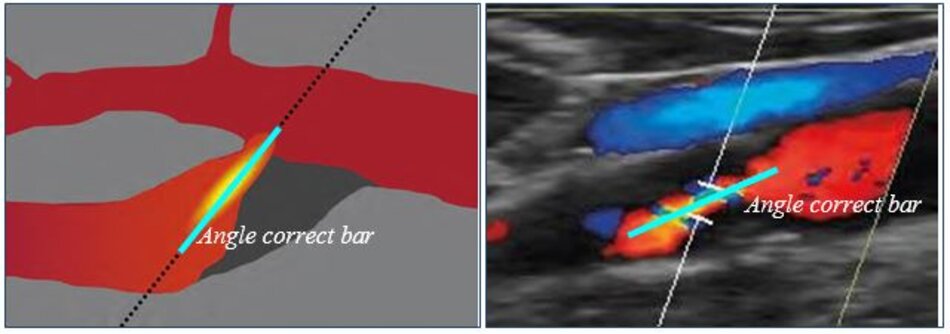
Thanh điều chỉnh góc (angle correct bar) phải được điều chỉnh sao cho trùng với trục của dòng chảy qua chỗ hẹp – stenotic jet – trục này thường không song song với thành mạch, trục này thấy rõ nhất bằng mode Doppler màu nhờ hiện tượng vượt ngưỡng (aliasing phenomenon) khi dòng chảy qua chỗ hẹp.
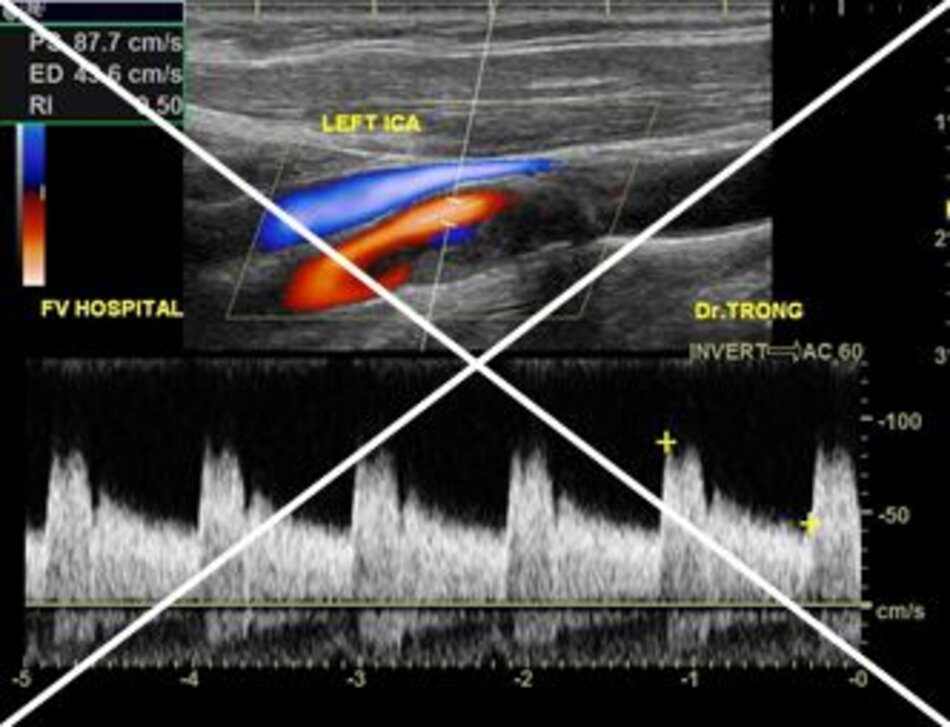

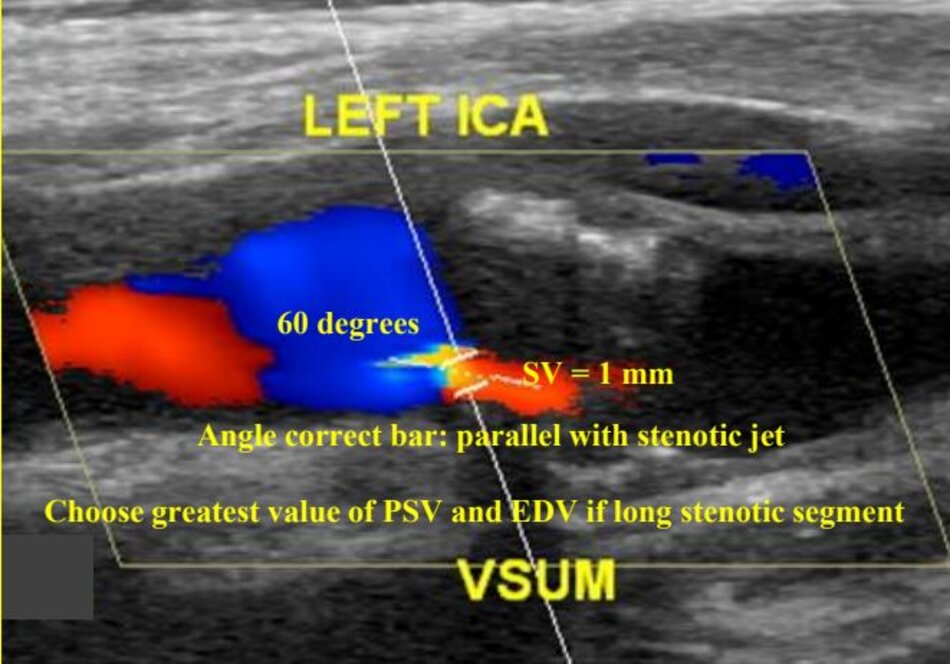
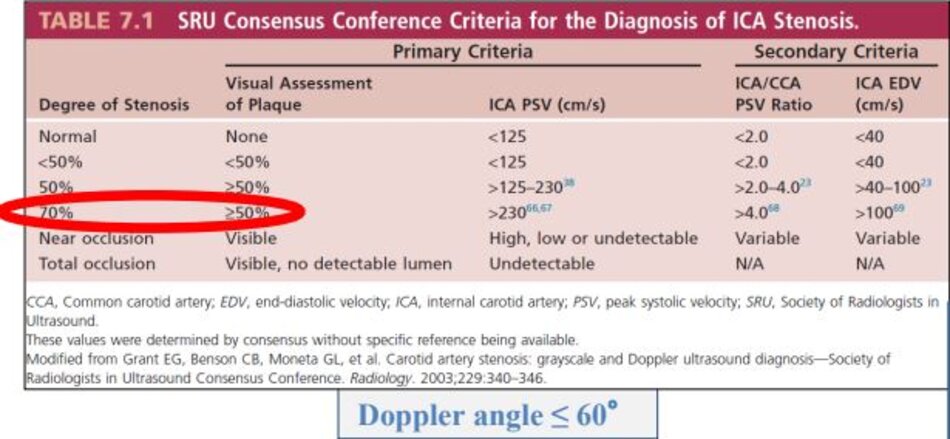
- Trong khi chưa có sự đồng thuận, nếu ta chọn đo với góc Doppler ≤ 600 thì việc ghi chú trị số góc Doppler tương ứng với từng vị trí khảo sát là cần thiết và bắt buộc.
- Còn nếu ta chọn đo với góc Doppler cố định bằng 600 thì ta cũng phải ghi chú điều này trong báo cáo kết quả.
4.1 Đôi điều lưu ý
- Góc Doppler bằng 600 được đề nghị cho tất cả các đo đạc.
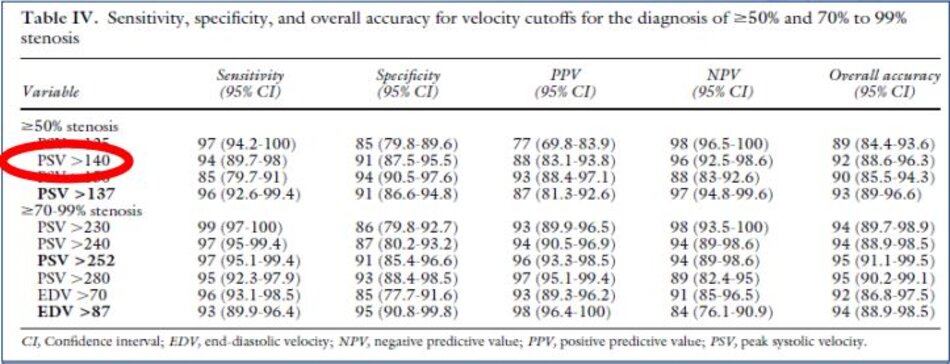
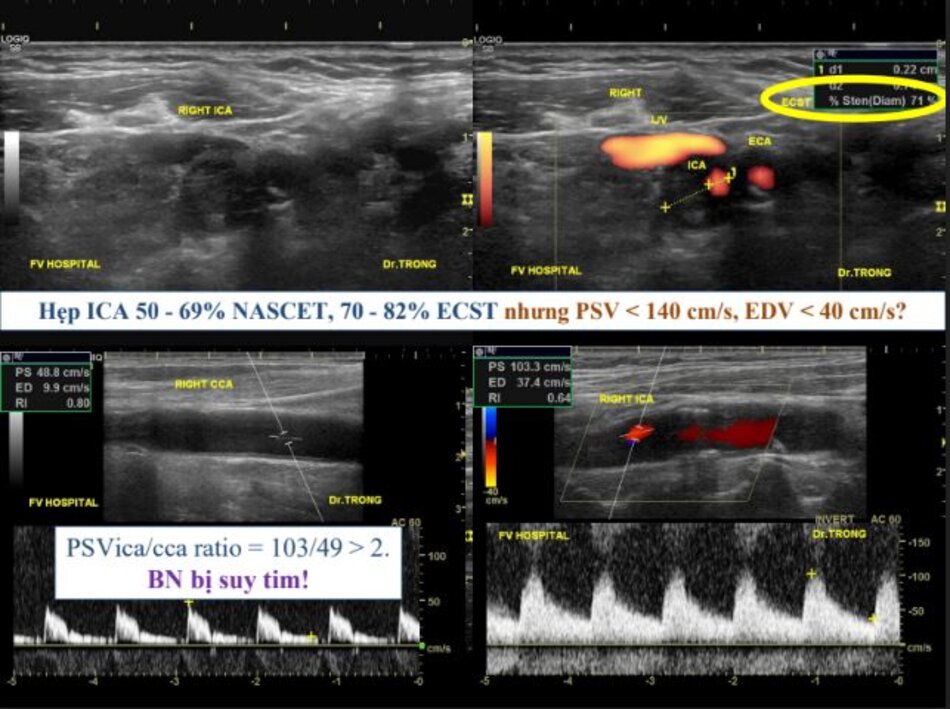
- PSV là thông số chính xác nhất cho những trường hợp hẹp ICA từ 50 – 90% NASCET, nhưng giá trị ngưỡng không có ý nghĩa tuyệt đối.
- Khi ICA gần tắc (hẹp từ 90 – 95%), PSV cũng như EDV sẽ “rơi tự do” cho nên trị số rất thay đổi.
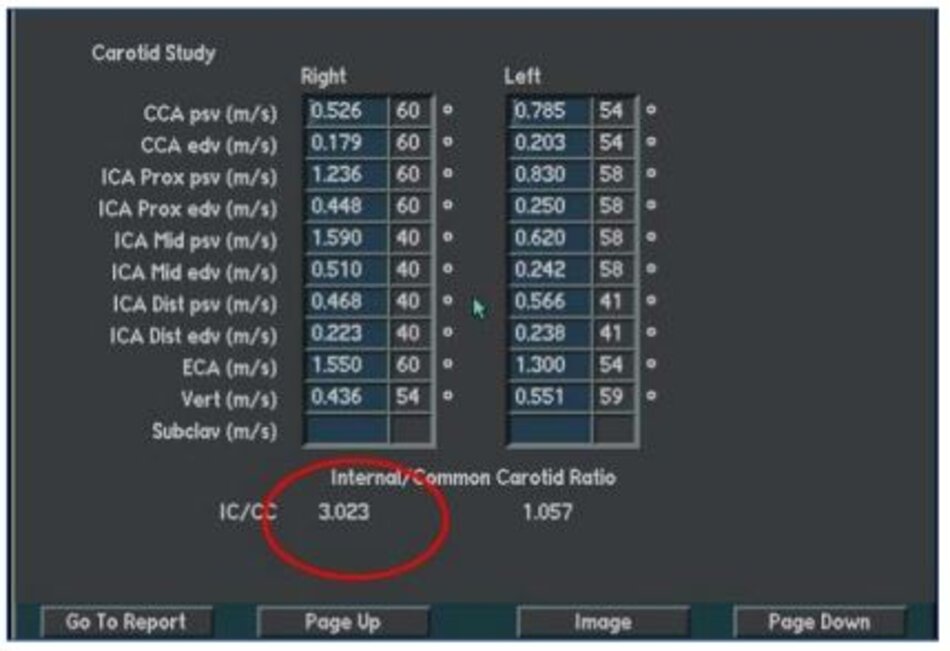
- ICA/CCA PSV ratio là một tỷ số, tỷ số này sẽ không bị ảnh hưởng bởi cung lượng tim như PSV và EDV. Do vậy tỷ số này rất quan trọng để đánh giá độ chênh vận tốc qua chỗ hẹp.
- EDV sẽ gia tăng nhanh khi hẹp nặng, do vậy EDV > 100 cm/s rất có giá trị trong chẩn đoán những trường hợp hẹp nặng (≥ 70% NASCET).
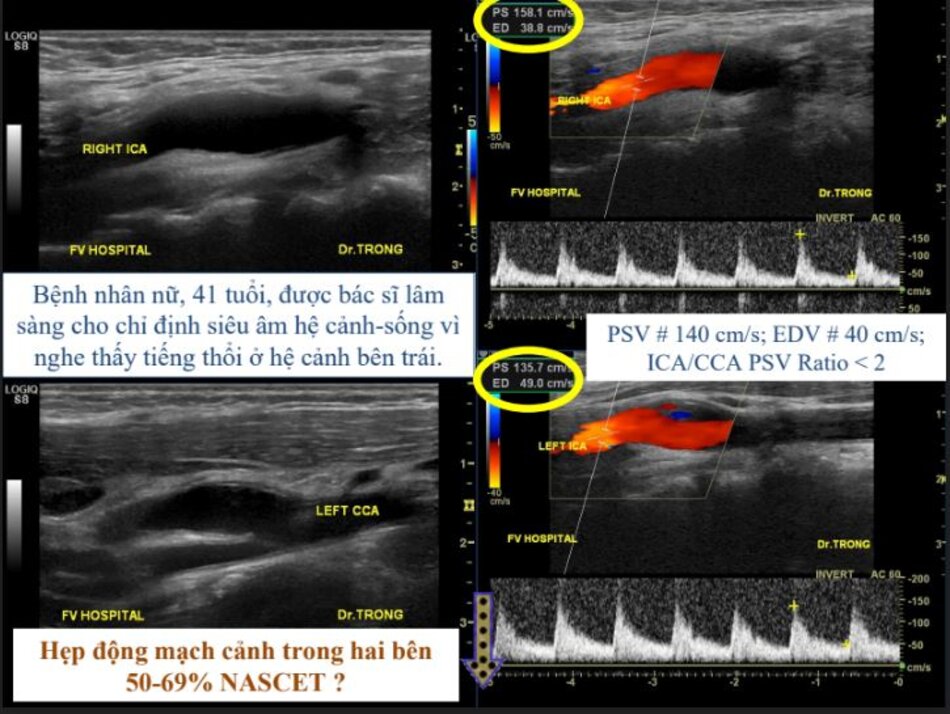
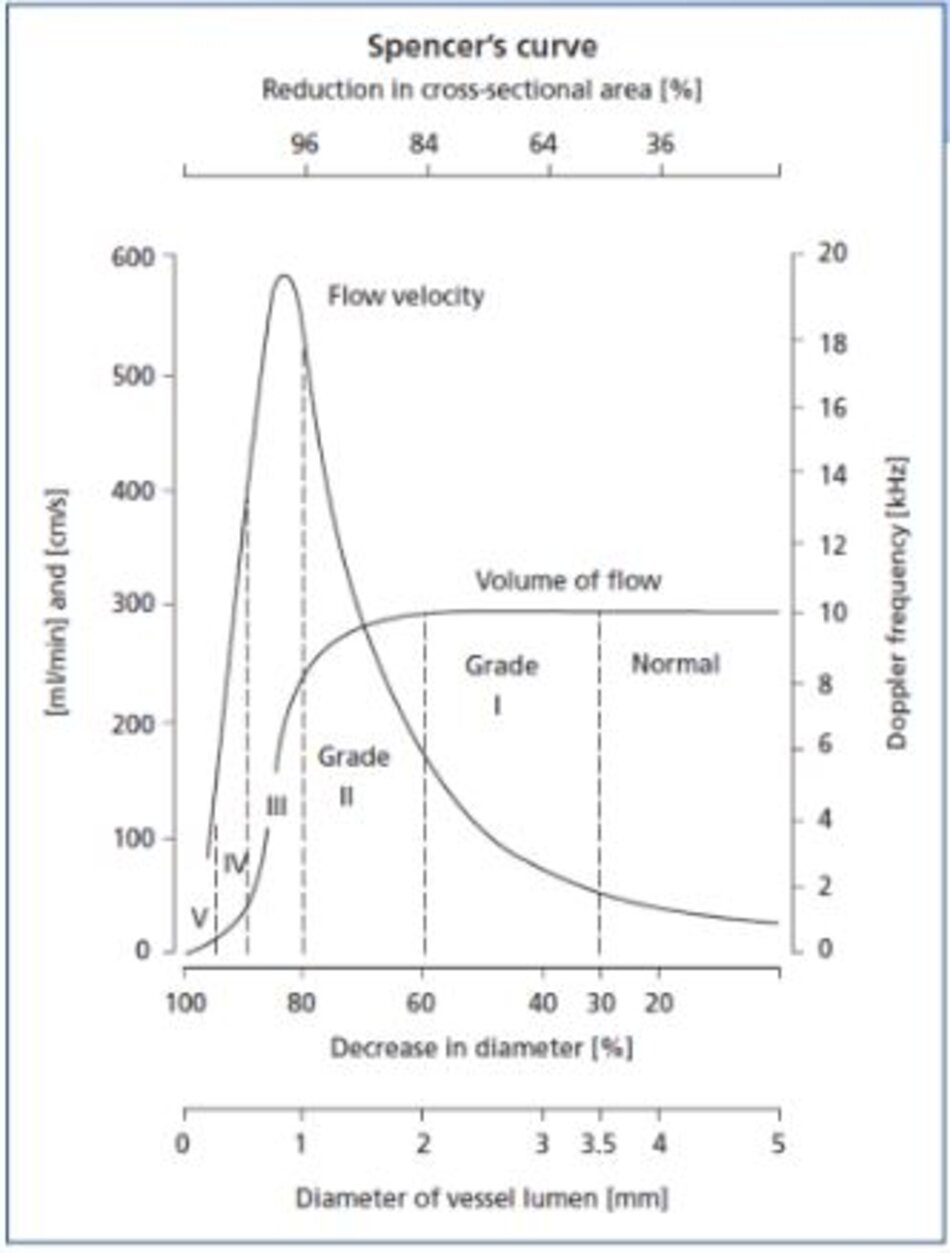
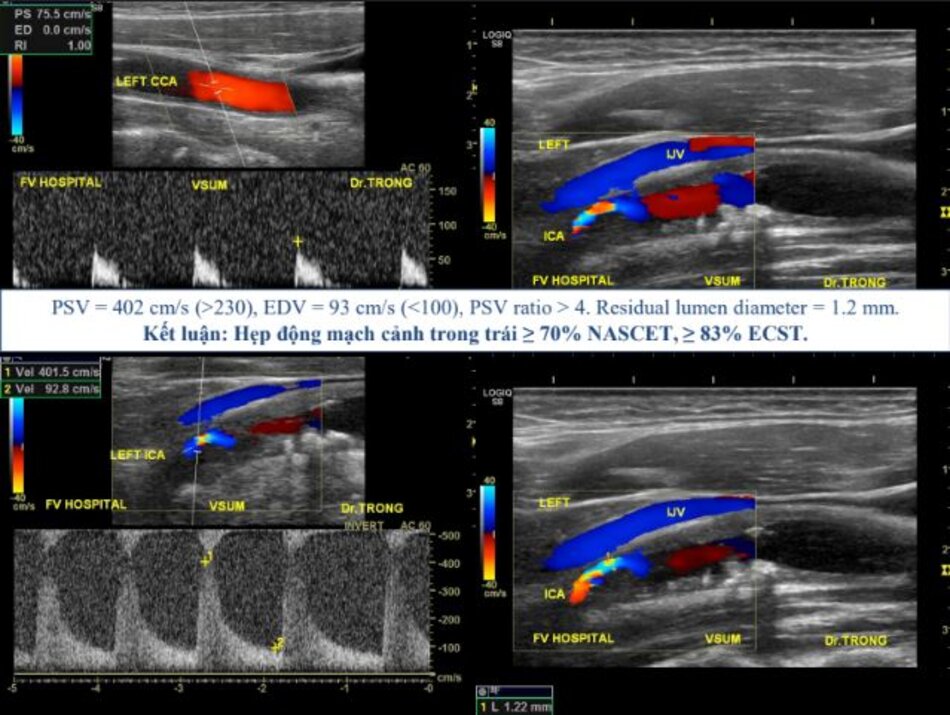
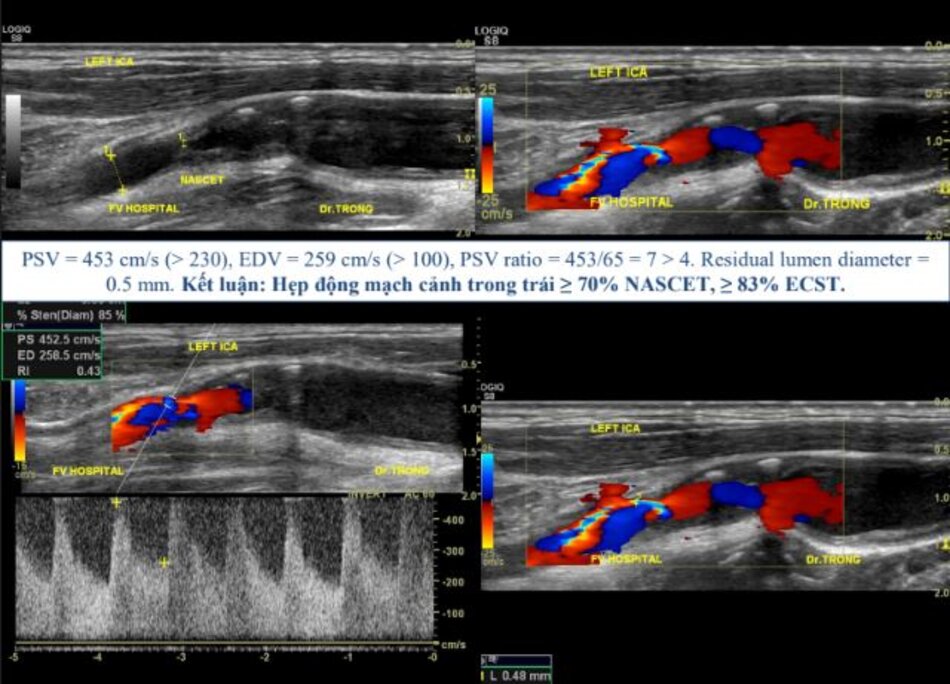
- Vì đường kính ICA bình thường sau hẹp không như nhau giữa các cá nhân (trung bình khoảng 5 mm), nhiều nghiên cứu đã chỉ ra rằng khẩu kính lòng mạch còn lại (residual lumen diameter) có giá trị tiên lượng đột quỵ (stroke) hơn là độ hẹp: Khẩu kính lòng mạch < 1.5 mm gợi ý hẹp nặng trên hầu hết các bệnh nhân.
- Khẩu kính chỗ hẹp 1.5 mm với đường kính ICA bình thường sau chỗ hẹp là 6 mm → Hẹp 75% NASCET (>70%).
- Khẩu kính chỗ hẹp 1.5 mm với đường kính ICA bình thường sau chỗ hẹp là 4 mm → Hẹp 62% NASCET (50-69%).
- Luôn luôn đo khẩu kính của ICA bình thường sau hẹp: điều này rất cần thiết để lựa chọn kích thước stent nếu có chỉ định đặt stent.

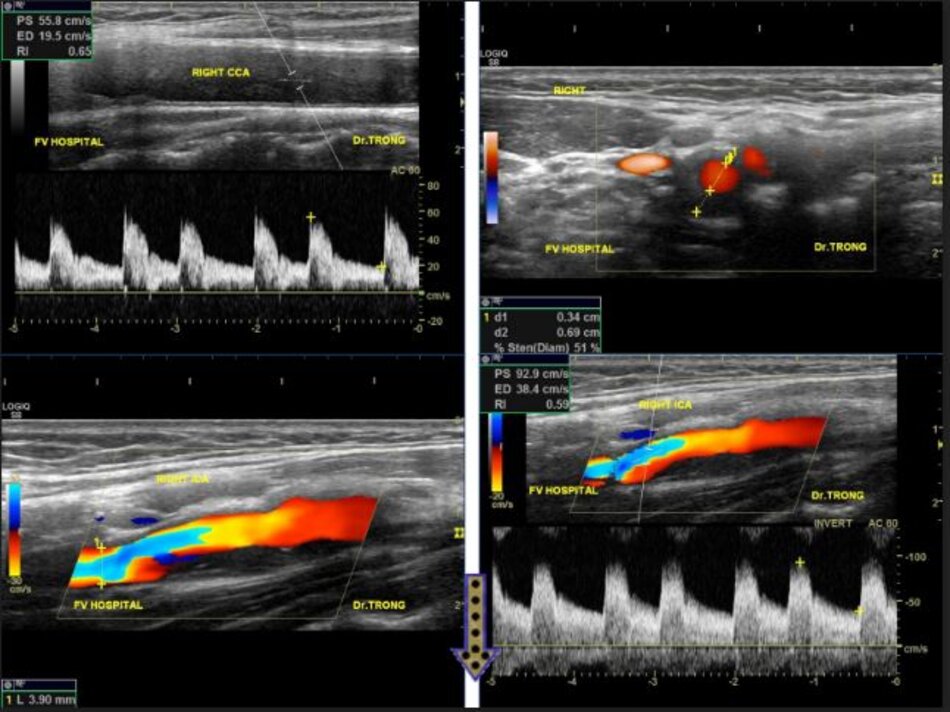
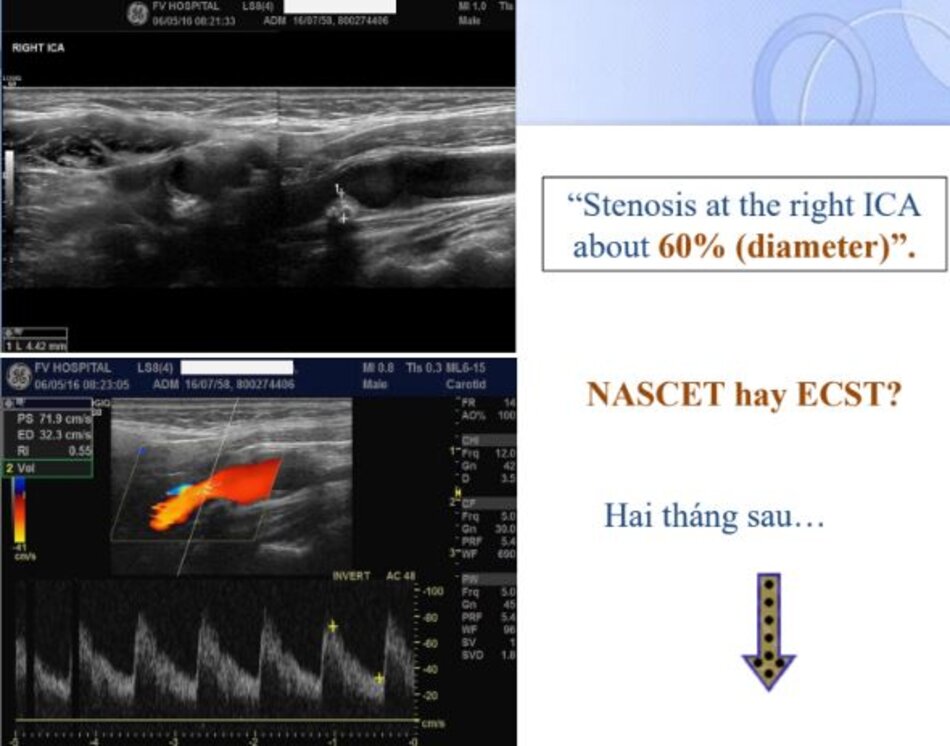
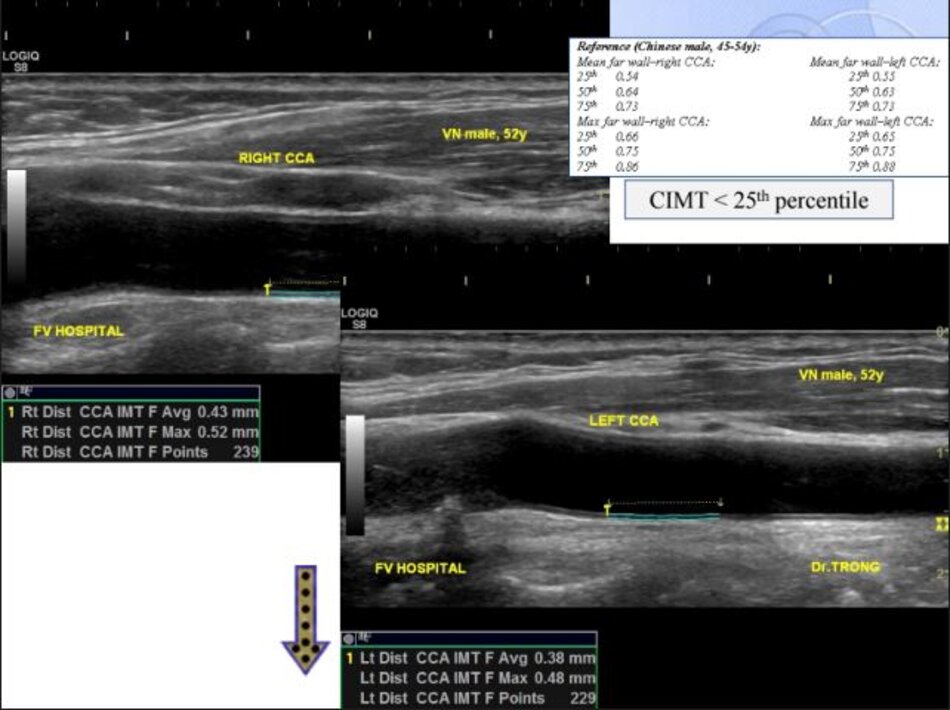
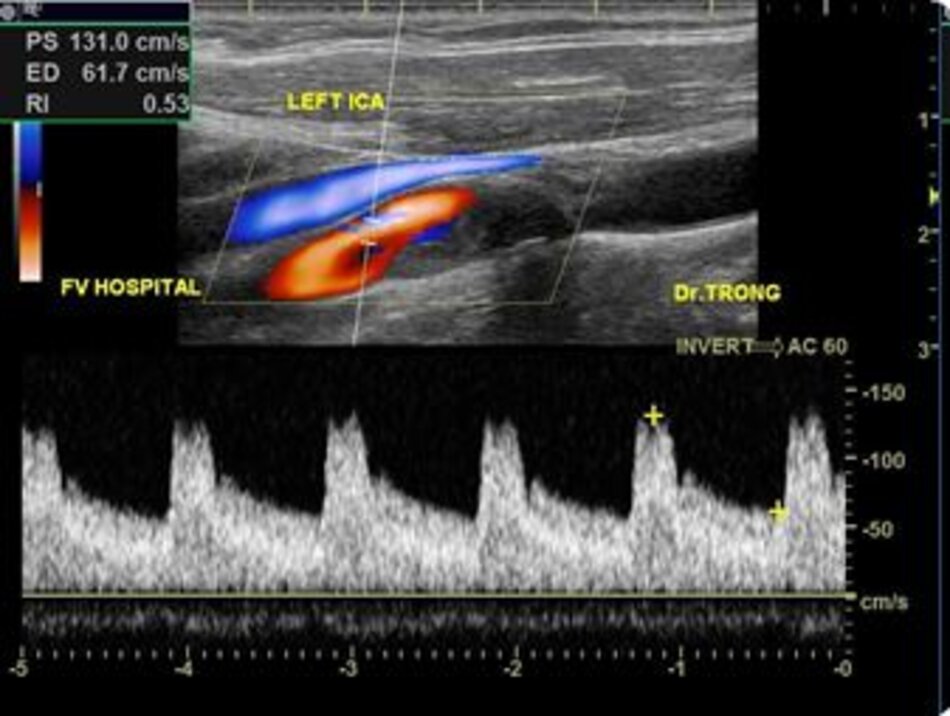
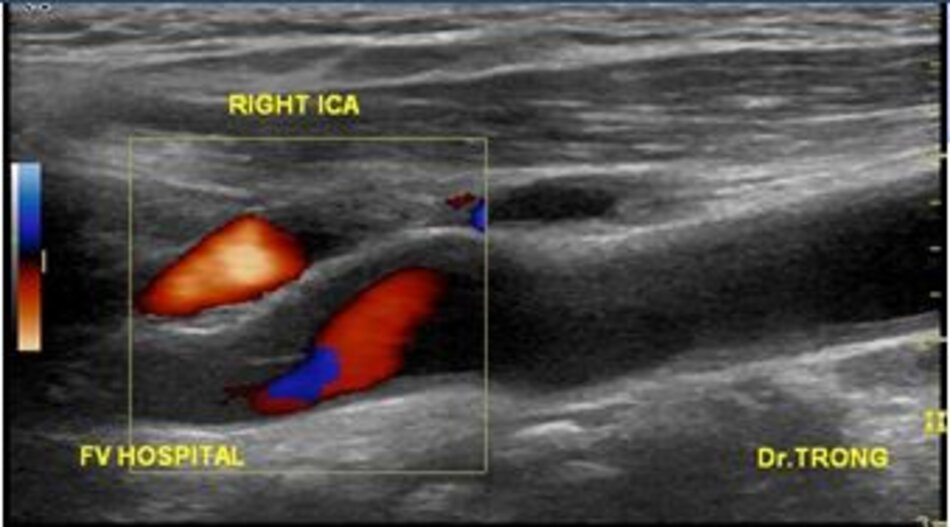
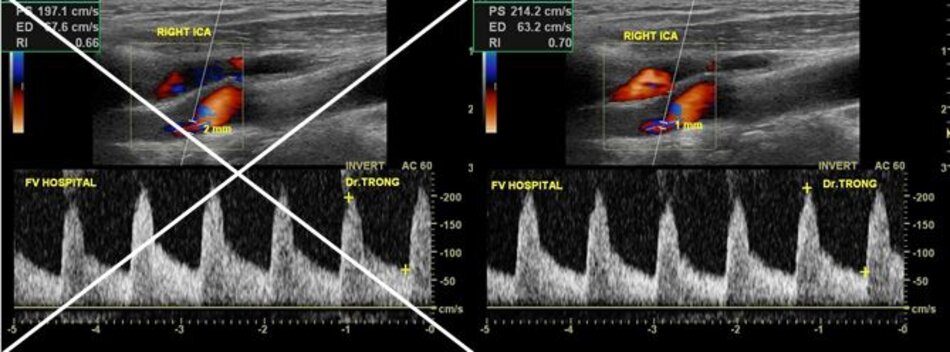
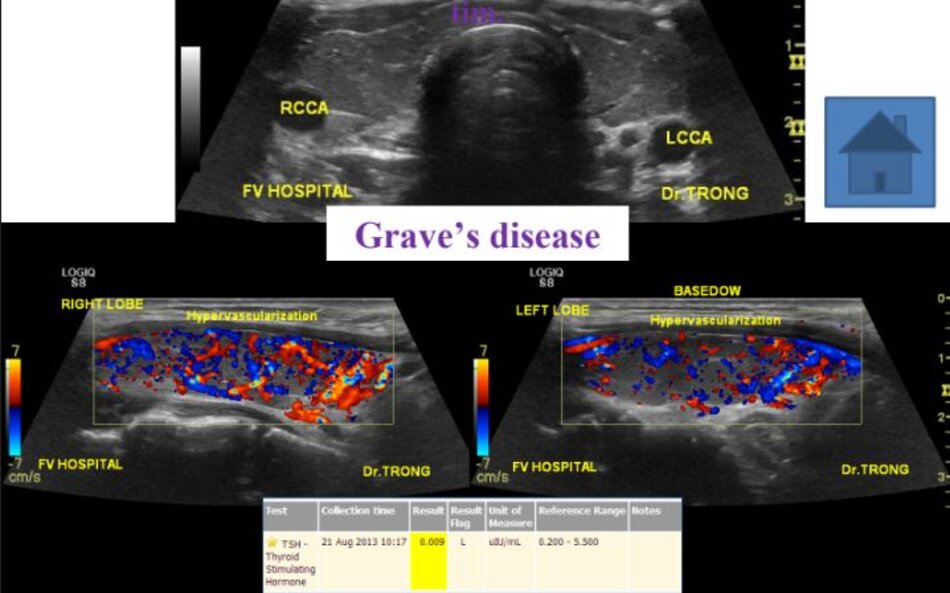
4.2 Siêu âm Dopper hệ cảnh – sống (VN male, 52 yo):
Kết quả:
Mean IMT động mạch cảnh chung phải (thành xa) = 0.43 mm. Max IMT động mạch cảnh chung phải (thành xa) = 0.52 mm. Max IMT hành cảnh phải (thành xa) = 0.50 mm.
Max IMT động mạch cảnh trong trái (thành xa) = 0.40 mm.
Mean IMT động mạch cảnh chung trái (thành xa) = 0.38 mm. Max IMT động mạch cảnh chung trái (thành xa) = 0.48 mm.
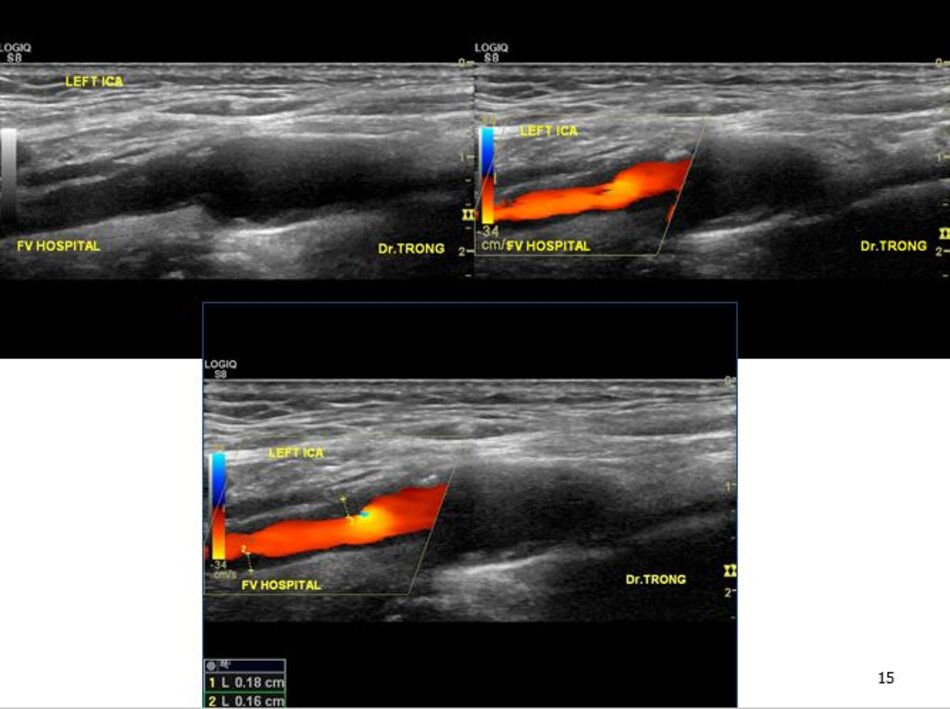
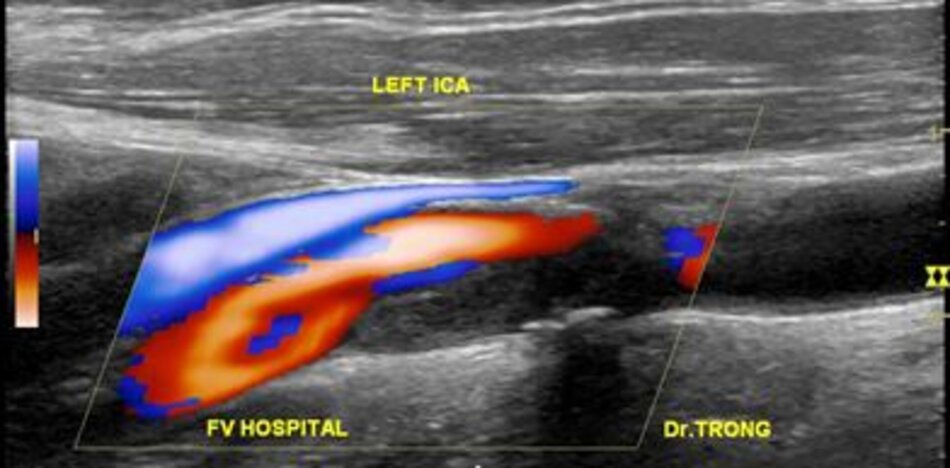
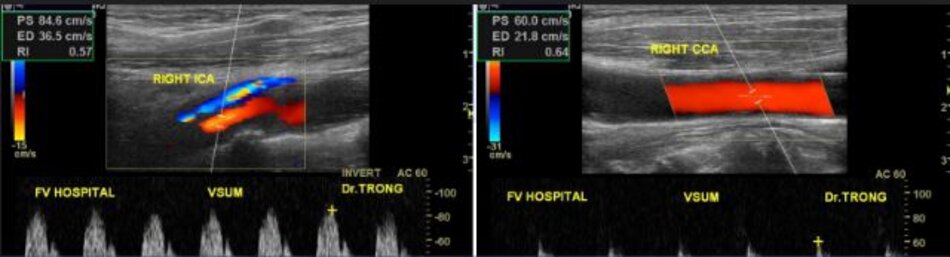
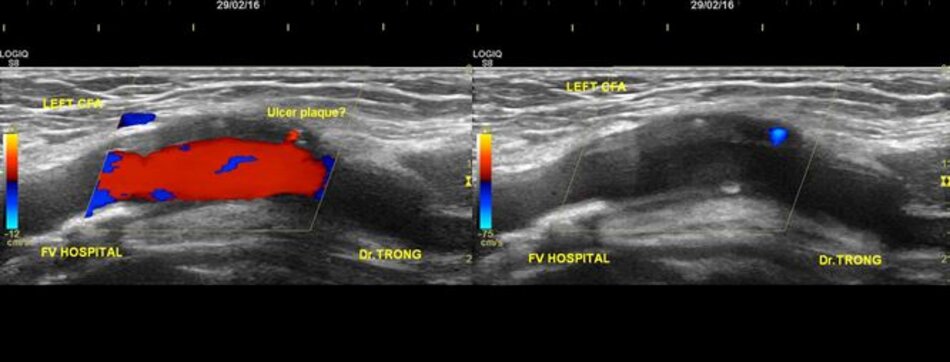
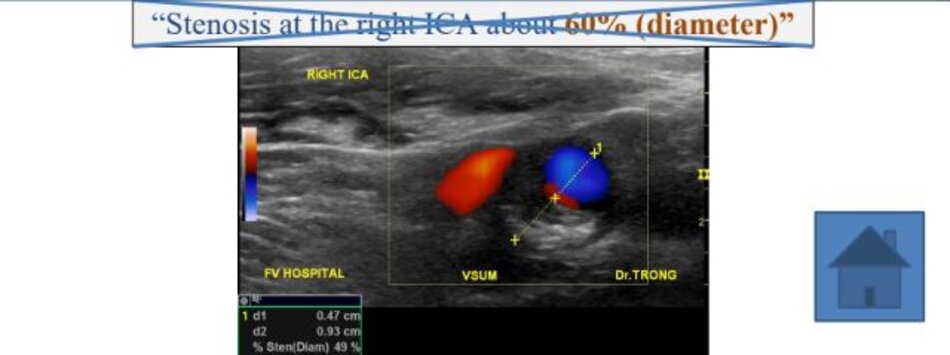
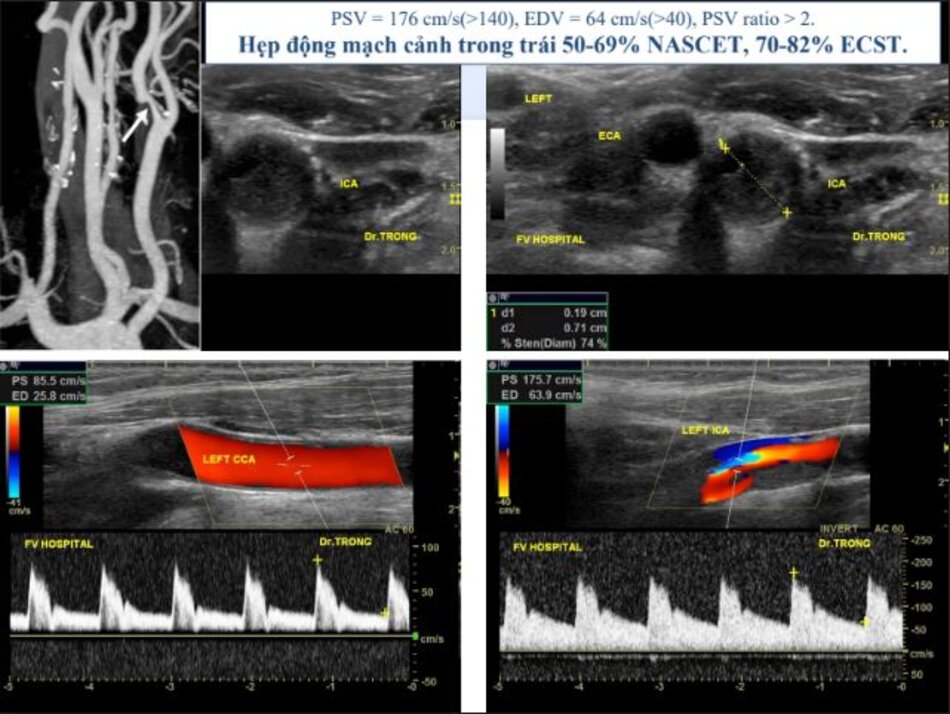
Hiện diện một mảng vữa xơ không ổ loét tại đoạn gần động mạch cảnh trong trái, 4.75 mm bề dày và 17.68 mm chiều dài. Mảng vữa xơ này gây nên hẹp đoạn gần động mạch cảnh trong trái khoảng 74% (phương pháp Châu Âu – ECST). Gia tăng nhẹ vận tốc tại chỗ hẹp, PSV = 176 cm/s. EDV = 64 cm/s. PSV (ICA/CCA) ratio = 176/86 > 2.
Vận tốc dòng chảy và trở kháng mạch máu tại các động mạch khác thuộc hệ cảnh – sống trong giới hạn bình thường.
Hướng và phổ Doppler động mạch cột sống hai bên bình thường.
Kết luận:
- Hẹp đoạn gần động mạch cảnh trong trái, 50-69% NASCET, 70-82% ECST.
- CIMTs trong giới hạn bình thường (< 25th percentile).
5. Kết luận
- Để đánh giá chính xác độ hẹp động mạch cảnh trong, ta cần phải kết hợp siêu âm 2D, Doppler màu và Doppler xung.
- Số đo độ hẹp trực tiếp trên 2D hoặc Doppler màu phải tương ứng trong khoảng hẹp đo được nhờ Doppler xung.
- Bảng đồng thuận 2002 chỉ lấy số đo độ hẹp theo phương pháp Bắc Mỹ (NASCET). Sai lầm thường gặp nhất đó là ta đo theo phương pháp Châu Âu (ECST), nhưng lại đối chiếu với bảng đồng thuận 2002. Do vậy, bảng tiêu chuẩn cải biên là một giải pháp để khắc phục điều này.
- Bảng tiêu chuẩn cải biên cũng đề nghị sử dụng góc Doppler bằng 600 cho tất cả các khảo sát.
- Khẩu kính lòng mạch còn lại cũng cần được ghi nhận. Khẩu kính lòng mạch < 1.5 mm gợi ý hẹp nặng trên hầu hết các bệnh nhân.
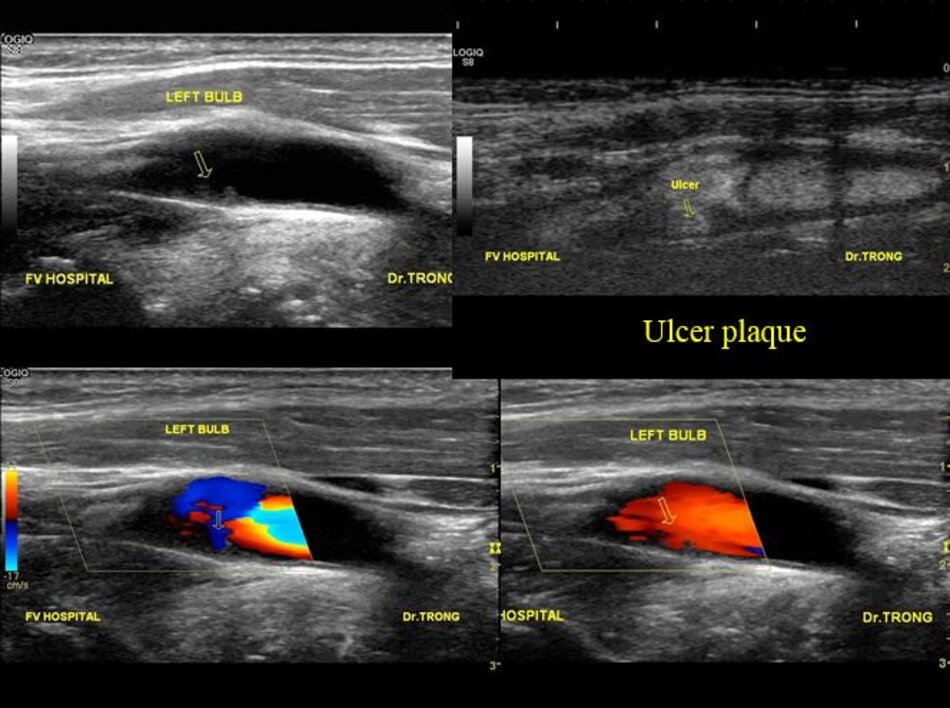
- Mảng vữa xơ có ổ loét cần phải được cảnh báo (nguy cơ nhồi máu não do vi huyết khối hình thành trong ổ loét).
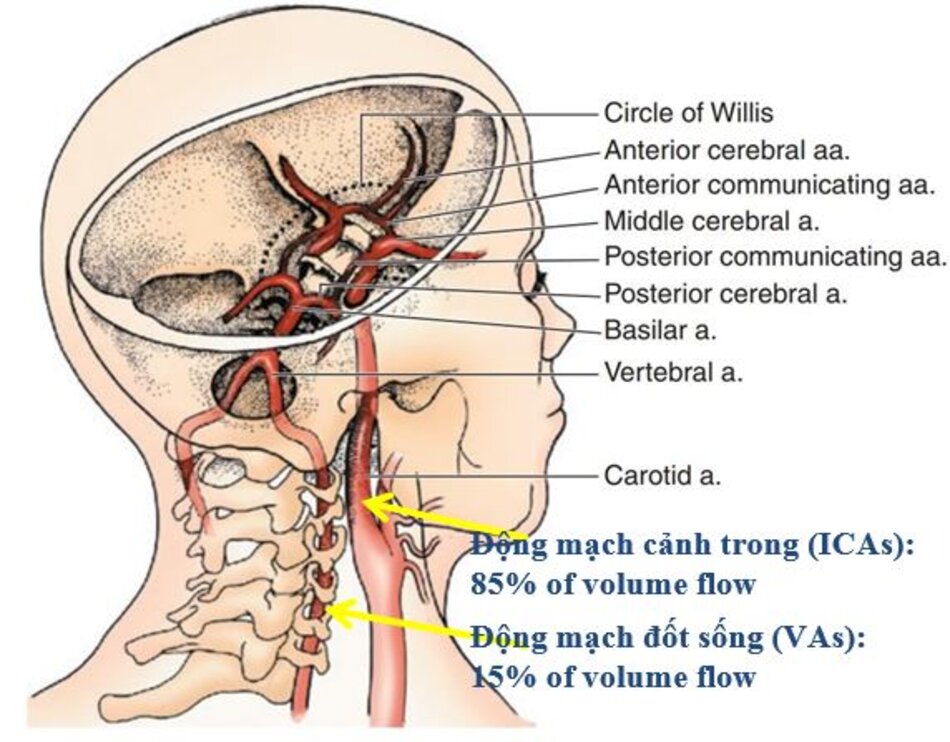
- Bảng đồng thuận 2002 chỉ dành cho hẹp động mạch cảnh trong ngay sau chỗ chia đôi (thường gặp nhất), không dùng cho đoạn ICA có thành mạch song song, không dùng cho CCA cũng như động mạch đốt sống.
6. Tài liệu tham khảo
- William J. Zwiebel and John S. Pellerito. Introduction to Vascular Ultrasonography, 5th Edition. 2005, Elsevier.
- John S. Pellerito and Joseph F. Polak. Introduction to Vascular Ultrasonography, 6th Edition. 2012, Elsevier.
- John S. Pellerito and Joseph F. Polak. Introduction to Vascular Ultrasonography, 7th Edition. 2019, Elsevier.
- W. Schaberle. Ultrasonography in Vascular Diagnosis, 2nd Edition. 2011, Springer-Verlag Berlin Heidelberg.
- W. Schaberle. Ultrasonography in Vascular Diagnosis, 3rd Edition. 2018, Springer-Verlag Berlin Heidelberg.
- Abigail Thrush et al. Peripheral Vascular Ultrasound – How, Why and When. 2nd Edition. 2005. Elsevier.
- Abigail Thrush et al. Peripheral Vascular Ultrasound – How, Why and When. 3rd Edition. 2010. Elsevier.
- M. A. Mansour et al. Vascular Diagnosis. 2nd Edition. 2005, Elsevier.
- Ali F. AbuRhama et al. Noninvasive Vascular Diagnosis – A Practical Guide to Therapy. 3rd Edition. 2013, Springer.
- Donald P. Ridway. Introduction to Vascular Scanning, 3rd Edition. Davie Publishing 2004.
- Paul L. Allan et al. Clinical Doppler Ultrasound, 2nd Edition. Elsevier 2006.
- Joseph F. Polak. Peripheral Vascular Sonography: A Practical Guide. 1992.
- Carol A. Crebs et al. Color Doppler. 2001
- D. Eugene Strandness. Duplex Scanning in Vascular Disorders, 3rd Edition. Lippincott Williams & Wilkins 2002.
- R. Eugene Zierler & David L Dawson. Strandness’s Duplex Scanning in Vascular Disorders: Fifth Edition. 2016. Wolters Kluwer Health
- Emile R. Mohler III et al. Essentials of Vascular Laboratory Diagnosis. 2005, Blackwell Futura.
- Arthur Fleischer, MD et al. Color Power Doppler Ultrasound. 1999.
- Kenneth A Myers et al. Making Sense of Vascular Ultrasound – A hands-on guide. Arnold. 2004.
- Edward I. Bluth and Barbara A. Carroll. The Extracranial Cerebral Vessels (chapter 25 in C.M.Rumack et al. Diagnostic Ultrasound. 4th Edition. 2011, Elsevier.).
- Paul L. Allan and Joanna M. Wardlaw. Carotids, vertebrals and TCD (transcranial Doppler) arteries (chapter 48 in Paul L. Allan et al. Clinical Ultrasound. 3rd Edition. 2011, Elsevier).
- Andrew Nicolaides et al. Ultrasound and Carotid Bifurcation Atherosclerosis. Springer-Verlag London Limited 2012.
- Bernhard Schaller. Imaging of Carotid Artery Stenosis, 2007.
- Matthias Hofer et al. Teaching Manual of Color Duplex Sonography, 3rd Edition. Thieme 2010.
- F.Cattin et al .Echo-Doppler des Arteres Carotides et Vertebrales, Doppler Transcranien. 2001.
- Ph.Melki et al. Echo-Doppler Vasculaire et Visceral. 2001.
- Plainfosse. Echo-Doppler Couleur en Practique Viscerale & Peripherique.
- H. Ric Harnsberger et al. Diagnostic Imaging-Head and Neck, 2004.
- Anil T. Ahuja et al. Diagnostic Imaging-Ultrasound, 2004.
- Mauricio Castillo. Neuroradiology Companion: Methods, Guidelines, and Imaging Fundamentals, 3rd Edition, 2006.
- H.R.Tahmasebpour et al. Sonographic Examination of the Carotid Arteries. Radiographics 2005;25:1561-1575.
- Hideki Ota et al. Quantitative Vascular Measurements in Arterial Occlusive Disease. Radiographics 2005;25:1141-1158.
- Eric M. Rohren et al. A Spectrum of Doppler Waveforms in the Carotid and Vertebral Arteries. AJR 2003; 181:1695-1704
- Mindy M. Horrow et al. Sonography of the Vertebral Arteries-A Window to Disease of the Proximal Great Vessels. AJR 2001; 177:53-59
- Mark A. Kliewer et al. Vertebral Artery Doppler Waveform Changes Indicating Subclavian Steal Physiology. AJR 2000; 174:815-819
- Carlos Nicolau, MD et al. Doppler sonography of the intertransverse segment of the vertebral artery. J Ultrasound Med 19:47-53, 2000.
- T M Buckenham et al. Ultrasound of the extracranial vertebral artery. British Journal of Radiology (2004) 77, 15-20.
- Mehmet Yurdakul, MD et al. Doppler Criteria for Identifying Proximal Vertebral Artery Stenosis of 50% or More. J Ultrasound Med 2011; 30:163–168.
- Yang Hua et al. Color Doppler Imaging Evaluation of Proximal Vertebral Artery Stenosis. AJR 2009; 193:1434–1438.
- Edoardo Vicenzini, MD et al. Extracranial and Intracranial Sonographic Findings in Vertebral Artery Diseases. J Ultrasound Med 2010; 29:1811–1823.
- Halil Arslan, MD et al. Power Doppler scanning in the diagnosis of carotid body tumors. J Ultrasound Med 19:367-370, 2000.
- Seong Ho Park, MD et al. Carotid artery involvement in Takayasu’s arteritis. J Ultrasound Med 20:371-378, 2001.
- James H. Stein et al. ASE CONSENSUS STATEMENT. Use of Carotid Ultrasound to Identify Subclinical Vascular Disease and Evaluate Cardiovascular
- Disease Risk: A Consensus Statement from the American Society of Echocardiography Carotid Intima-Media Thickness Task Force. Journal of the
- American Society of Echocardiography. February 2008.
- P.-J. Touboul et al. Mannheim Carotid Intima-Media Thickness Consensus (2004–2006). An Update on Behalf of the Advisory Board of the 3rd and 4th
- Watching the Risk Symposium 13th and 15th European Stroke Conferences, Mannheim, Germany, 2004, and Brussels, Belgium, 2006.
- Karen Quirk et al. Interpretation of carotid duplex testing. University of California, San Diego School of Medicine. Seminars in Vascular Surgery 26 (2014) 72-85.
- A. Rijbroek et al. Asymptomatic Carotid Artery Stenosis: Past, Present and Future. Eur Neurol 2006;56:139–154.
Xem thêm:
Các con đường tín hiệu và điều trị cơn bão cytokine trong COVID-19