Sản xuất Dược phẩm
PIC/S là gì? Tiêu chuẩn PIC/S GMP được ứng dụng như thế nào?
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Trong quá trình hội nhập toàn cầu hoá hiện nay, để tạo ra các điều kiện thuận lợi cho việc cấp phép và đảm bảo chất lượng tốt nhất cho dược phẩm, đã có nhiều nguyên tắc và các bộ tiêu chuẩn chung ra đời. Chúng được sự đồng thuận và nhất trí cao từ các thành viên tham gia, được vượt qua các bài kiểm tra, giám sát nghiêm ngặt giữa các quốc gia và khu vực đối với ngành thương mại dược phẩm. Một trong số bộ tiêu chuẩn đó có Tiêu chuẩn PIC/S-GMP. Vậy PIC/S là gì? Tiêu chuẩn PIC/S GMP được áp dụng như thế nào ? Mục đích và ý nghĩa thực tiễn của tiêu chuẩn PIC/S-GMP ? Hãy cùng Nhà Thuốc Ngọc Anh tìm hiểu những thông tin về Tiêu chuẩn PIC/S – GMP ngay trong bài viết sau đây nhé.
Khái niệm về PIC, PIC/S
PIC là kí hiệu được viết tắt bởi Pharmaceutical Inspection Convention hay là Công ước thanh tra dược phẩm.
PIC/S là kí hiệu viết tắt của cụm từ Pharmaceutical Inspection Co-operation Scheme – hay Hệ thống hợp tác thanh tra dược phẩm.
Bắt đầu từ tháng 11/1995 đến nay, PIC/S là kí hiệu được quyết định sử dụng làm tên viết tắt chung cho cả hai hệ thống trên và cùng hoạt động song song và có trụ sở chính đặt tại Geneva – Thuỵ Sĩ.
Thông thường, thời gian kể từ khi nộp đơn đăng ký đến lúc được Ủy ban PIC/S chấp nhận là thành viên của PIC/S, sẽ mất khoảng 6 năm.
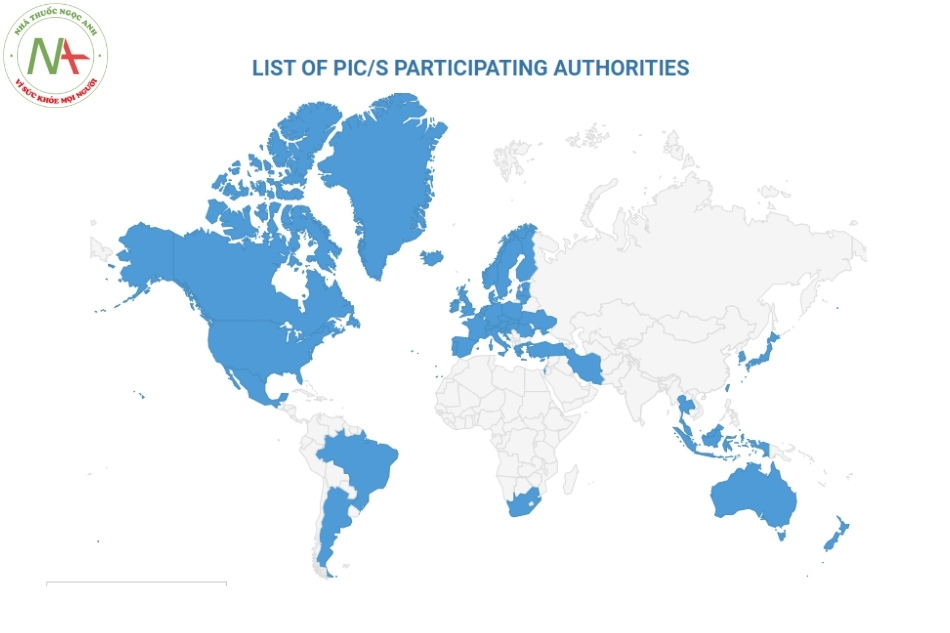
Số liệu thống kê tính đến thời điểm tháng 8/2020, PIC/S đã có 55 thành viên tham gia và đó chính là các cơ quan dược phẩm đến từ nhiều quốc gia trên thế giới, được thống kê trong bảng sau:
| Argentina | Estonia | Ireland | Mexico | Nam Phi |
| Australia | Phần Lan | Israel | Hà Lan | Tây Ban Nha |
| Áo | Pháp * | Italy * | New Zealand | Thụy Điển |
| Bỉ | Đức * | Nhật Bản * | Na Uy | Thụy Sĩ |
| Canada | Hy Lạp | Hàn Quốc | Ba Lan | Thái Lan |
| Đài Loan | Hồng Kông | Latvia | Bồ Đào Nha | Thổ Nhĩ Kỳ |
| Croatia | Hungary | Liechtenstein | Romani | Ukraine |
| Síp | Iceland | Lithuania | Singapore | Anh * |
| Cộng hoà Séc * | Indonesia | Malaysia | Slovakia | Hoa Kỳ |
| Đan Mạch | Iran | Malta | Slovenia |
(*): Các nước có 2 tổ chức là thành viên của PIC/S.
Tiêu chuẩn PIC/S-GMP là gì ?
PIC/S-GMP là tiêu chuẩn do PIC/S đặt ra, được hiểu là Công ước về Thanh tra Dược phối hợp với Chương trình Hợp tác Thanh tra trong lĩnh vực Thực hành Tốt Sản xuất Thuốc (GMP).
PIC/S-GMP là một thỏa thuận không chính thức và có sự ràng buộc giữa các Cơ quan quản lý trong lĩnh vực Thực hành Sản xuất Tốt (GMP) với các sản phẩm dược phẩm hoặc thuốc dùng cho người hoặc thú y.
Trên thế giới, Tiêu chuẩn PIC/S-GMP được mọi người biết đến như là một bộ tiêu chuẩn chất lượng đạt chuẩn quốc tế được áp dụng xuyên suốt trong quá trình sản xuất dược phẩm của doanh nghiệp và các cơ sở sản xuất dược phẩm.
Hiện nay có rất nhiều quốc gia đã và đang phát triển lựa chọn PIC/S-GMP là tiêu chuẩn trong sản xuất dược phẩm tại quốc gia mình vì mang lại nhiều lợi ích trong đảm bảo chất lượng dược phẩm và lợi thế dễ dàng xuất khẩu được sang các quốc gia khác.
Hoạt động của PIC/S-GMP
PIC/S hoạt động với mục tiêu nhằm hướng tới sứ mệnh lãnh đạo phát triển quốc tế, thực hiện và duy trì sự phối hợp hài hoà giữa các tiêu chuẩn GMP và hệ thống giám sát chất lượng dược phẩm của các cơ quan thanh tra dược.
- Phát triển và quảng bá các tiêu chuẩn GMP một cách hài hòa với các tài liệu hướng dẫn.
- Đào tạo, huấn luyện các cơ quan quản lý quốc gia, nhất là cơ quan thanh tra GMP
- Đánh giá và tái đánh giá các đoàn thanh tra
- Tạo điều kiện thuận lợi cho hợp tác và kết nối cho các cơ quan quản lý của các quốc gia và các tổ chức quốc tế khác trên thế giới.

Các đối tượng của tiêu chuẩn PIC/S- GMP hướng tới
- Nhân sự, thao tác, trình độ tay nghề của công nhân.
- Các yêu cầu về cơ sở hạ tầng, nhà xưởng, các trang thiết bị sản xuất, điều kiện vật chất của cơ sở sản xuất.
- Các yêu cầu về quy trình vệ sinh trong sản xuất, vệ sinh môi trường trong nhà xưởng, vệ sinh cá nhân mỗi nhân viên.
- Các yêu cầu về nguyên vật liệu, đánh giá khả năng cung ứng của nhà cung cấp nguyên vật liệu.
- Các yêu cầu về hàm lượng công thức bào chế.
- Chất lượng sản phẩm từ các thử nghiệm mẫu, đánh giá về tiêu chuẩn của từng sản phẩm.
- Xử lý sản phẩm lỗi, không phù hợp, giải quyết các khiếu nại liên của khách hàng.
- Tài liệu và một số hồ sơ thực hiện.
Nội dung được trình bày trong bộ Tiêu chuẩn PIC/S-GMP
Các hướng dẫn trong bộ tiêu chuẩn PIC/S-GMP được chia thành hai phần, cùng với phụ lục kèm theo.
Phần I: Bao gồm các nguyên tắc GMP cần được áp dụng trong công nghệ sản xuất dược phẩm.
Phần II: Bao gồm các tiêu chuẩn GMP đối với các hoạt chất được sử dụng làm nguyên liệu làm thuốc trong sản xuất thuốc.
Cụ thể từng phần như sau:
Về PE 009-14
Chương I: Quản lý chất lượng
Chương II: Nhân sự
Chương III: Mặt bằng và trang thiết bị
Chương IV: Tài liệu
Chương V: Sản xuất
Chương VI: Kiểm soát chất lượng sản phẩm
Chương VII: Các hoạt động thuê ngoài
Phụ lục I: Sản phẩm thuốc vô trùng
Phụ lục II: Các dược chất và sản phẩm sinh học dùng cho người
Phụ lục III: Các thuốc phóng xạ
Phụ lục IV: Thuốc khí
Phụ lục VII: Các sản phẩm thuốc thảo mộc
Phụ lục VIII: Lấy mẫu vật liệu ban đầu và vật liệu đóng gói
Phụ lục XI: Hệ thống máy tính
Phụ lục XIII: Các sản phẩm thuốc điều tra
Phụ lục XV: Thẩm định và xác nhận
Phụ lục XVII: Kiểm tra phát hành theo thời gian thực và phát hành tham số
Phụ lục XIX: Các mẫu tham chiếu và lưu giữ
Mục đích và Ý nghĩa trong thực tiễn của tiêu chuẩn PIC/S-GMP trong ngành sản xuất dược phẩm
Mục đích
Mục đích của hướng dẫn này là tạo những tiêu chuẩn chung trong Thực hành tốt sản xuất thuốc (GMP) với từng chức năng cụ thể:
- Đảm bảo vận hành và duy trì được các tiêu chuẩn chất lượng cao nhất trong nghiên cứu, phát triển, sản xuất và kiểm soát chất lượng của dược phẩm.
- Thúc đẩy sự thống nhất của các cơ quan có thẩm quyền trong vấn đề cấp phép.
- Tạo ra tính đồng bộ và nhất quán trong hệ thống thanh tra và kiểm tra.
- Tháo bỏ các rào cản thương mại trong lĩnh vực dược phẩm giữa các quốc gia và khu vực.
Ý nghĩa thực tiễn
Việc trở thành một trong những thành viên của PIC/S mang lại lợi ích rất to lớn cho các quốc gia thành viên. Không chỉ giúp sản phẩm của doanh nghiệp quốc gia đó luôn được đảm bảo về mặt chất lượng mà còn lợi thế khi được xuất khẩu sang các thị trường của các nước thành viên. Ngoài ra, việc đạt được các tiêu chuẩn PIC/S-GMP còn mang lại những ý nghĩa lo lớn khác cho doanh nghiệp :
PIC/S – GMP giúp nâng cao được năng lực quản lý cho các cơ quan. Thường xuyên được tập huấn, trao đổi thông tin, tạo điều kiện nâng cao được trình độ và học hỏi kinh nghiệm lẫn nhau trong khối tổ chức.
Áp dụng tiêu chuẩn PIC/S – GMP còn giúp doanh nghiệp tiết kiệm chi phí hơn trong thanh tra và kiểm tra. Tránh các trường hợp thanh, kiểm tra trùng lặp gây tốn kém thêm chi phí cho doanh nghiệp.
Khi là doanh nghiệp của quốc gia đã là thành viên của PIC/S và được công nhận đạt chuẩn PIC/S – GMP, thì doanh nghiệp có cơ hội rất lớn để mở rộng mạng lưới phân phối sang các thị trường khác với độ uy tín của sản phẩm cao. Được ưu thế xuất khẩu tới thị trường của các nước thành viên và cả những quốc gia không phải thành viên của PIC/S.
Đạt được tiêu chuẩn PIC/S – GMP tương tự như là doanh nghiệp đã có được một bằng chứng chứng nhận về đảm bảo chất lượng thuốc và các sản phẩm từ dược, tạo được lòng tin cậy cho cả những đối tác và cả người tiêu dùng.
Tại Việt Nam, các cơ sở sản xuất, doanh nghiệp sở hữu các dây chuyền sản xuất đạt tiêu chuẩn PIC/S-GMP sẽ có lợi thế rất lớn, được đấu thầu nhóm 2 trong nhóm thuốc Generic để được phân phối vào các kênh bệnh viện và phòng khám công.
Các thách thức trong quá trình tham gia PIC/S-GMP
Để tham gia PIC/S-GMP cũng đòi hỏi ở các doanh nghiệp rất nhiều công sức và sẽ gặp vô vàng thách thức như:
- Doanh nghiệp cần xây dựng được hệ thống quy định pháp lý cấp quốc gia để đồng bộ với PIC/-GMP.
- Doanh nghiệp cần phải chuẩn bị được các nguồn ngân sách bao gồm ngân sách nhà nước và ngân sách của chính doanh nghiệp.
- Mỗi doanh nghiệp cần cải thiện, nâng cấp nhà xưởng, trang thiết bị, hệ thống quản lý chất lượng, hồ sơ, không ngừng huấn luyện đào tạo, nâng cao trình độ của công, nhân viên trong doanh nghiệp.
- Các doanh nghiệp trong nước cần có tiếng nói chung để có thể huy động được sự tham gia của tất cả các doanh nghiệp trên toàn cả nước.
- Bất cứ một doanh nghiệp hoặc cơ sở sản xuất nào, nếu sản xuất kinh doanh không hợp chuẩn PIC/S-GMP, doanh nghiệp hoặc cơ sở đó đều có thể gặp những khó khăn nhất định mà trong đó có thể bị ngừng sản xuất.
Các doanh nghiệp và cơ sở sản xuất thuốc đạt tiêu chuẩn PIC/S-GMP
Kể từ năm 2015, Bộ Y tế Việt Nam đã khuyến khích các doanh nghiệp, các cơ sở sản xuất dược phẩm trong nước áp dụng tiêu chuẩn PIC/S-GMP trong quy trình sản xuất của mình. Để hiện thực hóa mục tiêu sau 6 năm, Việt Nam sẽ trở thành một trong những thành viên chính thức của tổ chức PIC/S.
Tuy nhiên, bởi chi phí đầu tư ban đầu là rất lớn, cần nhiều chuyên gia và thời gian trong xây dựng nên vẫn chưa có nhiều doanh nghiệp hay cơ sở sản xuất đạt tiêu chuẩn PIC/S tại Việt Nam.
Các doanh nghiệp và cơ sở sản xuất thuốc trong nước đã đạt được tiêu chuẩn PIC/S-GMP và cả EU-GMP được Bộ Y tế công bố theo công văn số 3517/QLD-CL (Đợt 72) được ban hành vào ngày 09 tháng 4 năm 2020.
Danh sách các doanh nghiệp này được đính kèm theo công văn, bạn đọc có thể tìm hiểu thêm tại đây.


bài viết rất hay và hữu ích !!!