nhathuocngocanh.com – OXH HÓA MÀNG NGOÀI CƠ THỂ (ECMO) Ở NGƯỜI LỚN – tải file PDF Tại đây.
Dịch bởi: BS Trịnh D Thế
GIỚI THIỆU
Hỗ trợ tim phổi cơ học thường được áp dụng nhất trong quá trình phẫu thuật tạo thuận lợi cho phẫu thuật tim (ví dụ, mổ bắc cầu tim phổi). Tuy nhiên, hỗ trợ tim phổi cũng có thể được cung cấp một cách lâu dài hơn trong một đơn vị chăm sóc tích cực, mặc dù điều này ít phổ biến hơn.
Hỗ trợ tim phổi kéo dài được gọi là oxy hóa qua màng ngoài cơ thể (ECMO), hỗ trợ sự sống qua màng ngoài cơ thể, hoặc hỗ trợ phổi qua màng ngoài cơ thể. Có hai loại ECMO: TM-ĐM (VA) và TM-TM (VV). Cả hai đều hỗ trợ hô hấp, nhưng chỉ VA ECMO cung cấp hỗ trợ huyết động.
Sự tác động của ECMO đến kết quả điều trị trên lâm sàng cũng như lựa chọn bệnh nhân, các khía cạnh kỹ thuật và các biến chứng sẽ được xem xét tại đây. Chỉ có các vấn đề liên quan đến người lớn được thảo luận. Thông tin mở rộng về các chỉ định, biến chứng và kết quả có sẵn từ trang web của Tổ chức Hỗ trợ sự sống ngoài cơ thể (ELSO) [1].
CÁC KẾT CỤC ĐIỀU TRỊ
Sống còn
Sự sống sót của bệnh nhân trải qua ECMO có thể được phân loại theo chỉ định cho ECMO: suy hô hấp cấp nặng hoặc suy tim.
Suy hô hấp cấp tính
Nhiều nghiên cứu đã đánh giá ảnh hưởng của ECMO đến tỷ lệ tử vong ở bệnh nhân suy hô hấp cấp tính nặng [2-15]. Một số nghiên cứu quan sát và thử nghiệm lâm sàng không kiểm soát ở những bệnh nhân bị suy hô hấp cấp tính nặng ghi nhận tỷ lệ sống sót từ 50 đến 71% trong số những bệnh nhân sử dụng ECMO so với tỷ lệ trước đó (dữ liệu trong quá khứ) [2-10,14-16]. Sau hai thử nghiệm ngẫu nhiên ECMO được thiết kế tương đối kém chất lượng vào những năm 1970, hai thử nghiệm ngẫu nhiên lớn và một phân tích bắt cặp tương đồng đã cho thấy lợi ích của việc chuyển sớm đến một trung tâm ECMO ở những bệnh nhân mắc hội chứng suy hô hấp cấp tính nặng (ARDS) [10,11,17]. Tuy nhiên, các nghiên cứu đã bị trở ngại bởi các chiến lược thông khí không đồng nhất (heterogeneous) trong nhánh điều trị theo quy ước và chồng chéo đáng kể từ các liệu pháp quy ước đến ECMO. Cân đo lại, chúng tôi tin rằng ECMO mang lại lợi ích cho những người không đáp ứng với dịch vụ chăm sóc y tế quy ước thông thường (ví dụ: tỉ số PaO 2/FiO2 liên tục thấp hơn 70 mmHg) và ECMO nên được sử dụng sớm trong quy trình điều trị thay vì là liệu pháp trị liệu cứu nguy; do đó, bệnh nhân người lớn bị suy hô hấp cấp tính nặng nên được chuyển đến trung tâm ECMO để xem xét ECMO sớm trong quá trình điều trị bệnh (ví dụ, trong vòng bảy ngày đầu tiên). Lợi ích tiềm năng từ ECMO phải luôn được cân nhắc trước rủi ro vận chuyển bệnh nhân. Trong các trung tâm ECMO có kinh nghiệm, khoảng 25 % bệnh nhân sẽ cải thiện và phục hồi mà không cần ECMO, trong khi 75 % bệnh nhân sẽ cần ECMO. Trong số những người cần ECMO, 60 đến 70 % sẽ sống sót. Dữ liệu để hỗ trợ chiến lược này bao gồm:
CESAR
Thử nghiệm hỗ trợ thở máy thông thường so với oxy hóa qua màng ngoài cơ thể đối với suy hô hấp cấp tính nặng (CESAR; 2009) đã chỉ định ngẫu nhiên 180 bệnh nhân bị suy hô hấp cấp tính nặng được chuyển đến một trung tâm ECMO duy nhất ở Anh hoặc tiếp tục điều trị thông thường [11]. Nhóm được đề cập đến trung tâm ECMO đã tăng đáng kể tỷ lệ sống sót mà không bị tàn tật sau sáu tháng so với quản lý thông thường (63 so với 47%). Hai mươi lăm % bệnh nhân được giới thiệu ECMO không được điều trị bằng ECMO vì 5 người đã chết trước khi chuyển đến trung tâm ECMO và 16 người được phục hồi với phương thức (protocol) thông khí thông thường được sử dụng bởi trung tâm ECMO. Đáng chú ý, thử nghiệm đã xác định suy hô hấp cấp tính nặng là nhiễm toan hô hấp tăng CO2 với pH động mạch <7,20 hoặc điểm số Murray lớn hơn 3 điểm. Điểm số Murray định lượng mức độ nghiêm trọng của bệnh phổi trên cơ sở tỷ lệ PaO2 /FiO2, áp lực dương cuối kỳ thở ra (PEEP), độ giãn nở (compliance) phổi và X quang phổi. Các tiêu chí loại trừ quan trọng bao gồm tuổi <18 hoặc> 65 tuổi, đặt nội khí quản lớn hơn 7 ngày và chống chỉ định thuốc chống đông máu. Tuy nhiên, thử nghiệm này đã bị phê bình vì các chiến lược thông khí không đồng nhất trong nhóm đối chứng và số lượng lớn bệnh nhân được chuyển sang ECMO không bao giờ nhận thông khí thể tích thấp tiêu chuẩn. Kết luận của thử nghiệm này là người lớn bị suy hô hấp cấp tính nặng nên được chuyển đến trung tâm ECMO để đánh giá ECMO.
EOLIA
Thử nghiệm điều trị ECMO cứu nguy tổn thương phổi trong ARDS nặng (EOLIA; 2018) đã chỉ định ngẫu nhiên cho 249 bệnh nhân bị ARDS nặng ( tỉ lệ [PaO2 : FiO2] <50 trong > 3 giờ hoặc PaO2 : FiO2 <80 trong> 6 giờ) để nhận được sớm (ngay khi đáp ứng các tiêu chí) ECMO tĩnh mạch – tĩnh mạch hoặc thông khí thông thường thể tích lưu thông thấp – áp suất thấp (có thể bao gồm ECMO muộn như một liệu pháp cứu hộ) [17]. ECMO dẫn đến việc cải thiện oxy hóa, nhiều ngày không bị suy thận (46 so với 21%) và ít bệnh nhân bị đột quỵ do thiếu máu cục bộ (0 so với 5%). Mặc dù nghiên cứu đã bị dừng lại sớm bởi ban giám sát và an toàn dữ liệu về kết quả tạm thời có lợi cho ECMO [18], sau khi phân tích cuối cùng, sự khác biệt 11% về tỷ lệ tử vong trong 60 ngày, trong khi cũng đồng thuận ECMO sớm, không đáng kể (35 so với 46%). Mặc dù không có phân tích dưới nhóm chính thức nào được thực hiện, nhưng giữ được lợi ích có thể có từ liệu pháp ECMO sớm, tỷ lệ sống sót cao hơn ở những người nhận được sớm (hai ngày sau khi khởi phát bệnh; 65%) so với muộn (sáu ngày sau khi khởi phát; tức là giải cứu) ECMO (43 %). Liên quan đến các tác dụng không mong muốn, ECMO dẫn đến tỷ lệ cao hơn chảy máu cần truyền máu (46 so với 28%) và giảm tiểu cầu nặng (27 so với 16%) so với điều trị thông thường.
Những kết quả này có thể bị chệch trong việc chăm sóc thông thường bởi một số yếu tố bao gồm chấm dứt sớm thử nghiệm, tỷ lệ cao bệnh nhân mắc bệnh nặng đã chuyển từ nhóm điều trị thông thường sang nhóm ECMO để điều trị cứu hộ (28%; PaO2 trung bình là 51 mmHg so với 73 mmHg khi vào nghiên cứu) và mức độ sử dụng cao trong nhóm kiểm soát của việc sự dụng các liệu pháp điều trị ARDS có cải thiện kết cục hoặc oxy hóa bao gồm nằm sấp (90%), thuốc giãn mạch phổi dạng hít (83%) và thuốc ức chế dẫn truyền thần kinh cơ (100%). Theo ý kiến chúng tôi, nghiên cứu này ủng hộ kết luận rằng những bệnh nhân mắc ARDS nặng không đáp ứng với điều trị đã tối ưu (ví dụ, thông khí thể tích lưu thông thấp có hoặc không có thử nghiệm ngắn về thông khí nằm sấp, thuốc giãn mạch phổi và thuốc ức chế dẫn truyền thần kinh cơ) nên được quản lý bằng ECMO kịp thời chứ không phải là một điều trị cứu hộ.
Các phân tích bắt cặp tương đồng – Một nghiên cứu trên 75 cặp bệnh nhân liên quan mắc hội chứng suy hô hấp cấp tính nặng do cúm H1N1 cho thấy việc chuyển tuyến và chuyển đến trung tâm ECMO có liên quan đến tỷ lệ tử vong tại viện thấp hơn (23,7 so với 52,5%) [10]. 85 % bệnh nhân được chuyển đến trung tâm ECMO đã được điều trị bằng ECMO, trong khi những người khác được cải thiện bằng thông khí thông thường. Ngược lại, một nghiên cứu khác trong cùng một quần thể đã báo cáo không có sự khác biệt khi so sánh với điều trị thở máy thông thường. [12]
Phân tích tổng hợp
Một phân tích tổng hợp của hai thử nghiệm ngẫu nhiên [11,18] và ba nghiên cứu quan sát cho thấy tỷ lệ tử vong trong 60 ngày thấp hơn ở những bệnh nhân sử dụng ECMO tĩnh mạch (34 so với 47%; nguy cơ tương đối 0,73; 95% CI 0,58- 0,92) [19]. Các sự cố y khoa bất lợi có thể đã không được đào xới bởi vì thiếu báo cáo trong các nhóm được kiểm soát nhưng được đánh giá ở mức 19% và có khả năng cao hơn ở những người nhận ECMO so với các chiến lược thông khí cơ học tiêu chuẩn. Một phân tích tổng hợp hệ thống so sánh một số can thiệp ở bệnh nhân ARDS trung bình đến nặng khi thở máy Vt thấp đã báo cáo cho thấy ECMO có liên quan đến giảm tử vong trong 28 ngày [20].
Các nghiên cứu khác đã cho thấy giá trị ở những người cần một “cầu nối” để đến với điều trị ghép tạng. Một ví dụ, trong một nghiên cứu trên 21 bệnh nhân bị suy hô hấp cấp tính do bệnh phổi mô kẽ, sáu người đã được “bắc cầu” thành công để ghép phổi, 5/6 người trong số họ cuối cùng đã được xuất viện [21].
Suy tim
ECMO tĩnh mạch – động mạch (VA) có thể cung cấp hỗ trợ cấp tính trong sốc tim hoặc ngừng tim ở người lớn. Giả sử rằng chức năng não là bình thường hoặc chỉ bị suy giảm một cách tối thiểu, ECMO được cung cấp cho đến khi bệnh nhân hồi phục hoặc nhận được một thiết bị hỗ trợ tâm thất dài hạn như là một cầu nối cho việc ghép tim.
Các nghiên cứu quan sát và báo cáo hàng loạt ca bệnh đã báo cáo tỷ lệ sống sót từ 20 đến 50% trong số những bệnh nhân sử dụng ECMO vì ngừng tim, sốc tim thể nặng hoặc không cai sữa từ phẫu thuật tim phổi sau phẫu thuật tim và kể cả người lớn tuổi [22-33].
● Trong hai nghiên cứu quan sát, ECMO thực hiện cho ngừng tim có liên quan đến tăng tỷ lệ sống so với hồi sức tim phổi quy chuẩn [34,35].
● Những người còn sống sót lâu của ECMO được thực hiện vì sốc tim có sức khỏe tổng quát, sức khỏe thể chất và hoạt động xã hội tốt hơn so với những bệnh nhân cần chạy thận nhân tạo chu kỳ, bị suy tim tiến triển hoặc hồi phục sau ARDS [26].
Trong một nghiên cứu khác về những bệnh nhân bị suy tim phổi cấp tính, tỷ lệ tử vong chung là 60% sau một tháng và 76% sau một năm; tỷ lệ tử vong trở nên tệ hơn nếu ECMO được yêu cầu trong hơn ba ngày [30]. Không giống như ECMO cho suy hô hấp, sẽ không bao giờ có một thử nghiệm kiểm soát ECMO đối với suy tim vì việc chỉ định cho một nhóm kiểm soát là không chính đáng.
Trong một cơ quan đăng ký tổ chức hỗ trợ sự sống ngoài cơ thể, trong số 9000 người trưởng thành trải qua ECMO, 41% sống sót sau khi xuất viện với tỷ lệ sống thấp nhất được báo cáo ở những người mắc bệnh tim bẩm sinh (37%) [31].
Trong một đánh giá tổng quan hệ thống những người trưởng thành bị kéo dài ngừng tim ở bệnh viện, tỷ lệ sống sót là 22% ở 833 bệnh nhân được điều trị ECMO trong quá trình hồi sức và một nửa trong số này đã hồi phục thần kinh tốt [36]. Ngoài ra, 17 người hiến tạng đã được xác định trong dân số không có khả năng sống sót. Dữ liệu có đăng ký cho thấy tỷ lệ sống tương tự 29% trong số 2885 người trưởng thành được hỗ trợ ECMO trong hồi sinh tim phổi [31].
LỰA CHỌN BỆNH NHÂN
Chỉ định
Các hướng dẫn mô tả các chỉ định và thực hành ECMO được xuất bản bởi Tổ chức hỗ trợ sự sống ngoài cơ thể (ELSO) [37,38]. Các tiêu chí để bắt đầu ECMO bao gồm suy tim hoặc suy chức năng phổi cấp tính mức độ nặng mà có khả năng hồi phục và không đáp ứng với điều trị thông thường. Ví dụ về các tình huống lâm sàng có thể gợi ý chỉ định ECMO bao gồm:
- Suy hô hấp do thiếu oxy với tỷ lệ PaO2/FiO2 <100 mmHg mặc dù đã tối ưu hóa các thiết lập máy thở, bao gồm: Vt thấp, PEEP, tỷ lệ I:E. Tài liệu đồng thuận Berlin về hội chứng suy hô hấp cấp tính (ARDS) đề nghị xem xét ECMO khi PaO2/FiO2 <70 [39].
- Suy hô hấp tăng thán khí (CO2) với pH động mạch dưới 7,20 [40].
- Hỗ trợ thông khí như một cầu nối để ghép phổi.
- Suy tim / suy tuần hoàn / Sốc tim kháng trị [41].
- Thuyên tắc phổi diện rộng.
- Ngừng tim [41,42].
- Thất bại trong việc cai bypass tim phổi sau phẫu thuật
- Là cầu nối để ghép tim hoặc phổi hoặc đặt thiết bị hỗ trợ tâm thất [43]
Chống chỉ định tương đối
Chống chỉ định tuyệt đối duy nhất với ECMO là tình trạng tồn tại từ trước không phù hợp với khả năng phục hồi của bệnh nhân (tổn thương thần kinh nghiêm trọng, bệnh lý ác tính ở giai đoạn cuối). Chống chỉ định tương đối bao gồm chảy máu không kiểm soát được và tiên lượng rất xấu từ tình trạng ban đầu. Kết quả trong suy hô hấp sẽ tốt hơn khi ECMO được đặt trong vòng bảy ngày kể từ khi đặt nội khí quản.
KỸ THUẬT
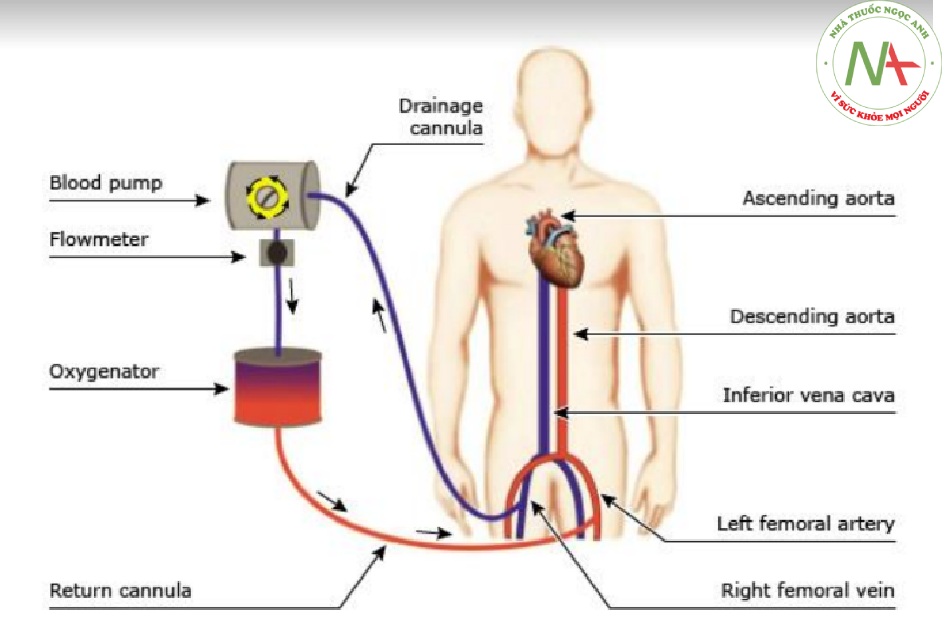
ECMO đang được sử dụng ngày càng nhiều [44]. ECMO chỉ nên được thực hiện bởi các bác sĩ lâm sàng có đào tạo và kinh nghiệm trong việc bắt đầu, duy trì vận hành và ngừng kết nối ECMO.
Trong suốt quá trình ECMO, máu được rút ra khỏi hệ thống mạch máu tự nhiên, lưu thông bên ngoài cơ thể bằng bơm cơ học vàđược đưa vào lại hệ thống tuần hoàn của BN đó. Trong khi bên ngoài cơ thể, máu đi qua một hệ thống trao đổi oxy và trao đổi nhiệt. Trong màng oxy hóa máu, huyết sắc tố trở nên bão hòa hoàn toàn với oxy, trong khi carbon dioxide (CO2 ) được loại bỏ. Sự Oxy hóa được xác định bởi tốc độ dòng chảy, trong khi loại bỏ CO2 có thể được kiểm soát bằng cách điều chỉnh tốc độ dòng khí ngược dòng qua máy tạo oxy [45].
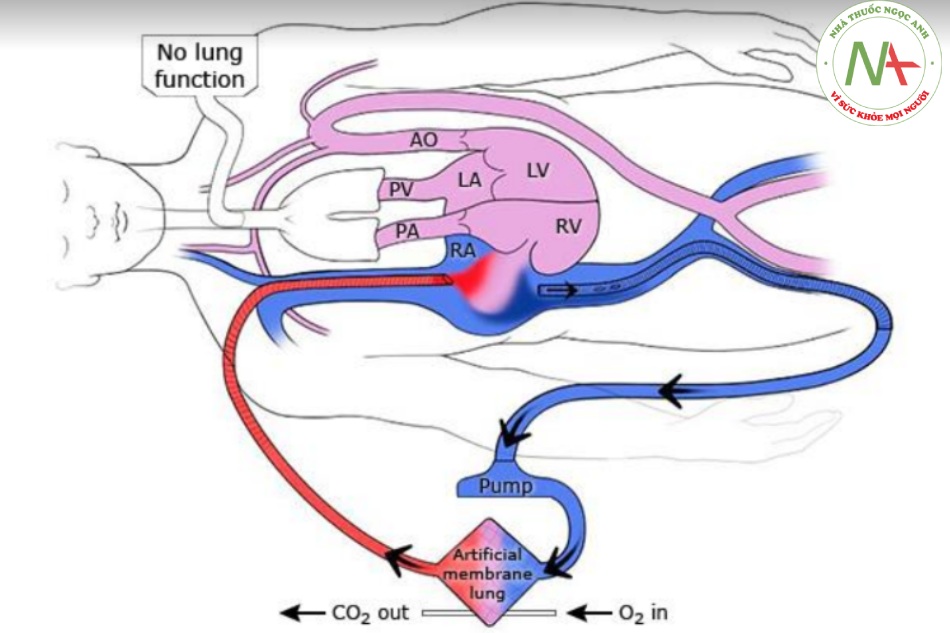
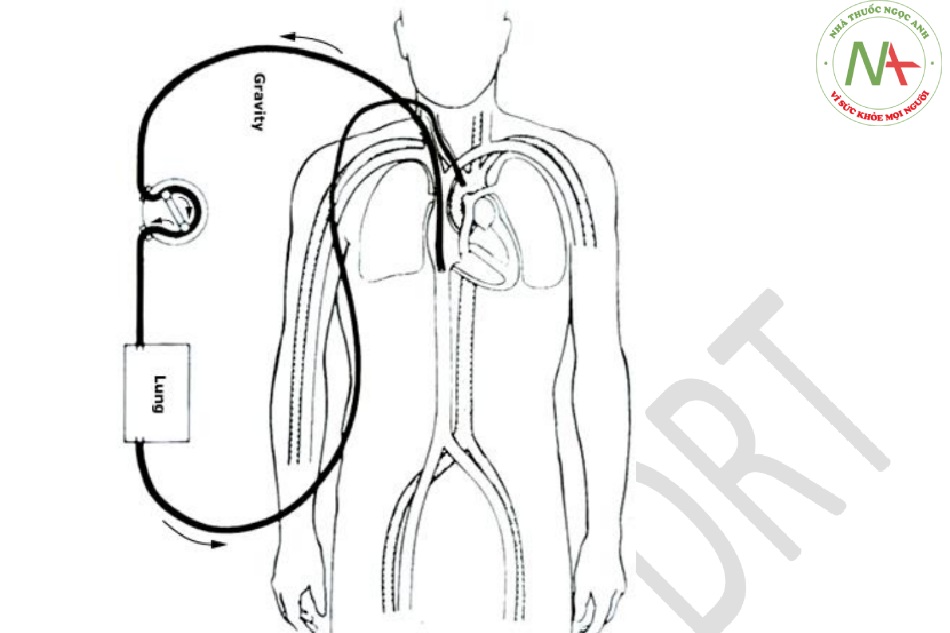
ECMO có thể là tĩnh mạch – tĩnh mạch (VV) hoặc tĩnh mạch – động mạch (VA):
- Trong VV ECMO, máu được trích ra từ tĩnh mạch chủ hoặc tâm nhĩ phải và trở về tâm nhĩ phải ( hình 1 ). VV ECMO cung cấp hỗ trợ hô hấp, nhưng bệnh nhân phụ thuộc vào huyết động học của chính mình.
- Trong VA ECMO, máu được trích ra từ tâm nhĩ phải và quay trở lại hệ thống động mạch, đi vòng về tim và phổi ( hình 2 và hình 3 ). VA ECMO cung cấp cả hỗ trợ hô hấp và huyết động. Lợi ích bổ sung của hỗ trợ huyết động đi kèm với rủi ro bổ sung, sẽ được thảo luận dưới đây. (Xem ‘Biến chứng đặc trưng VA ECMO’ bên dưới.)
Khởi đầu
Một khi đã quyết định rằng ECMO sẽ được bắt đầu, bệnh nhân được chống đông (thường là dùng heparin tiêm tĩnh mạch) và sau đó đặt ống thông vào. Hỗ trợ ECMO được bắt đầu khi cannulae được kết nối với các chi phù hợp với vòng ECMO.
Đặt ống thông – Ống thông (cannula) thường được đặt trực tiếp bằng kỹ thuật Seldinger. Các ống thông lớn nhất có thể được đặt trong các mạch máu được sử dụng.
Đối với VV ECMO, ống thông tĩnh mạch thường được đặt phổ biến ở tĩnh mạch đùi phải hoặc trái (để lấy máu ra) và tĩnh mạch cảnh trong phải (để trả máu về). Đầu của ống thông xương đùi nên được duy trì gần điểm nối của tĩnh mạch chủ dưới và tâm nhĩ phải, trong khi đầu ống thông TM chủ trên nên được duy trì gần chỗ giao của tĩnh mạch chủ trên và tâm nhĩ phải. Ngoài ra, một ống thông đôi (double lumen) có thể được dùng mà đủ lớn để đạt lưu lượng máu từ 4 đến 5 L/phút [46]. Ống thông có sẵn trong nhiều kích cỡ, với 31F là lớn nhất và thích hợp nhất cho nam giới trưởng thành. Các ống lấy máu ra và trả máu về đã được thiết kế để tránh hiện tượng tái tuần hoàn (recirculation)
Đối với VA ECMO, một ống thông tĩnh mạch được đặt trong tĩnh mạch chủ dưới hoặc tâm nhĩ phải (để lấy máu ra) và một ống thông động mạch được đặt vào động mạch đùi phải (để trả máu về).
Tiếp cận mạch máu đùi được ưa thích cho VA ECMO vì việc đè ép mạch máu tương đối dễ dàng. Hạn chế chính của tiếp cận mạch máu đùi là thiếu máu cục bộ ở phần dưới của chi. Khả năng của biến chứng này có thể được giảm bằng cách đặt thêm một ống thông tái cho động mạch ngoại biên từ ống thông động mạch đùi và chuyển một phần máu truyền vào ống thông này để “tái tưới máu” vùng dưới thấp. Ngoài ra, một ống thông có thể được đưa vào động mạch chày sau để dòng chảy ngược về vùng dưới thấp [47].
Đôi khi, các mạch xương đùi không phù hợp để đặt ống thông VA ECMO (ví dụ, bệnh nhân bị bệnh động mạch ngoại biên nghiêm trọng hoặc tái tạo động mạch đùi trước). Trong trường hợp như vậy, động mạch cảnh chung phải hoặc động mạch dưới đòn có thể được sử dụng. Theo kinh nghiệm của chúng tôi, có nguy cơ từ 5 đến 10% nguy cơ nhồi máu não lớn khi sử dụng động mạch cảnh chung phải. Việc sử dụng động mạch dưới đòn mang lại lợi thế cho phép bệnh nhân trên ECMO được di chuyển [48].
Đối với ECMO sau phẫu thuật tim, cannula được sử dụng cho phẫu thuật bắc cầu tim phổi có thể được chuyển từ máy tim phổi sang hệ thống tuần hoàn ECMO, với máu chảy ra từ tâm nhĩ phải và được tái sử dụng vào động mạch chủ tăng dần.
Điều chỉnh (chuẩn độ)
Sau khi cannulation, bệnh nhân được kết nối với hệ thống ECMO và lưu lượng máu được tăng lên cho đến khi các thông số hô hấp và huyết động tương đối là thỏa đáng. Các mục tiêu hợp lý bao gồm:
- Độ bão hòa oxyhemoglobin động mạch SaO2> 90% đối với VA ECMO hoặc SaO2> 75% đối với VV ECMO
- Độ bão hòa oxyhemoglobin tĩnh mạch < 20 đến 25% so với độ bão hòa động mạch, được đo trên đường tĩnh mạch.
- Tưới máu mô tương đối đầy đủ, được xác định bởi huyết áp động mạch, độ bão hòa oxy tĩnh mạch và mức độ lactate máu.
Duy trì
Một khi các mục tiêu hô hấp và huyết động ban đầu đã đạt được, lưu lượng máu được duy trì ở mức đó. Đánh giá và điều chỉnh thường xuyên được tạo thuận lợi bởi phương pháp oxy hóa tĩnh mạch liên tục, đo trực tiếp độ bão hòa oxyhemoglobin của máu trong chi tĩnh mạch của vòng tuần hoàn ECMO. Khi độ bão hòa oxyhemoglobin tĩnh mạch dưới mức mục tiêu, các biện pháp can thiệp có thể hữu ích bao gồm tăng một hoặc nhiều điều sau đây: lưu lượng máu, thể tích nội mạch hoặc nồng độ hemoglobin. Giảm sự hấp thu oxy toàn thân bằng cách giảm nhiệt độ cũng có thể hữu ích.
Chống đông máu được duy trì trong suốt ECMO với truyền liên tục heparin không phân đoạn hoặc chất ức chế thrombin trực tiếp được điều chỉnh thông qua xét nghiệm thời gian đông máu hoạt hóa (ACT) từ 180 đến 210 giây. Mục tiêu ACT bị giảm nếu chảy máu phát triển. ACT dễ dàng được xác định tại điểm chăm sóc, nhưng xét nghiệm thời gian thromboplastin một phần hoạt hóa (aPTT, TCK) huyết tương (1,5 lần bình thường) cũng có thể được sử dụng. Xét nghiệm đo độ đàn hồi cục máu (thromboelastography) là một bổ trợ hữu ích. Khi heparin được sử dụng, tác dụng chống đông máu phụ thuộc vào lượng antithrombin nội sinh (AT3). Nếu nghi ngờ thiếu AT3, mức độ thiếu có thể được đo. Nếu dưới 50 % bình thường, AT3 được thay thế bằng huyết tương tươi đông lạnh. Ít phổ biến hơn, một số trung tâm chuyên chuyên sâu theo dõi yếu tố Xa. Một đánh giá của 16 nghiên cứu cho thấy các mục tiêu tối ưu khác nhau giữa các trung tâm dẫn đến tỷ lệ chảy máu và huyết khối thay đổi [49]. (Xem phần “Thiếu antithrombin” .)
Tiểu cầu được tiêu thụ liên tục trong ECMO vì chúng được kích hoạt khi tiếp xúc với khu vực bề mặt lạ. Số lượng tiểu cầu nên được duy trì lớn hơn 50.000 / microliter, có thể cần truyền tiểu cầu.
Vòng tuần hoàn ECMO thường là nguồn oxy duy nhất ở những bệnh nhân bị suy tim hoặc phổi hoàn toàn. Việc cung cấp oxy phụ thuộc vào lượng huyết sắc tố và lưu lượng máu. Nguy cơ lưu lượng máu cao nghiêm trọng hơn nguy cơ truyền máu, do đó huyết sắc tố được duy trì trên 12 g / dL ở bệnh nhân ECMO [50].
Cài đặt máy thở được giảm trong ECMO để tránh chấn thương khí áp (barotrauma), chấn thương thể tích (volutrauma) (nghĩa là tổn thương phổi do máy thở) và độc tính oxy. Áp lực đường thở cao nguyên phải được duy trì dưới 20 cm H2O và FiO2 dưới 0,5. Giảm hỗ trợ máy thở thường đi kèm với tăng hồi lưu tĩnh mạch (venous return), giúp cải thiện cung lượng tim.
Chúng tôi thực hiện mở khí quản sớm để giảm khoảng chết và cải thiện sự thoải mái cho bệnh nhân. Bệnh nhân thường yêu cầu an thần nhẹ trong ECMO, mặc dù chúng tôi muốn duy trì bệnh nhân tỉnh táo, rút ống và thở tự nhiên. (Xem phần “Tổng quan về mở khí quản” .)
Các cân nhắc đặc biệt
VV ECMO thường được sử dụng cho suy hô hấp, trong khi VA ECMO được sử dụng cho suy tim. Có những cân nhắc duy nhất cho từng loại ECMO, có ảnh hưởng đến việc quản lý.
- Lưu lượng máu – Tốc độ dòng chảy gần tối đa thường được mong muốn trong VV ECMO để tối ưu hóa việc cung cấp oxy. Ngược lại, tốc độ dòng chảy được sử dụng trong VA ECMO phải đủ cao để cung cấp đủ áp lực tưới máu và độ bão hòa oxyhemoglobin tĩnh mạch (đo trên đường máu ra), nhưng đủ thấp để cung cấp đủ tiền tải để duy trì luồng tống của thất trái.
- Lợi tiểu – Vì hầu hết bệnh nhân bị quá tải dịch khi bắt đầu ECMO, nên thuốc lợi tiểu tích cực được cho phép một khi bệnh nhân ổn định trên ECMO. Siêu lọc có thể dễ dàng được thêm vào vòng tuần hoàn ECMO nếu bệnh nhân không thể sản xuất đủ nước tiểu dù đã dùng thuốc lợi tiểu.
Theo dõi thất trái – khả năng tống thất trái nên được theo dõi chặt chẽ trong VA ECMO vì chức năng thất trái có thể xấu đi. Nguyên nhân thường là do đa yếu tố, bao gồm đã rối loạn chức năng thất trái (trước đây và hiện tại) và không khả năng tải do tâm thất trái bị căng phồng do lưu lượng máu liên tục đến thất trái từ tuần hoàn phế quản và thất phải. Cung lượng thất trái có thể được theo dõi chặt chẽ bằng cách xác định xung trong dạng sóng của động mạch và bằng siêu âm tim thường xuyên. Các can thiệp có thể cải thiện cung lượng thất trái bao gồm inotropes (ví dụ, dobutamine, milrinone) để tăng khả năng co bóp và chống co thắt bóng động mạch chủ để giảm hậu tải và tạo cải thiện cung lượng thất trái.
Giải áp tâm thất trái cấp cứu là điều cần thiết để tránh xuất huyết phổi nếu không thể duy trì tống máu thất trái mặc dù có bóng đối xung nội động mạch chủ (intra-aortic balloon counterpulsation) và các thuốc tăng co bóp. Điều này có thể được thực hiện bằng phẫu thuật hoặc qua da. Các phương pháp giải nén thất trái qua da bao gồm mở vách liên nhĩ bằng bóng (transatrial balloon septostomy) hoặc đặt vào nhĩ trái hoặc đặt cannula hút máu vào tâm thát trái.
Cai ECMO
Đối với bệnh nhân suy hô hấp, sự cải thiện về hình ảnh X quang, độ giãn nở phổi và bão hòa oxyhemoglobin động mạch cho thấy bệnh nhân có thể sẵn sàng được giải phóng khỏi ECMO. Đối với bệnh nhân bị suy tim, tăng dòng máu phụt qua động mạch chủ tương quan với việc cải thiện cung lượng thất trái và chỉ ra rằng bệnh nhân có thể sẵn sàng để được giải phóng khỏi ECMO.
Một hoặc nhiều thử nghiệm đưa bệnh nhân ra khỏi ECMO nên được thực hiện trước khi ngừng ECMO vĩnh viễn:
- Các thử nghiệm VV ECMO được thực hiện bằng cách loại bỏ tất cả dòng khí ngược chiều qua thiết bị oxy máu. Lưu lượng máu màng ngoài cơ thể không đổi, nhưng trao đổi khí không xảy ra. Bệnh nhân được theo dõi trong vài giờ, trong suốt quá trình đó, cài đặt máy thở là cần thiết để duy trì đủ oxy và thông khí khi tắt ECMO đã được quyết định.
- Các thử nghiệm VA ECMO yêu cầu kẹp tạm thời cả hai đường hút máu ra và truyền máu về, đồng thời cho phép vòng tuần hoàn ECMO lưu thông qua một cầu nối giữa động mạch và tĩnh mạch các chi. Điều này ngăn ngừa huyết khối của máu ứ đọng trong vòng tuần hoàn ECMO. Ngoài ra, các đường động mạch và tĩnh mạch nên được rửa liên tục bằng nước muối sinh lý chứa heparin hoặc xen kẽ với máu có heparin từ hệ thống ECMO. Các thử nghiệm VA ECMO thường có thời gian ngắn hơn so với các thử nghiệm VV ECMO vì nguy cơ hình thành huyết khối cao hơn.
Khi quyết định đã được đưa ra để ngừng ECMO, ống thông được loại bỏ. Cầm máu được thực hiện bằng cách đè ép các vị trí đặt cannula. Đối với những bệnh nhân đã nhận VA ECMO, cần ít nhất ba mươi phút đè ép tại vị trí động mạch
BIẾN CHỨNG
Các biến chứng chính là chảy máu và huyết khối.
Chảy máu
Chảy máu xảy ra ở 30 đến 50 % bệnh nhân sử dụng ECMO và có thể đe dọa tính mạng [49,51]. Đó là do cả việc chống đông máu liên tục và rối loạn chức năng tiểu cầu. Kỹ thuật phẫu thuật tỉ mỉ, duy trì số lượng tiểu cầu lớn hơn 50.000/mm3 và duy trì thời gian đông máu được kích hoạt mục tiêu (ACT) làm giảm khả năng chảy máu.
Can thiệp là cần thiết khi chảy máu nghiêm trọng xảy ra. Chảy máu từ vết thương phẫu thuật thường đòi hỏi bộc lộc kịp thời với việc sử dụng đốt điện rộng rãi. Xuất huyết vào các khoang cơ thể (ví dụ bụng, khoang màng phổi) có thể cần thăm dò phẫu thuật để đạt được cầm máu, sau đó nên đóng – hút hỗ trợ bằng chân không (vacuum- assisted ) được khuyến nghị vì nó cho phép loại bỏ và đo lượng máu. Các chất ức chế plasminogen (ví dụ, axit aminocaproic ) có thể được truyền hoặc có thể ngừng sử dụng heparin trong vài giờ, nhưng những hành động này có thể làm tăng nguy cơ huyết khối mạch [52-54].
Truyền yếu tố VII hoạt hóa đã được báo cáo với kết quả hỗn tạp và chỉ nên được xem xét cho xuất huyết đe dọa tính mạng sau khi tất cả các lựa chọn khác đã thất bại [55,56].
ACT mục tiêu thường được giảm một khi chảy máu xảy ra và truyền thuốc chống đông máu được giảm hoặc giữ yên. Ví dụ, ACT mục tiêu có thể trở thành 170 đến 190 giây, thay vì 210 đến 230 giây. Với các thiết bị hiện đại, việc chống đông máu có thể được dừng lại hoàn toàn trong nhiều ngày nếu chảy máu là một vấn đề. Yếu tố tái tổ hợp VIIa đã được sử dụng cho một số trường hợp chảy máu kháng trị [57].
Thuyên tắc do huyết khối
Thuyên tắc huyết khối hệ thống do hình thành huyết khối trong màng oxy hóa ngoài cơ thể là một biến chứng có thể tàn phá với một báo cáo cho thấy tỷ lệ thuyên tắc phổi có thể lên tới 16% [49,58,59]; tỷ lệ huyết khối tĩnh mạch sâu có thể cao hơn (lên đến 70 %) và có thể liên quan đến đặt cannula, đặc biệt là cannula đùi – đùi. Tác động của nó lớn hơn với ECMO VA so với ECMO VV vì truyền máu vào hệ tuần hoàn. Thuốc chống đông máu đạt được mục tiêu ACT và theo dõi sát vòng tuần hoàn để tìm dấu hiệu hình thành cục máu đông để ngăn ngừa thuyên tắc do huyết khối ở hầu hết bệnh nhân.
Theo dõi sát các dấu hiệu hình thành cục máu đông bao gồm kiểm tra mặc định hàng ngày tất cả các đầu nối và theo dõi áp lực xuyên màng oxy hóa máu. Một sự thay đổi đột ngột áp lực xuyên màng gợi ý cho biết một cục huyết khối đã phát triển. Các cục máu đông lớn hoặc di động cần thay vòng tuần hoàn hoặc các thành phần hệ thống ECMO ngay lập tức. Mồi vòng tuần hoàn thường được thực hiện ngay tạigiường nếu ACT mục tiêu đã bị giảm do chảy máu vì nguy cơ hình thành huyết khối là lớn nhất trong tình huống này. Có một vòng tuần hoàn đã được mồi sẵn sẽ tạo điều kiện thuận lợi cho việc thay màng hoặc thành phần hệ thống ECMO khẩn cấp, nếu cần thiết.
Thần kinh
Tỷ lệ tổn thương thần kinh ở bệnh nhân suy hô hấp ở người trưởng thành được ghi nhận bởi ELSO là 10%. Tỷ lệ suy tim và được sử dụng ECMO trong quá trình hồi sức tim phổi là 50% [9,60].
Liên quan đến can thiệp đặt cannula – Một loạt các biến chứng có thể xảy ra trong quá trình đặt cannula, bao gồm thủng mạch máu với xuất huyết, bóc tách động mạch, thiếu máu cục bộ và vị trí không chính xác (ví dụ, ống thông tĩnh mạch trong động mạch). Những biến chứng này rất hiếm (<5%). Một bác sĩ phẫu thuật lành nghề và có kinh nghiệm là rất quan trọng để tránh hoặc giải quyết các biến chứng như vậy.
Giảm tiểu cầu do Heparin – Giảm tiểu cầu do Heparin (HIT) có thể xảy ra ở những bệnh nhân dùng ECMO. Khi HIT được chứng minh, truyền dịch heparin nên được thay thế bằng thuốc chống đông máu không phải heparin [61]. Chúng tôi ủng hộ argatroban vì thời gian bán hủy của nó ngắn và với phạm vi mục tiêu ACT tương tự là có hiệu quả. (Xem phần “Xử trí giảm tiểu cầu do heparin” .)
Biến chứng đặc hiệu VA ECMO
- Xuất huyết phổi – Phù phổi và xuất huyết có thể xảy ra ở những bệnh nhân không có khả năng làm rỗng thất trái (LV) trong VA ECMO. Phù phổi xảy ra khi áp lực nhĩ trái (LA) vượt quá 25 mmHg. Nó được điều trị bằng cách dẫn lưu LA hoặc LV. (Xem ‘Cân nhắc đặc biệt’ ở trên.)
- Huyết khối tim – Có lưu lượng máu ngược trong động mạch chủ tăng dần bất cứ khi nào động mạch đùi và tĩnh mạch đùi được sử dụng cho VA ECMO. Sự ngưng trệ của máu có thể xảy ra nếu cung lượng thất trái không được duy trì, điều này có thể dẫn đến huyết khối.
- Thiếu oxy mạch vành hoặc thiếu oxy não – Trong VA ECMO, máu bão hòa hoàn toàn trả vào động mạch đùi từ vòng tuần hoàn ECMO sẽ ưu tiên tưới máu cho các chi dưới và nội tạng bụng. Máu được bơm ra từ trái tim sẽ chọn lọc tưới máu cho tim, não và các chi trên. Kết quả là, độ bão hòa oxyhemoglobin của máu tưới máu cho các chi dưới và nội tạng bụng có thể cao hơn đáng kể so với việc tưới máu cho tim, não và các chi trên. Tình trạng thiếu oxy tim và não có thể tồn tại và không được nhận ra nếu oxy được theo dõi chỉ sử dụng máu từ chi dưới. Để tránh biến chứng này, cần theo dõi độ bão hòa oxyhemoglobin động mạch ở cực trên bên phải.
- Tổn thương thần kinh – Trong một báo cáo về tổn thương thần kinh ở bệnh nhân ECMO tim (VA) ở một cơ sở, 42 trong số 87 bệnh nhân bị chấn thương thần kinh kéo dài (khoảng 50%) [60]. Các loại tổn thương thần kinh bao gồm hôn mê do nguyên nhân không chắc chắn (11 bệnh nhân), bệnh não (11 bệnh nhân), tổn thương não do thiếu oxy (9 bệnh nhân), đột quỵ (7 bệnh nhân), chết não (3 bệnh nhân) và bệnh giật rung cơ (1 bệnh nhân). Điều quan trọng là phải nhận ra rằng những phát hiện này có thể là hậu quả của tình trạng thúc đẩy bởi ECMO, chứ không phải là một biến chứng của quá trình ECMO. Một báo cáo khác cho thấy mức độ tán huyết thấp có thể xảy ra trong VA-ECMO có thể dẫn đến đột quỵ không chảy máu[62].
TƯƠNG LAI
Các ứng dụng cho ECMO có thể mở rộng trong tương lai bao gồm hỗ trợ thất trái tạm thời qua da và ECMO lưu lượng thấp để loại bỏ CO2 (ECOOR) [63]. Ngoài ra, các công nghệ mới sẽ cải thiện tính đơn giản và an toàn của ECMO, bao gồm màng oxy hóa máu thế hệ mới, máy bơm và lớp phủ bề mặt mới.
Màng oxy hóa máu sử dụng sợi rỗng được cấu tạo từ polymethyl-pentene có thể sử dụng thường quy và có thể được sử dụng trong nhiều tuần [64- 66]. Ưu điểm so với các thiết bị cũ bao gồm thể tích dịch mồi thấp hơn, thời gian mồi nhanh, rò rỉ huyết tương giảm và trở kháng lưu lượng máu thấp, có thể làm giảm sự hoạt hóa và tiêu hủy tiểu cầu. Một nghiên cứu báo cáo rằng không có sự khác biệt giữa các màng oxy hóa máu mới hơn về tác động lên cầm máu, chống đông máu hoặc tan máu [67].
Trước đây, các trung tâm ECMO phụ thuộc vào máy bơm trục lăn được tự điều chỉnh (nghĩa là tự động) để tạo dòng máu, đòi hỏi sự theo dõi liên tục của các nhân viên được đào tạo. Máy bơm ly tâm không có tự điều chỉnh đã thay thế máy bơm trục lăn ở hầu hết các trung tâm. Ưu điểm là áp suất đầu ra được giới hạn, do đó “dòng ra” với áp suất cao là không thể. Tuy nhiên, những máy bơm này có thể gây ra vi bọt khí và tán huyết khi đầu vào bị tắc. Máy bơm ly tâm thế hệ mới hơn có cánh quạt (khối quay) đặc biệt giúp giảm sinh nhiệt và vi bọt khí [68,69]. Những máy bơm này hiện đang được sử dụng rộng rãi cho ECMO.
Các lớp phủ bề mặt bắt chước lớp lót nội mạch của các mạch máu và giảm hoạt hóa tế bào máu đang được phát triển [70]. Trong vòng tuần hoàn ECMO, các lớp phủ như vậy có thể làm giảm huyết khối, làm giảm nhu cầu chống đông máu liên tục và giảm tỷ lệ biến chứng liên quan.
ECMO di động vẫn còn đang điều tra nghiên cứu thêm [71].
TÓM TẮT VÀ KIẾN NGHỊ
Oxy hóa màng ngoài cơ thể (ECMO) là một loại hỗ trợ tim phổi cơ học kéo dài thường được cung cấp trong các đơn vị chăm sóc tích cực. ECMO chỉ nên được thực hiện tại các trung tâm có thiết bị và có chuyên môn phù hợp.
- Chúng tôi đề nghị những bệnh nhân bị suy hô hấp cấp tính hoặc suy tim cấp tính nặng nhưng có khả năng hồi phục, không đáp ứng với điều trị và chăm sóc thông thường nên được đánh giá ECMO nếu có sẵn trong cơ sở y tế ( Lớp 2B ). Đối với những bệnh nhân ở trong một trung tâm y tế không cung cấp ECMO, việc chuyển đến một trung tâm y tế khác để được đánh giá ECMO nên được xem xét ngay khi rõ ràng rằng bệnh nhân không đáp ứng với điều trị. Quyết định cuối cùng cần cân nhắc cẩn thận tỷ lệ sống cho bệnh nhân được chuyển đến trung tâm ECMO so với rủi ro khi vận chuyển bệnh nhân. (Xem ‘Chỉ dẫn’ ở trên.)
- Có hai loại ECMO, (VV) và (VA) ( hình 1 và hình 2 và hình 3 ). VV ECMO được sử dụng ở bệnh nhân suy hô hấp, còn VA ECMO được sử dụng ở bệnh nhân suy tim. (Xem ‘Kỹ thuật’ ở trên.)
- Khi đã xác định rằng ECMO sẽ được khởi trị, bệnh nhân sẽ được chống đông. Cannula sau đó được đặt và bệnh nhân được kết nối với vòng tuần hoàn ECMO. Lưu lượng máu được tăng lên cho đến khi các thông số hô hấp và huyết động thỏa đáng. Khi các mục tiêu hô hấp và huyết động ban đầu đã đạt được, lưu lượng máu được duy trì, hỗ trợ máy thở được giảm thiểu và thuốc vận mạch được giảm xuống mức tối thiểu. Thường xuyên đánh giá lại và điều chỉnh là cần thiết.
- Sự sẵn sàng của bệnh nhân để cai ECMO nên được đánh giá thường xuyên. Trước khi ngừng ECMO vĩnh viễn, nên thực hiện một hoặc nhiều thử nghiệm trong thời gian bệnh nhân tắt Các thử nghiệm như vậy cung cấp cho bác sĩ lâm sàng cơ hội để xác định liệu chăm sóc hỗ trợ thông thường có đủ cho bệnh nhân hay không.
- Chảy máu là biến chứng phổ biến nhất (30 đến 40 %) của ECMO. Thuyên tắc do huyết khối và biến chứng do cannula là rất hiếm (<5 %). (Xem phần ‘Biến chứng’ ở trên.)
REFERENCES
- The Registry of the Extracorporeal Life Support Organization. elso.org (Accessed on October 09, 2015).
- Hemmila MR, Rowe SA, Boules TN, et al. Extracorporeal life support for severe acute respiratory distress syndrome in adults. Ann Surg 2004; 240:595.
- Peek GJ, Moore HM, Moore N, et al. Extracorporeal membrane oxygenation for adult respiratory failure. Chest 1997; 112:759.
- Lewandowski K, Rossaint R, Pappert D, et al. High survival rate in 122 ARDS patients managed according to a clinical algorithm including extracorporeal membrane oxygenation. Intensive Care Med 1997; 23:819.
- Ullrich R, Lorber C, Röder G, et al. Controlled airway pressure therapy, nitric oxide inhalation, prone position, and extracorporeal membrane oxygenation (ECMO) as components of an integrated approach to ARDS. Anesthesiology 1999; 91:1577.
- Rich PB, Awad SS, Kolla S, et al. An approach to the treatment of severe adult respiratory failure. J Crit Care 1998; 13:26.
- Kolla S, Awad SS, Rich PB, et al. Extracorporeal life support for 100 adult patients with severe respiratory failure. Ann Surg 1997; 226:544.
- Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigators, Davies A, Jones D, et al. Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA 2009; 302:1888.
- Brogan TV, Thiagarajan RR, Rycus PT, et al. Extracorporeal membrane oxygenation in adults with severe respiratory failure: a multi-center database. Intensive Care Med 2009; 35:2105.
- Noah MA, Peek GJ, Finney SJ, et al. Referral to an extracorporeal membrane oxygenation center and mortality among patients with severe 2009 influenza A(H1N1). JAMA 2011; 306:1659.
- Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009; 374:1351.
- Pham T, Combes A, Rozé H, et al. Extracorporeal membrane oxygenation for pandemic influenza A(H1N1)-induced acute respiratory distress syndrome: a cohort study and propensity-matched analysis. Am J Respir Crit Care Med 2013; 187:276.
- Bartlett RH. Clinical Research in Acute Fatal Illness: Lessons From Extracorporeal Membrane Oxygenation. J Intensive Care Med 2016; 31:456.
- Posluszny J, Rycus PT, Bartlett RH, et al. Outcome of Adult Respiratory Failure Patients Receiving Prolonged (≥14 Days) ECMO. Ann Surg 2016; 263:573.
- Robba C, Ortu A, Bilotta F, et al. Extracorporeal membrane oxygenation for adult respiratory distress syndrome in trauma patients: A case series and systematic literature review. J Trauma Acute Care Surg 2017; 82:165.
- Boissier F, Bagate F, Schmidt M, et al. Extracorporeal Life Support for Severe Acute Chest Syndrome in Adult Sickle Cell Disease: A Preliminary Report. Crit Care Med 2019; 47:e263.
- Combes A, Hajage D, Capellier G, et al. Extracorporeal Membrane Oxygenation for Severe Acute Respiratory Distress Syndrome. N Engl J Med 2018; 378:1965.
- Harrington D, Drazen JM. Learning from a Trial Stopped by a Data and Safety Monitoring Board. N Engl J Med 2018; 378:2031.
- Munshi L, Walkey A, Goligher E, et al. Venovenous extracorporeal membrane oxygenation for acute respiratory distress syndrome: a systematic review and meta- Lancet Respir Med 2019; 7:163.
- Aoyama H, Uchida K, Aoyama K, et al. Assessment of Therapeutic Interventions and Lung Protective Ventilation in Patients With Moderate to Severe Acute Respiratory Distress Syndrome: A Systematic Review and Network Meta- JAMA Netw Open 2019; 2:e198116.
- Trudzinski FC, Kaestner F, Schäfers HJ, et al. Outcome of Patients with Interstitial Lung Disease Treated with Extracorporeal Membrane Oxygenation for Acute Respiratory Failure. Am J Respir Crit Care Med 2016; 193:527.
- Younger JG, Schreiner RJ, Swaniker F, et al. Extracorporeal resuscitation of cardiac arrest. Acad Emerg Med 1999; 6:700.
- Massetti M, Tasle M, Le Page O, et al. Back from irreversibility: extracorporeal life support for prolonged cardiac arrest. Ann Thorac Surg 2005; 79:178.
- Smedira NG, Blackstone EH. Postcardiotomy mechanical support: risk factors and outcomes. Ann Thorac Surg 2001; 71:S60.
- Kelly RB, Porter PA, Meier AH, et al. Duration of cardiopulmonary resuscitation before extracorporeal rescue: how long is not long enough? ASAIO J 2005; 51:665.
- Combes A, Leprince P, Luyt CE, et al. Outcomes and long-term quality-of-life of patients supported by extracorporeal membrane oxygenation for refractory cardiogenic shock. Crit Care Med 2008; 36:1404.
- Pagani FD, Aaronson KD, Swaniker F, Bartlett RH. The use of extracorporeal life support in adult patients with primary cardiac failure as a bridge to implantable left ventricular assist device. Ann Thorac Surg 2001; 71:S77.
- Kagawa E, Dote K, Kato M, et al. Should we emergently revascularize occluded coronaries for cardiac arrest?: rapid-response extracorporeal membrane oxygenation and intra-arrest percutaneous coronary intervention. Circulation 2012; 126:1605.
- Bednarczyk JM, White CW, Ducas RA, et al. Resuscitative extracorporeal membrane oxygenation for in hospital cardiac arrest: a Canadian observational Resuscitation 2014; 85:1713.
- Chang CH, Chen HC, Caffrey JL, et al. Survival Analysis After Extracorporeal Membrane Oxygenation in Critically Ill Adults: A Nationwide Cohort Circulation 2016; 133:2423.
- Thiagarajan RR, Barbaro RP, Rycus PT, et al. Extracorporeal Life Support Organization Registry International Report 2016. ASAIO J 2017; 63:60.
- Pontailler M, Demondion P, Lebreton G, et al. Experience with Extracorporeal Life Support for Cardiogenic Shock in the Older Population more than 70 Years of ASAIO J 2017; 63:279.
- Chung M, Zhao Y, Strom JB, et al. Extracorporeal Membrane Oxygenation Use in Cardiogenic Shock: Impact of Age on In-Hospital Mortality, Length of Stay, and Costs. Crit Care Med 2019; 47:e214.
- Shin TG, Choi JH, Jo IJ, et al. Extracorporeal cardiopulmonary resuscitation in patients with inhospital cardiac arrest: A comparison with conventional cardiopulmonary resuscitation. Crit Care Med 2011; 39:1.
- Chen YS, Lin JW, Yu HY, et al. Cardiopulmonary resuscitation with assisted extracorporeal life-support versus conventional cardiopulmonary resuscitation in adults with in-hospital cardiac arrest: an observational study and propensity analysis. Lancet 2008; 372:554.
- Ortega-Deballon I, Hornby L, Shemie SD, et al. Extracorporeal resuscitation for refractory out-of-hospital cardiac arrest in adults: A systematic review of international practices and outcomes. Resuscitation 2016; 101:12.
- https://www.elso.org/Portals/0/ELSO%20Guidelines%20General%20All%20 ECLS%20Version%201_4.pdf (Accessed on July 23, 2018).
- Tsai HC, Chang CH, Tsai FC, et al. Acute Respiratory Distress Syndrome With and Without Extracorporeal Membrane Oxygenation: A Score Matched Study. Ann Thorac Surg 2015; 100:458.
- Ferguson ND, Fan E, Camporota L, et al. The Berlin definition of ARDS: an expanded rationale, justification, and supplementary material. Intensive Care Med 2012; 38:1573.
- Braune S, Sieweke A, Brettner F, et al. The feasibility and safety of extracorporeal carbon dioxide removal to avoid intubation in patients with COPD unresponsive to noninvasive ventilation for acute hypercapnic respiratory failure (ECLAIR study): multicentre case-control study. Intensive Care Med 2016; 42:1437.
- Ouweneel DM, Schotborgh JV, Limpens J, et al. Extracorporeal life support during cardiac arrest and cardiogenic shock: a systematic review and meta-analysis. Intensive Care Med 2016; 42:1922.
- Debaty G, Babaz V, Durand M, et al. Prognostic factors for extracorporeal cardiopulmonary resuscitation recipients following out-of-hospital refractory cardiac A systematic review and meta-analysis. Resuscitation 2017; 112:1.
- Hakim AH, Ahmad U, McCurry KR, et al. Contemporary Outcomes of Extracorporeal Membrane Oxygenation Used as Bridge to Lung Transplantation. Ann Thorac Surg 2018; 106:192.
- Rush B, Wiskar K, Berger L, Griesdale D. Trends in Extracorporeal Membrane Oxygenation for the Treatment of Acute Respiratory Distress Syndrome in the United States. J Intensive Care Med 2017; 32:535.
- Schmidt M, Tachon G, Devilliers C, et al. Blood oxygenation and decarboxylation determinants during venovenous ECMO for respiratory failure in Intensive Care Med 2013; 39:838.
- Wang D, Zhou X, Liu X, et al. Wang-Zwische double lumen cannula-toward a percutaneous and ambulatory paracorporeal artificial lung. ASAIO J 2008; 54:606.
- Madershahian N, Nagib R, Wippermann J, et al. A simple technique of distal limb perfusion during prolonged femoro-femoral cannulation. J Card Surg 2006; 21:168.
- Navia JL, Atik FA, Beyer EA, Ruda Vega P. Extracorporeal membrane oxygenation with right axillary artery perfusion. Ann Thorac Surg 2005; 79:2163.
- Sklar MC, Sy E, Lequier L, et al. Anticoagulation Practices during Venovenous Extracorporeal Membrane Oxygenation for Respiratory Failure. A Systematic Review. Ann Am Thorac Soc 2016; 13:2242.
- Spinelli E, Bartlett RH. Anemia and Transfusion in Critical Care: Physiology and Management. J Intensive Care Med 2016; 31:295.
- Mazzeffi M, Greenwood J, Tanaka K, et al. Bleeding, Transfusion, and Mortality on Extracorporeal Life Support: ECLS Working Group on Thrombosis and Ann Thorac Surg 2016; 101:682.
- Wilson JM, Bower LK, Fackler JC, et al. Aminocaproic acid decreases the incidence of intracranial hemorrhage and other hemorrhagic complications of ECMO. J Pediatr Surg 1993; 28:536.
- Biswas AK, Lewis L, Sommerauer JF. Aprotinin in the management of life- threatening bleeding during extracorporeal life support. Perfusion 2000; 15:211.
- Peek, G, Wittenstein, et al. Management of bleeding during ECLS. In: ECMO in Critical Care, Van Meurs, K, Lally, KP, Peek, G, Zwischenberger, JB (Eds), Extracorporeal life support organization, Ann Arbor
- Bui JD, Despotis GD, Trulock EP, et al. Fatal thrombosis after administration of activated prothrombin complex concentrates in a patient supported by extracorporeal membrane oxygenation who had received activated recombinant factor J Thorac Cardiovasc Surg 2002; 124:852.
- Wittenstein B, Ng C, Ravn H, Goldman A. Recombinant factor VII for severe bleeding during extracorporeal membrane oxygenation following open heart surgery. Pediatr Crit Care Med 2005; 6:473.
- Anselmi A, Guinet P, Ruggieri VG, et al. Safety of recombinant factor VIIa in patients under extracorporeal membrane oxygenation. Eur J Cardiothorac Surg 2016; 49:78.
- Parzy G, Daviet F, Persico N, et al. Prevalence and Risk Factors for Thrombotic Complications Following Venovenous Extracorporeal Membrane Oxygenation: A CT Scan Study. Crit Care Med 2020; 48:192.
- Hartley EL, Singh N, Barrett N, et al. Screening pulmonary angiogram and the effect on anticoagulation strategies in severe respiratory failure patients on venovenous extracorporeal membrane oxygenation. J Thromb Haemost 2020; 18:217.
- Mateen FJ, Muralidharan R, Shinohara RT, et al. Neurological injury in adults treated with extracorporeal membrane oxygenation. Arch Neurol 2011; 68:1543.
- Cornell T, Wyrick P, Fleming G, et al. A case series describing the use of argatroban in patients on extracorporeal circulation. ASAIO J 2007; 53:460.
- Saeed O, Jakobleff WA, Forest SJ, et al. Hemolysis and Nonhemorrhagic Stroke During Venoarterial Extracorporeal Membrane Oxygenation. Ann Thorac Surg 2019; 108:756.
- Thiele H, Sick P, Boudriot E, et al. Randomized comparison of intra-aortic balloon support with a percutaneous left ventricular assist device in patients with revascularized acute myocardial infarction complicated by cardiogenic shock. Eur Heart J 2005; 26:1276.
- Peek GJ, Killer HM, Reeves R, et al. Early experience with a polymethyl pentene oxygenator for adult extracorporeal life support. ASAIO J 2002; 48:480.
- Toomasian JM, Schreiner RJ, Meyer DE, et al. A polymethylpentene fiber gas exchanger for long-term extracorporeal life support. ASAIO J 2005; 51:390.
- Khoshbin E, Roberts N, Harvey C, et al. Poly-methyl pentene oxygenators have improved gas exchange capability and reduced transfusion requirements in adult extracorporeal membrane oxygenation. ASAIO J 2005; 51:281.
- Malfertheiner MV, Philipp A, Lubnow M, et al. Hemostatic Changes During Extracorporeal Membrane Oxygenation: A Prospective Randomized Clinical Trial Comparing Three Different Extracorporeal Membrane Oxygenation Systems. Crit Care Med 2016; 44:747.
- Hoshi H, Shinshi T, Takatani S. Third-generation blood pumps with mechanical noncontact magnetic bearings. Artif Organs 2006; 30:324.
- Lawson DS, Ing R, Cheifetz IM, et al. Hemolytic characteristics of three commercially available centrifugal blood pumps. Pediatr Crit Care Med 2005; 6:573.
- Zhang H, Annich GM, Miskulin J, et al. Nitric oxide releasing silicone rubbers with improved blood compatibility: preparation, characterization, and in vivo Biomaterials 2002; 23:1485.
- Bharat A, Pham DT, Prasad SM. Ambulatory Extracorporeal Membrane Oxygenation: A Surgical Innovation for Adult Respiratory Distress Syndrome. JAMA Surg 2016; 151:478.