Bệnh Nội tiết - chuyển hóa, Bệnh tiêu hóa
Những bất thường làm rỗng dạ dày ở bệnh nhân đái tháo đường
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Tác giả: Raj K. Goyal, M.D.
Biên dịch: Bác sĩ Thành Minh Khánh.
N Engl J Med 2021;384:1742-51.
DOI: 10.1056/NEJMra2020927
Copyright © 2021 Massachusetts Medical Society.
Để tải bài viết Những bất thường làm rỗng dạ dày ở bệnh nhân đái tháo đường PDF được xuất bản trên BMJ – Tạp chí Y khoa Anh Quốc mời các bạn click vào link ở đây.
Đái tháo đường liên quan đến một, nhiều bất thường làm rỗng dạ dày (GASTRIC EMPTYING), bao gồm làm rỗng dạ dày chậm thoáng qua “transient slow gastric emptying”, làm rỗng dạ dày nhanh thoáng qua “transient fast gastric emptying”, làm rỗng dạ dày chậm hoặc trì trệ kéo dài “persistent slow or delayed gastric emptying” (liệt dạ dày – gastroparesis), và làm rỗng dạ dày nhanh kéo dài (persistent fast gastric emptying). Những thay đổi thoáng qua trong quá trình làm rỗng dạ dày là đáp ứng đối điều hòa (counterregulatory responses) và không cần điều trị. Làm rỗng dạ dày bị trì trệ có liên quan đến các triệu chứng ở bụng và được cho là một nguyên nhân của bệnh nặng. Tuy nhiên, làm rỗng dạ dày nhanh có liên quan đến các triệu chứng tương tự. Trong khi làm rỗng dạ dày chậm có thể gây khó khăn trong việc kiểm soát glucose ở bệnh nhân điều trị bằng insulin thì làm rỗng dạ dày nhanh đóng một vai trò quan trọng trong sự hình thành và tiến triển của bệnh đái tháo đường type 2. Điều trị làm rỗng dạ dày nhanh đang nổi trội lên như một mục tiêu quan trọng để xử trí tăng glucose huyết sau ăn.
Tỷ lệ làm rỗng dạ dày thể hiện lượng chất dinh dưỡng đi vào ruột được điều hòa ở mức độ cao. Dạ dày cho ra từ 1 đến 4 kcal thức ăn đồng nhất mỗi phút vào tá tràng, bất kể thành phần carbohydrate, protein và chất béo. 1 Thành tích đáng kể này đạt được thông qua các hoạt động vận động được tích hợp của các bộ phận khác nhau của dạ dày, được điều hòa bởi các cơ chế thần kinh – thể dịch phức tạp2 (để biết chi tiết, xem Phụ lục bổ sung, có bản fulltext của bài này tại NEJM.org).
Bệnh tiểu đường dẫn đến những dạng làm rỗng dạ dày bất thường bằng việc thay đổi hoạt động vận động của các phân đoạn khác nhau của dạ dày. Những thay đổi này được trung gian bởi các rối loạn chức năng của hệ thống thần kinh phế vị, thông qua các tế bào kẽ Cajal và trơn cơ (xem Phụ lục bổ sung). Thay đổi đột ngột nồng độ glucose huyết làm ảnh hưởng đến các neuron được kích thích bởi glucose hoặc bị ức chế bởi glucose ở hệ thống thần kinh phế vị ức chế hay kích thích dạ dày và dẫn đến thay đổi quá trình làm rỗng dạ dày. Tăng glucose huyết kéo dài ảnh hưởng đến các thành phần phân tử của neuron, tế bào cơ trơn, và các tế bào kẽ Cajal qua các stress do oxy hóa và các sản phẩm của các đại thực bào bị phân cực (polarized marcophages) M1 (tiền viêm) và M2 (tiền làm lành hoặc sửa chữa) . Các chất chuyển hóa này có thể có những ảnh hưởng phức tạp đến các chức năng của tế bào. Chúng có thể gây ra những thay đổi phiên mã protein và microRNA (miRNA), với sự thay đổi theo sau của kiểu hình tế bào làm các tế bào cơ trơn tăng co hoặc giảm co.
Các triệu chứng vùng bụng trên giống giống với khó tiêu chức năng được cho rằng là do làm rỗng dạ dày bị trì trệ ẩn bên dưới. Tuy nhiên, các triệu chứng tương tự có liên quan đến làm rỗng dạ dày nhanh, cho thấy rằng liệt dạ dày có thể không phải là nguyên nhân của các triệu chứng này. Thay vào đó, các triệu chứng có thể là do sự hoạt song song của các thụ thể cảm giác gây ra bởi những thay đổi do viêm ở thành dạ dày. Do đó, các thủ thuật làm thúc đẩy nhanh quá trình làm rỗng dạ dày có thể không làm giảm triệu chứng và có thể làm trầm trọng thêm tình trạng tăng glucose huyết.
Tổng quan này tóm tắt sinh lý bệnh của các bất thường làm rỗng dạ dày trong bệnh đái tháo đường và cơ sở cho việc xử trí chúng. Thực hành điều trị đối với liệt dạ dày có triệu chứng hiện này được bao hàm rộng rãi trong các bài đánh giá gần đây. [3-5]
Các thay đổi về chuyển hóa ảnh hưởng đến làm rỗng dạ dày
Glucose đi vào các tế bào chủ yếu qua kênh protein vận chuyển glucose (GLUT) và đồng vận chuyển natri – glucose (SGLT). [6] Glucokinase chuyển đổi glucose nội bào thành glucose-6-phosphate, glucose-6-phosphate trải qua quá trình đường phân, một quá trình dẫn đến sự sản xuất ATP và các gốc oxy phản ứng trong ty thể. [7,8] Stress oxy hóa nhẹ làm tăng điều hòa (up-regulation) phiên mã của enzyme NADPH oxidase 4 (NOX4), dẫn đến stress oxy hóa vừa phải. [9] Ngoài ra, stress oxy hóa vừa phải, cùng với các sản phẩm của quá trình oxy hóa lipid, các sản phẩm cuối của quá trình glycosyl hóa bền vững (advanced glycation end-products) và các cacbonyl phản ứng làm thay đổi các protein của chất nền ngoại bào và tăng khả năng kết dính và hoạt hóa của đại thực bào. Tùy thuộc vào các tín hiệu tại chỗ cụ thể, đại thực bào10 trải qua quá trình phân cực (polarization) để trở thành đại thực bào M1 [11,12] hoặc M2, sản xuất nhiều loại cytokine. Stress oxy hóa và các cytokine có thể hoạt động thông qua các yếu tố phiên mã để làm thay đổi trực tiếp các protein truyền tin hoặc gián tiếp thông qua việc điều hòa các miRNA.[13,14] Những RNA không mã hóa này là những nhân tố quan trọng điều hòa sự biểu hiện gen sau phiên mã. Chúng có thể gắn vào các mRNA đích của chúng để ngăn chặn quá trình dịch mã thành các protein của tế bào và dẫn đến những thay đổi đáng kể lên kiểu hình của tế bào. [9,15,16] Do đó, miRNA đang nổi lên như một đích đến điều trị quan trọng.[17]
Các thay đổi về chuyển hóa khác nhau gây nên những thay đổi tế bào đặc trưng dẫn đến các bất thường làm rỗng dạ dày. Sự thay đổi tức thì nồng độ glucose huyết tương sẽ hoạt hóa các vòng vận động phế vị (vagal motor circuits), dẫn đến những bất thường làm rỗng dạ dày thoáng qua. Tăng glucose huyết mạn tính liên kết đến stress oxy hóa và đại thực bào bị phân cực thi có những ảnh hưởng đặc trưng lên dẫn truyền thần kinh cơ, tế bào kẽ Cajal, và cơ trơn, tùy thuộc vào loại phân cực đại của thực bào và mức độ stress do oxy hóa và do viêm. Stress oxy hóa mức độ vừa làm gián đoạn dẫn truyền thần kinh cơ, làm tăng số lượng tế bào kẽ của Cajal, và chuyển cơ trơn thành loại tế bào kiểu hình tăng co (hypercontractile phenotype). Ngoài ra, stress oxy hóa mức độ vừa thúc đẩy sự phân cực của đại thực bào thành loại M2 hoặc M1. Phân cực thành đại thực bào M2 thì kiềm hãm đại thực bào M1 và các đáp ứng viêm của chúng và dẫn đến mất khả năng dẫn truyền thần kinh trầm trọng, mất tế bào kẽ Cajal và chuyển cơ trơn thành dạng tế bào kiểu hình giảm co (hypocontractile phenotype) (xem Phụ lục bổ sung).
Làm rỗng dạ dày chậm thoáng qua (Transient Slow Gastric Emptying)
Tăng glucose huyết sau ăn là đặc điểm của không dung nạp glucose trong bệnh đái tháo đường. Tăng glucose huyết cấp làm chậm làm rỗng dạ dày đối với thức ăn được tiêu hóa và cặn thức ăn không được tiêu hóa trong khoảng thời gian đói. Giảm tốc độ làm rỗng dạ dày làm kiềm hãm sự tăng glucose huyết sau ăn và đóng vai trò như một vòng feedback âm. Làm chậm quá trình làm rỗng dạ dày là do giảm trương lực đoạn gần dạ dày và kiềm hãm co thắt tâm vị. [18] Tăng glucose huyết cũng kiềm hãm các cơn co thắt mạnh mẽ của phức hợp vận động di chuyển giữa các bữa ăn (interdigestive migrating motor complex), 19 dẫn đến làm rỗng dạ dày chậm ở cả pha tiêu hóa (digestive phase) và pha giữa các bữa ăn (interdigestive/ fasting phase).
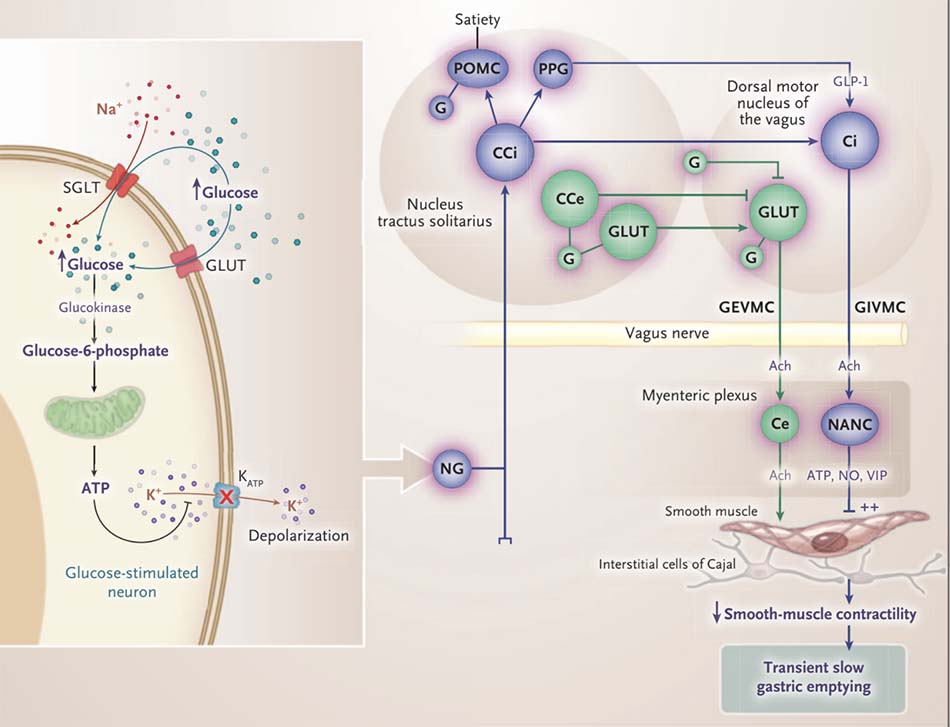
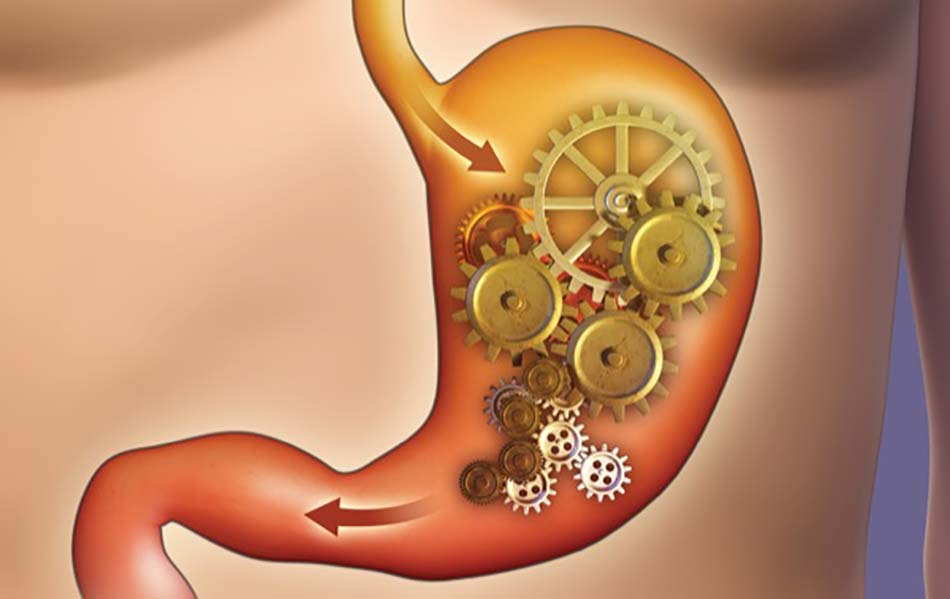
Như đã thể hiện trong Hình 1, tăng glucose huyết kích thích các neuron nhạy cảm với glucose ở các sợi phế vị hướng tâm bằng cách ức chế kênh kali nhạy cảm với ATP (kênh K-ATP). [20] Sự kích thích các vòng vận động phế vị ức chế dạ dày có thể ảnh hưởng đến các sóng điện chậm, cũng như cơ trơn. Tăng glucose huyết cấp tính có thể làm gián đoạn các sóng chậm bằng cách gây ảnh hưởng lên các tế bào kẽ Cajal ở cơ ruột, dẫn đến tình trạng “isolated tachygastria” (tăng hoạt động điện chu kỳ ở dạ dày, với tần số > 3,6 chu kỳ mỗi phút), [21] mặc dù nồng độ glucose cao không ảnh hưởng trực tiếp đến các tế bào kẽ Cajal.[22] Tachygastria và những bất thường sóng chậm khác được cho rằng gây ra giảm các cơn co thắt tâm vị; tuy nhiên, sóng chậm không tương quan với co thắt cơ học. [18] Nồng độ glucose huyết cao kích thích con đường vận động phế vị ức chế dạ dày; do đó sự kích thích này đã ức chế các cơn co thắt và ưu thế hơn sự co thắt qua trung gian tăng glucose huyết “hyperglycemia-mediated contraction” của cơ trơn đơn độc. [23] Làm rỗng dạ dày chậm thoáng qua do tăng glucose huyết cấp tính là một hiện tượng điều hòa ngược và không cần sự xử trí. Bản chất thoáng qua của các ảnh hưởng của tăng glucose huyết được cho là do sự down-regulation của glucokinase. [24]
Làm rỗng dạ dày nhanh thoáng qua (Transient Rapid Gastric Emptying)
Hạ glucose huyết cấp làm rỗng dạ dày nhanh. Hạ glucose huyết do thầy thuốc là một biến chứng phổ biến và nghiêm trọng của điều trị insulin. Hạ glucose huyết cấp gây hoạt hóa vòng vận động phế vị kích thích dạ dày (GEVMC), vòng phế vị cung cấp sự chi phối thần kinh kích thích cholinergic đến cơ trơn dạ dày, làm tăng cường hoạt động co bóp và do đó dẫn đến làm rỗng dạ dày nhanh. GEVMC cũng được kết nối với các tế bào alpha bài tiết glucagon, với các orexigenic neuron (kích thích sự thèm ăn), với con đường giao cảm thượng thận và với các neuron vùng hạ đồi tham gia vào các phản ứng đối điều hòa với tình trạng hạ glucose huyết. Nồng độ glucose huyết dưới mức bình thường gây kích hoạt hoạt động phó giao cảm và tăng tiết glucagon. Nồng độ glucose tiếp tục giảm nữa thì sẽ gây kích hoạt hoạt động giao cảm.[25]
Sự hoạt hóa GEVMC là do sự kích thích các neuron γ-aminobutyric acid– producing (GABAergic) neuron, các neuron biểu hiện GLUT2 ở nhân bó đơn độc. Hạ glucose huyết dẫn đến giảm glucose nội bào và giảm nồng độ ATP nội bào, làm giảm hoạt tính của bơm Na+/ K+/ ATPase và gây khử cực màng [26] (Hình 2). Các phản ứng với hạ glucose huyết cấp tính là thoáng qua do sự tăng điều hòa (up-regulation) nhanh chóng của glucokinase và việc sử dụng các nguồn năng lượng khác không phải glucose. Làm rỗng dạ dày nhanh thoáng qua là một phần của phản ứng đối điều hòa và nên được điều trị. Trong hạ glucose huyết tái phát, những những thay đổi này có thể đóng vai trò là cơ chế bảo vệ chống lại các biến chứng của hạ glucose huyết như suy thần kinh tự chủ và nhận thức bị suy giảm do hạ glucose huyết (hypoglycemia-associated autonomic failure & impaired awareness), là những tình trạng có thể đe dọa tính mạng.[26,27]
Làm rỗng dạ dày nhanh kéo dài (Persistent Rapid Gastric Emptying)
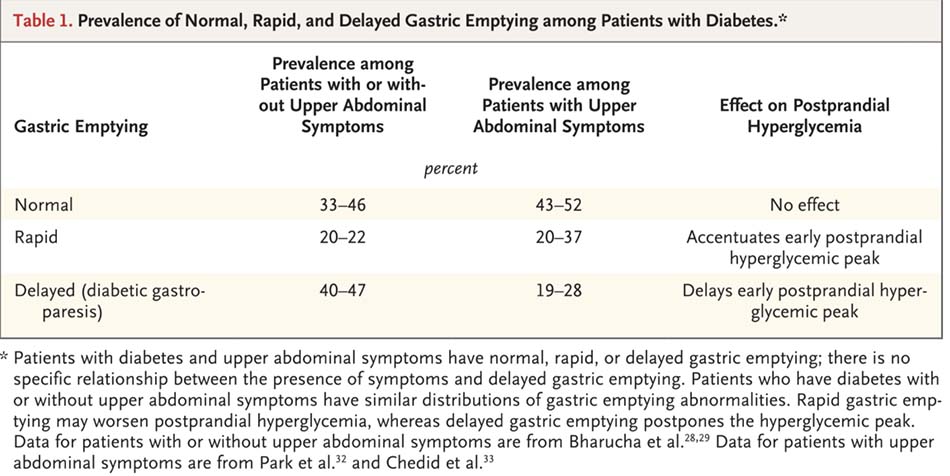
Trước đây, việc làm rỗng dạ dày nhanh kéo dài thì không được coi là một biến chứng của đái tháo đường. Gần 20% bệnh nhân mắc đái tháo đường type 1 hoặc 2 kiểm soát kém, lâu năm, bất kể có hoặc không có triệu chứng vùng bụng trên, có làm rỗng dạ dày nhanh ngay cả trong các giai đoạn cuối của bệnh [28,29,30] Hội chứng Dumping, với các triệu chứng buồn nôn sau ăn, đầy bụng, chóng mặt, đỏ bừng mặt, đánh trống ngực, đau thắt “cramps”, chứng sôi bụng “borborygmi”, và tiêu chảy, xảy ra sau khi phẫu thuật cắt dạ dày.[31] Tuy nhiên, các triệu chứng như vậy không xảy ra ở những bệnh nhân còn dạ dày nguyên vẹn. Các triệu chứng ở bụng trên không thể phân biệt được với những triệu chứng của khó tiêu chức năng hoặc chứng liệt dạ dày. Khoảng 20 đến 37% bệnh nhân mắc đái tháo đường và có các triệu chứng vùng bụng trên bị làm rỗng dạ dày nhanh. [32,33] Tỷ lệ này tương tự với số những bệnh nhân mắc bệnh đái tháo đường lâu năm, cho dù họ có các triệu chứng ở bụng trên hay không [28-30] (Bảng 1), điều này cho thấy rằng các triệu chứng ở bụng không liên quan đến làm rỗng dạ dày nhanh một cách đặc hiệu. Rối loạn này có lẽ là để đáp ứng với liệu pháp insulin khắt khe ở bệnh nhân mắc bệnh đái tháo đường type 1. [29,34]
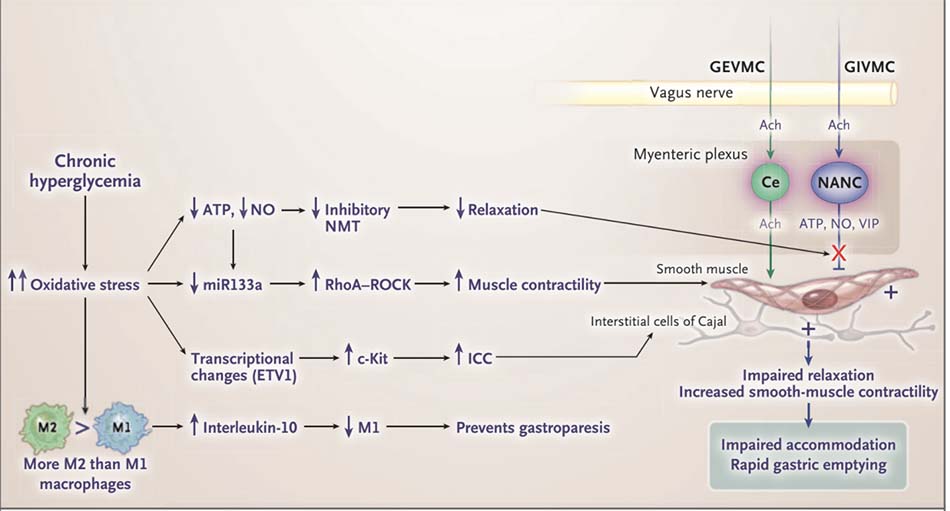
Làm rỗng dạ dày nhanh có ảnh hưởng sâu sắc đến tình trạng không dung nạp glucose,35 và nó đã được liên quan đến bệnh sinh và diễn tiến của đái tháo đường type 2. [36] Điều chỉnh đối với làm rỗng dạ dày nhanh bằng các giới hạn chế độ ăn và liệu pháp dược lý là cốt lõi của kiểm soát tăng glucose huyết sau ăn.[37] Thiếu hụt amylin hoặc leptin có liên quan đến tăng glucose huyết mạn tính và làm rỗng dạ dày nhanh. [38,39] Các tác nhân như metformin, amylin analogues, đồng vận glucagon-like peptide 1 làm giảm tốc độ làm rỗng dạ dày. [34,40-42] Làm rỗng dạ dày nhanh có liên quan đến sự giãn cơ giảm và khả năng co bóp tăng của cơ tại đáy vị như một kết cục của sự truyền tín hiệu ức chế bị suy giảm và khả năng co bóp cơ trơn tăng lên. Các cơn co thắt nhu động hang vị tăng lên do sự co thắt cơ trơn tăng và có thể là do sự gia tăng về số lượng của các tế bào kẽ Cajal cơ tim. [43]
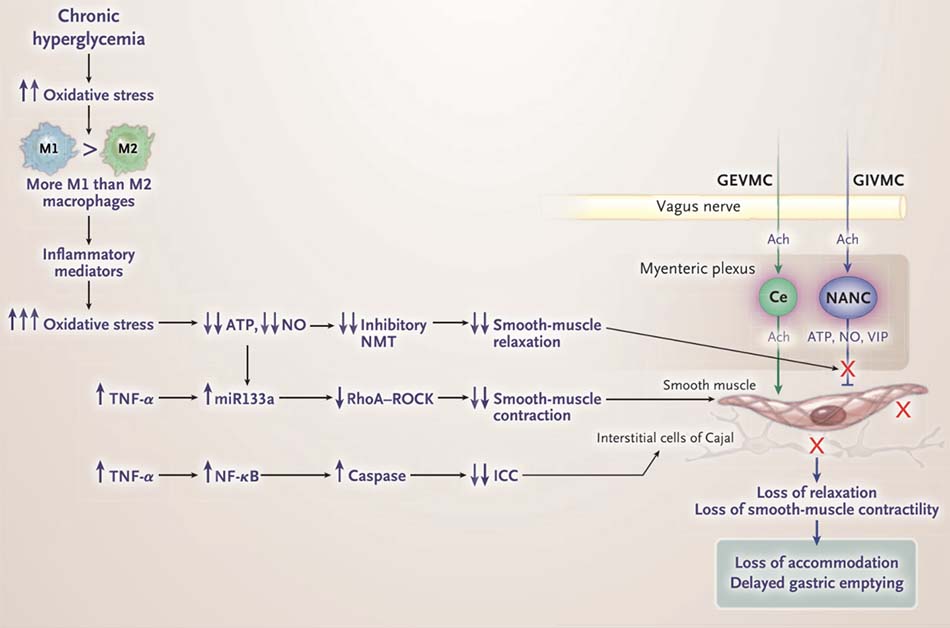
Như đã cho thấy ở hình 3, stress oxy hóa mức độ vừa dẫn đến mất dẫn truyền tín hiệu ức chế thần kinh cơ, sự gia tăng phiên mã ở c-Kit, và tăng số lượng tế bào kẽ Cajal. [39] Stress oxy hóa cũng gây giảm điều hòa quá trình phiên mã của miRNA-133a, dẫn đến tăng điều hòa tín hiệu small guanosine triphosphatase protein RhoA và protein kinase liên kết với Rho (RhoA – ROCK). [44,45] Những thay đổi này dẫn đến điều tiết dạ dày bị suy giảm và khả năng co bóp tăng, làm thúc đẩy làm rỗng dạ dày nhanh. [46] Các sản phẩm của đại thực bào M2 như interleukin-10 và enzyme heme oxygenase kiềm hãm đại thực bào M1 và ngăn cản tình trạng liệt dạ dày. Co bóp cơ trơn tăng ở nhiều phần khác của ruột có thể liên quan đến các đường tín hiệu khác [47] (xem chi tiết tại Phụ lục bổ sung).
Liệt dạ dày (Gastroparesis)
Liệt dạ dày do đái tháo đường (diabetic gastroparesis) là biến chứng được nhắc đến nhiều nhất của đái tháo đường. Nói một cách đơn giản, liệt dạ dày do đái tháo đường là một biến chứng của chuyển động dạ dày ở bệnh đái tháo đường, đặc trưng bởi việc làm rỗng dạ dày bị trì trệ kéo dài. Tắc nghẽn cơ học ở đầu ra và các tình trạng cùng tồn tại khác ảnh hưởng đến làm rỗng dạ dày phải được loại trừ để hình thành chẩn đoán này.
Bất thường về vận động
Tỷ lệ bệnh lưu hành của làm rỗng dạ dày bị trì trệ ở các trường hợp không được điều trị là 40 – 47% trong số bệnh nhân đái tháo đường type 1 và 32 – 47% trong số những người mắc đái tháo đường type 2. [28-30] Liệt dạ dày do đái tháo đường không thay đổi theo thời gian, [29,48] và nó xảy ra với cả chất lỏng và chất rắn có thể được tiêu hóa, như cũng như với cặn thức ăn không thể được tiêu hóa. Tuy nhiên, làm rỗng dạ dày bị suy yếu đối với các chất rắn không thể được tiêu hóa có lẽ là một là một bất thường ở giai đoạn sớm hơn. [49]
Làm rỗng dạ dày bị trì trệ có thể có ảnh hưởng có lợi ở bệnh đái tháo đường type 2, vì nó trì hoãn đỉnh tăng glucose huyết sau ăn. Tuy nhiên, ở những bệnh nhân đang dùng liệu pháp insulin điều trị đái tháo đường, một sự chậm trễ như vậy có thể dẫn đến các cơn hạ glucose huyết sớm sau ăn trừ khi sự hiệu chỉnh cẩn thận được thực hiện theo liều và chọn thời điểm dùng insulin. Điều trị để đẩy nhanh làm rỗng dạ dày thậm chí có thể làm tệ hơn việc kiểm soát glucose huyết. [50]
Liệt dạ dày do đái tháo đường có liên quan đến các bất thường về vận động ở các phần khác nhau của dạ dày, bao gồm các khiếm khuyết ở cơ trơn, tế bào kẽ Cajal, và dẫn truyền thần kinh. Đáy vị có đặc điểm là mất tính giãn do sự kiềm hãm của dẫn truyền thần kinh ức chế, cũng như co bóp có trương lực (tonic contraction) giảm vì khả năng co bóp của cơ bị giảm. Không có các cơn co thắt theo pha (phasic contractions) hoặc các sóng chậm ở đáy vị. Tính giãn giảm dẫn đến sự điều tiết giảm và co bóp có trương lực kém làm suy yếu quá trình làm rỗng của dạ dày.
Có sự giảm ở các cơn co thắt đẩy tới (propulsive contractions) ở tâm vị dẫn đến khả năng nghiền, trộn và tống thức ăn vào tá tràng kém. Những thay đổi này liên quan đến sự mất khả năng dẫn truyền thần kinh cơ kích thích cholinergic và làm yếu cơ trơn. Ngoài ra, bất thường của sóng chậm có thể góp phần làm yếu khả năng co bóp. Tâm vị có thể có các khoảng hoạt động sóng chậm xảy ra nhanh. Thông thường, tần số hoạt động sóng chậm giao động giữa 2,4 và 3,6 chu kỳ mỗi phút. “Tachygastria” phản ánh tần số sóng chậm lớn hơn 3,6 chu kỳ mỗi phút và “bradygastria” phản ánh tần số nhỏ hơn 2,4 chu kỳ mỗi phút. Bất thường ở tần số sóng chậm có thể góp phần làm yếu khả năng co bóp. Tuy nhiên, các bất thường của sóng chậm liên quan với các triệu chứng buồn nôn hơn là hơn sự suy yếu về co bóp và có thể xem như như là một dấu hiệu điện “electrical marker” của sự buồn nôn. [51] Liệt dạ dày do đái tháo đường được đặc trưng bởi sự khởi đầu và dẫn truyền sóng chậm bất thường trên lập bản đồ điện độ phân giải cao “highresolution electrical mapping”. Những bất thường này có thể góp phần vào khuếch đại tình trạng các cơn co bị rối loạn và làm rỗng dạ dày chậm. [52]
Mặc dù cơ trơn có hình thái bình thường trong hầu hết các trường hợp liệt dạ dày do đái tháo đường, nhưng trong hầu hết trường hợp rất nặng, sự thoái hóa, xơ hóa cơ trơn, lắng đọng collagen, và các thể vùi bạch cầu ái toan đã được quan sát thấy. [53] Tuy nhiên, các nghiên cứu về chức năng cho thấy khả năng co bóp của cơ trơn bị suy giảm trong bệnh liệt dạ dày do đái tháo đường. Sự tăng cường co thắt tâm vị là một trong những cơ chế chính của sự hoạt hóa của các tác nhân cường động ở dạ dày (gastric prokinetic agents) được sử dụng để thúc đẩy làm rỗng dạ dày. [3,4,54]
Trong liệt dạ dày do đái tháo đường, tính giãn của môn vị và tá tràng có thể bị suy giảm, dẫn đến tắc nghẽn dòng đầu ra. Mất tính giãn của môn vị và mất phối hợp tâm vị – tá tràng là do mất sự dẫn truyền thần kinh – cơ ức chế. [55,56] Ở chuột mất neuronal nitric oxide synthase isoform α (nNOSα −/−), sự suy yếu của dẫn truyền thần kinh – cơ ức chế có liên quan với tắc nghẽn đầu ra về mặt chức năng. Tuy nhiên, ở liệt dạ dày do đái tháo đường, khả năng cơ bóp co trơn bị suy yếu có thể làm suy yếu tắc nghẽn đầu ra.
Trong một số trường hợp, tắc nghẽn môn vị đáng kể về mặt lâm sàng có thể được ghi nhận khi sử dụng các kỹ thuật như phép đo trở kháng Endoflip (Endoflip impedance planimetry). Các thử nghiệm có đối chứng giả là cần thiết để thiết lập tính hữu ích của các can thiệp ở môn vị để thúc đẩy quá trình làm rỗng dạ dày được xác định cụ thể các trường hợp liệt dạ dày. [3] Người ta đã biết rằng việc đặt một ống thông rộng trong môn vị không đẩy nhanh quá trình làm rỗng dạ dày trong trường hợp không có sự hiệu quả của các co thắt tâm vị.
Như đã thể hiện trong Hình 4, liệt dạ dày do đái tháo đường có liên quan đến sự phân cực hóa đại thực bào M1 và giải phóng các sản phẩm viêm. Những các sản phẩm gây stress oxy hóa mạnh, dẫn đến mất dẫn truyền thần kinh ức chế thông qua sự tách rời của nNOSα và sự dọn dẹp các chất dẫn truyền thần kinh đã được giải phóng, nitric oxide. Stress oxy hóa mạnh cũng làm mất dẫn truyền ức chế purinergic. [46]
Sự mất tế bào kẽ Cajal là do yếu tố hoại tử khối u (tumor necrosis factor, TNF) hoặc TNF- α và sự tăng điều hòa phiên mã của caspase.[57] Tế bào kẽ Cajal rất dễ bị tổn thương và có thể bị sụt giảm thông qua các con đường khác, bao gồm insulin và truyền tín hiệu yếu tố tăng trưởng giống insulin (insulin-like growth factor) bị sụt giảm, [22] bệnh cơ của cơ trơn và mất tiếp đó của yếu tố tế bào gốc (stem-cell factor),[58] và mất nitric oxide. [59] Khả năng co bóp của cơ bị giảm có thể do phân cực hóa đại thực bào M1, với sự giải phóng TNF, interleukin-6 và các cytokine viêm khác. [60] TNF được biết là nguyên nhân gây tăng sự điều hòa của miRNA-133a thông qua yếu tố phiên mã yếu tố nhân κB, kèm theo sự giảm liên quan đến tín hiệu RhoA – ROCK ở các cơ trơn ống tiêu hóa.[44] Stress oxy hóa nặng có thể dẫn đến khả năng co bóp của cơ bị giảm. [45] Truyền tín hiệu RhoA– ROCK bị giảm thì liên quan đến cơ trơn giảm khả năng co bóp đã được báo cáo ở bệnh nhân có liệt dạ dày do đái tháo đường.[61] Những quan sát này từ các nghiên cứu được thực hiện trong các mô hình thử nghiệm giống các chữ ký transcriptomic “transcriptomic signatures” của rối loạn điều hòa miễn dịch ở bệnh liệt dạ dày.[54,62]
Các triệu chứng vùng bụng trên
Liệt dạ dày do đái tháo đường được mô tả lần đầu vào năm 1958 bởi Kassander [63] ở một nhóm bệnh nhân mắc đái tháo đường có làm rỗng dạ dày bị trì trệ không hồi phục và ứ đọng dạ dày (gastric stasis) mà không có tắc nghẽn cơ học, với tên gọi là “gastroparesis diabeticorum”, tình trạng là được cho là do bất thường về khả năng vận động của dạ dày. Sau đó, những bệnh nhân bị liệt dạ dày do đái tháo đường được phát hiện có các triệu chứng đường tiêu hóa trên. Theo từ điển Merriam-Webster’s Medical Dictionary định nghĩa liệt dạ dày là “liệt một phần của dạ dày ”và trích dẫn từ G.F. Cahill và cộng sự, lưu ý rằng “Liệt dạ dày do đái tháo đường được đặc trưng bởi một bộ ba các triệu chứng sau ăn: buồn nôn, nôn, và chướng bụng. ” Liệt dạ dày do đái tháo đường với các triệu chứng vùng bụng trên được gọi là “liệt dạ dày có triệu chứng hoặc liệt dạ dày trên lâm sàng”. Các triệu chứng khác, bao gồm đau bụng trên dữ dội, đã được thêm vào định nghĩa của liệt dạ dày, khiến cho các định nghĩa luôn thay đổi. [3-5,64]
Để xác định các triệu chứng liệt dạ dày do đái tháo đường khác với các triệu chứng của khó tiêu chức năng, Chỉ số Triệu chứng chính của Liệt dạ dày (the Gastroparesis Cardinal Symtom Index, GCSI) và Chỉ số Độ nặng Triệu chứng Đánh giá Bệnh nhân có các Rối loạn Tiêu hóa (the Patient Assessment of Gastrointestinal Disorders Symptom Severity Index , PAGI-SYM) đã được ra đời. Các triệu chứng chính của chứng dạ dày bao gồm đầy bụng sau ăn, cảm giác no sớm, buồn nôn, nôn và trướng bụng, những triệu chứng này không phân biệt được giữa khó tiêu chức năng và liệt dạ dày trên lâm sàng.[65] Do đó, liệt dạ dày trên lâm sàng được coi là một phần của khó tiêu chức năng. Các triệu chứng vùng bụng trên gợi ý khó tiêu chức năng xảy ra lên đến 10% dân số chung.66 Làm rỗng dạ dày bị trì trệ được báo cáo ở 19 – 28% bệnh nhân đái tháo đường có các triệu chứng ở vùng bụng trên [32,33] (Bảng 1). Cherian và cộng sự, trong nghiên cứu của họ về các triệu chứng của liệt dạ dày do đái tháo đường, bao gồm những bệnh nhân có các bệnh lý đi kèm mà được điều trị bằng opiate hoặc các thuốc trị liệu tâm lý có thể tạo ra các triệu chứng không liên quan đến chứng rối loạn dạ dày do đái tháo đường. [67] GCSI sửa đổi với một điểm số ghi chép hàng ngày cho các triệu chứng đã được hình thành để định lượng mức độ nghiêm trọng của các triệu chứng. Không có mối tương quan đáng kể nào được tìm thấy giữa điểm số triệu chứng và làm rỗng dạ dày. [67]
Các nghiên cứu hiện có không hỗ trợ cho một mối quan hệ nhân quả giữa các bất thường về vận động và các triệu chứng trong liệt dạ dày do đái tháo đường. Phản bác được nhắc đến nhiều nhất chống lại các bất thường về vận động dạ dày trong bệnh liệt dạ dày do đái tháo đường là thực tế rằng bệnh nhân mắc đái tháo đường và các triệu chứng vùng bụng trên thì có làm rỗng dạ dày bình thường, bị trì trệ hoặc nhanh [32,33] (Bảng 1). Tần suất điều tiết dạ dày giảm ở những bệnh nhân bị bệnh liệt dạ dày không cao hơn ở những người bị liệt dạ dày so với giữa những người có làm rỗng dạ dày bình thường hoặc nhanh.33 Hơn nữa, việc bình thường hóa làm rỗng dạ dày không không cải thiện các triệu chứng với bất kỳ tính nhất quán nào, [68-71] và cũng không cải thiện các triệu chứng làm cho làm rỗng dạ dày được cải thiện. [72]
Khi nhận ra rằng không có mối quan hệ nhân quả giữa các bất thường về vận động và các triệu chứng, một số bác sĩ lâm sàng tự hỏi liệu liệt dạ dày là một bệnh lý riêng biệt hay chỉ đơn giản là một phần của khó tiêu.[73] Hơn nữa, việc sử dụng các thủ thuật xâm lấn nhằm mục tiêu làm rỗng dạ dày để giảm bớt các triệu chứng không được khuyến khích.[74] Quan sát cho thấy việc đẩy nhanh quá trình làm rỗng dạ dày làm trầm trọng thêm tình trạng tăng glucose huyết 50 càng làm dấy lên các lo ngại về việc sử dụng bừa bãi các biện pháp can thiệp như vậy. Có vẻ như các triệu chứng không với khó tiêu chức năng trong liệt dạ dày có thể phát sinh không phải là do thay đổi về vận động mà là do các thay đổi song song của ảnh hưởng stress oxy hóa và sự viêm lên các thụ thể đau “nociceptors” và sợi thần kinh hướng tâm khác khác tạo ra các triệu chứng này. [75] Các khái niệm gần đây về cơ chế của khó tiêu chức năng cho thấy sự liên quan của viêm và hóa chất trung gian mức độ thấp trong các triệu chứng liên quan đến khó tiêu chức năng. [76] Điều trị hiệu quả các triệu chứng trong bệnh liệt dạ dày do đái tháo đường có thể tương tự như điều trị khó tiêu chức năng.
Kết luận
Sự tiến bộ gần đây của các xét nghiệm dễ sử dụng, có thể sử dụng (xạ hình dạ dày hoặc test hơi thở đồng vị ổn định 13C) đã giúp xác định các bất thường làm rỗng dạ dày, đặc biệt là làm rỗng dạ dày nhanh. Các nghiên cứu gần đây đã chỉ ra rằng các triệu chứng do liệt dạ dày không đặc hiệu nhưng cũng có thể bắt gặp ở làm rỗng dạ dày nhanh hoặc bình thường. Làm rỗng dạ dày nhanh hiện đang nổi lên như một cơ chế quan trọng của tình trạng tăng glucose huyết sau ăn. Các nghiên cứu trên động vật đã chỉ ra rằng dây thần kinh phế vị có thể kiểm soát quá trình làm rỗng dạ dày thông qua các vòng phế vị và các sản phẩm chuyển hóa liên quan đến tăng glucose huyết có thể có những ảnh hưởng rõ rệt đến chuyển động dạ dày. Sự hiểu biết về cơ chế của những biến chứng này có thể giúp xác định các đích điều trị mới hợp lý.
Tài liệu tham khảo
Gastric Emptying Abnormalities in Diabetes Mellitus, N Engl J Med 2021; 384:1742-1751 DOI: 10.1056/NEJMra2020927, bài báo gốc xem ở đây.

![Những bất thường làm rỗng dạ dày ở bệnh nhân đái tháo đường 12 Hình 1. Tăng đường huyết cấp tính Làm rỗng dạ dày chậm. Tăng đường huyết cấp tính kích hoạt các tế bào thần kinh kích thích glucose của các tế bào hướng tâm vị trong hạch nút (NG) và nhân đường sinh dục, là một phần của mạch vận động phế vị ức chế dạ dày (GIVMC). Họ chịu đựng những- chất vận chuyển cose (GLUT, loại không xác định) và chất vận chuyển natri-glucose (SGLT). Tăng đường huyết dẫn đến nhanh chóng tăng nồng độ glucose nội bào. Glucokinase chuyển đổi glucose thành glucose-6-phosphate, trải qua quá trình gly- sự đồng phân để tạo ra axit pyruvic, dẫn đến việc sản xuất ATP trong ti thể. ATP ức chế các potas- nhạy cảm với ATP kênh sium (KATP), gây ra sự khử cực và kích hoạt các tế bào thần kinh hướng tâm để kích thích GIVMC. Tuy nhiên, Tác dụng kích thích tăng đường huyết bị chấm dứt vì tăng đường huyết cũng gây giảm điều hòa glucoki- nase. Việc kích hoạt GIVMC giải phóng các chất dẫn truyền ức chế (oxit nitric [NO], ATP, và hoạt mạch đường ruột peptide [VIP]), làm giảm sự co bóp của cơ trơn và gây rối loạn chức năng của các tế bào kẽ của Cajal, với dẫn đến bất thường sóng chậm. Ach biểu thị acetylcholine, CCe tế bào thần kinh catecholaminergic của con đường kích thích- cách, tế bào thần kinh CCi catecholaminergic của con đường ức chế, tế bào thần kinh cholinergic Ce của con đường kích thích, Tế bào thần kinh cholinergic của con đường ức chế, nhân vận động ở lưng của phế vị, axit G γ-aminobutyric – sản xuất- thần kinh ing (GABAergic), mạch vận động phế vị kích thích dạ dày GEVMC, NANC nonadrenergic noncholinergic neu- ron, nơ-ron proopiomelanocortin POMC, và nơ-ron tiền tế bào PPG.](https://nhathuocngocanh.com/wp-content/uploads/2021/12/tang_duong_huyet_lam_rong_da_day.jpg)