Bệnh huyết học
Nguyên nhân và hậu quả của việc kích hoạt quá trình đông máu trong nhiễm trùng huyết: Sự phát triển trong quan điểm y học
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh – Để tải bài viết Nguyên nhân và hậu quả của việc kích hoạt quá trình đông máu trong nhiễm trùng huyết: Sự phát triển trong quan điểm y học file PDF xin vui lòng click vào link ở đây.
Tác giả: Maiara Marx Luz Fiusa, Marco Antonio Carvalho-Filho, Joyce M Annichino-Bizzacchi and Erich V De Paula
Biên dịch: Tùng Long
Tóm lược
Bối cảnh: Sự đông máu và khả năng miễn dịch bẩm sinh có mối liên hệ với nhau trong ít nhất 450 triệu năm tiến hóa. Nhiễm trùng huyết, một trong những nguyên nhân gây tử vong hàng đầu thế giới, có lẽ là tình trạng làm rõ ràng hơn mối liên hệ này. Tuy nhiên, sự liên quan về mặt sinh học và lâm sàng của nó mới chỉ nhận được sự chú ý trong cộng đồng các nhà khoa học.
Thảo luận: Trong nhiễm trùng huyết, phản ứng của cơ thể với mầm bệnh luôn liên quan đến sự kích hoạt đông máu. Trong nhiều năm qua, kích hoạt đông máu chỉ được coi là một cơ chế gây tổn thương mô, điều này dẫn đến vô số thử nghiệm lâm sàng về các thuốc chống đông cho bệnh nhân nhiễm trùng huyết. Nhưng gần đây, cơ chế đó đang bị lung lay bởi sự thất bại của chính các thử nghiệm lâm sàng này, và bởi một lượng lớn bằng chứng ủng hộ quan niệm rằng kích hoạt đông máu có lợi cho việc loại bỏ mầm bệnh. Trong bài viết này, chúng tôi muốn chỉ ra một cái nhìn cân bằng hơn về tác hại và lợi ích của việc kích hoạt đông máu trong nhiễm trùng huyết.
Tóm tắt: Đánh giá lại mối liên quan giữa đông máu và kích hoạt miễn dịch từ góc độ y học tiến hóa mang đến cơ hội duy nhất để có được những hiểu biết mới về cơ chế bệnh sinh của nhiễm trùng huyết, mở đường cho các phương pháp tiếp cận thành công hơn trong cả nghiên cứu lâm sàng và nghiên cứu cơ bản trong lĩnh vực này.
Background
Nhiễm trùng huyết gần đây đã được xác định là một tình trạng đe dọa tính mạng, xảy ra khi phản ứng của cơ thể khi bị nhiễm trùng làm tổn thương các mô và cơ quan của chính cơ thể đó [1]. Hàng thập kỷ qua, chúng ta đã chứng kiến những cải tiến liên tục trong sự hiểu biết về cơ chế bệnh sinh của tình trạng này. Tuy nhiên, nhiễm trùng huyết vẫn liên quan đến tỷ lệ tử vong cao tới 30% [2] và với tỷ lệ mắc hàng năm tăng 10% [2], đây vẫn là một trong những thách thức lớn nhất của y học hiện đại [3].
Đáp ứng của cơ thể với mầm bệnh là một trong những yếu tố chính quyết định đến kết cục trong nhiễm trùng huyết [4]. Khái niệm này được thừa nhận trong nhiều thập kỷ dựa trên giới hạn của liệu pháp kháng sinh trong điều trị nhiễm trùng huyết, và được hỗ trợ bằng cách tăng cường sự hiểu biết về các con đường tế bào cũng như phân tử liên quan đến vật chủ: sự tương tác với mầm bệnh [4,5]. Hầu như tất cả các sinh vật đã phát triển các cơ chế cảm biến để phát hiện nhanh chóng các mầm bệnh, mà ở người được đại diện bởi các pattern-recognition receptors (PRR). Những thụ thể này nhận ra các hình mẫu được bảo tồn trong mầm bệnh cũng như các tín hiệu nguy hiểm gây ra stress tế bào trong điều kiện viêm vô trùng [6,7]. Như dự đoán, các thụ thể và phối tử của hệ thống cảm biến này đã chịu áp lực chọn lọc mạnh mẽ trong lịch sử tiến hóa của các loài linh trưởng và vượn cổ [8,9], mà mầm bệnh được xem là yếu tố chính quyết định cách thức tiến hóa. Một ví dụ về khái niệm này là chứng minh sự tiến hóa hội tụ của các gen Toll-like receptor (TLR) ở các quần thể châu Âu và Rroma (Gypsy) có cùng khu vực địa lý. Những điểm giống nhau trên gen TLR đã được tìm thấy trong hai quần thể này sau khi họ bị phơi nhiễm với bệnh dịch hạch ở châu Âu trong thời trung cổ. Do mức độ nghiêm trọng của nhiễm trùng huyết liên quan đến đáp ứng của vật chủ với mầm bệnh, không có gì ngạc nhiên khi biến thể của các gen này và các gen liên quan đến miễn dịch khác có thể ảnh hưởng đến mức độ nghiêm trọng của nhiễm trùng huyết [11].
Tuy nhiên, các con đường tế bào được kích hoạt do sự xâm nhập của mầm bệnh trong nhiễm trùng huyết không chỉ dừng lại ở các gen liên quan đến miễn dịch cổ điển, còn có các cơ chế ít liên quan đến hệ thống miễn dịch. Điều chỉnh tính toàn vẹn của hàng rào nội mô và sự kích hoạt đông máu là hai ví dụ quan trọng. Thứ nhất, bạch cầu tiếp cận các mô bằng cách xuyên mạch, góp phần tiêu diệt mầm bệnh. Thứ hai, thảo luận về lý do tại sao đông máu được kích hoạt trong nhiễm trùng huyết và hậu quả của chúng là hai mục tiêu chính của bài tổng quan này. Tầm quan trọng của hai câu hỏi này nằm ở chỗ cường độ và sự điều hòa kích hoạt đông máu trong nhiễm trùng huyết dường như đóng vai trò chính trong việc xác định kết cục của bệnh nhân: có thể giúp tiêu diệt mầm bệnh (và khỏi bệnh), hoặc làm nặng thêm tổn thương mô thứ cấp như đông máu nội mạch lan tỏa (DIC) hoặc rối loạn chức năng đa cơ quan (MOF) [12].
Để giải quyết những câu hỏi quan trọng này, trước tiên chúng ta sẽ thảo luận về một số áp lực chọn lọc tiềm năng đã phát triển hệ thống đông máu của con người hiện đại. Tiếp theo, so sánh quan điểm cổ điển về vai trò của kích hoạt đông máu trong nhiễm trùng huyết với những dữ liệu thực nghiệm gần đây có thể giúp chúng ta trả lời câu hỏi quan trọng rằng, tại sao lại xảy ra sự kích hoạt đông máu trong khi nhiễm trùng huyết. Cuối cùng, chúng tôi sẽ thảo luận về cách mà các quan điểm xuất hiện từ cuộc thảo luận này có thể ảnh hưởng đến nghiên cứu về nhiễm trùng huyết sau này.
Thảo luận
Áp lực chọn lọc tạo nên hệ thống cầm máu
Trong khi mầm bệnh được công nhận là áp lực chọn lọc chính đối với các gen liên quan đến miễn dịch như TLR và các loại khác [9,13], thì người ta biết rất ít về những áp lực ảnh hưởng đến sự tiến hóa của hệ thống đông máu. Ở người, mục tiêu cuối cùng của đông máu là giữ cho máu không rời khỏi khoang nội mạch thông qua các tổn thương tại lớp tế bào nội mô. Điều này đạt được nhờ một hệ thống được điều chỉnh tốt có khả năng đáp ứng nhanh chóng với sự tác động của yếu tố mô (TF), một loại protein thường được tách biệt ở khoang ngoại mạch, với các yếu tố đông máu có trong huyết tương. Hệ thống này được tổ chức theo kiểu “dòng thác” liên quan đến tiểu cầu, bạch cầu, và các protein đông/chống đông máu, hoạt động đồng bộ để thúc đẩy sự hình thành các cục máu đông tại vị trí tổn thương cho đến khi mô được chữa lành.
Bằng chứng sinh hóa và phân tử ủng hộ ý tưởng rằng, hiện tại sự tổ chức của hệ thống đông máu ở người đã phát triển hơn 450 triệu năm trước [14]. Mặc dù có rất ít thông tin về áp lực chọn lọc dẫn đến sự tiến hóa này, nhưng người ta có thể suy đoán rằng sự phức tạp ngày càng tăng của tổ chức cơ thể người có thể là một yếu tố quan trọng. Các hệ thống đông máu ở động vật không xương sống như sam hoặc ruồi giấm (Drosophila) bao gồm ít gen và protein hơn nhiều so với động vật có xương sống, nhưng ở chúng có những điểm tương đồng cho thấy nguồn gốc chung ở ít nhất một thành phần trong số đó. Ví dụ, sự ổn định cục máu đông phụ thuộc vào hoạt động của một Transglutaminase dường như góp phần vào quá trình đông máu ở tất cả các động vật không xương sống và tương đồng với yếu tố XIIIa ở người [15]. Ở động vật có tổ chức cơ thể phức tạp hơn, việc hạn chế khuếch tán oxy và các phân tử quan trọng khác, cũng như sự phân loại các chức năng của cơ thể trong các cơ quan khác nhau đòi hỏi cần phải phát triển các hệ tuần hoàn kín với sự thích nghi đặc biệt của các cơ quan về mặt giải phẫu và sinh lý của giường mao mạch. Sự phức tạp này dựa trên sự không đồng nhất đáng kể về kiểu hình của tế bào nội mô trên toàn bộ hệ thống mạch máu [16,17] và cũng liên quan đến sự thay đổi chức năng cầm máu giữa động mạch và tĩnh mạch, thậm chí trong các giường mao mạch. Các biến thể đặc trưng của cơ quan cầm máu được minh họa rõ bởi sự khác biệt lâm sàng trong biểu hiện của bệnh huyết khối ở các cơ quan khác nhau [18].
Ngoài việc thích ứng với các hệ tuần hoàn ngày càng phức tạp, sự liên kết chặt chẽ giữa cầm máu và đáp ứng miễn dịch bẩm sinh là một yếu tố khác ảnh hưởng đến sự tiến hóa của hệ thống cầm máu ở người. Bằng chứng là cầm máu và viêm tiến hóa từ một cơ chế kích hoạt đơn lẻ có thể được truy nguyên từ hơn 450 triệu năm trước, dựa trên các nghiên cứu với sam (Limulus polyphemus) [19]. Chấn thương ở lớp vỏ cứng là mối đe dọa lớn đối với những động vật không xương sống có hệ thống phản ứng tế bào nhanh theo kiểu dòng thác, có thể hình thành cục máu đông trong trường hợp có bất kỳ tổn thương nào ở lớp vỏ của chúng. Vì những sinh vật nhân chuẩn cổ đại này sống ở biển, cho nên quá trình tiến hóa đã chọn ra một hệ thống được kích hoạt chỉ với một nồng độ nội độc tố vi khuẩn tối thiểu, hiện diện trong Cyanobacteria (vi khuẩn lam) trong hơn 2 tỷ năm [20]. Điều thú vị là độ nhạy cực cao của hệ thống này là cơ sở của các xét nghiệm dùng để phát hiện nội độc tố trong phòng thí nghiệm, bằng cách sử dụng các protein có nguồn gốc từ các động vật không xương sống này. Sam không có hệ thống tuần hoàn, cho nên hệ thống được kích hoạt bởi nội độc tố này bảo vệ chúng khỏi bị nhiễm trùng và mất vật chất bên trong cơ thể sau khi bị thương. Ở người, các hệ thống độc lập và phức tạp hơn tồn tại nhằm chống lại sự xâm nhập của mầm bệnh và chảy máu. Tuy nhiên, việc có cùng các chất kích hoạt phổ biến (như endotoxin), cũng như sự chồng chéo giữa một số con đường, cho thấy mối liên hệ chặt chẽ giữa sự tiến hóa của cầm máu và hệ thống miễn dịch trong 450 triệu năm qua.
Các bệnh truyền nhiễm như đậu mùa, dịch hạch và sốt rét được công nhận là áp lực chọn lọc mạnh mẽ tác động lên các gen của hệ thống miễn dịch trong 10.000 đến 20.000 năm qua [8,21]. Tuy nhiên, những áp lực chọn lọc khác nhau phải liên quan đến sự tiến hóa của miễn dịch bẩm sinh và cầm máu trong 2,5 triệu năm tiến hóa còn lại của loài Người [22]. Trong thời gian dài này, mật độ dân số thấp và thói quen du cư của những tộc người săn bắt hái lượm không cho phép các kiểu lây lan mầm bệnh được quan sát thấy trong các xã hội hậu nông nghiệp, do đó chấn thương và những bệnh không truyền nhiễm là nguyên nhân chính gây tử vong [21]. Theo những quan sát này, một chương trình tử thiết toàn diện thực hiện tại một công viên quốc gia ở Tanzania đã xác định rằng chấn thương chứ không phải nhiễm trùng là nguyên nhân chính gây tử vong cho tinh tinh trong tự nhiên [23]. Tương tự, các thương tích trong khi săn mồi được xác định là một áp lực chọn lọc quan trọng của các loài linh trưởng [24]. Ở môi trường mà chấn thương phải được xử lý mà không có sự trợ giúp của chăm sóc sức khỏe hiện đại, một hệ thống cầm máu nhanh chóng và hiệu quả cao rất có thể đã chịu một áp lực chọn lọc mạnh mẽ. Hơn nữa, khi không có kiến thức vệ sinh cơ bản và kháng sinh, có thể dễ dàng hình dung tầm quan trọng của cầm máu như một phần của hệ thống miễn dịch bẩm sinh khi fibrin, tiểu cầu và bạch cầu góp phần tránh lây lan mầm bệnh, như đã nêu trong giả thuyết “hemostatic containment” [25].
Trong bối cảnh này, bát kỳ đặc tính nào giúp tối ưu hóa việc cám máu và chữa lành vết thương mà không làm tăng nguy cơ huyết khối phải được hưởng lợi từ tiến hóa. Do tỷ lệ mắc các yếu tố nguy cơ ở thời hiện đại đối với các bệnh huyết khối trong thời cổ đại rất tháp, sự cân bằng giữa chảy máu và tạo huyết khối có thể ủng hộ cho sự phát triển của một hệ thống cám máu cực kỳ hiệu quả. Nhưng khi tiếp xúc với các yếu tố nguy cơ thời hiện đại như chế độ ăn nhiều chất béo, hút thuốc, ít vận động và lão hóa đã góp phần tăng tỷ lệ mắc bệnh huyết khối [26]. Sự xuất hiện và ổn định của yếu tố V Leiden ở vùng Bắc Âu khoảng 30.000 năm trước là một minh họa tốt cho khái niệm này. Yếu tố V Leiden là một đa hình di truyền làm tăng khả năng cám máu của mỗi cá nhân, dẫn đến ít chảy máu hơn trong khi sinh. Tuy nhiên, khi kết hợp với liệu pháp estrogen ngoại sinh có trong thuốc tránh thai đường uống thời hiện đại, nó làm tăng tỷ lệ mắc bệnh huyết khối tĩnh mạch [27]. Thực tế là những áp lực chọn lọc này trên hệ thống cám máu dã hoạt động trong một khoảng thời gian dài hơn nhiêu so với lịch sử của dịch bệnh dịch hạch và thùy dậu, thậm chí có thể trước thời kỳ phân ly của loài Người từ các loài vượn cổ khác. Vì vậy có thể giải thích tại sao các công cụ hiện đại được sử dụng để phát hiện những dấu án chọn lọc trong bộ gen người có xu hướng nhâm xác định hệ thống miễn dịch (chứ không phải hệ thống cám máu), dây là mục tiêu chính của chọn lọc tự nhiên. Theo đó, các biến thể ủng hộ hệ thống cầm máu hiệu quả cao có thế đã tồn tại trong bộ gen của chúng ta trong hàng triệu năm và chúng khó bị nhận diện bời các công cụ hiện nay. Thật thú vị khi KNG1 (gen mã hóa kininogen, là một trong những liên hệ chính giữa cám máu và viêm) gân đây đã được chứng minh là mục tiêu của áp lực chọn lọc trong thời gian dài [28].
Quan điểm cổ điển về vai trò của sự kích hoạt đông máu trong nhiễm trùng huyết
Việc thu hồi gần đây của protein c hoạt hóa tái tổ hợp (rhaPC), một chất chống đông máu tự nhiên được sử dụng trong điều trị nhiễm trùng huyết, là kết quả cho sự thất bại liên tiếp của nhung thử nghiệm lâm sàng có quy mô lớn được thiết kế để kiểm tra một giả thuyết được chấp nhận rộng rãi rằng, kích hoạt đông máu và huyết khối vi mạch là những yếu tố chính quyết định tổn thương mô trong nhiễm trùng huyết [29]. Bằng chứng sớm nhất về vai trò của kích hoạt đông máu trong nhiễm trùng huyết bao gồm chứng minh mô học của huyết khối vi mạch tại các cơ quan đích của bệnh nhân nhiễm trùng và giảm dần số lượng tiểu cầu cũng như nồng độ các yếu tố đông máu ở giai đoạn muộn của nhiễm trùng huyết, đổ lỗi cho sự “tiêu thụ các yếu tố đông máu”. Những năm tiếp theo, phần lớn các dữ liệu thực nghiệm chỉ ra rằng nhiễm trùng huyết thực sự có liên quan đến sự thay đổi trong cân bằng đông máu, nghiêng về phía đông máu. Dữ liệu thuyết phục nhất là: (i) chứng minh sự biểu hiện của TF(III) trong bạch cầu lưu hành có thể được kích hoạt bởi mầm bệnh; (ii) thiếu hụt protein chống đông nội sinh như antithrombin và protein C ở bệnh nhân nhiễm trùng huyết; và (iii) sự gia tăng các chất ức chế phân hủy fibrin như PAI-1 [30]. Những dữ liệu này hỗ trợ cho khái niệm nâng kích hoạt đỏng máu chịu một phần trách nhiệm cho tình trạng suy tạng mà ta quan sát thấy trong nhiễm trùng huyết. Việc điều trị chống đông trên động vật nhiễm trùng huyết đã hỗ trợ thêm cho khái niệm này, bằng cách cho thấy rằng suy nội tạng và thậm chí tử vong có thể được hạn chế bằng cách ức chế các yếu tố đông máu riêng biệt như yếu tố III [311 và yếu tó VII [32] trong số những yếu tố khác .
Dựa trên mô hình này, các chiến lược phát triển đáy tham vọng của thuốc chống đông máu tự nhiên tái tổ hợp (antithrombin, TFPI và rhaPC) ở bệnh nhân nhiễm trùng huyết đã được thực hiện đến phase 3, một trong số đó đang ở giai đoạn market approval. Thật không may, những lợi ích của chúng không thể được công nhận thông qua các thử nghiệm đó, mặc dù các thử nghiệm lâm sàng và phân tích tổng hợp bổ sung dược bảo đảm trước khi có thể đưa ra kết luận chắc chắn về vấn đề này [33]. Những hạn chế của mô hình động vật [34] và trong thiết kế của thử nghiệm lâm sàng [29] đều bị đánh giá là không có mối liên hệ giữa dữ liệu tiền lâm sàng và lâm sàng. Chúng ta cùng có thể đóng góp cho cuộc thảo luận này bằng cách đưa ra một cái nhìn thận trọng hơn về mối quan hệ nhân quả trực tiếp giữa kích hoạt đông máu và suy đa cơ quan trong nhiễm trùng huyết Trên thực tế, sự hiện diện của huyết khối vi mạch ở các cơ quan đích trong nhiễm trùng huyết chỉ được chứng minh trong các nghiên cứu với một số bệnh nhân hạn chế, không có sự phân loại các giai đoạn khác nhau của nhiễm trùng huyết trong phân tích của họ [35,36]. Các nghiên cứu tử thiết gần đây xác nhận rằng những phát hiện này chì giới hạn trong một số lượng nhỏ bệnh nhân nhiễm trùng huyết nặng [37,38]. Ngoài ra, mặc dù chúng tỏi không tranh luận về các mức độ tăng đóng hệ thống khác nhau trong nhiễm trùng huyết, nhưng ván đế này gần đây đã được chứng minh là một yếu tố dự báo độc lập của huyết khối tĩnh mạch và động mạch [39,40]. Sự hiện diện của hiện tượng này trong giai đoạn đầu nhiễm trùng huyết đã bị phản đối bởi dữ liệu thu được từ các xét nghiệm đông máu toàn bộ với sự điều chỉnh giảm tạo thrombin trong giai đoạn đầu của nhiễm trùng huyết [41,42]. Do đó, việc đánh giá lại những dữ liệu cũ và mới bằng cách sử dụng nền tảng y học tiến hóa [43] có thể giúp chúng ta tìm ra nguyên nhân sau cùng của kích hoạt đông máu trong nhiễm trùng huyết.
Tại sao đông máu được kích hoạt trong nhiễm trùng huyết?
Khái niệm kích hoạt đông máu có thể có lợi trong quá trình nhiễm trùng đã được đưa ra cách đây vài năm [20] và đang nhận được ngày càng nhiều sự ủng hộ trong thập kỷ qua. Những bài review xuất sắc về các nghiên cứu liên hệ giữa đông máu và miễn dịch bẩm sinh đã được công bố gần đây [4,44,45]. Mục tiêu của chúng tôi ở đây là trình bày một bản tóm tắt cập nhật của các nghiên cứu này, nêu bật cách giải thích của họ từ góc độ y học tiến hóa.
Nhiều nghiên cứu cho thấy các protein đông máu là cần thiết để loại bỏ mầm bệnh. Hiện tại người ta đã biết rằng TF cũng kích hoạt các con đường truyền tín hiệu độc lập với đông máu qua trung gian các thụ thể kích hoạt protease (PAR) trên các tế bào miễn dịch [46]. Các tín hiệu phụ thuộc PAR dẫn đến các con đường viêm và chống viêm giúp điều hòa sự di chuyển và tăng sinh của các tế bào miễn dịch, tái tạo mạch, sự kết dính nội mô và nhiều phản ứng khác của vật chủ đối với nhiễm trùng [47,48]. Con đường phụ thuộc PAR cũng được kích hoạt bởi các thành phần khác của dòng thác đông máu như protein C hoạt hóa, yếu tố Xa và thrombin [46], bổ sung thêm vào danh sách các yếu tố đông máu tham gia vào quá trình miễn dịch.
Hệ thống hoạt hóa tiếp xúc (The contact system), trước đây được xem là khởi đầu cho con đường đông máu nội sinh, cũng tham gia vào phản ứng của vật chủ với mầm bệnh. Kininogen, một trong những thành phần của hệ thống hoạt hóa tiếp xúc, hiện được công nhận là một nguồn peptide kháng khuẩn quan trọng được tiết ra khi nhận diện được một số vi sinh vật bởi nó [49]. Đáng chú ý, một nghiên cứu về gen gần đây đã chỉ ra rằng kininogen đã chịu áp lực chọn lọc mạnh mẽ trong quá trình tiến hóa [28]. Các thành phần khác của đông máu, chẳng hạn như các yếu tố đông máu II, X và fibrinogen, cũng đã được chứng minh là có giải phóng các peptide kháng khuẩn, không nhất thiết liên quan đến đông máu (reviewed in [44]).
Một cơ chế khác cho thấy kích hoạt đông máu góp phần thải trừ mầm bệnh là bằng cách hình thành một hàng rào vật lý ngăn chặn sự lây nhiễm của bệnh, từ đó tạo điều kiện cho sự tiêu diệt mầm bệnh của các tế bào miễn dịch. Giả thuyết này
[25] hiện tại được hỗ trợ bởi hàng loạt các bằng chứng chỉ ra rằng việc điều chỉnh giảm các yếu tố khác nhau của quá trình đông máu (như fibrin và tiểu cầu) làm cản trở sự thải trừ mầm bệnh (Bảng 1). Một minh chứng thuyết phục rằng fibrin có thể là một yếu tố bảo vệ trong quá trình nhiễm trùng, xuất hiện trong một nghiên cứu với những con chuột bị thiếu fibrinogen, cho thấy có tăng tỷ lệ tử vong và sự tăng trưởng vi khuẩn trong mô hình nhiễm khuẩn Listeria monocytogenes.Vai trò của sự hình thành fibrin trong tác dụng bảo vệ đã được khẳng định bằng sự lặp lại của kết quả này ở chuột được điều trị bằng warfarin, một chất chống đông máu điều chỉnh sự hình thành fibrin theo một cơ chế khác [50]. Một chiến dịch tương tự đã xác nhận vai trò của việc tạo thrombin và hình thành fibrin trong nhiễm trùng Yersinia enteratioitica [51]. Độ thải trừ mầm bệnh giảm ở chuột thiếu fibrinogen cũng được đề xuất trong một nghiên cứu sử dụng mô hình nhiễm liên cầu khuẩn nhóm A [52]. Yếu tố XIII, được coi là yếu tố đông máu tiến hóa nhất được bảo tồn [53], dường như cũng rất quan trọng đối với sự thải trừ mầm bệnh, đã được đề xuất bởi một nghiên cứu cho thấy Streptococcus pyogenes bị bất hoạt và tiêu diệt bên trong cục máu đông fibrin [ 15].
Hệ thống tiêu sợi huyết, giúp điều chỉnh chức năng đông máu bằng sự thoái hóa của fibrin thrombi khi chúng không còn cần thiết, dường như cũng liên quan đến việc thải trừ mầm bệnh. Trong nhiều năm, người ta đã biết rằng nhiễm trùng huyết có liên quan đến việc giảm khả năng tiêu sợi huyết do sự gia tăng nhanh chóng của chất ức chế tiêu sợi huyết (PAI-1) trong huyết tương [54,55]. Trong khi tình trạng giảm tiêu sợi huyết này được xem là một trong những nguyên nhân gây ra huyết khối vi mạch và tổn thương mô trong nhiều năm nay, một lời giải thích khác là bằng cách chấm dứt quá trình tiêu sợi huyết, vật chủ có thể hạn chế sự lây lan của mầm bệnh bởi các khối fibrin chắc chắn hơn. Các nghiên cứu với chuột biến đổi gen hỗ trợ cho giải thích này. Theo đó, những con chuột bị thiếu chất kích hoạt plasminogen mô dẫn đến sự ly giải fibrin bị suy yếu, cho thấy sự phát triển của vi khuẩn thấp hơn ở vị trí nhiễm trùng chính (phổi) trong mô hình chuột bị nhiễm trùng gram âm [56]. Theo quan sát này, sự thiếu hụt các chất ức chế phân hủy fibrin PAI-1 [57,58] và α2-antiplasmin [59], cả hai đều có liên quan đến tăng hoạt động tiêu sợi huyết, dẫn đến suy giảm khả năng thải trừ mầm bệnh trong các mô hình nhiễm trùng do vi khuẩn và virus. Một manh mối tiến hóa rất có ý nghĩa khác đến từ một số ví dụ về các yếu tố độc lực gây bệnh dựa trên các protease làm thoái hóa các khối fibrin [60], trong đó streptokinase từ Streptococcus pyogenes [61] và một chất kích hoạt plasminogen từ Yersinia pestis là những ví dụ nổi tiếng nhất [62,63]
Giảm số lượng tiểu cầu từ lâu đã được công nhận là một yếu tố tiên lượng quan trọng, là một biomarker chỉ mức độ nghiêm trọng của nhiễm trùng huyết. Về vấn đề này, gần đây chúng tôi đã chứng minh rằng số lượng tiểu cầu, được đo bằng mẫu tiểu cầu chưa trưởng thành, tương quan với mức độ nghiêm trọng nhiễm trùng huyết [64]. Tuy nhiên, các nghiên cứu gần đây chỉ ra rằng tiểu cầu trên thực tế là một yếu tố bảo vệ quan trọng của vật chủ. Wong và cộng sự đã chứng minh rằng tiểu cầu hỗ trợ các tế bào Kupffer để “nhốt” các mầm bệnh lây truyền qua máu trong gan [65]. Trong một nghiên cứu thú vị khác, giảm tiểu cầu do kháng thể dẫn đến giảm khả năng sống sót, song song với tăng tỷ lệ tăng trưởng vi khuẩn trong một mô hình nhiễm trùng huyết do viêm phổi [66]. Sự tham gia của neutrophil extracellular traps-NET trong vai trò bảo vệ vật chủ [67,68] và vai trò kích hoạt tiểu cầu trong sự hình thành NET [69] cung cấp một sự liên hệ khác giữa cầm máu và miễn dịch bẩm sinh [45].
Mặc dù có tất cả những bằng chứng này, người ta nên ghi nhớ sự phức tạp của các tương tác giữa cầm máu, miễn dịch bẩm sinh và mầm bệnh. Vì những lý do chưa rõ ràng, thiếu hụt yếu tố XI ở chuột, cũng liên quan đến việc giảm hình thành fibrin, được chứng minh là cải thiện, thay vì cản trở, phản ứng của vật chủ trong các mô hình nhiễm trùng khác nhau [70,71]. Khả năng sống sót quan sát được trong các nghiên cứu trên chuột thiếu yếu tố đông máu không phải lúc nào cũng cho ra kết quả giống nhau khi mà các mô hình nhiễm trùng khác nhau được thử nghiệm [72]. Và trong một số hoàn cảnh, cuộc chiến giữa mầm bệnh và vật chủ dường như đã biến fibrin thành yếu tố có lợi với một số mầm bệnh [72]. Thật vậy, sự phức tạp này được minh họa rõ ràng bởi tính không đồng nhất của sự điều hòa giảm của việc tạo thành thrombin trong kết cục của nhiễm trùng huyết ở các mô hình động vật khác nhau (Bảng 1).
Dữ liệu lâm sàng cũng góp phần vào ý tưởng rằng một số mức độ kích hoạt đông máu có thể có lợi cho việc thải trừ mầm bệnh. Các nghiên cứu cho rằng ức chế đông máu giúp hạn chế tổn thương mô trong nhiễm trùng huyết đã không được công nhận trong phase 3 clinical trials cho các thuốc chống đông sử dụng trên những bệnh nhân này [73-75]. Tác động của yếu tố V Leiden (FVL), một biến thể của yếu tố V, trong tử vong do nhiễm trùng huyết cũng là điều đáng bàn luận. Khi được phân tích ở phase 3 của một nghiên cứu lớn, những người có FVL có tỷ lệ tử vong 28 ngày thấp hơn đáng kể so với nhóm không có FVL [76]. Mặc dù dữ liệu này chưa thể được xác nhận bởi các nghiên cứu khác [27], nhưng ít nhất nó phản đối khái niệm về sự bất lợi của kích hoạt đông máu trong nhiễm trùng huyết.
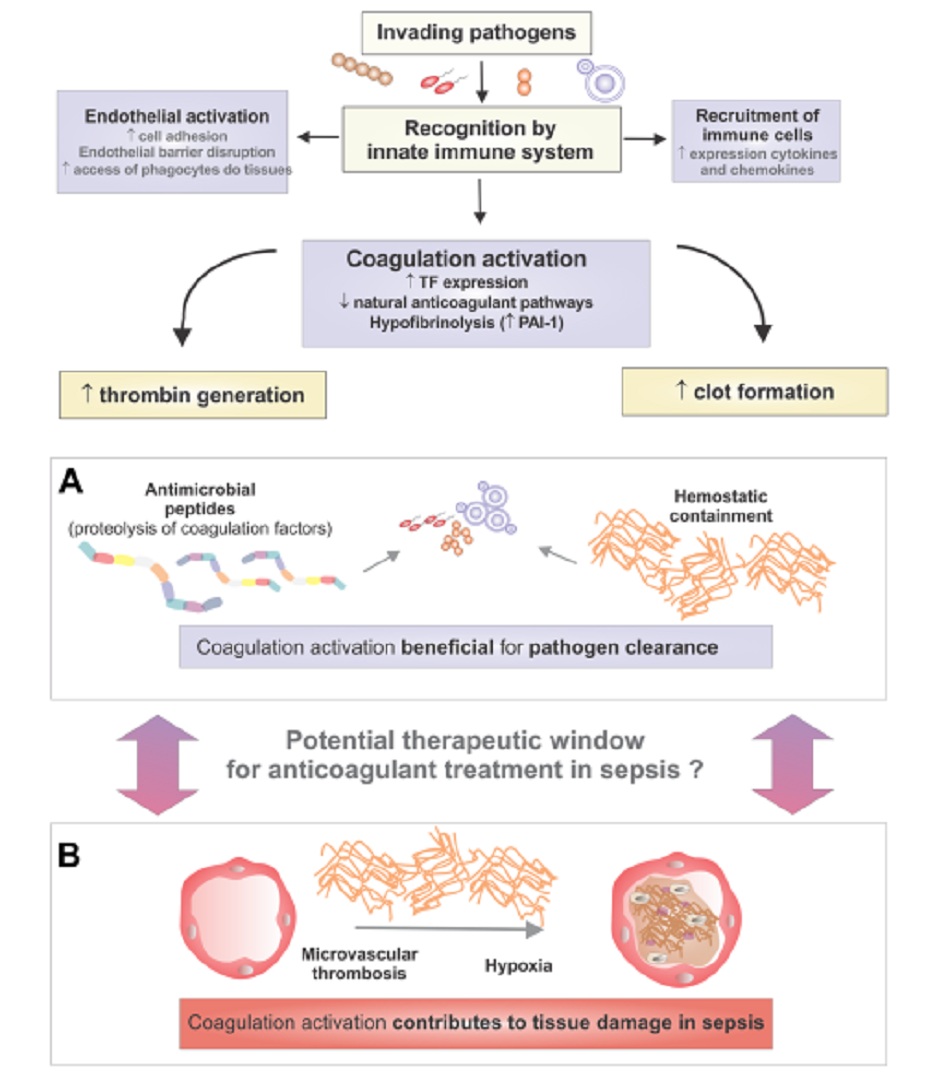
Mặc dù các bằng chứng trong phòng thí nghiệm và trên lâm sàng cho thấy vai trò có lợi của kích hoạt đông máu trong nhiễm trùng huyết, bằng chứng mới ủng hộ cho giả thiết cổ điển rằng kích hoạt đông máu có thể góp phần gây tổn thương mô trong nhiễm trùng huyết cũng đã được công bố. Các nghiên cứu hình ảnh vi mạch in vivo đã chứng minh rối loạn tưới máu mô ở bệnh nhân nhiễm trùng huyết có thể được đảo ngược bằng cách sử dụng protein C hoạt hóa [77,78]. Ngoài ra, các kết quả âm tính của các thử nghiệm lâm sàng ngẫu nhiên về các thuốc chống đông máu trong nhiễm trùng huyết đã bị phản đối bởi các đánh giá hệ thống và thử nghiệm lâm sàng gần đây [79,80], cho thấy tác dụng có lợi của chiến lược điều trị này trên các nhóm bệnh nhân nhiễm trùng huyết. Nếu được xác nhận (trong các thử nghiệm lâm sàng đang diễn ra và trong phân tích tổng hợp lớn hơn [33]), những kết quả này chỉ ra sự tồn tại của ngưỡng mà kích hoạt đông máu trở nên bất lợi trong nhiễm trùng huyết.
Tóm lược
Nguyên nhân sau cùng của kích hoạt đông máu trong nhiễm trùng huyết và gợi ý cho các nghiên cứu tương lai Những dữ liệu này cùng cho thấy kích hoạt đông máu là một thành phần quan trọng trong phản ứng tổng thể giúp chống lại mầm bệnh, và việc loại bỏ mầm bệnh có thể được xem là nguyên nhân sau cùng của kích hoạt đông máu trong quá trình nhiễm trùng và nhiễm trùng huyết. Từ quan điểm này, ta có thể hiểu tại sao một số thành phần đông máu riêng lẻ được điều chỉnh theo hướng tăng tạo thrombin, dựa trên tầm quan trọng của fibrin và tiểu cầu trong phản ứng của vật chủ với nhiễm trùng. Phân tích về kích hoạt đông máu trong nhiễm trùng huyết từ quan điểm y học tiến hóa này cũng có thể góp phần giải thích tại sao việc sử dụng thuốc chống đông máu hệ thống không có lợi trong các thử nghiệm có quy mô lớn về nhiễm trùng huyết, nhấn mạnh tầm quan trọng của việc xác định thời điểm chính xác mà việc kích hoạt đông máu chuyển từ có lợi thành có hại trong nhiễm trùng huyết (Hình 1). Trong bối cảnh này, bất kỳ phương pháp điều trị nào làm hạn chế sự kích hoạt đông máu cũng nên được chỉnh chuốt, mục đích là để duy trì cơ chế hình thành chức năng bảo vệ của vật chủ dường như đã tồn tại trong ít nhất 450 triệu năm qua.
Competing interests
The authors declare that they have no competing interests.
Authors Contributions
MMLF, MAC, JMA, and EVDP discussed all aspects of this review. EVDP drafted the manuscript. All authors reviewed and approved the final version of the manuscript.
Acknowledgments
This study was financially supported by Fapesp and CNPq, Brazil. The Hematology and Hemotherapy Center, Hemocentro UNICAMP, forms part of the National Institute of Science and Technology of Blood, Brazil (INCT do Sangue CNPq/MCT/ FAPESP).
Received: 5 November 2014 Accepted: 16 March 2015
Tài liệu tham khảo
- Vincent J-L, Opal SM, Marshall JC, Tracey KJ. Sepsis definitions: time for change. Lancet. 2013;381:774–5.
- Gaieski DF, Edwards JM, Kallan MJ, Carr BG. Benchmarking the incidence and mortality of severe sepsis in the United States. Crit Care Med. 2013;41:1167–74.
- Angus DC, van der Poll T. Severe sepsis and septic shock. N Engl J Med. 2013;369:840–51.
- Wiersinga WJ, Leopold SJ, Cranendonk DR, van der Poll T. Host innate immune responses to sepsis. Virulence. 2014;5:36–44.
- Salomao R, Brunialti MKC, Rapozo MM, Baggio-Zappia GL, Galanos C, Freudenberg M. Bacterial sensing, cell signaling, and modulation of the immune response during sepsis. Shock. 2012;38:227–42.
- Chen GY, Nuñez G. Sterile inflammation: sensing and reacting to damage. Nat Rev Immunol. 2010;10:826–37.
- Hansen JD, Vojtech LN, Laing KJ. Sensing disease and danger: a survey of vertebrate PRRs and their origins. Dev Comp Immunol. 2011;35:886–97.
- Barreiro LB, Quintana-Murci L. From evolutionary genetics to human immunology: how selection shapes host defence genes. Nat Rev Genet. 2010;11:17–30.
- Quach H, Wilson D, Laval G, Patin E, Manry J, Guibert J, et al. Different selective pressures shape the evolution of Toll-like receptors in human and African great ape populations. Hum Mol Genet. 2013;22:4829–40.
- Laayouni H, Oosting M, Luisi P, Ioana M, Alonso S, Ricaño-Ponce I, et al. Convergent evolution in European and Rroma populations reveals pressure exerted by plague on Toll-like receptors. Proc Natl Acad Sci U S A. 2014;111:2668–73.
- Pino-Yanes M, Corrales A, Casula M, Blanco J, Muriel A, Espinosa E, et al. Common variants of TLR1 associate with organ dysfunction and sustained pro-inflammatory responses during sepsis. PLoS One. 2010;5:e13759.
- Seeley EJ, Matthay MA, Wolters PJ. Inflection points in sepsis biology: from local defense to systemic organ injury. Am J Physiol Lung Cell Mol Physiol. 2012;303:L355–63.
- Areal H, Abrantes J, Esteves PJ. Signatures of positive selection in Toll-like receptor (TLR) genes in mammals. BMC Evol Biol. 2011;11:368.
- Davidson CJ, Tuddenham EG, McVey JH. 450 million years of hemostasis. J Thromb Haemost. 2003;1:1487–94.
- Loof TG, Mörgelin M, Johansson L, Oehmcke S, Olin AI, Dickneite G, et al. Coagulation, an ancestral serine protease cascade, exerts a novel function in early immune defense. Blood. 2011;118:2589–98.
- Monahan-Earley R, Dvorak AM, Aird WC. Evolutionary origins of the blood vascular system and endothelium. J Thromb Haemost. 2013;11:46–66.
- Aird WC. Endothelial cell heterogeneity. Cold Spring Harb Perspect Med. 2012;2:a006429.
- Rosenberg RD, Aird WC. Vascular-bed–specific hemostasis and hypercoagulable states. N Engl J Med. 1999;340:1555–64.
- Opal SM, Esmon CT. Bench-to-bedside review: functional relationships between coagulation and the innate immune response and their respective roles in the pathogenesis of sepsis. Crit Care. 2003;7:23–38.
- Opal SM. Phylogenetic and functional relationships between coagulation and the innate immune response. Crit Care Med. 2000;28:S77–80.
- Diamond JM. Guns, germs, and steel: the fates of human societies. New York, NY, USA: W. W. Norton and Company; 1999. p. 496.
- Antón SC, Potts R, Aiello LC. Human evolution. Evolution of early Homo: an integrated biological perspective. Science. 2014;345:1236828.
- Terio KA, Kinsel MJ, Raphael J, Mlengeya T, Lipende I, Kirchhoff CA, et al. Pathologic lesions in chimpanzees (Pan trogylodytes schweinfurthii) from Gombe National Park, Tanzania, 2004–2010. J Zoo Wildl Med. 2011;42:597–607.
- Semple S, Cowlishaw G, Bennett PM. Immune system evolution among anthropoid primates: parasites, injuries and predators. Proc Biol Sci. 2002;269:1031–7.
- Alcock J, Brainard AH. Hemostatic containment – an evolutionary hypothesis of injury by innate immune cells. Med Hypotheses. 2008;71:960–8.
- Lee PY, Yun AJ, Bazar KA. Acute coronary syndromes and heart failure may reflect maladaptations of trauma physiology that was shaped during pre-modern evolution. Med Hypotheses. 2004;62:861–7.
- Van Mens TE, Levi M, Middeldorp S. Evolution of Factor V Leiden. Thromb Haemost. 2013;110:23–30.
- Cagliani R, Forni D, Riva S, Pozzoli U, Colleoni M, Bresolin N, et al. Evolutionary analysis of the contact system indicates that kininogen evolved adaptively in mammals and in human populations. Mol Biol Evol. 2013;30:1397–408.
- Opal SM, Dellinger RP, Vincent J-L, Masur H, Angus DC. The next generation of sepsis clinical trial designs: what is next after the demise of recombinant human activated protein C? Crit Care Med. 2014;42:1714–21.
- Levi M, Keller TT, van Gorp E, ten Cate H. Infection and inflammation and the coagulation system. Cardiovasc Res. 2003;60:26–39.
- Pawlinski R, Pedersen B, Schabbauer G, Tencati M, Holscher T, Boisvert W, et al. Role of tissue factor and protease-activated receptors in a mouse model of endotoxemia. Blood. 2004;103:1342–7.
- Xu H, Ploplis VA, Castellino FJ. A coagulation factor VII deficiency protects against acute inflammatory responses in mice. J Pathol. 2006;210:488–96.
- Jiang L, Jiang S, Feng X, Ma Y, Zhang M. The efficacy and safety of different anticoagulants on patients with severe sepsis and derangement of coagulation: a protocol for network meta-analysis of randomised controlled trials. BMJ Open. 2014;4:e006770.
- Seok J, Warren HS, Cuenca AG, Mindrinos MN, Baker HV, Xu W, et al. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 2013;110:3507–12.
- Shimamura K, Oka K, Nakazawa M, Kojima M. Distribution patterns of microthrombi in disseminated intravascular coagulation. Arch Pathol Lab Med. 1983;107:543–7.
- Kojima M, Shimamura K, Mori N, Oka K, Nakazawa M. A histological study on microthrombi in autopsy cases of DIC. Bibl Haematol. 1983;49:95–106.
- Tajiri T, Tate G, Masunaga A, Miura K, Masuda S, Kunimura T, et al. Autopsy cases of fulminant bacterial infection in adults: clinical onset depends on the virulence of bacteria and patient immune status. J Infect Chemother. 2012;18:637–45.
- Tajiri T, Tate G, Enosawa T, Akita H, Ohike N, Masunaga A, et al. Clinicopathological findings in fulminant-type pneumococcal infection: report of three autopsy cases. Pathol Int. 2007;57:606–12.
- Donzé JD, Ridker PM, Finlayson SRG, Bates DW. Impact of sepsis on risk of postoperative arterial and venous thromboses: large prospective cohort study. BMJ. 2014;349:g5334.
- Ribeiro DD, Lijfering WM, Van Hylckama VA, Rosendaal FR, Cannegieter SC. Pneumonia and risk of venous thrombosis: results from the MEGA study. J Thromb Haemost. 2012;10:1179–82.
- Picoli-Quaino SK, Alves BE, Faiotto VB, Montalvao SAL, De Souza CA, Annichino-Bizzacchi JM, et al. Impairment of thrombin generation in the early phases of the host response of sepsis. J Crit Care. 2014;29:31–6.
- Massion PB, Peters P, Ledoux D, Zimermann V, Canivet J-L, Massion PP, et al. Persistent hypocoagulability in patients with septic shock predicts greater hospital mortality: impact of impaired thrombin generation. Intensive Care Med. 2012;38:1326–35.
- Brüne M, Hochberg Z. Evolutionary medicine – the quest for a better understanding of health, disease and prevention. BMC Med. 2013;11:116.
- Van der Poll T, Herwald H. The coagulation system and its function in early immune defense. Thromb Haemost. 2014;112:640–8.
- Engelmann B, Massberg S. Thrombosis as an intravascular effector of innate immunity. Nat Rev Immunol. 2013;13:34–45.
- Ruf W. Protease-activated receptor signaling in the regulation of inflammation. Crit Care Med. 2004;32:S287–92.
- Coughlin SR. Protease-activated receptors in hemostasis, thrombosis and vascular biology. J Thromb Haemost. 2005;3:1800–14.
- Mackman N. The many faces of tissue factor. J Thromb Haemost. 2009;7:136–9.
- Nickel KF, Renné T. Crosstalk of the plasma contact system with bacteria. Thromb Res. 2012;130 Suppl :S78–83.
- Mullarky IK, Szaba FM, Berggren KN, Parent MA, Kummer LW, Chen W, et al. Infection-stimulated fibrin deposition controls hemorrhage and limits hepatic bacterial growth during listeriosis. Infect Immun. 2005;73:3888–95.
- Luo D, Szaba FM, Kummer LW, Plow EF, Mackman N, Gailani D, et al. Protective roles for fibrin, tissue factor, plasminogen activator inhibitor-1, and thrombin activatable fibrinolysis inhibitor, but not factor XI, during defense against the gram-negative bacterium Yersinia enterocolitica. J Immunol. 2011;187:1866–76.
- Sun H, Wang X, Degen JL, Ginsburg D. Reduced thrombin generation increases host susceptibility to group A streptococcal infection. Blood. 2009;113:1358–64.
- Loof TG, Schmidt O, Herwald H, Theopold U. Coagulation systems of invertebrates and vertebrates and their roles in innate immunity: the same side of two coins? J Innate Immun. 2011;3:34–40.
- Van Deventer SJ, Büller HR, ten Cate JW, Aarden LA, Hack CE, Sturk A. Experimental endotoxemia in humans: analysis of cytokine release and coagulation, fibrinolytic, and complement pathways. Blood. 1990;76:2520–6.
- Biemond BJ, Levi M, Ten Cate H, Van der Poll T, Büller HR, Hack CE, et al. Plasminogen activator and plasminogen activator inhibitor I release during experimental endotoxaemia in chimpanzees: effect of interventions in the cytokine and coagulation cascades. Clin Sci (Lond). 1995;88:587–94.
- Kager LM, Wiersinga WJ, Roelofs JJTH, Meijers JCM, Levi M, Van’t Veer C, et al. Endogenous tissue-type plasminogen activator impairs host defense during severe experimental Gram-negative sepsis (melioidosis)*. Crit Care Med. 2012;40:2168–75.
- Kager LM, Wiersinga WJ, Roelofs JJTH, Meijers JCM, Levi M, Van’t Veer C, et al. Plasminogen activator inhibitor type I contributes to protective immunity during experimental Gram-negative sepsis (melioidosis). J Thromb Haemost. 2011;9:2020–8.
- Lim JH, Woo C-H, Li J-D. Critical role of type 1 plasminogen activator inhibitor (PAI-1) in early host defense against nontypeable Haemophilus influenzae (NTHi) infection. Biochem Biophys Res Commun. 2011;414:67–72.
- Kager LM, Weehuizen TA, Wiersinga WJ, Roelofs JJTH, Meijers JCM, Dondorp AM, et al. Endogenousα2-antiplasmin is protective during severe gram-negative sepsis (melioidosis). Am J Respir Crit Care Med. 2013;188:967–75.
- Bergmann S, Hammerschmidt S. Fibrinolysis and host response in bacterial infections. Thromb Haemost. 2007;98:512–20.
- Loof TG, Deicke C, Medina E. The role of coagulation/fibrinolysis during Streptococcus pyogenes infection. Front Cell Infect Microbiol. 2014;4:128.
- Lathem WW, Price PA, Miller VL, Goldman WE. A plasminogen-activating protease specifically controls the development of primary pneumonic plague. Science. 2007;315:509–13.
- Sodeinde OA, Subrahmanyam YV, Stark K, Quan T, Bao Y, Goguen JD. A surface protease and the invasive character of plague. Science. 1992;258:1004–7.
- Enz Hubert RM, Rodrigues MV, Andreguetto BD, Santos TM, de Fátima Pereira Gilberti M, de Castro V, et al. Association of the immature platelet fraction with sepsis diagnosis and severity. Sci Rep. 2015;5:8019.
- Wong CHY, Jenne CN, Petri B, Chrobok NL, Kubes P. Nucleation of platelets with blood-borne pathogens on Kupffer cells precedes other innate immunity and contributes to bacterial clearance. Nat Immunol. 2013;14:785–92.
- De Stoppelaar SF, van’t Veer C, Claushuis TAM, Albersen BJA, Roelofs JJTH, van der Poll T. Thrombocytopenia impairs host defense in gram-negative pneumonia derived sepsis. Blood. 2014;124:3781–90.
- Martinod K, Wagner DD. Thrombosis: tangled up in NETs. Blood. 2013;123:2768–76.
- Yipp BG, Kubes P. NETosis: how vital is it? Blood. 2013;122:2784–94.
- Clark SR, Ma AC, Tavener SA, McDonald B, Goodarzi Z, Kelly MM, et al. Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. Nat Med. 2007;13:463–9.
- Luo D, Szaba FM, Kummer LW, Johnson LL, Tucker EI, Gruber A, et al. Factor XI-deficient mice display reduced inflammation, coagulopathy, and bacterial growth during listeriosis. Infect Immun. 2012;80:91–9.
- Tucker EI, Gailani D, Hurst S, Cheng Q, Hanson SR, Gruber A. Survival advantage of coagulation factor XI-deficient mice during peritoneal sepsis. J Infect Dis. 2008;198:271–4.
- Flick MJ, Du X, Prasad JM, Raghu H, Palumbo JS, Smeds E. Genetic elimination of the binding motif on fibrinogen for the S. aureus virulence factor ClfA improves host survival in septicemia. Blood. 2013;121:1783–94.
- Abraham E, Reinhart K, Opal S, Demeyer I, Doig C, Rodriguez AL, et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA. 2003;290:238–47.
- Warren BL, Eid A, Singer P, Pillay SS, Carl P, Novak I, et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA. 2001;286:1869–78.
- Ranieri VM, Thompson BT, Barie PS, Dhainaut J-F, Douglas IS, Finfer S, et al. Drotrecogin alfa (activated) in adults with septic shock. N Engl J Med. 2012;366:2055–64.
- Kerlin BA, Yan SB, Isermann BH, Brandt JT, Sood R, Basson BR, et al. Survival advantage associated with heterozygous factor V Leiden mutation in patients with severe sepsis and in mouse endotoxemia. Blood. 2003;102:3085–92.
- De Backer D, Verdant C, Chierego M, Koch M, Gullo A, Vincent J-L. Effects of drotrecogin alfa activated on microcirculatory alterations in patients with severe sepsis. Crit Care Med. 2006;34:1918–24.
- Donati A, Damiani E, Botticelli L, Adrario E, Lombrano MR, Domizi R, et al. The aPC treatment improves microcirculation in severe sepsis/septic shock syndrome. BMC Anesthesiol. 2013;13:25.
- Kalil AC, LaRosa SP. Effectiveness and safety of drotrecogin alfa (activated) for severe sepsis: a meta-analysis and metaregression. Lancet Infect Dis. 2012;12:678–86.
- Iba T, Saitoh D, Wada H, Asakura H. Efficacy and bleeding risk of antithrombin supplementation in septic disseminated intravascular coagulation: a secondary survey. Crit Care. 2014;18:497.
- Schouten M, de Boer JD, Kager LM, Roelofs JJTH, Meijers JCM, Esmon CT, et al. The endothelial protein C receptor impairs the antibacterial response in murine pneumococcal pneumonia and sepsis. Thromb Haemost. 2014;111:970–80.
- Kager LM, Schouten M, Wiersinga WJ, de Boer JD, Lattenist LCW, Roelofs JJTH, et al. Overexpression of the endothelial protein C receptor is detrimental during pneumonia-derived gram-negative sepsis (Melioidosis). PLoS Negl Trop Dis. 2013;7:e2306.
- Zheng X, Li W, Song Y, Hu Y, Ferrell GL, Esmon NL, et al. Non-hematopoietic EPCR regulates the coagulation and inflammatory responses during endotoxemia. J Thromb Haemost. 2007;5:1394–400.
- Renckens R, Roelofs JJTH, Florquin S, de Vos AF, Pater JM, Lijnen HR, et al. Endogenous tissue-type plasminogen activator is protective during Escherichia coli-induced abdominal sepsis in mice. J Immunol. 2006;177:1189–96.
- Vancine SMC, Picoli-Quaino SK, Costa DSP, Montalvao SAL, Ozelo MC, Annichino-Bizzacchi JM, et al. Evaluation of the host response to endotoxemia of FVIII and FIX deficient mice. Haemophilia. 2011;17:800–7.
- Schoenmakers SHHF, Brüggemann LW, Groot AP, Maijs S, Reitsma PH, Spek CA. Role of coagulation FVIII in septic peritonitis assessed in hemophilic mice. J Thromb Haemost. 2005;3:2738–44.
- Renckens R, Roelofs JJTH, Bonta PI, Florquin S, de Vries CJM, Levi M, et al. Plasminogen activator inhibitor type 1 is protective during severe Gram-negative pneumonia. Blood. 2007;109:1593–601.
- Schoenmakers SHHF, Versteeg HH, Groot AP, Reitsma PH, Spek CA. Tissue factor haploinsufficiency during endotoxin induced coagulation and inflammation in mice. J Thromb Haemost. 2004;2:2185–93.
- Levi M, Dörffler-Melly J, Reitsma P, Buller H, Florquin S, van der Poll T, et al. Aggravation of endotoxin-induced disseminated intravascular coagulation and cytokine activation in heterozygous protein-C-deficient mice. Blood. 2003;101:4823–7.
- Renckens R, Roelofs JJTH, ter Horst SAJ, van’t Veer C, Havik SR, Florquin S, et al. Absence of thrombin-activatable fibrinolysis inhibitor protects against sepsis-induced liver injury in mice. J Immunol. 2005;175:6764–71.
- Brüggemann LW, Schoenmakers SHHF, Groot AP, Reitsma PH, Spek CA. Role of the factor V Leiden mutation in septic peritonitis assessed in factor V Leiden transgenic mice. Crit Care Med. 2006;34:2201–6.
Xem thêm: