Bệnh hô hấp
Mười quy tắc vàng cho thông khí cơ học cá nhân hóa trong hội chứng nguy kịch hô hấp cấp tính
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Bài viết Mười quy tắc vàng cho thông khí cơ học cá nhân hóa trong hội chứng nguy kịch hô hấp cấp tính – tải file PDF Tại đây.
Denise BattagliniMarco Sottano, Lorenzo Ball, chiara Robba, Patricia R.M. Rocco, Paolo Pelosi.
Bản dịch của BS. Đặng Thanh Tuấn – BV Nhi Đồng 1
Tóm tắt
Những tiến bộ đáng kể đã được thực hiện trong những thập kỷ qua trong việc kiểm soát hội chứng suy hô hấp cấp tính (acute respiratory distress syndrome, ARDS). Thông khí cơ học (mechanical ventilation, MV) vẫn là nền tảng của liệu pháp hỗ trợ cho ARDS. MV bảo vệ phổi giảm thiểu nguy cơ tổn thương phổi do máy thở (ventilator-induced lung injury, VILI) và cải thiện khả năng sống sót. Một số thông số góp phần gây ra nguy cơ VILI và yêu cầu cài đặt cẩn thận bao gồm thể tích khí lưu thông (Vt), áp lực cao nguyên (Pplat), áp lực đẩy (AP), áp lực dương cuối thì thở ra (PEEP) và nhịp thở. Đo năng lượng và công suất cơ học cho phép định lượng sự đóng góp tương đối của các thông số khác nhau (Vt, Pplat, AP, PEEP, nhịp thở và lưu lượng khí) để cá nhân hóa cài đặt MV. Việc sử dụng các thuốc ức chế thần kinh cơ chủ yếu trong các trường hợp ARDS nặng có thể cải thiện quá trình oxygen hóa và giảm sự mất đồng bộ, mặc dù chúng không được biết là mang lại lợi ích sống còn. Các liệu pháp cấp cứu hô hấp như tư thế nằm sấp, oxit nitric dạng hít và các kỹ thuật hỗ trợ ngoài cơ thể có thể được áp dụng trong các tình huống cụ thể. Hơn nữa, các quy trình cai máy hô hấp cũng cần được xem xét. Dựa trên việc xem xét các thử nghiệm lâm sàng gần đây, chúng tôi trình bày 10 quy tắc vàng cho MV cá nhân hóa trong quản lý ARDS.
Giới thiệu
Hội chứng nguy kịch hô hấp cấp tính (ARDS) được mô tả lần đầu tiên cách đây hơn 50 năm [1]. Mặc dù đã có nghiên cứu đáng kể về các liệu pháp hỗ trợ/nhân quả hiệu quả kể từ đó, ARDS vẫn khó điều trị, với 33,2 trường hợp tử vong trong mỗi 100.000 trường hợp liên quan đến ARDS ở Hoa Kỳ và từ 2,6 đến 7,2 trong mỗi 100.000 người ở Châu Âu, với tỷ lệ giảm hàng năm [2].
Người ta ước tính có hơn 3 triệu người/năm bị ảnh hưởng bởi ARDS [3], chiếm tới 10% số ca nhập viện vào đơn vị chăm sóc đặc biệt (intensive care unit, ICU) mỗi năm trên toàn cầu và cần phải thở máy (MV) bản thân nó có thể làm hỏng phổi ARDS vốn đã bị tổn thương [4]. Chấn thương phổi do máy thở (VILI) là hậu quả chính của MV gây thương tích [5]. Nỗ lực lớn đã được thực hiện để xác định các chiến lược thông khí khả thi nhằm giảm thiểu nguy cơ VILI ở những bệnh nhân nặng mắc ARDS [6]. Một số thử nghiệm ngẫu nhiên có đối chứng (RCT) và nghiên cứu quan sát đã nghiên cứu vai trò của MV bảo vệ phổi đối với kết quả ARDS, do đó cách mạng hóa việc quản lý thông khí thông thường [7], [8], [9], [10], [11]. Hơn nữa, loại bỏ carbon dioxide ngoại cơ thể (ECCO2R) [12], oxygen hóa màng ngoại bào (ECMO) [13], thuốc giãn mạch dạng hít [14], thuốc ức chế thần kinh cơ (NMBA) [15] và tư thế nằm sấp [16], [17] đã được thảo luận bởi các nhóm đa ngành trong các hướng dẫn gần đây như là chiến lược cấp cứu tiềm năng cho các trường hợp nặng hơn [18], [19].
Mục đích của đánh giá này là cung cấp cho các bác sĩ y tế danh sách cập nhật các quy tắc vàng để chẩn đoán, phân loại và điều trị ARDS theo những phát hiện mới trong lĩnh vực nghiên cứu này.
Quy tắc 1. Phân loại mức độ nghiêm trọng
ARDS là một hội chứng chứ không phải là bệnh [20], được đặc trưng bởi tổn thương viêm phổi dẫn đến cứng và đông đặc nhu mô, đóng phế nang, thay đổi tính thấm của mạch máu, tăng hàm lượng nước trong phổi và cuối cùng là suy trao đổi khí nghiêm trọng khi khởi phát cấp tính của tình trạng thiếu oxy máu. Định nghĩa mới nhất về ARDS là định nghĩa Berlin, được đề xuất vào năm 2012 bởi một nhóm chuyên gia đồng thuận [21], trong đó nêu 4 tiêu chí sau phải được đáp ứng đồng thời để chẩn đoán ARDS: (1) mức độ thiếu oxy nhất định, được đánh giá bằng cách đo tỷ lệ áp lực riêng phần của oxy (PaO2)/nồng độ oxy hít vào (FiO2); (2) khởi phát tình trạng thiếu oxy cấp tính, với các triệu chứng hô hấp bắt đầu trong vòng 1 tuần kể từ khi có biểu hiện lâm sàng; (3) sự hiện diện của các đám mờ hai bên trên hình ảnh ngực mà không được giải thích đầy đủ bằng tràn dịch màng phổi, xẹp phế nang/thùy hoặc các nốt; và (4) không có suy tim và/hoặc quá tải dịch. Định nghĩa Berlin cũng phân loại mức độ nghiêm trọng của ARDS dựa trên tỷ lệ PaO2/FiO2 với áp lực dương cuối thì thở ra (PEEP) hoặc áp lực đường thở dương liên tục >5 cmH2O: ARDS nhẹ (tỷ lệ PaO2/FiO2 trong khoảng từ 200 đến 300), với tỷ lệ tử vong dự đoán là 27%; ARDS vừa phải (tỷ lệ PaO2/FiO2 trong khoảng từ 100 đến 200), với tỷ lệ tử vong dự đoán là 32%; và ARDS nặng (tỷ lệ PaO2/FiO2 <100), với tỷ lệ tử vong được dự đoán là 45% [21]. Năm 2013, Villar và cộng sự [22] đã sửa đổi định nghĩa về mức độ nghiêm trọng của ARDS với mục đích đánh giá nguy cơ tử vong tại ICU theo tỷ lệ PaO2/FiO2; các tác giả đã kiểm tra 2 mức PEEP và FiO2 (PEEP >5 và >10 cmH2O và FiO2 >0,5 và 1,0) vào 24 giờ sau khi chẩn đoán ARDS và kết luận rằng phân tầng nguy cơ ARDS đạt được tốt nhất với PEEP >10 cmH2O và FiO2 >0,5, với tỷ lệ tử vong lần lượt là 17%, 41% và 58% ở các nhóm ARDS nhẹ, trung bình và nặng. Giống như phân tầng rủi ro ARDS, kiểu hình ARDS vẫn chưa được xác định rõ ràng. Calfee và cộng sự [23] đã kết hợp 2 kiểu hình vào định nghĩa về ARDS. Kiểu hình 1 được đặc trưng bởi tình trạng viêm và sốc ít nghiêm trọng hơn. Kiểu hình 2 được đặc trưng bởi nồng độ dấu ấn sinh học gây viêm trong huyết tương cao hơn, nồng độ bicarbonate huyết thanh thấp hơn, sử dụng thuốc vận mạch thường xuyên hơn và tỷ lệ nhiễm trùng huyết cao hơn; nó cũng liên quan đến tỷ lệ tử vong cao hơn, số ngày không thở máy ít hơn và các phản ứng khác nhau (ví dụ: tỷ lệ tử vong và số ngày không thở máy) đối với PEEP cao so với PEEP thấp, tương tự như kiểu hình của bệnh vi-rút Corona 2019(Covid-19)) [24]. Do đó, định nghĩa Berlin và phân loại mức độ nghiêm trọng của ARDS cũng như độ chính xác tiên lượng vẫn còn gây tranh cãi.
Quy tắc 2. Thể tích khí lưu thông (Vt), áp lực cao nguyên (Pplat) và áp lực đẩy (Áp)
Quy ước trước đây cho MV trong ARDS là thể tích khí lưu thông (Vt) là 10-15 ml/kg trọng lượng cơ thể dự đoán (PBW) [8]. Trong những thập kỷ qua, người ta đã biết nhiều điều về di chứng bất lợi của MV như phổi căng quá mức (ví dụ, trong trường hợp Vt cao) với chấn thương thể tích tiếp theo, cùng với xẹp phổi và chấn thương sinh học tạo thành cơ sở cho VILI [25], [26]. Một RCT đa trung tâm được thực hiện vào năm 2000 đã thay đổi cách quản lý lâm sàng ARDS. Thử nghiệm đã bị ngưng sau khi thu nhận 861 bệnh nhân vì tỷ lệ tử vong cao hơn và số ngày không thở máy ít hơn ở những bệnh nhân được điều trị bằng Vt thông thường (12 ml/kg PBW và Pplat là 50 cmH2O) so với những người được điều trị với Vt thấp hơn (6 ml/kg PBW và Pplat 30 cmH2Ơ) [8]. Nghiên cứu ARDSNet đã cố gắng duy trì áp lực riêng phần của carbon dioxide (PaCƠ2) càng gần với phạm vi bình thường càng tốt, dẫn đến nhịp thở cao hơn (25-30 nhịp thở/phút), thường được yêu cầu để duy trì PaCO2 dưới 50 mmHg nhưng có thể dẫn đến siêu bơm phồng động. Mặc dù tăng CO2 có thể gây ra sự giải phóng catecholamine và tăng sức cản mạch máu phổi, nhưng nó cũng ngăn chặn tình trạng viêm và sản xuất các gốc tự do [27]. Các hướng dẫn hiện tại đề xuất sử dụng máy tạo độ ẩm có sưởi để kiểm soát chứng tăng CO2 máu; tuy nhiên, Vt có thể tăng hơn 6 ml/kg (PBW) trong trường hợp tăng CO2 rõ rệt và dai dẳng với tần số hô hấp đã tăng và giảm khoảng chết [19]. Một nghiên cứu gần đây so sánh Vt < 6,5 ml/kg và >6,5 ml/kg cho thấy rằng tăng 1 ml/kg PBW có liên quan đến việc tăng nguy cơ tử vong (tỷ lệ rủi ro = 1,23, khoảng tin cậy 95% [CI]: 1,06 -1,44, P = 0,008) [28]. Ngược lại, trong nghiên cứu LUNG SAFE, Vt > 7,1 ml/kg không liên quan đến tăng tỷ lệ tử vong nhưng Pplat, PEEP và AP được chứng minh là ảnh hưởng đáng kể đến các kết quả đo lường [29]. Do đó, Pplat là một thông số quan trọng trong cơ chế bệnh sinh của VILI cùng với Vt và PEEP, tất cả đều được đưa vào tính toán độ giãn nở tĩnh [30]. Vt thấp hơn có liên quan đến khả năng sống sót tốt hơn nhưng chỉ khi Pplat <27 cmH2O [31]; mặt khác, Vt cao có liên quan đến tăng oxygen hóa và cải thiện độ giãn nở nhưng cũng có tỷ lệ tử vong cao hơn [31], [32]. Một nghiên cứu gần đây báo cáo rằng Pplat là yếu tố quyết định quan trọng hơn đến tỷ lệ tử vong và kết quả so với AP [33]. AP được định nghĩa là VT/Crs (độ giãn nở của hệ hô hấp). Trong công thức này, Vt được chuẩn hóa thành Crs của hệ hô hấp bị tổn thương và có thể là yếu tố dự báo khả năng sống sót tốt hơn so với Vt được chia tỷ lệ theo thể tích phổi bình thường bằng cách sử dụng PBW, được xác định theo chiều cao và giới tính [34]. Nói cách khác, AP đại diện cho áp lực căng trong hệ hô hấp khi Vt được máy thở cung cấp. Vt, PEEP và Pplat có thể đóng góp vào VILI nhưng cũng có thể tương tác một cách phức tạp; do đó, mối quan hệ giữa bất kỳ thông số đơn lẻ nào và tỷ lệ tử vong là không rõ ràng [35]. Vì Crs liên quan trực tiếp đến thể tích phổi thông khí bình thường, nên AP là thông số tốt nhất để dự đoán tỷ lệ tử vong ở bệnh nhân ARDS [36]. Một phân tích hậu kiểm của các thử nghiệm đã công bố đã chứng minh rằng AP có mối tương quan cao với tỷ lệ tử vong [34]. PEEP và Vt chỉ có thể có tác dụng bảo vệ khi giảm AP. Một nghiên cứu khác đề xuất nhắm mục tiêu AP xuống dưới 13-15 cmH2O [37]. Việc có nên đặt PEEP để giảm thiểu giá trị của AP hay không vẫn đang được tranh luận; điều này đã làm tăng tỷ lệ tử vong trong một thử nghiệm gần đây [38]. Do đó, việc thiết lập các thông số dựa trên việc giảm AP không được khuyến khích và Pplat vẫn là thông số quan trọng nhất để bảo vệ chống lại tổn thương phổi [33]. Cuối cùng, không nên sử dụng AP tốt nhất để tối ưu hóa MV trong ARDS.
Quy tắc 3. PEEP
PEEP là một khía cạnh thiết yếu của quản lý ARDS [21]. Lợi ích của việc sử dụng PEEP bao gồm huy động phế nang, giảm shunt trong phổi và oxygen hóa động mạch [39]; mặt khác, các tác động bất lợi bao gồm tăng thể tích phổi cuối thì hít vào và tăng nguy cơ chấn thương thể tích và VILI [40]. Các hướng dẫn hiện tại khuyến nghị nên dành PEEP cao cho bệnh nhân ARDS vừa hoặc nặng và tránh sử dụng PEEP trong những trường hợp nhẹ [41]. Trong phân tích thứ cấp của Nghiên cứu thông khí phổi mở (Lung Open Ventilation), những bệnh nhân mắc ARDS cho thấy tình trạng oxygen hóa được cải thiện với PEEP cao có nguy cơ tử vong thấp hơn (tỷ lệ chênh lệch = 0,8; CI 95%: 0,72- 0,89), trong khi những thay đổi về độ giãn nở và khoảng chết là không liên quan đến tỷ lệ tử vong [42]. Ngưỡng xác định PEEP cao và thấp là 12 cmH2O [19]. Một phân tích tổng hợp gần đây so sánh Vt thấp kết hợp với PEEP cao hoặc thấp cho thấy PEEP cao cải thiện tỷ lệ sống sót (nguy cơ tương đối [RR] = 0,58; CI 95%: 0,41-0,82; P = 0,05) [43]. Ba RCT lớn so sánh mức PEEP cao và trung bình ở bệnh nhân ARDS được thở máy với Vt thấp (6 ml/kg PBW) không tìm thấy bất kỳ sự khác biệt nào về tỷ lệ tử vong [44], [45], [46]. PEEP cao có liên quan đến tỷ lệ tử vong thấp hơn ở những bệnh nhân mắc ARDS vừa và nặng và tỷ lệ tử vong cao hơn ở những bệnh nhân mắc ARDS nhẹ [47]. Mức PEEP cao có liên quan đến stress tĩnh tăng lên, nhưng cần thiết để tránh việc đóng và mở lặp lại các đơn vị phế nang [48]. Thử nghiệm ART đã chứng minh rằng giá trị PEEP >15 cmH2Ơ có liên quan đến tăng tỷ lệ tử vong, đặc biệt ở những bệnh nhân suy giảm huyết động và viêm phổi [38]. Do đó, chúng tôi khuyên bạn không nên sử dụng mức PEEP trung bình >15 cmH2Ơ vì điều này có thể ảnh hưởng đến chức năng huyết động và tăng nhu cầu dịch.
Không có khuyến nghị dứt khoát về cách đặt PEEP. Ở những bệnh nhân mắc ARDS vừa hoặc nặng, cài đặt PEEP theo áp lực xuyên phổi (Pl) hoặc PEEP/FiO2 không ảnh hưởng đến tỷ lệ tử vong [38]. Cách tốt nhất để cá nhân hóa PEEP là sử dụng bảng PEEP/PaO2/FiO2 thấp [49], vì những bệnh nhân cần nhiều PEEP hơn thì phổi có thể huy động được nhiều hơn và ngược lại. Mặt khác, việc sử dụng AP hoặc chỉ số căng thẳng tốt nhất, cũng như PL ở cuối thì thở ra có liên quan đến PEEP cao hơn ở những phổi ít có thể huy động được hơn và PEEP thấp hơn ở những phổi có thể huy động được nhiều hơn. PEEP nên được cá nhân hóa, nhưng không sử dụng AP và độ giãn nở làm phương pháp chuẩn độ, do độ giãn nở giảm theo thể tích và huy động phổi (và bị ảnh hưởng bởi Vt); nghĩa là, độ giãn nở càng cao thì AP càng thấp. PEEP cao hơn làm tăng huy động trong khí lưu thông, từ đó làm tăng độ giãn nở (mặc dù điều này là không mong muốn). Những thay đổi về AP từ áp lực đường thở có thể được giải thích một phần bằng những thay đổi về độ giãn nở của thành ngực ở bệnh nhân có áp lực ổ bụng cao. Cần tôn trọng các ngưỡng sau để giảm thiểu nguy cơ mắc VILI: Pplat nên được duy trì ở mức thấp nhất có thể (<25-27 cmH20); và AP phải ở mức thấp để giảm công suất cơ học (mechanical power, MP) liên quan đến việc giảm Vt, mặc dù AP thấp hơn không làm giảm MP khi kết hợp với PEEP tối ưu (được đặt là AP). Cuối cùng, nên loại bỏ khái niệm lỗi thời về PEEP cao và PEEP thấp. Trong một mô hình thử nghiệm, PEEP cao hơn làm tăng strain tĩnh và VILI, trong khi chấn thương thể tích gây tổn thương phổi nhiều hơn chấn thương do xẹp phổi [50], [51].
PEEP nên được đặt ở mức thấp nhất cần thiết để đạt được độ bão hòa oxy tối thiểu có thể chấp nhận được (SpO2) (88-92%) hoặc PaO2 (55- 70 mmHg) [52]. PaO2 và việc cung cấp oxy có thể được tối ưu hóa bằng cách tăng pHa trong máu và giảm PaCO2, làm tăng nồng độ hemoglobin, cung lượng tim và hàm lượng oxy trong động mạch. Các bác sĩ lâm sàng nên thận trọng khi áp dụng các chiến lược bảo vệ phổi, đặc biệt với mục tiêu oxy thấp và tăng CO2 cho phép [53]. PEEP cũng nên được cài đặt để bảo vệ tâm thất phải, vì việc huy động các đơn vị phổi dẫn đến mất huy động các mao mạch. Ở PEEP cao, cần nhiều dịch hơn để huy động mao mạch và cải thiện chức năng tâm thất phải và giảm lưu lượng bạch huyết thoát ra khỏi phổi [54].
Điều trị thông khí cá nhân được tối ưu hóa dựa trên chụp X-quang ngực và chụp cắt lớp vi tính (CT) không mang lại kết quả tốt hơn và thậm chí còn dẫn đến kết quả tồi tệ hơn [55], cho thấy rằng hình ảnh ngực không phải là phương pháp tốt nhất để tối ưu hóa MV ở bệnh nhân ARDS.
Bệnh nhân béo phì có nguy cơ phát triển ARDS đặc biệt cao do những thay đổi về mặt giải phẫu và sinh lý ảnh hưởng đến thành ngực, phổi, hầu họng, mặt và cổ [56]. Những bệnh nhân này có biểu hiện giảm dung tích cặn chức năng và độ giãn nở của phổi, tình trạng thiếu oxy và không phù hợp về thông khí/tưới máu. Áp dụng PEEP cho nhóm đối tượng này là rất quan trọng để giảm thiểu tình trạng xẹp phổi và tắc nghẽn đường thở ở xa. về vấn đề này, tắc nghẽn đường thở ở cuối thì hít vào là một phương pháp hữu ích để cá nhân hóa PEEP theo sinh lý cụ thể của bệnh nhân [57], [58], [59].
Chúng tôi không khuyến nghị sử dụng mức PEEP >15 cmH2O. Vt thấp kết hợp với mức PEEP tối thiểu cần thiết để đạt được mục tiêu bão hòa/PaO2 (88%-92%/55-70 mmHg) [52] là lựa chọn tốt nhất để tránh xẹp và mở lại phế nang nhiều lần, về cơ bản bằng cách đóng phổi và giữ chúng ở trạng thái nghỉ để giảm thiểu VILI [60]. Cần xóa bỏ sự phân biệt giữa PEEP cao và thấp và PEEP nên được cá nhân hóa dựa trên đặc điểm chức năng của từng bệnh nhân ARDS.
Quy tắc 4. Thủ thuật huy động (RM)
Tổng trọng lượng của phổi tăng lên trong ARDS do phù mô kẽ và phế nang. Kết quả là tình trạng xẹp phổi ở các vùng phụ thuộc của phổi là phổ biến; sự xẹp của phế nang không chỉ làm giảm tổng bề mặt phổi có sẵn để trao đổi khí mà còn thúc đẩy tổn thương phổi bằng cách tăng ứng suất cắt (shear stress) ở các khu vực nằm ở ranh giới giữa phế nang được thông khí và xẹp, trải qua quá trình huy động và mất huy động theo chu kỳ [61]. RM (Recruitment maneuvers) làm giảm shunt trong phổi và cải thiện quá trình oxygen hóa và độ giãn nở. Do đó, RM có thể được coi là một “cách tiếp cận mở phổi” bảo vệ đối với MV; mặc dù nó có thể dẫn đến suy giảm huyết động và căng phổi quá mức, nguy hiểm hơn xẹp phổi [62], [63].
Một phân tích tổng hợp gần đây về 6 RCT liên quan đến 1423 bệnh nhân ARDS cho thấy tỷ lệ tử vong giảm khi sử dụng RM. Đáng chú ý, 5 trong số các nghiên cứu đã sử dụng PEEP cao trong nhóm can thiệp, cho thấy rằng RM có thể được sử dụng kết hợp với chiến lược bảo vệ phổi mở. Trong nghiên cứu không áp dụng đồng thời can thiệp và chỉ sử dụng RM định kỳ mà không có PEEP cao hơn, tỷ lệ tử vong đã giảm mặc dù chất lượng bằng chứng thấp. Tất cả 6 nghiên cứu đều cho thấy tình trạng oxygen hóa được cải thiện sau 24 giờ (tăng trung bình: 52 mmHg; CI 95%: 23-81 mmHg) [64]. Trong một phân tích tổng hợp khác gồm 10 thử nghiệm chỉ sử dụng PEEP cao (n = 3), chỉ RM (n = 1) hoặc kết hợp chúng (n = 6), không có sự khác biệt về tỷ lệ tử vong (RR=0,96, 95% CI: 0,84- 1,09, P = 0,5) hoặc tỷ lệ mắc chấn thương khí áp (RR=1,22, CI 95%: 0,93-1,61, P = 0,16) [7]. Ve tác động bất lợi liên quan đến RM, không có sự gia tăng nguy cơ chấn thương khí áp (4 thử nghiệm; RR = 0,84; CI 95%: 0,46-1,55) hoặc tỷ lệ rối loạn huyết động (3 thử nghiệm; RR=1,30; CI 95%: 0,92-1,78) [64]. Các RM phổi khác nhau đã được sử dụng bao gồm áp lực đường thở cao được duy trì trong một khoảng thời gian giới hạn, tăng PEEP từng bước với AP cố định, v.v. [65], [66], [67], [68]; sự không đồng nhất này có thể hạn chế tính chính xác của các phân tích tổng hợp.
Cần có những nghiên cứu sâu hơn để đánh giá tác động có lợi của RM; hiện tại, chúng không được khuyến cáo trong hướng dẫn điều trị cho bệnh nhân mắc ARDS nặng [19].
Quy tắc 5. Thuốc ức chế thần kinh cơ (NMBA)
NMBA (neuromuscular blocking agents) hoạt động bằng cách ức chế nhịp thở chủ động của bệnh nhân. Bệnh nhân mắc ARDS nặng có thể được hưởng lợi từ NMBA, đặc biệt là những người có điểm APACHE-II cao hơn, chênh lệch oxy phế nang-động mạch và Pplat, những người cần các liệu pháp cứu hộ như tư thế nằm sấp và ECMO [16], [17], [69]. NMBA làm giảm sự không đồng bộ của bệnh nhân-máy thở và mức tiêu thụ oxy, đồng thời tăng độ giãn nở, dung tích cặn chức năng và phân bố Vt theo vùng, dẫn đến tác dụng chống viêm [16], [70]. NMBA cũng đóng một vai trò quan trọng trong việc hạn chế mất huy động và duy trì PEEP, do đó làm giảm sự biến động của Pl gây ra bởi nỗ lực hít vào mạnh và xẹp phế nang thở ra [71]. Một tác dụng phụ chính của việc sử dụng NMBA lâu dài là yếu cơ, có thể gây bất lợi trong quá trình cai máy MV.
Một phân tích tổng hợp gần đây đánh giá tác động của NMBA đối với kết quả của bệnh nhân ARDS cho thấy NMBA không làm giảm nguy cơ tử vong sau 28 ngày (RR = 0,9; CI 95%: 0,78-1,03; P = 0,12) và 90 ngày (RR = 0,81; 95% CI: 0,62- 1,06; P = 0,06), nhưng giảm đáng kể nguy cơ tử vong tại ICU (RR = 0,72; 95% CI: 0,57-0,91; P = 0,007), số ngày không thở máy và thời gian MV, và tăng lượng oxygen hóa (ví dụ, bằng cách giảm tỷ lệ xảy ra tình trạng không đồng bộ) [72]. Phân tích tổng hợp này không bao gồm thử nghiệm ROSE [72], bởi vì các tác giả đã sử dụng bảng PEEP đã sửa đổi chứ không phải giao thức của Viện Tim, Phổi và Máu Quốc gia được sử dụng trong các RCT khác; hơn nữa, bệnh nhân chỉ được dùng thuốc an thần nhẹ, trái ngược với chiến lược gây mê sâu được sử dụng trong các thử nghiệm khác. Điều này có thể giải thích tại sao trong thử nghiệm ROSE, bệnh nhân ARDS có tỷ lệ sử dụng thuốc vận mạch thấp hơn, thời gian đặt nội khí quản ngắn hơn và tỷ lệ tử vong thấp hơn. Trong thử nghiệm ROSE, bệnh nhân mắc ARDS từ trung bình đến nặng được chia ngẫu nhiên thành 2 nhóm (thuốc an thần nặng bằng NMBA và thuốc an thần nhẹ bằng giả dược); các chiến lược hạn chế dịch và thông khí với PEEP cao giống nhau đã được sử
dụng ở cả hai nhóm để tránh những hạn chế của việc đồng can thiệp. Không có sự khác biệt về tỷ lệ tử vong ở ngày thứ 28 và 90, và tỷ lệ mắc bệnh yếu cơ là tương tự giữa các nhóm [73]. Trong thử nghiệm ACURASYS, tỷ lệ tử vong sau 90 ngày không khác nhau giữa nhóm NMBA (31,6%; 95% CI: 25,2-38,8) và nhóm giả dược (40,7%; 95% CI: 33,5-48,4) (P = 0,08), mặc dù tỷ lệ tử vong sau 28 ngày khác nhau đôi chút ở mức 23,7% (CI 95%: 18,1-30,5) và 33,3% (CI 95%: 26,5-40,9) ở nhóm NMBA và nhóm giả dược, tương ứng (P = 0,05) [10].
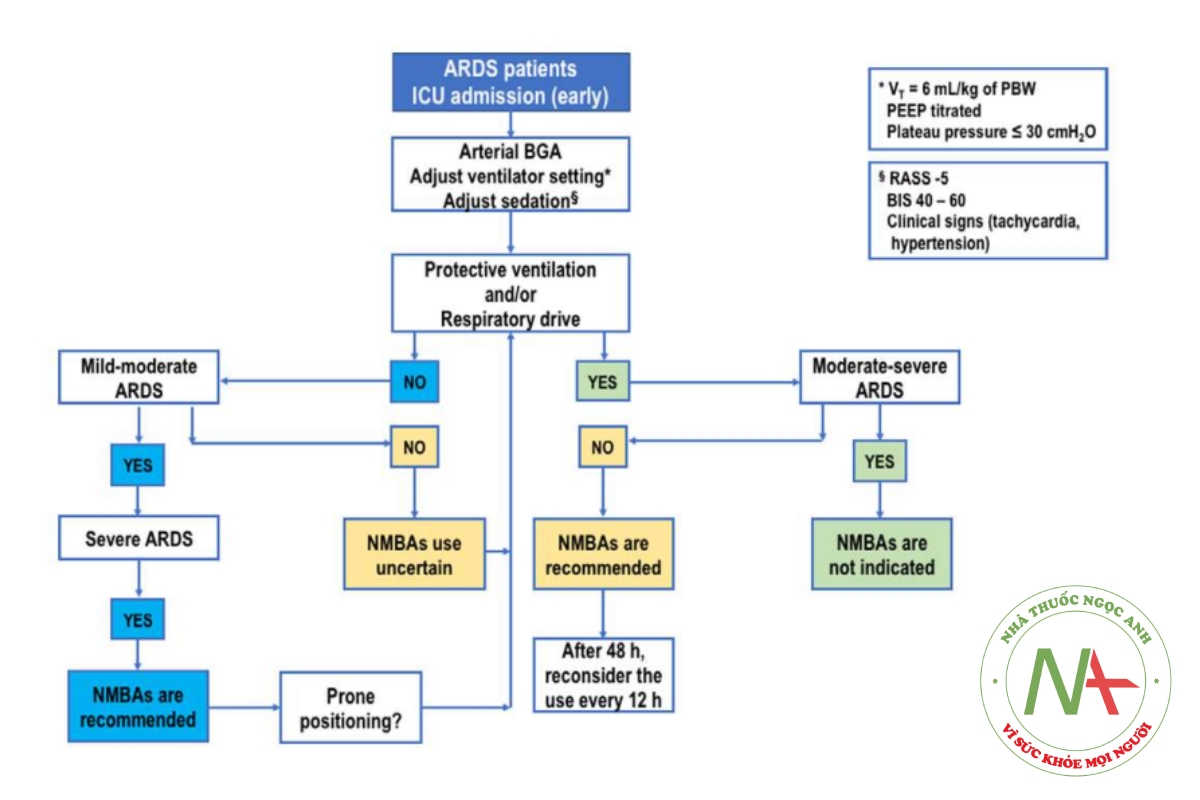
Tóm lại, NMBA không làm giảm nguy cơ tử vong ở ngày thứ 28 và 90, ngày không thở máy hoặc thời gian MV, nhưng cải thiện quá trình oxygen hóa và giảm chấn thương khí áp mà không ảnh hưởng đến tình trạng suy yếu của ICU. Hình 1 phác thảo thuật toán quản lý việc sử dụng NMBA ở bệnh nhân ARDS từ trung bình đến nặng.
=> Tham khảo: Tìm kiếm áp lực dương cuối thì thở ra tối ưu để thông khí bảo vệ phổi.
Quy tắc 6. Thông khí hỗ trợ
Trong giai đoạn cấp tính của ARDS, điều hợp lý là duy trì bệnh nhân điều trị NMBA liên tục ở chế độ thông khí bảo vệ, có kiểm soát. Khi có sự cải thiện lâm sàng, nên bắt đầu rút khỏi MV. Thở tự nhiên có tác dụng thuận lợi như giảm lãng phí cơ hô hấp và cải thiện quá trình oxygen hóa và độ giãn nở [74]. NMBA và thuốc an thần trước tiên được rút ra cho đến khi quan sát thấy nỗ lực thở tự nhiên. Việc quay trở lại chế độ thông khí tự phát là điều không thể tránh khỏi nhưng cũng đầy thách thức. Có một số vấn đề liên quan đến cái gọi là chế độ thông khí hỗ trợ áp lực (PSV).
Thở tự nhiên có thể làm tăng phản ứng viêm và VILI [75] và nỗ lực thở mạnh do điều hòa hô hấp quá mức có thể làm trầm trọng thêm tổn thương phổi do bệnh nhân tự gây ra (patient self-inflicted lung injury) do tình trạng căng phồng quá mức của các vùng phổi được thông khí với strain tăng lên. Theo nguyên tắc chung, các tiêu chí bảo vệ tương tự như tiêu chí áp dụng cho thông khí có kiểm soát trong ARDS [36] phải được đáp ứng để hỗ trợ thông khí tự nhiên. Liên quan đến chế độ máy thở trước khi cai máy và rút ống, một RCT không thua kém gần đây so sánh thông khí hỗ trợ mà không có hoặc với thủ thuật thở sâu ở bệnh nhân thiếu oxy cấp tính cho thấy 23% bệnh nhân trong nhóm sau không thể duy trì thông khí kiểm soát áp lực, so với đến 30% ở nhóm chỉ thở máy hỗ trợ (chênh lệch tuyệt đối, -7%; 95% CI: -18% – 4%; P = 0,015), nêu bật lợi ích lâm sàng của việc sử dụng thủ thuật thở sâu trong quá trình thông khí hỗ trợ [76].
Quy tắc 7. Tư thế nằm sấp
Thông khí của các vùng phụ thuộc bị suy giảm nghiêm trọng ở tư thế nằm ngửa ở bệnh nhân ARDS so với bệnh nhân không mắc ARDS [77]. Do trọng lực, các vùng phụ thuộc cũng được tưới máu nhiều hơn, dẫn đến thiếu oxy máu do thông khí/tưới máu không phù hợp. Sự gia tăng oxygen hóa rõ rệt thường được quan sát thấy ở bệnh nhân ARDS ở tư thế nằm sấp khi đạt được tỷ lệ thông khí/tưới máu đồng nhất hơn và do đó shunt trong phổi giảm đi [78]. Tư thế nằm sấp không chỉ cải thiện quá trình oxygen hóa mà còn làm giảm nguy cơ VILI [79]. Cải thiện oxygen hóa mà không thay đổi PaCƠ2 dẫn đến tái phân phối tưới máu thay vì huy động vì thông khí khu vực không được cải thiện. Mặt khác, quá trình oxygen hóa được cải thiện liên quan đến việc giảm PaCO2 dẫn đến huy động và tăng thông khí khu vực cũng như khả năng sống sót [80].
Những phát hiện mâu thuẫn đã được báo cáo liên quan đến lợi ích của tư thế nằm sấp. RCT nằm ngửa-nằm sấp II [81], bao gồm 342 bệnh nhân ARDS trưởng thành bị thiếu oxy máu vừa và nặng, không tìm thấy sự khác biệt đáng kể nào về khả năng sống sót chung sau 28 ngày và 6 tháng giữa bệnh nhân nằm ngửa và bệnh nhân nằm sấp (trong 20 giờ/ngày); tuy nhiên, các biến chứng cao hơn đáng kể ở nhóm sau. Một phân tích tổng hợp gần đây của 8 RCT cũng cho thấy không có sự khác biệt về tỷ lệ tử vong giữa các nhóm nhưng trong phân tích dưới nhóm, tỷ lệ tử vong thấp hơn ở những bệnh nhân nằm sấp > 12 giờ/ngày; hơn nữa, tỷ lệ PaO2/FiO2 cao hơn và các biến chứng như vì vết loét do áp lực và tắc nghẽn ống nội khí quản thường xuyên hơn ở nhóm nằm sấp [82]. Trong thử nghiệm PROSEVA với 466 bệnh nhân mắc ARDS nặng, nhóm can thiệp (237 bệnh nhân) vẫn ở tư thế nằm sấp trong 16 giờ/ngày (trung bình 4 buổi nằm sấp cho mỗi bệnh nhân); tỷ lệ tử vong thấp hơn đáng kể ở những bệnh nhân này ở thời điểm 28 ngày và 90 ngày trong khi tỷ lệ biến chứng tương đương với tỷ lệ ở nhóm nằm ngửa, ngoại trừ ngừng tim xảy ra thường xuyên hơn ở nhóm sau [83]. Những dữ liệu này cho thấy tư thế nằm sấp có thể có lợi ích lâm sàng trong các trường hợp ARDS nặng, miễn là tư thế nằm sấp được duy trì trong ít nhất 16 giờ.
Các hướng dẫn hiện tại khuyến nghị các chu kỳ nằm sấp kéo dài ít nhất 16 giờ đối với bệnh nhân có PaO2/FiO2 <150 để giảm tỷ lệ tử vong. Nằm sấp có hiệu quả về mặt chi phí và tương đối dễ thực hiện, mặc dù việc định vị bệnh nhân chính xác và an toàn đòi hỏi kỹ năng kỹ thuật và hết sức thận trọng [18]. Tư thế nằm sấp trong 1 ngày (12-18 giờ) lặp lại 3 lần (2-5 ngày) là lịch trình hợp lý.
Tư thế nằm sấp là kỹ thuật tốt nhất để mở phổi và giữ cho chúng mở, nhưng ở mức oxygen hóa và áp lực đường thở ở mức tối thiểu có thể chấp nhận được và PEEP thấp hơn. Trong bối cảnh này, PEEP nên được đặt để giảm thiểu strain tĩnh có hại.
Quy tắc 8. Các liệu pháp cứu hộ khác
Các liệu pháp cứu hộ cho ARDS được chỉ định khi các chiến lược ít xâm lấn khác không thành công. ECCO2R với lưu lượng máu lên tới 1.500 ml/phút là liệu pháp hiệu quả cho bệnh nhân ARDS bị suy hô hấp do thiếu oxy hoặc tăng CO2 máu. Phổi nhân tạo có sẵn trên thị trường, có thể được sử dụng trong hệ thống bơm ly tâm thông thường tách biệt hoặc trong mạch trị liệu thay thế thận liên tục [84]. Theo ý kiến của chúng tôi, các mạch và máy bơm cần được cải thiện hơn nữa trong tương lai gần. Hệ thống này hấp dẫn vì nó cho phép loại bỏ CO2 lưu lượng thấp trong các trường hợp ARDS nặng, đồng thời tránh sự xâm lấn của ECMO lưu lượng cao. Loại bỏ CO2 lưu lượng thấp duy trì quá trình oxygen hóa với ít MP hơn và có thể áp dụng dễ dàng và an toàn tại đầu giường [84], [85]. ECCO2R bảo vệ chống lại VILI bằng cách giảm Vt và Pplat đồng thời kiểm soát nhiễm toan hô hấp [86]; tuy nhiên, vẫn còn những câu hỏi liên quan đến chỉ định của nó vì hầu hết dữ liệu đến từ các nghiên cứu quan sát về hàng loạt trường hợp nhỏ hoặc từ các phân tích hồi cứu. Một tuyên bố đồng thuận được công bố vào năm 2020 về việc sử dụng ECCO2R ở bệnh nhân ARDS đã xác định tiêu chí mục tiêu cho MV như sau: AP < 14 cmH2O, Pplat < 25 cmH2O và nhịp thở 20-25 nhịp thở/phút. Chỉ định bắt đầu ECCO2R bao gồm AP > 15-20 cmH2O, Pplat > 30-35 cmH2O, PaCO2 > 60 mmHg, pH < 7,25, nhịp thở > 20-30 nhịp/phút, PaO2/FiO2 < 150 và PEEP > 8-15 cmH2O [86].
Hít oxit nitric (iNO) là một chiến lược cứu hộ khác thường được sử dụng ở những bệnh nhân ARDS không đáp ứng với các phương pháp điều trị thông thường. iNO được báo cáo lần đầu tiên vào năm 1987 dưới dạng thuốc giãn mạch nội sinh để điều trị tăng huyết áp phổi và các bệnh phổi khác; gần đây nó đã được chứng minh là có lợi cho sự không phù hợp về thông khí/tưới máu. Dữ liệu hiện tại chỉ ra rằng iNO có thể được áp dụng một cách an toàn, mặc dù các tác dụng phụ tiềm ẩn bao gồm methemoglobinemia, giảm kết tập tiểu cầu, giãn mạch toàn thân và rối loạn chức năng thận. Vì vậy, iNO nên được sử dụng cẩn thận ở những bệnh nhân mắc bệnh thận và cần theo dõi chặt chẽ chức năng thận trong quá trình điều trị [87].
Quy tắc 9. ECMO
Trong khi các hệ thống lưu lượng thấp như ECCO2R (0,5-1,5 L/phút) cung cấp đủ lưu lượng cho cả quá trình oxygen hóa và loại bỏ CO2, thì các hệ thống lưu lượng cao như ECMO (2-4 L/phút) cung cấp quá nhiều lưu lượng cho mức oxygen hóa và loại bỏ CO2 tối thiểu (cần lưu lượng máu thấp) [86], [87], [88]. Trong thử nghiệm EOLIA, ECMO đã được sử dụng ở những bệnh nhân đã nằm sấp nhưng không cho thấy sự cải thiện đầy đủ. Thử nghiệm không chứng minh được sự khác biệt đáng kể về tỷ lệ tử vong trong 60 ngày giữa ECMO và nhóm đối chứng [69]. Một phân tích tổng hợp gần đây về 2 RCT với tổng số 429 bệnh nhân đã báo cáo tỷ lệ tử vong trong 60 ngày thấp hơn ở nhóm ECMO tĩnh mạch-tĩnh mạch (RR=0,73; CI 95%: 0,58-0,92; P = 0,008), trong khi 3 nghiên cứu khác báo cáo tỷ lệ xuất huyết nặng cao hơn ở những bệnh nhân sử dụng ECMO [89]. Không phải tất cả các trung tâm tham gia vào các thử nghiệm này đều áp dụng các chiến lược cứu hộ thông thường cho các trường hợp ARDS nghiêm trọng và một số trung tâm còn thiếu chuyên môn trong việc sử dụng ECMO. Hướng dẫn mới nhất của Tổ chức Hỗ trợ Sự sống Ngoài cơ thể để bắt đầu ECMO bao gồm suy hô hấp do thiếu oxy với nguy cơ tử vong >50% (PaO2/FiO2 < 150 với FiO2 > 90% và/hoặc điểm Murray là 2-3, Chỉ số Oxy điều chỉnh theo tuổi Điểm [AOI] là 60 hoặc điểm APSS [dựa trên tuổi, PaO2/FiO2 và Pplat]), nguy cơ tử vong >80% (PaO2/FiO2 < 100 với FiO2 > 90%, và/hoặc điểm Murray 3-4, điểm AOI >80 hoặc điểm APSS là 8); duy trì PaCO2 mặc dù đã cài đặt MV tối đa; hội chứng rò rỉ không khí nghiêm trọng; bệnh nhân có tên trong danh sách ghép phổi; hoặc suy tim hoặc suy hô hấp [90], [91], [92]. ECMO cũng nên được sử dụng để giảm nguy cơ VILI bằng cách áp dụng chiến lược máy thở siêu bảo vệ [93]. Mặc dù không có chống chỉ định tuyệt đối nhưng nên xem xét các chống chỉ định tương đối như cài đặt MV tối đa >7 ngày; ức chế miễn dịch; xuất huyết hệ thần kinh trung ương, tổn thương hoặc bệnh ác tính giai đoạn cuối; và tuổi tăng lên [88].
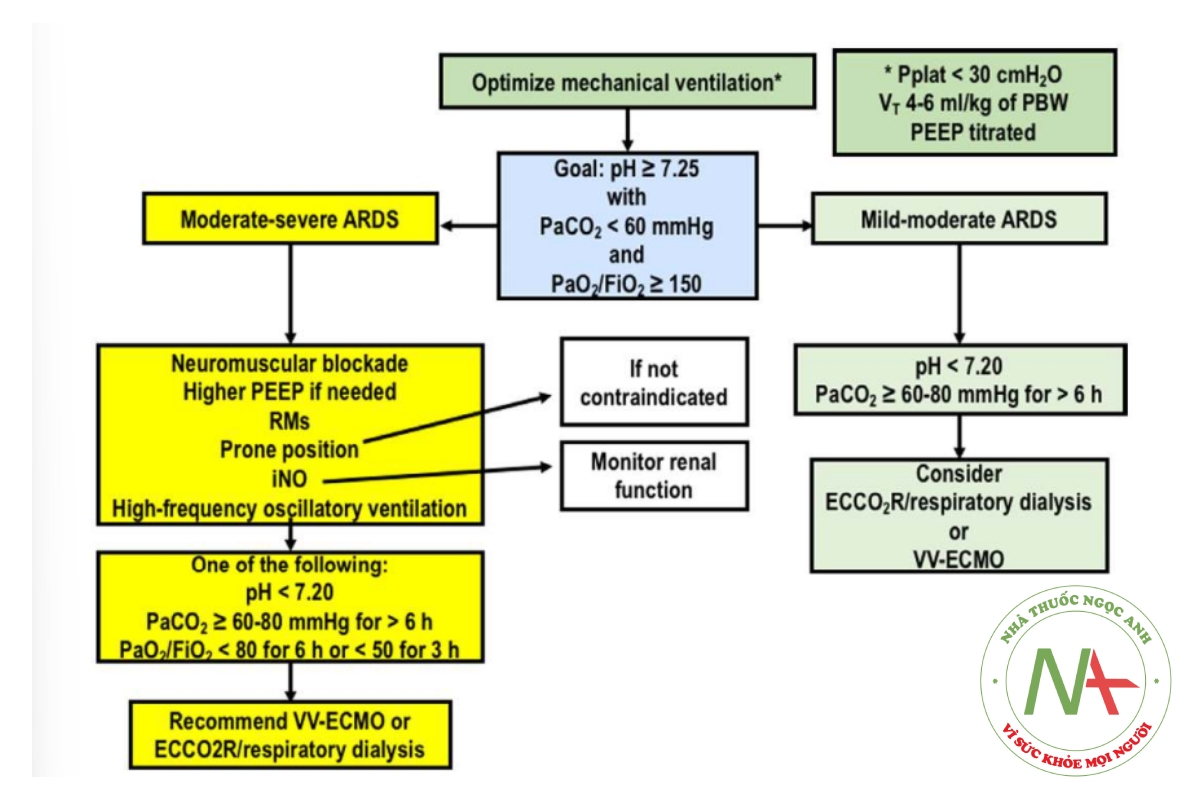
Chiến lược lựa chọn bệnh nhân có thể hưởng lợi từ chiến lược cấp cứu được trình bày trong Hình 2.
Quy tắc 10. Cai máy thở máy
Khi đã đạt được mức hỗ trợ áp lực mong muốn thấp hơn trong thông khí hỗ trợ, nên giảm thuốc an thần và giảm đau và tiến hành thử nghiệm thở tự nhiên (SBT). Suy hô hấp sau rút nội khí quản có liên quan đến nguy cơ tử vong cao [94], [95], [96]. Việc ngừng dùng thuốc an thần hàng ngày để đánh giá mức độ kích động và đau đã được áp dụng từ năm 2000; thực hành này có thể giảm số ngày nằm MV và thời gian nằm ICU [97].
Việc cai MV có thể được chia thành đơn giản, khó khăn và kéo dài [98]. Một số phương pháp đã được đề xuất để dự đoán việc cai MV thành công, mỗi phương pháp đều có những ưu điểm và hạn chế; thước đo được sử dụng phổ biến nhất là tỷ lệ tần số/ Vt [99].Các chiến lược cai máy thường được sử dụng ở bệnh nhân ICU nói chung bao gồm PSV hoặc thử nghiệm ống chữ T. Trong một RCT so sánh 30 phút PSV thấp (8 cmH2Ơ và 0 PEEP) và 2 giờ với ống chữ T, điều trị trước mang lại thành công lớn hơn khi rút ống nội khí quản. Tuy nhiên, mặc dù quyết định nối bệnh nhân với ống thông mũi lưu lượng cao hoặc sử dụng NIV sau khi rút nội khí quản hoặc kết nối lại bệnh nhân 1 giờ trước khi rút ống nội khí quản trong giai đoạn ngẫu nhiên, nhánh PSV đã nhận được ống thông mũi lưu lượng cao hoặc NIV cho thời gian dài hơn nhóm ống chữ T (25% so với 19%; P = 0,01), có khả năng làm sai lệch kết quả cuối cùng [100]. Hơn nữa, trong một số thử nghiệm, bệnh nhân được kết nối lại với máy thở trong một khoảng thời gian nhất định trước khi rút ống, trong khi ở những thử nghiệm khác, họ được rút ống trực tiếp sau khi vượt qua SBT. Một RCT khác được thực hiện vào năm 2017 đã chứng minh rằng thời gian nghỉ 1 giờ sau khi vượt qua SBT đã làm giảm tỷ lệ đặt lại ống nội khí quản trong vòng 48 giờ sau khi rút ống [101]. Một hướng dẫn thực tế để cai máy là thực hiện SBT với tăng áp lực hít vào và mức PEEP trong khoảng từ 0 đến 5 cmH2Ơ, sau đó rút ống nội khí quản và NIV ở những bệnh nhân có nguy cơ cao thất bại trong việc rút ống nội khí quản (ví dụ: bệnh nhân tăng CO2
máu, bệnh phổi tắc nghẽn mạn tính, sung huyết suy tim hoặc các bệnh đi kèm nghiêm trọng khác) [102]. Các phương pháp tiếp cận được cá nhân hóa để cai máy cho bệnh nhân ICU nói chung cần phải an toàn hơn và nhanh hơn. Vì chưa có các nghiên cứu cụ thể về cai máy trong ARDS, chúng tôi khuyên bạn nên tuân theo các quy trình địa phương dựa trên bằng chứng hiện tại thu được từ dân số ICU nói chung. Ngoài ra, vai trò của vật lý trị liệu hô hấp là rất quan trọng trong bối cảnh này. Vật lý trị liệu ngực nên được bắt đầu càng sớm càng tốt ngay cả trong quá trình MV có kiểm soát để cải thiện kết quả và giảm các biến chứng. Đặc biệt, hỗ trợ vận động, trị liệu tư thế, kích thích điện thần kinh cơ và rèn luyện cơ hô hấp có thể làm giảm tình trạng yếu cơ ở bệnh nhân ICU, và trong khi siêu bơm phồng bằng tay hoặc máy thở [103], định vị [104], chu kỳ thở tích cực và dẫn lưu dịch tiết dưới thanh môn có thể giảm các biến chứng hô hấp như xẹp phổi, viêm phổi liên quan đến máy thở và viêm khí phế quản [105].
ARDS COVID-19
Hội chứng hô hấp cấp tính nặng do virus Corona-2 (SARS-CoV-2) lần đầu tiên được xác định ở Vũ Hán, Trung Quốc vào tháng 12 năm 2019. Nó nhanh chóng trở thành đại dịch. Hầu hết các trường hợp nhiễm vi- rút chỉ giới hạn ở bệnh sốt nhẹ, nhưng một số phát triển ARDS cần phải nhập viện ICU và chăm sóc đặc biệt [106], [107]. Việc quản lý hô hấp của COVID-19 ARDS dựa trên các kiểu hình riêng biệt theo kết quả CT ngực [24], [108], [109], [110] và sinh lý phổi; chúng bao gồm kiểu hình 1, với độ giãn nở của phổi được bảo tồn nhưng có ít vùng phế nang cần huy động, cùng với các vùng có tưới máu cao; kiểu hình 2, với xẹp phổi phân bố không đồng nhất; và kiểu hình 3, có độ giãn nở thấp và phân bố xẹp phổi không đồng nhất (rất giống với ARDS truyền thống) [108].
Ngoài chiến lược MV bảo vệ được khuyến nghị cho bệnh nhân ARDS nói chung, đối với ARDS kiểu hình 1, chúng tôi khuyên bạn nên sử dụng PEEP vừa phải để phân phối lại lưu lượng máu phổi từ vùng không được thông khí đến vùng được thông khí hơn. Đối với kiểu hình 2, chúng tôi khuyên bạn nên sử dụng PEEP từ trung bình đến cao để cải thiện việc huy động phổi; Các liệu pháp cứu hộ cũng có thể được xem xét. Đối với kiểu hình 3, chúng tôi khuyên bạn nên áp dụng các khuyến nghị hiện tại cho ARDS điển hình (không phải COVId) [[24], [105-111]].
Triển vọng tương lai
Các nghiên cứu gần đây đã chứng minh rằng không chỉ các thông số tĩnh (PEEP, Pplat và AP) mà cả các thông số động (lưu lượng khí, thời gian hít vào và nhịp thở) đều có thể gây tổn thương phổi [112]. MP, tích của năng lượng cơ học và nhịp thở, là thước đo lượng năng lượng được máy thở cơ học truyền cho bệnh nhân. Một tham số liên quan, cường độ, được MP chuẩn hóa theo diện tích bề mặt phổi [[5]-[114]]. Với cùng một MP, cường độ sẽ cao hơn trên diện tích bề mặt nhỏ hơn [5]. Ba hoặc nhiều phương trình đã được đề xuất để tính MP tùy thuộc vào cài đặt thông khí. Chúng tôi đề xuất rằng các phương trình đơn giản nhất được áp dụng ở đầu giường trong trường hợp thông khí kiểm soát áp lực và thể tích [115-118] (Hình 3). MP nên được duy trì dưới 12 J/phút trong ARDS và dưới 17 J/phút ở không phải ARDS. Hơn nữa, mức MP >27 J/phút nên được xem xét trong ECMO [119]. Khái niệm MP còn mới và vẫn đang được nghiên cứu; mặc dù nó hấp dẫn nhưng nó có thể không hữu ích trong thực hành lâm sàng để thiết lập các thông số MV ở bệnh nhân ARDS.
Kết luận
Trong vài thập kỷ qua đã có những tiến bộ đáng kể trong quản lý ARDS. MV nên tuân theo các tiêu chí về thông gió bảo vệ để giảm thiểu nguy cơ VILI. Khi không thể tối ưu hóa cài đặt MV, nên bắt đầu các biện pháp xử lý cứu hộ. Những cách tiếp cận này phải được thực hiện bằng cách xem xét kinh nghiệm và lợi ích của trung tâm điều trị đối với bệnh nhân. Nói chung, nên giảm thiểu Vt, Pplat, AP, PEEP và PaO2, đồng thời tăng mức hemoglobin, đồng thời cho phép xẹp phổi và thiếu oxy máu. Do đó, chiến lược đóng phổi và giữ cho chúng nghỉ ngơi có thể giảm thiểu VILI trong ARDS.