Trypsin
Danh pháp
Tên chung quốc tế
Mã ATC
B – Máu và cơ quan tạo máu
B06 – Các thuốc khác về huyết học
B06A – Các thuốc khác về huyết học
B06AA – Các Enzyme
B06AA07 – Trypsin
D – Da liễu
D03 – Thuốc điều trị vết thương và loét da
D03B – Các Enzyme
D03BA – Các Enzyme phân giải Protein
D03BA01 – Trypsin
Mã UNII
GV54A213NN
Mã CAS
9002-07-7
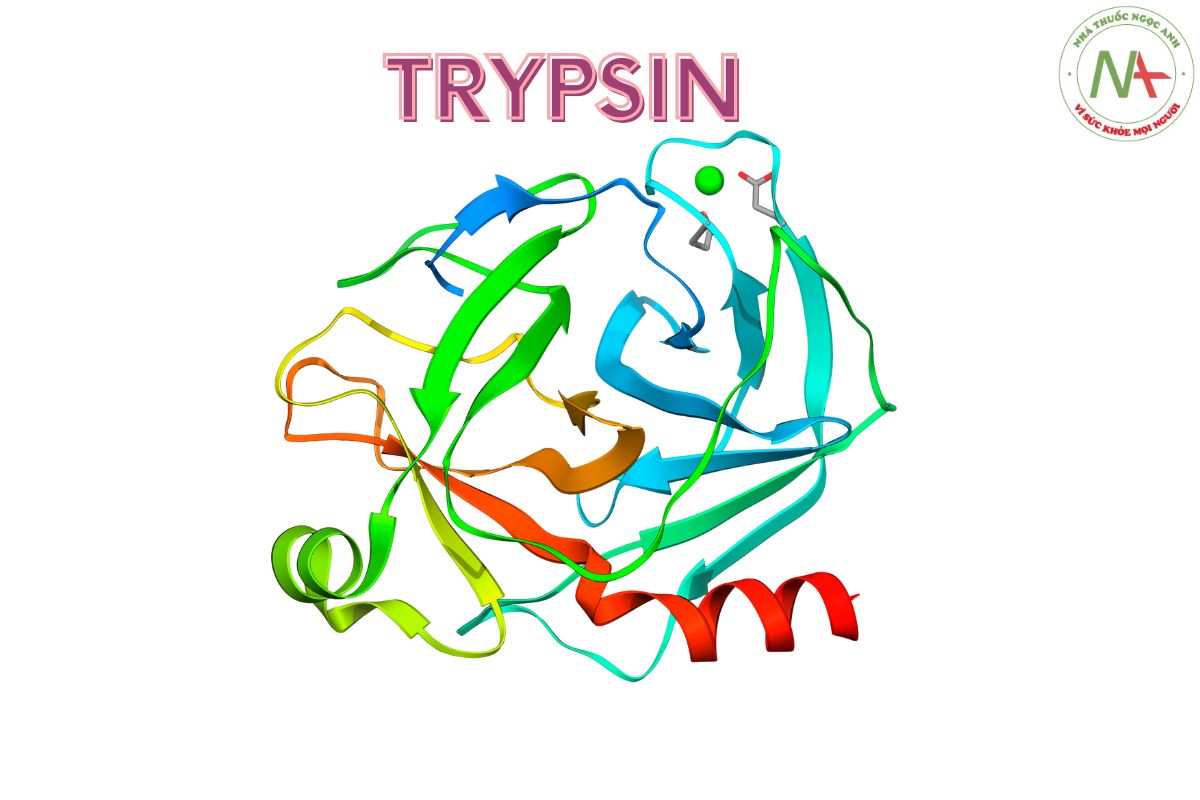
Cấu trúc phân tử
Cấu trúc phân tử
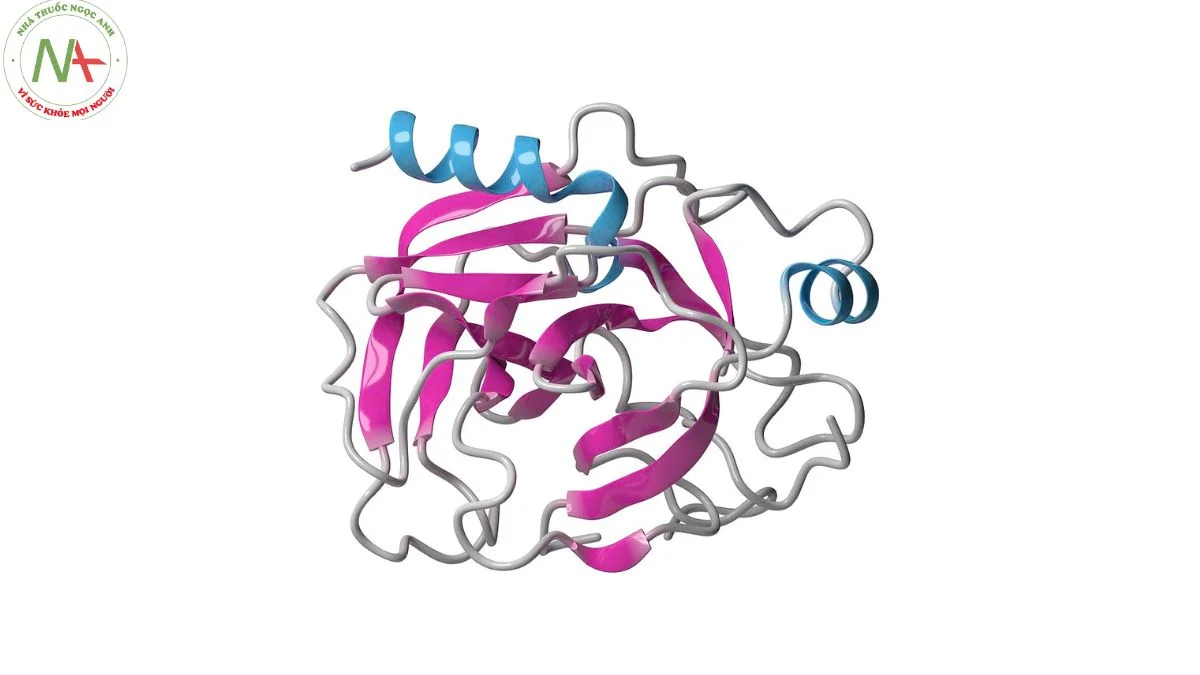
Trypsin là một protein hình cầu, bao gồm 220 đơn phân. Protein này chứa 13 chuỗi beta, sáu trong số 13 chuỗi này hình thành một cấu trúc dạng thùng beta. Có bốn vùng xoắn alpha, và sáu cầu disulfide. Vòng gắn Ca2+ kéo dài từ Glu70 tới Glu80.
Phân tử lượng
Là một protein, trypsin có trọng lượng phân tử khác nhau tùy thuộc vào nguồn. Ví dụ, trọng lượng phân tử 23,3 kDa được báo cáo cho trypsin từ nguồn bò và lợn.
Dạng bào chế
Viên nén: 1 mg, 720 FIP units, 1440 FIP units, 1740 FIP units
Khí dung: 0.12 mg/1g
Gel: 0.012 g/100g
Thuốc mỡ: 0.0036 mg/1g, 90 [USP’U]/1g
Độ ổn định và điều kiện bảo quản
Trypsin của con người có nhiệt độ hoạt động tối ưu khoảng 37°C. Ngược lại, cá tuyết Đại Tây Dương có một số loại trypsin để cá biến nhiệt có thể tồn tại ở các nhiệt độ cơ thể khác nhau. Trypsin cá tuyết bao gồm trypsin I với phạm vi hoạt động từ 4 đến 65 °C và hoạt động tối đa ở 55 °C, cũng như trypsin Y với phạm vi hoạt động từ 2 đến 30 °C và hoạt động tối đa ở 21 °C.
Hoạt động của trypsin không bị ảnh hưởng bởi chất ức chế enzyme tosyl phenylalanyl chloromethyl ketone, TPCK, chất làm vô hiệu hóa chymotrypsin.
Trypsin nên được bảo quản ở nhiệt độ rất lạnh (trong khoảng từ −20 đến −80 °C) để ngăn chặn quá trình tự phân hủy, điều này cũng có thể bị cản trở khi bảo quản trypsin ở pH 3 hoặc bằng cách sử dụng trypsin được biến đổi bằng quá trình methyl hóa khử. Khi độ pH được điều chỉnh trở lại pH 8, hoạt tính enzyme sẽ quay trở lại.
Nguồn gốc
Trypsin là gì? Trypsin là một enzyme tiêu hóa có khả năng phân giải protein thành các peptit nhỏ hơn. Enzyme trypsin được phát hiện lần đầu tiên vào năm 1876 bởi nhà sinh học người Đức Wilhelm Kühne, khi ông thử nghiệm với dịch tụy của chó. Ông đặt tên cho enzyme này là “pepsin B”, vì ông cho rằng nó có chức năng tương tự như pepsin, một enzyme khác có trong dịch vị.
Trypsin có ở đâu? Sau đó, vào năm 1896, nhà hóa sinh người Pháp Maurice Arthus và nhà hóa sinh người Anh John Howard Northrop xác định cấu trúc phân tử của trypsin và chứng minh rằng nó là một protein. Họ cũng phát hiện ra rằng trypsin có thể được kích hoạt từ một dạng tiền chất không hoạt động gọi là trypsinogen, do tuyến tụy tiết ra.
Trypsin đã được sử dụng rộng rãi trong nghiên cứu sinh học, y học và công nghệ sinh học, nhờ vào khả năng của nó cắt đứt liên kết peptit ở vị trí các axit amin lizin và arginin. Trypsin cũng có vai trò quan trọng trong quá trình tiêu hóa thức ăn chứa protein ở người và động vật.
Dược lý và cơ chế hoạt động
Trypsin là một enzyme tiêu hóa thuộc nhóm protease, có khả năng phân giải các liên kết peptit trong chuỗi polypeptide của protein.
Trypsin được tiết ra từ tuyến tụy dưới dạng trypsinogen, một dạng không hoạt động của enzyme. Khi trypsinogen đến ruột non, nó được kích hoạt thành trypsin bởi enzyme enterokinase. Trypsin sau đó có thể tự kích hoạt thêm trypsinogen thành trypsin, tạo ra hiệu ứng xích.
Cơ chế tác dụng của trypsin là dựa vào sự tương tác giữa nhóm amino axit ở vị trí hoạt chất của enzyme và nhóm amino axit ở vị trí đích của protein. Trypsin có đặc tính là chỉ phân cắt các liên kết peptit mà ở đó có sự hiện diện của các amino axit có nhóm bên thơm hoặc cơ bản, như phenylalanine, tyrosine, tryptophan, lysine và arginine. Nhờ vậy, trypsin có thể phân tách protein thành các đoạn peptid ngắn hơn, giúp quá trình tiêu hóa và hấp thu protein diễn ra hiệu quả hơn.
Ứng dụng trong y học
Trypsin là một enzyme phân giải protein thuộc họ serine protease, được tìm thấy chủ yếu trong tuyến tụy của động vật có xương sống. Mặc dù chức năng chính của trypsin là giúp tiếp tục quá trình tiêu hóa protein trong ruột non, nhưng trypsin cũng có nhiều ứng dụng quan trọng khác ngoài hệ tiêu hóa, đặc biệt trong lĩnh vực y học.
Chẩn đoán và điều trị bệnh lý tuyến tụy: Chất cản trở Trypsin (trypsin inhibitor) trong huyết thanh được sử dụng như một chỉ số để chẩn đoán viêm tuyến tụy, sưng to tuyến tụy cấp tính và ung thư tuyến tụy. Bên cạnh đó, trypsin cũng được sử dụng trong điều trị một số bệnh lý tuyến tụy bằng cách tiêm trực tiếp vào tuyến.
Làm loãng đờm: Trong điều kiện bệnh lý như hen suyễn hoặc bệnh phổi tắc nghẽn mạn tính (COPD), dịch đờm trong đường hô hấp thường đặc và khó đào thải. Trypsin có tác dụng phân giải protein trong đờm, giúp làm loãng đờm và giảm triệu chứng của bệnh nhân.
Chuẩn bị mẫu mô học: Trong phòng thí nghiệm, trypsin thường được sử dụng để tách các tế bào từ mô gốc hoặc để tách các tế bào khỏi một môi trường cấy. Việc này giúp nghiên cứu hoặc phân loại các tế bào dễ dàng hơn.
Điều trị vết thương và loét: Trypsin và chymotrypsin được kết hợp với nhau, đã được sử dụng để làm sạch vết thương và loét da. Nó giúp loại bỏ các mô chết và dịch mủ, từ đó tăng cường quá trình phục hồi.
Nghiên Cứu dược học: Trypsin được sử dụng trong việc sản xuất một số dạng thuốc nhờ khả năng cắt đứt các liên kết peptide. Nó cũng được sử dụng trong nghiên cứu về cơ chế hoạt động của các protein và peptit.
Điều trị viêm khớp: Một số nghiên cứu đã chỉ ra rằng việc sử dụng trypsin có thể giảm viêm và đau ở bệnh nhân mắc bệnh viêm khớp. Cơ chế hoạt động của trypsin trong trường hợp này dựa trên khả năng tiêu hóa và loại bỏ các protein gây viêm trong khớp.
Điều trị bệnh sưng to cơ: Trypsin, đặc biệt khi kết hợp với chymotrypsin và bromelain, đã được sử dụng để giảm sưng và đau sau những chấn thương cơ bắp, chẳng hạn như căng cơ hay chấn thương khi tập thể thao.
Dược động học
Hấp thu
Trong điều kiện bình thường, trypsin không được hấp thụ vào máu từ ruột non. Nó hoạt động ở đường tiêu hóa và giữ lại ở đó.
Phân bố
Trypsin hoạt động chủ yếu trong ruột non.
Chuyển hóa
Trypsin tự tiết trong dạ dày và được kích hoạt bởi enterokinase. Sau khi thực hiện chức năng của nó trong việc phân giải protein, trypsin sẽ bị các inhibitor protease trong dịch tiêu hóa và mô ruột ngăn chặn, giảm thiểu hại cho mô ruột.
Thải trừ
Các sản phẩm cắt của trypsin và các enzym tiêu hóa khác sẽ được bài tiết ra khỏi cơ thể qua phân.
Phương pháp sản xuất
Trypsin được sử dụng rộng rãi trong công nghiệp dược phẩm, chẳng hạn như trong sản xuất insulin, vaccine và thuốc chống ung thư. Để sản xuất trypsin trong công nghiệp, người ta thường sử dụng hai phương pháp chính: chiết tách từ mô động vật hoặc tổng hợp sinh học.
Phương pháp chiết tách từ mô động vật là cách truyền thống nhất để sản xuất trypsin. Người ta lấy mô tụy của bò, lợn hoặc gà, rồi xử lý bằng các dung dịch muối, axit hoặc kiềm để tách trypsin ra khỏi các thành phần khác. Sau đó, trypsin được tinh chế bằng cách sắc ký hoặc kết tinh. Phương pháp này có ưu điểm là đơn giản và chi phí thấp, nhưng có nhược điểm là chất lượng trypsin không cao, có thể bị nhiễm khuẩn hoặc gây dị ứng.
Phương pháp tổng hợp sinh học là cách hiện đại hơn để sản xuất trypsin. Người ta sử dụng các vi sinh vật biến đổi gen, chẳng hạn như vi khuẩn E.coli hoặc nấm men Saccharomyces cerevisiae, để biểu hiện gen mã hóa trypsin. Sau đó, trypsin được thu từ nước nuôi cấy của các vi sinh vật này. Phương pháp này có ưu điểm là chất lượng trypsin cao, không bị nhiễm khuẩn hoặc gây dị ứng, và có thể điều chỉnh được độ hoạt động của trypsin. Nhưng phương pháp này cũng có nhược điểm là phức tạp và chi phí cao hơn.
Độc tính ở người
Trypsin có thể gây ra độc tính nếu tiếp xúc với các mô khác nhau trong cơ thể, như da, mắt, niêm mạc hoặc máu. Độc tính của trypsin phụ thuộc vào nồng độ, thời gian tiếp xúc và loại mô bị ảnh hưởng.
Trypsin có thể gây ra viêm, phù nề, đau, ngứa, kích ứng, hoại tử hoặc thậm chí tử vong nếu không được điều trị kịp thời. Trypsin cũng có thể tương tác với các chất khác trong cơ thể, như hệ miễn dịch, hệ đông máu hoặc hệ thần kinh, và gây ra các biến chứng nghiêm trọng.
Tính an toàn
Một số đối tượng đặc biệt cần phải cẩn thận khi sử dụng thuốc trypsin là:
- Những người bị dị ứng với trứng, sữa, hoặc các sản phẩm từ động vật. Trypsin thường được chiết xuất từ tụy của bò hoặc lợn, nên có thể gây ra phản ứng dị ứng nghiêm trọng ở những người nhạy cảm với protein động vật.
- Những người bị bệnh máu, như thiếu máu, bệnh tiểu đường, hoặc bệnh đông máu. Trypsin có thể làm giảm khả năng đông máu của cơ thể, gây ra chảy máu hoặc vết thương khó lành.
- Những người có thai, cho con bú, hoặc dự định mang thai. Trypsin có thể ảnh hưởng đến sự phát triển của thai nhi hoặc sữa mẹ, nên cần được tham khảo ý kiến của bác sĩ trước khi sử dụng.
Tương tác với thuốc khác
Trypsin có thể làm giảm hấp thu của các thuốc chống đông máu, như warfarin, heparin, aspirin, clopidogrel, v.v. Điều này có thể làm tăng nguy cơ xuất huyết hoặc đột quỵ.
Trypsin có thể làm tăng hấp thu của các thuốc kháng sinh, như amoxicillin, cefalexin, doxycycline, v.v. Điều này có thể làm tăng nguy cơ bị quá liều hoặc phản ứng dị ứng.
Trypsin có thể làm giảm hiệu quả của các thuốc chống viêm, như ibuprofen, naproxen, diclofenac, v.v. Điều này có thể làm giảm khả năng giảm đau hoặc chống sưng viêm.
Trypsin có thể làm tăng hiệu quả của các thuốc chống ung thư, như methotrexate, cyclophosphamide, fluorouracil, v.v. Điều này có thể làm tăng nguy cơ bị tác dụng phụ nghiêm trọng, như mất tóc, nôn mửa, suy giảm miễn dịch.
Lưu ý khi sử dụng Trypsin
Không sử dụng trypsin nếu bạn bị dị ứng với nó hoặc với bất kỳ thành phần nào của thuốc.
Không sử dụng trypsin nếu bạn đang mang thai, cho con bú hoặc có kế hoạch mang thai trong tương lai gần.
Không sử dụng trypsin nếu bạn đang dùng thuốc chống đông máu, thuốc chống viêm hoặc thuốc kháng sinh.
Hỏi ý kiến bác sĩ trước khi sử dụng trypsin nếu bạn có bệnh lý gan, thận, tim, tiêu hóa hoặc bất kỳ bệnh lý khác.
Sử dụng trypsin theo chỉ định của bác sĩ và không vượt quá liều lượng khuyến cáo.
Uống trypsin cùng với một ly nước lớn và không nhai hoặc nghiền thuốc.
Bảo quản trypsin ở nơi khô ráo, thoáng mát và xa tầm tay trẻ em.
Nếu bạn quên uống một liều trypsin, uống liều bỏ qua ngay khi nhớ ra. Nếu đã gần giờ uống liều tiếp theo, bỏ qua liều quên và tiếp tục theo lịch uống bình thường. Không uống hai liều cùng một lúc để bù đắp cho liều quên.
Nếu bạn uống quá liều trypsin, hãy gọi ngay cho bác sĩ hoặc cơ quan y tế khẩn cấp gần nhất. Các triệu chứng của quá liều trypsin có thể bao gồm: buồn nôn, nôn mửa, đau bụng, tiêu chảy, máu trong phân, chảy máu không ngừng, phù nề, khó thở hoặc ngất xỉu.
Nếu bạn gặp phải bất kỳ tác dụng phụ nào khi sử dụng trypsin, hãy thông báo cho bác sĩ ngay. Các tác dụng phụ có thể xảy ra khi sử dụng trypsin có thể gồm: phát ban, ngứa, đỏ da, phù mặt, môi hoặc lưỡi, khó thở, hoặc sốt.
Một vài nghiên cứu của Trypsin trong Y học
Tác dụng của Trypsin-Chymotrypsin đối với cơn đau sau phẫu thuật sau một lần điều trị nội nha: Một thử nghiệm ngẫu nhiên có đối chứng
Giới thiệu: Hiệu quả của trypsin-chymotrypsin trong việc kiểm soát cơn đau sau phẫu thuật sau khi điều trị tủy răng một lần cho những răng bị viêm tủy không hồi phục có triệu chứng đã được đánh giá. Ngoài ra, tác dụng hiệp đồng với thuốc chống viêm không steroid và tác dụng phụ được báo cáo cũng đã được nghiên cứu.
Phương pháp: Thử nghiệm ngẫu nhiên có đối chứng, song song, mù ba giai đoạn IV này bao gồm 60 bệnh nhân có răng hàm dưới lớn thứ nhất có biểu hiện viêm tủy không hồi phục có triệu chứng.
Các bệnh nhân được phân ngẫu nhiên bằng phần mềm máy tính vào một trong bốn nhóm điều trị (mỗi nhóm n = 15) và ibuprofen (600 mg), ambezim-G (trypsin 5mg-chymotrypsin 5 mg), kết hợp cả hai hoặc thuốc giả dược sau phẫu thuật.
Những người tham gia ghi điểm cường độ đau ở các khoảng thời gian khác nhau bằng thang số và giám sát thụ động tác hại được sử dụng để phát hiện sự an toàn lâm sàng. Tuổi được so sánh giữa các nhóm bằng cách sử dụng phân tích phương sai một chiều.
Điểm đau được phân tích bằng các bài kiểm tra của Kruskal-Wallis và Friedman, và nếu có ý nghĩa, bài kiểm tra của Dunn sẽ được sử dụng để so sánh theo cặp. Kiểm định chi bình phương được sử dụng để so sánh dữ liệu định tính và mức ý nghĩa được đặt ở giá trị P ≤ 0,05.
Kết quả: Tất cả các biện pháp can thiệp đều có hiệu quả trong việc giảm đau sau phẫu thuật và không có sự khác biệt có ý nghĩa thống kê giữa nhóm dùng ibuprofen, trypsin-chymotrypsin và nhóm kết hợp. Tuy nhiên, cả 3 nhóm đều khác biệt đáng kể so với nhóm dùng giả dược. Hồ sơ an toàn của các biện pháp can thiệp không khác biệt đáng kể.
Kết luận: Trypsin-chymotrypsin có hiệu quả tương đương với các thuốc chống viêm không steroid. Không có tác dụng hiệp đồng nào xảy ra khi cả 2 được sử dụng kết hợp. Đây là thử nghiệm ngẫu nhiên có đối chứng đầu tiên để đánh giá tác động của enzyme phân giải protein đối với cơn đau sau nội nha.
Tài liệu tham khảo
- Drugbank, Trypsin, truy cập ngày 8 tháng 10 năm 2023.
- Hashem, A. A. R., Abd El Sattar, A. A., & Abdel Rahman, T. Y. (2023). The Effect of Trypsin-Chymotrypsin on Postoperative Pain after Single Visit Endodontic Treatment: A Randomized Controlled Trial. Journal of endodontics, 49(3), 240–247. https://doi.org/10.1016/j.joen.2022.12.010
- Pubchem, Trypsin, truy cập ngày 8 tháng 10 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội