Tixagevimab
Danh pháp
Tên chung quốc tế
Nhóm thuốc
Kháng thể đơn dòng kháng vi-rút
Mã ATC
J – Thuốc kháng khuẩn sử dụng có hệ thống
J06 – Huyết thanh miễn dịch và globulin miễn dịch
J06B – Imunoglobulin
J06BD – Kháng thể đơn dòng kháng vi-rút
J06BD03 — Tixagevimab và cilgavimab
Mã UNII
F0LZ415Z3B
Mã CAS
2420564-02-7
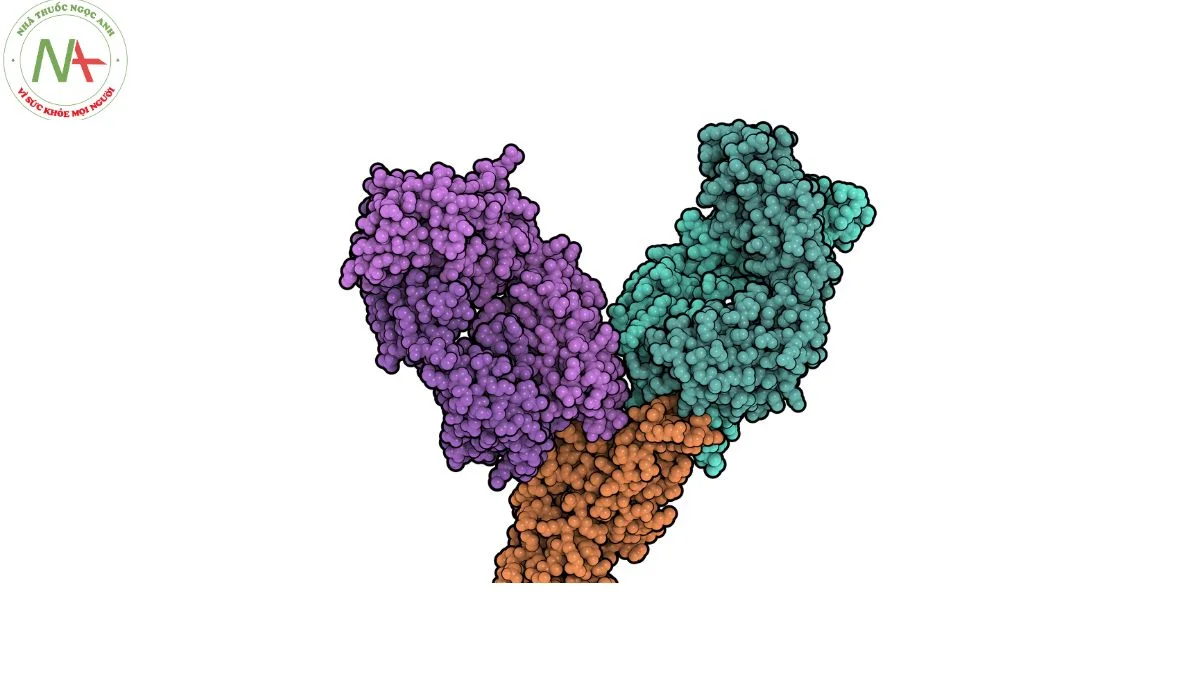
Cấu trúc phân tử
Tixagevimab là một kháng thể đơn dòng IgG1κ tái tổ hợp.
Dạng bào chế
Dung dịch tiêm Tixagevimab 100 mg/ml, Tixagevimab 150 mg / 1.5 mL
Độ ổn định và điều kiện bảo quản
Tixagevimab phải được bảo quản ở nhiệt độ 2-8 độ C trong tủ lạnh và không được đông lạnh. Tixagevimab cũng phải được bảo vệ khỏi ánh sáng và nhiệt độ cao.
Nếu có bất kỳ dấu hiệu nào cho thấy Tixagevimab bị biến đổi, như màu sắc, độ trong suốt, hoặc xuất hiện tạp chất, thuốc phải được vứt bỏ và không được tiêm cho bệnh nhân.
Nguồn gốc
Tixagevimab là một loại kháng thể đơn dòng nhân tạo được thiết kế để ngăn chặn sự lây nhiễm của virus SARS-CoV-2, gây ra bệnh COVID-19. Tixagevimab được phát hiện và phát triển bởi công ty dược phẩm AbCellera Biologics Inc. ở Canada, với sự hợp tác của Eli Lilly and Company.
Tixagevimab được chọn từ hàng triệu kháng thể được tạo ra bởi hệ thống miễn dịch của những người đã hồi phục từ COVID-19. Tixagevimab đã được thử nghiệm lâm sàng trên hàng nghìn bệnh nhân COVID-19 ở nhiều quốc gia và cho thấy hiệu quả cao trong việc giảm nguy cơ nhập viện và tử vong.
Tixagevimab cũng có thể kết hợp với các loại kháng thể khác để tăng cường hiệu quả điều trị. Tixagevimab đang chờ được cấp phép sử dụng khẩn cấp tại một số quốc gia.
Dược lý và cơ chế hoạt động
SARS-CoV-2, nguyên nhân chính của COVID-19, xâm nhập vào tế bào chủ bằng cách kết nối giữa protein đột biến (S) và enzyme ACE2 trên tế bào. Trong protein trimeric S, tiểu đơn vị S1 kết nối với ACE2 thông qua khu vực RBD, trong khi S2 đóng vai trò trung gian trong việc hợp nhất sau khi S1 tách ra. Qua các thử nghiệm lớn, kháng thể có khả năng trung hòa mạnh mẽ thường được tìm thấy từ tế bào B của những người từng nhiễm bệnh, và chúng kết nối với RBD của S1, ngăn chặn sự tương tác với ACE2.
Tixagevimab (AZD8895) là kháng thể tái tạo ở người dựa trên một kháng thể trung hòa từ bệnh nhân đã nhiễm SARS-CoV-2. Được điều chỉnh để kéo dài thời gian hoạt động và giảm tác động bên, Tixagevimab kết nối với một khu vực độc đáo của S1 RBD và chỉ kết nối khi protein S ở dạng “mở”. Thử nghiệm cho thấy Tixagevimab không gây độc cho tế bào và chủ yếu hoạt động bằng cách chặn sự tương tác RBD-ACE2. Nó chặn sự kết nối này với chỉ số IC50 là 0,32 nM và vô hiệu hóa virus với giá trị EC50 là 60,7 pM.
Tuy nhiên, như mọi liệu pháp kháng virut, có rủi ro các biến thể kháng thuốc có thể phát triển. Các thử nghiệm đã xác định một số biến thể có khả năng trở nên kháng lại cilgavimab. Tuy nhiên, không có biến thể nào được xác định là kháng lại tixagevimab hoặc sự kết hợp của cilgavimab và tixagevimab.
Ứng dụng trong y học
Trong lĩnh vực y học, Tixagevimab, khi kết hợp với cilgavimab, đã nhận được sự chấp thuận sử dụng khẩn cấp từ FDA để phòng tránh COVID-19 cho bệnh nhân trưởng thành và thanh thiếu niên từ 12 tuổi, nặng ít nhất 40 kg. Điều này áp dụng cho bệnh nhân chưa nhiễm SARS-CoV-2 hoặc đã tiếp xúc gần với người nhiễm, đồng thời mắc các tình trạng sức khỏe yếu, thuốc hoặc liệu pháp giảm miễn dịch hoặc không thể tiêm vắc xin COVID-19 do tiền sử có phản ứng không mong muốn.
Tại Hoa Kỳ, việc kết hợp tixagevimab và cilgavimab không được chấp thuận để điều trị hoặc dự phòng COVID-19 sau khi tiếp xúc. Nó cũng không thể thay thế cho việc tiêm chủng ngừa COVID-19. Những ai đã tiêm vắc xin COVID-19 và muốn điều trị này cần chờ ít nhất hai tuần.
Trong khi đó, tại Châu Âu và Canada, sự kết hợp của cilgavimab và tixagevimab đã được chấp thuận như một phương pháp dự phòng trước khi tiếp xúc với COVID-19 cho người trưởng thành và thanh thiếu niên từ 12 tuổi trở lên, nặng ít nhất 40 kg.
Dược động học
Hấp thu
Khi tiêm một lượng 150 mg Tixagevimab cùng với 150 mg cilgavimab, giá trị Cmax trung bình đạt 16,5 μg/mL với độ biến thiên là 35,6%. Thời gian Tmax trung bình đạt 14,0 ngày, nằm trong khoảng từ 3,1 đến 30 ngày. Giá trị quan sát sau 1, 150 và 210 ngày sau liều dược phẩm lần lượt là 4,4 μg/mL (độ biến thiên 92,2%), 6,6 μg/mL (25,6%) và 4,0 μg/mL (31,6%). AUC0-∞ cho liều này đạt 2529 μg*ngày/mL với độ biến thiên là 30,2%.
Phân bố
Dung tích phân bố của Tixagevimab được ước lượng ở mức 7,7 L, có độ lệch chuẩn là 1,97 L.
Chuyển hóa
Tixagevimab, một kháng thể đơn dòng, dự kiến sẽ bị thủy phân ở mức protein.
Thải trừ
Việc bài tiết Tixagevimab qua thận có vẻ khá khó khăn. Thời gian bán hủy của nó khoảng 87,9 ngày, với độ lệch chuẩn là 13,9 ngày. Độ thanh thải dự kiến của Tixagevimab đạt mức 0,062 L/ngày và có độ lệch chuẩn 0,019 L/ngày.
Phương pháp sản xuất
Để sản xuất Tixagevimab trong công nghiệp dược phẩm, các nhà khoa học sử dụng một quy trình gồm nhiều bước. Đầu tiên, họ tạo ra các tế bào nhân tạo có khả năng sản sinh Tixagevimab bằng cách chèn gen mã hóa kháng thể vào tế bào hamster Trung Quốc (CHO). Sau đó, họ nuôi cấy các tế bào này trong các bình chứa lớn có chứa dung dịch nuôi cấy, và thu kháng thể từ dung dịch này. Tiếp theo, họ làm sạch kháng thể bằng cách sử dụng các kỹ thuật lọc và cô đặc, và kiểm tra chất lượng của nó bằng các phương pháp phân tích sinh học. Cuối cùng, họ đóng gói kháng thể vào các ống tiêm hoặc chai lọ, và gửi đến các cơ sở y tế để sử dụng cho bệnh nhân.
Độc tính ở người
Tixagevimab có thể gây ra một số tác dụng phụ, nhưng chúng thường nhẹ và có thể được điều trị. Các tác dụng phụ phổ biến nhất là phản ứng liên quan đến tiêm, như đau, sưng, đỏ và ngứa ở vùng tiêm. Các tác dụng phụ khác có thể bao gồm sốt, nôn, đau đầu, mệt mỏi và phát ban. Các tác dụng phụ nghiêm trọng hơn, như phản vệ quá mẫn, viêm gan, suy thận và rối loạn đông máu, hiếm khi xảy ra. Bệnh nhân dùng quá liều có nguy cơ cao bị tác dụng phụ nghiêm trọng.
Tính an toàn
FDA của Hoa Kỳ đã thu hồi giấy phép sử dụng khẩn cấp cho tixagevimab và cilgavimab do kết quả không hiệu quả trước một số biến thể của SARS-CoV-2. Cả hai thuốc này là kháng thể đơn dòng nhằm chống lại vi rút SARS-CoV-2 – tác nhân gây ra COVID-19, chủ yếu được dùng làm phương pháp dự phòng cho những người có hệ thống miễn dịch yếu.
Đối với việc sử dụng trong giai đoạn cho con bú, hiện chưa có dữ liệu rõ ràng. Tuy nhiên, tixagevimab và cilgavimab là những phân tử protein lớn, do đó, lượng thuốc trong sữa mẹ có thể rất ít. Thêm vào đó, chúng có thể bị phân giải một cách đáng kể trong hệ tiêu hóa của trẻ, và sự hấp thụ vào cơ thể trẻ sẽ rất hạn chế. Cho tới khi có thêm thông tin, việc sử dụng tixagevimab và cilgavimab trong thời gian cho con bú cần được cân nhắc kỹ, đặc biệt đối với những bà mẹ đang nuôi con mới sinh hoặc trẻ sinh non.
Khi sử dụng cùng với cilgavimab, kết hợp này mang theo rủi ro về phản ứng dị ứng. Bác sĩ cần cẩn trọng khi kê đơn cho những bệnh nhân có giảm tiểu cầu hoặc có vấn đề về đông máu.
Bởi dữ liệu lâm sàng về sự kết hợp này vẫn còn giới hạn, nên cần đặc biệt quan tâm khi dùng cho bệnh nhân có nguy cơ về tim mạch hoặc tiền sử vấn đề tim.
Do kinh nghiệm về việc dùng kết hợp này chưa đầy đủ, có khả năng xuất hiện các tác dụng phụ nghiêm trọng không lường trước.
Tương tác với thuốc khác
Thuốc chống đông máu, như heparin, clopidogrel, warfarin, aspirin. Tixagevimab có thể làm tăng nguy cơ xuất huyết hoặc giảm khả năng đông máu của máu.
Thuốc chống virus, như remdesivir, favipiravir, oseltamivir. Tixagevimab có thể làm giảm hiệu quả của các thuốc này trong việc ngăn chặn sự nhân lên của virus SARS-CoV-2.
Thuốc ức chế miễn dịch, như corticosteroid, cyclosporine, tacrolimus. Tixagevimab có thể làm tăng nguy cơ nhiễm trùng hoặc suy giảm miễn dịch của bệnh nhân.
Lưu ý khi sử dụng Tixagevimab
Tixagevimab là một loại thuốc kháng thể đơn dòng được sử dụng để điều trị bệnh nhân nhiễm virus corona chủng mới (SARS-CoV-2) có nguy cơ cao bị nặng. Tixagevimab có thể giúp ngăn chặn virus lây lan trong cơ thể và làm giảm các triệu chứng của bệnh. Tuy nhiên, tixagevimab không phải là thuốc chữa bệnh và không thay thế cho các biện pháp phòng ngừa khác như đeo khẩu trang, rửa tay và tiêm vaccine. Khi sử dụng tixagevimab, cần lưu ý những điều sau:
- Tixagevimab chỉ được sử dụng khi có chỉ định của bác sĩ và phải được tiêm dưới sự giám sát của nhân viên y tế. Không nên tự mua hoặc sử dụng tixagevimab mà không có sự cho phép của bác sĩ.
- Tixagevimab được tiêm vào tĩnh mạch qua ống nội khí quản trong khoảng 1 giờ. Bệnh nhân cần ở lại bệnh viện ít nhất 1 giờ sau khi tiêm để theo dõi có biến chứng gì không. Một số biến chứng có thể xảy ra là phản ứng dị ứng, sốt, đau đầu, buồn nôn, tiêu chảy, đau bụng, hoặc viêm gan.
- Tixagevimab có thể tương tác với một số loại thuốc khác, do đó cần thông báo cho bác sĩ về tất cả các thuốc bạn đang dùng, kể cả thuốc kê đơn, thuốc không kê đơn, thực phẩm chức năng, hoặc thảo dược. Cũng cần hỏi bác sĩ về việc uống rượu hoặc các chất kích thích khác khi sử dụng tixagevimab.
- Tixagevimab có thể gây ảnh hưởng đến thai nhi hoặc thai kỳ, do đó cần nói với bác sĩ nếu bạn đang mang thai, có kế hoạch mang thai, hoặc cho con bú. Bạn cũng cần sử dụng biện pháp tránh thai hiệu quả trong khi và sau khi sử dụng tixagevimab.
- Tixagevimab có thể làm giảm khả năng miễn dịch, do đó cần tránh tiếp xúc với những người bị bệnh nhiễm trùng hoặc có triệu chứng cảm lạnh. Cũng cần theo dõi sức khỏe của mình và báo cho bác sĩ nếu có dấu hiệu nhiễm trùng như sốt, ho, khó thở, đau họng, mủ trong mắt, hoặc vết thương mủ.
Một vài nghiên cứu của Tixagevimab trong Y học
Tính nhạy cảm của các biến thể Omicron của SARS-CoV-2 với các kháng thể đơn dòng điều trị: Đánh giá hệ thống và phân tích tổng hợp
Các biến thể Omicron của SARS-CoV-2 chứa nhiều đột biến trong miền liên kết với thụ thể tăng đột biến, mục tiêu của tất cả các kháng thể đơn dòng (MAbs). Việc xác định mức độ mà các biến thể Omicron làm giảm độ nhạy cảm với MAb là rất quan trọng để ngăn ngừa và điều trị COVID-19.
Chúng tôi đã xem xét một cách có hệ thống PubMed và ba máy chủ in sẵn, được cập nhật lần cuối vào ngày 11 tháng 4 năm 2022, về hoạt động in vitro của các MAbs chống lại các biến thể Omicron.
Năm mươi mốt nghiên cứu đủ điều kiện, bao gồm 50 nghiên cứu chứa dữ liệu về độ nhạy cảm với Omicron BA.1 và 17 nghiên cứu chứa dữ liệu về độ nhạy cảm với Omicron BA.2.
Hai kết hợp MAb được cấp phép đầu tiên là bamlanivimab/etesevimab và casirivimab/imdevimab, phần lớn không có tác dụng đối với các biến thể Omicron BA.1 và BA.2.
Trong 34 nghiên cứu, sotrovimab cho thấy mức giảm trung bình 4,0 lần (phạm vi liên vùng [IQR]: 2,6 đến 6,9) trong hoạt động so với Omicron BA.1, và trong 12 nghiên cứu, nó cho thấy mức giảm trung bình 17 lần (IQR: 13 đến 30) hoạt tính chống lại Omicron BA.2.
Trong 15 nghiên cứu, sự kết hợp cilgavimab/tixagevimab cho thấy mức giảm trung bình 86 lần (IQR: 27 đến 151) trong hoạt động chống lại Omicron BA.1, và trong sáu nghiên cứu, nó cho thấy mức trung bình giảm 5,4 lần (IQR: 3,7 đến 6,9) hoạt tính chống lại Omicron BA.2.
Trong tám nghiên cứu chống lại Omicron BA.1 và sáu nghiên cứu chống lại Omicron BA.2, bebtelovimab cho thấy không có sự giảm hoạt động.
Kết quả khác nhau giữa các xét nghiệm là phổ biến. Đối với các MAb, kết quả 51/268 (19,0%) cho các biến thể kiểm soát kiểu hoang dã và kết quả 78/348 (22,4%) cho các biến thể Omicron BA.1 và BA.2 cao hơn 4 lần so với mức thấp hơn hoặc gấp 4 lần so với mức kết quả trung bình cho MAb đó.
Các kết quả có sự khác biệt lớn giữa các xét nghiệm được công bố cho thấy cần phải cải thiện tiêu chuẩn hóa xét nghiệm độ nhạy cảm MAb hoặc hiệu chuẩn giữa các xét nghiệm.
Kháng thể đơn dòng (MAbs) nhắm vào protein tăng đột biến của SARS-CoV-2 là một trong những biện pháp hiệu quả nhất để ngăn ngừa và điều trị COVID-19. Tuy nhiên, các biến thể Omicron của SARS-CoV-2 chứa nhiều đột biến trong các miền liên kết với thụ thể tăng đột biến, mục tiêu của tất cả các MAb. Do đó, việc xác định mức độ mà các biến thể Omicron làm giảm độ nhạy cảm với MAb là rất quan trọng để ngăn ngừa và điều trị COVID-19.
Chúng tôi đã xác định được 51 nghiên cứu báo cáo tính nhạy cảm in vitro của hai biến thể Omicron chính BA.1 và BA.2 với MAb điều trị trong quá trình phát triển lâm sàng nâng cao, bao gồm tám MAb riêng lẻ được cấp phép và ba kết hợp MAb được cấp phép.
Chúng tôi ước tính mức độ mà các MAb khác nhau thể hiện hoạt động giảm đi so với các biến thể Omicron. Sự mất hoạt động rõ rệt của nhiều MAb so với các biến thể Omicron nhấn mạnh tầm quan trọng của việc phát triển MAb nhắm vào các vùng tăng đột biến được bảo tồn. Các kết quả có sự khác biệt lớn giữa các xét nghiệm cho thấy sự cần thiết phải cải thiện tiêu chuẩn hóa xét nghiệm độ nhạy cảm với MAb.
Tài liệu tham khảo
- Drugbank, Tixagevimab, truy cập ngày 10 tháng 10 năm 2023.
- Tao, K., Tzou, P. L., Kosakovsky Pond, S. L., Ioannidis, J. P. A., & Shafer, R. W. (2022). Susceptibility of SARS-CoV-2 Omicron Variants to Therapeutic Monoclonal Antibodies: Systematic Review and Meta-analysis. Microbiology spectrum, 10(4), e0092622. https://doi.org/10.1128/spectrum.00926-22
- Pubchem, Tixagevimab, truy cập ngày 10 tháng 10 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội