Tirzepatide
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
20-[[(1R)-4-[2-[2-[2-[2-[2-[2-[[(5S)-5-[[(2S)-5-amino-2-[[(2S)-2-[[(2S,3S)-2-[[(2S)-6-amino-2-[[(2S)-2-[[(2S)-2-[[2-[[(2S,3S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S,3R)-2-[[(2S)-2-[[(2S,3R)-2-[[2-[[(2S)-2-[[2-[[(2S)-2-amino-3-(4-hydroxyphenyl)propanoyl]amino]-2-methylpropanoyl]amino]-4-carboxybutanoyl]amino]acetyl]amino]-3-hydroxybutanoyl]amino]-3-phenylpropanoyl]amino]-3-hydroxybutanoyl]amino]-3-hydroxypropanoyl]amino]-3-carboxypropanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-3-hydroxypropanoyl]amino]-3-methylpentanoyl]amino]-2-methylpropanoyl]amino]-4-methylpentanoyl]amino]-3-carboxypropanoyl]amino]hexanoyl]amino]-3-methylpentanoyl]amino]propanoyl]amino]-5-oxopentanoyl]amino]-6-[[(2S)-1-[[(2S)-1-[[(2S)-1-[[(2S)-5-amino-1-[[(2S)-1-[[(2S)-1-[[(2S,3S)-1-[[(2S)-1-[[2-[[2-[(2S)-2-[[(2S)-1-[[(2S)-1-[[2-[[(2S)-1-[(2S)-2-[(2S)-2-[(2S)-2-[[(2S)-1-amino-3-hydroxy-1-oxopropan-2-yl]carbamoyl]pyrrolidine-1-carbonyl]pyrrolidine-1-carbonyl]pyrrolidin-1-yl]-1-oxopropan-2-yl]amino]-2-oxoethyl]amino]-3-hydroxy-1-oxopropan-2-yl]amino]-3-hydroxy-1-oxopropan-2-yl]carbamoyl]pyrrolidin-1-yl]-2-oxoethyl]amino]-2-oxoethyl]amino]-1-oxopropan-2-yl]amino]-3-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-(1H-indol-3-yl)-1-oxopropan-2-yl]amino]-1,5-dioxopentan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]amino]-1-oxo-3-phenylpropan-2-yl]amino]-1-oxopropan-2-yl]amino]-6-oxohexyl]amino]-2-oxoethoxy]ethoxy]ethylamino]-2-oxoethoxy]ethoxy]ethylamino]-1-carboxy-4-oxobutyl]amino]-20-oxoicosanoic acid
Nhóm thuốc
Thuốc điều trị đái tháo đường
Mã ATC
A – Đường tiêu hóa và trao đổi chất
A10 – Thuốc điều trị đái tháo đường
A10B – Thuốc hạ đường huyết, không bao gồm insulin
A10BX – Thuốc hạ đường huyết khác, không bao gồm insulin
A10BX16 – Tirzepatide
Mã UNII
OYN3CCI6QE
Mã CAS
2023788-19-2
Cấu trúc phân tử
Công thức phân tử
C225H348N48O68
Phân tử lượng
4813
Cấu trúc phân tử
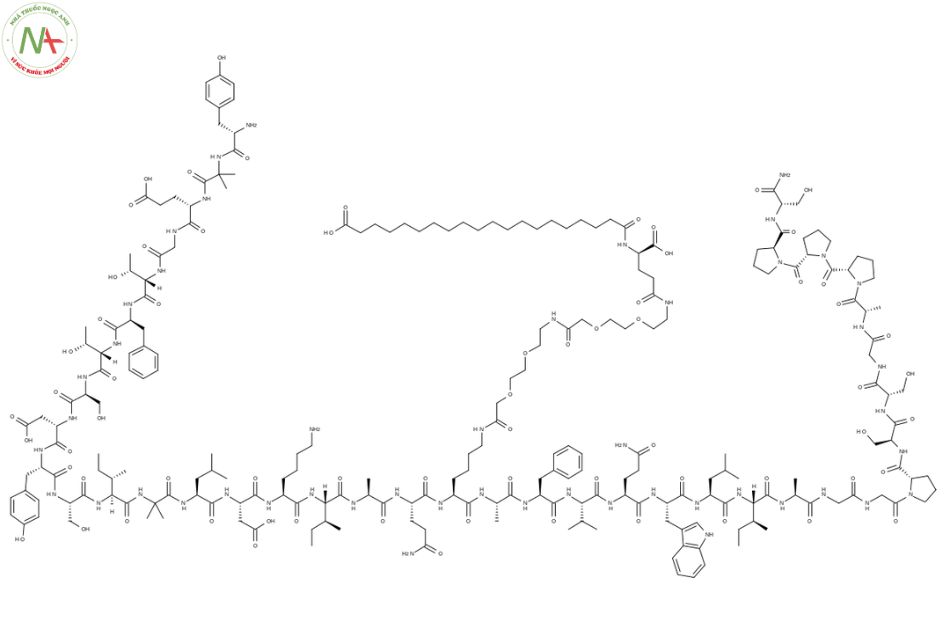
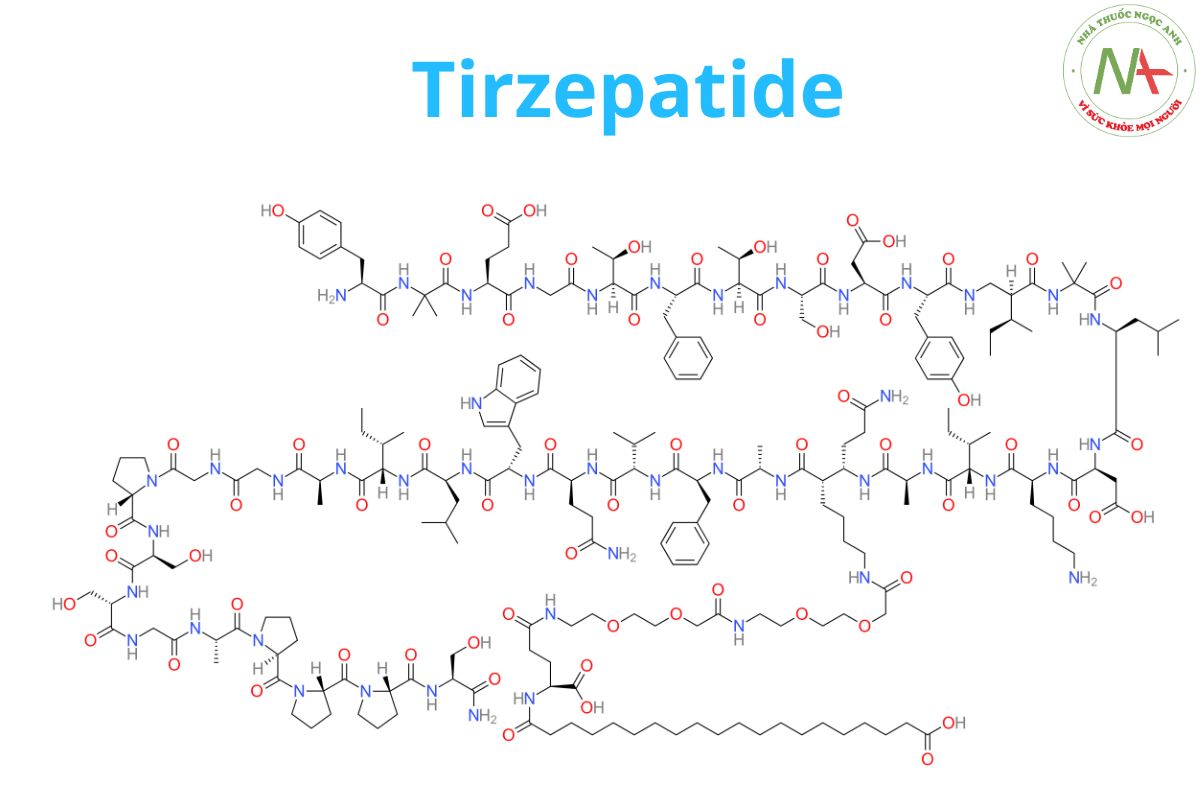
Tirzepatide là một polypeptide mạch thẳng gồm 39 axit amin được liên hợp với gốc diacid béo C20 thông qua một trình tự liên kết được kết nối với lysine -20.
Các tính chất phân tử
Số liên kết hydro cho: 58
Số liên kết hydro nhận: 70
Số liên kết có thể xoay: 163
Diện tích bề mặt tôpô: 1790 Ų
Số lượng nguyên tử nặng: 341
Các tính chất đặc trưng
Độ tan trong nước: <1mg/mL
Chu kì bán hủy: 5 ngày
Khả năng liên kết với Protein huyết tương: 99%
Cảm quan
Dạng bào chế
Dung dịch tiêm: 5 mg/5 ml, 7.5 mg/5 ml, 10 mg/5 ml, 12.5 mg/5 ml, 15 mg/5 ml.
Độ ổn định và điều kiện bảo quản
Các chế phẩm tirzepatide nên được bảo quản kín, trong tủ lạnh ở 2°C đến 8°C. Nếu cần, có thể được bảo quản không làm lạnh ở nhiệt độ không quá 30ºC trong tối đa 21 ngày.
Nguồn gốc
Eli Lilly và Công ty lần đầu tiên đăng ký bằng sáng chế cho tirzepatide vào đầu năm 2016 và được công bố vào cuối năm đó. Sau khi vượt qua các thử nghiệm lâm sàng giai đoạn III, Lilly đã nộp đơn xin phê duyệt cho FDA vào tháng 10 năm 2021 với phiếu xem xét ưu tiên và được chấp thuận vào ngày 13 tháng 5 năm 2022 để điều trị cho người lớn mắc bệnh đái tháo đường typ 2. Điều này khiến tirzepatide trở thành chất chủ vận thụ thể GIP và GLP-1 đầu tiên và duy nhất cho chỉ định này.
Dược lý và cơ chế hoạt động
Tirzepatide là một peptide tổng hợp có tác dụng hạ đường huyết, hoạt động bằng cách kích thích tiết insulin giai đoạn đầu và giai đoạn hai, đồng thời làm giảm nồng độ glucagon, cả hai đều phụ thuộc vào glucose. Tirzepatide cũng được chứng minh là làm chậm quá trình làm rỗng dạ dày, giảm nồng độ glucose lúc đói và sau ăn, giảm lượng thức ăn và giảm trọng lượng cơ thể ở bệnh nhân đái tháo đường typ 2. Ngoài ra, tirzepatide có thể làm tăng độ nhạy insulin.
Các thụ thể peptide-1 (GLP-1) giống glucagon (GLP-1R) được biểu hiện khắp cơ thể, bao gồm các tế bào beta tuyến tụy và đường tiêu hóa. Chúng có liên quan đến sinh lý bệnh của đái tháo đường typ 2 vì tín hiệu GLP-1R liên quan đến kiểm soát glucose bằng cách tăng cường tiết insulin được kích thích bằng glucose, trì hoãn quá trình vận chuyển dạ dày, giảm nồng độ glucagon trong huyết tương và giảm trọng lượng cơ thể bằng cách kích hoạt các con đường gây chán ăn trong não.
Cả polypeptide insulinotropic phụ thuộc glucose (GIP) và GLP-1 đều là các hormone peptide liên quan đến cân bằng nội môi glucose: chúng thúc đẩy bài tiết insulin được kích thích bằng glucose từ các tế bào beta của tuyến tụy. Tuy nhiên, GIP là hormone incretin chính có tác dụng hướng insulin để đáp ứng với lượng thức ăn đưa vào.
Cơ chế hoạt động chính xác của tirzepatide chưa được làm rõ hoàn toàn; tuy nhiên, sự đồng vận kép ở GIP và GLP-1R có thể góp phần vào tác dụng kiểm soát đường huyết và cân nặng của thuốc. Các nghiên cứu đã chứng minh rằng việc sử dụng đồng thời GIP và chất chủ vận GLP-1R làm tăng đáng kể phản ứng insulin và ức chế tiết glucagon so với việc sử dụng riêng lẻ từng loại hormone.
Tirzepatide liên kết với GIP và GLP-1R với ái lực cao. In vitro, tirzepatide có ái lực gắn kết thụ thể GIP tương đương với GIP tự nhiên và ái lực với GLP-1R thấp hơn năm lần so với GLP-1 tự nhiên. Tirzepatide kích hoạt mạnh con đường truyền tín hiệu GLP-1R để kích thích bài tiết insulin phụ thuộc glucose thông qua hoạt động ở thụ thể GIP (GIPR) hoặc GLP-1R.
Tuy nhiên, vai trò của chủ vận GIPR trong cơ chế hoạt động của thuốc cần được nghiên cứu thêm, vì bằng chứng về chủ vận GIPR đối với kiểm soát đường huyết và cân nặng trong các nghiên cứu lâm sàng và tiền lâm sàng còn mâu thuẫn nhau.
Ứng dụng trong y học
Tirzepatide là một polypeptide insulinotropic phụ thuộc glucose kép (GIP) và chất chủ vận thụ thể peptide-1 (GLP-1) giống glucagon, được chỉ định như một chất hỗ trợ cho chế độ ăn kiêng và tập thể dục để cải thiện kiểm soát đường huyết ở người lớn mắc bệnh đái tháo đường týp 2. Tuy nhiên, tirzepatide không được chỉ định sử dụng cho bệnh nhân đái tháo đường týp 1.
Chất chủ vận GIP/GLP-1 kép ngày càng được chú ý vì là tác nhân trị liệu mới để kiểm soát đường huyết và cân nặng khi chúng chứng tỏ khả năng kiểm soát glucose và giảm cân tốt hơn so với chất chủ vận thụ thể GLP-1 chọn lọc trong các thử nghiệm lâm sàng và tiền lâm sàng.
Ở châu Âu, tirzepatide có thể được sử dụng đơn trị liệu hoặc kết hợp với các loại thuốc khác dùng để điều trị bệnh đái tháo đường.
Một phân tích tổng hợp vào năm 2021 đã cho thấy trong hơn một năm sử dụng lâm sàng, tirzepatide có hiệu quả vượt trội so với dulaglutide, semaglutide, degludec và insulin glargine về tác dụng kiểm soát đường huyết và giảm béo phì.
Dược động học
Hấp thu
Trong khoảng liều 1-5 mg, Cmax của tirzepatide nằm trong khoảng từ 108 đến 397 ng/mL. Sinh khả dụng tuyệt đối trung bình của tirzepatide sau khi tiêm dưới da là 80%. Sau khi tiêm dưới da, Tmax dao động từ 8 đến 72 giờ. Nồng độ huyết tương ở trạng thái ổn định đạt được sau bốn tuần tiêm dưới da mỗi tuần một lần.
Phân bố
Sau khi tiêm dưới da, thể tích phân bố trung bình ở trạng thái ổn định là 9,5 L. Thể tích phân bố trung bình ở trạng thái ổn định biểu kiến của tirzepatide sau khi tiêm dưới da ở bệnh nhân đái tháo đường typ 2 là khoảng 10,3 L.
Vì peptit được liên hợp với nửa diacid béo C20 thông qua một liên kết ưa nước ở gốc lysine ở vị trí 20, nên tirzepatide liên kết cao với albumin trong huyết tương (99%), giúp kéo dài thời gian bán hủy của nó.
Chuyển hóa
Tirzepatide được chuyển hóa bằng cách phân tách protein của khung peptide, quá trình oxy hóa beta của gốc diacid béo C20 và thủy phân amit.
Thải trừ
Tirzepatide được bài tiết chủ yếu qua nước tiểu và phân, chủ yếu ở dạng chất chuyển hóa. Thời gian bán hủy là khoảng 5 ngày.
Độ thanh thải trung bình biểu kiến của tirzepatide là 0,061 L/h. Độ thanh thải biểu kiến ở trạng thái ổn định trung bình của tirzepatide là 0,056 L/h.
Phương pháp sản xuất
Quá trình tổng hợp tirzepatide lần đầu tiên được mô tả trong bằng sáng chế do Eli Lilly và Công ty đệ trình. Theo đó, họ đã sử dụng phương pháp tổng hợp peptit pha rắn tiêu chuẩn, với nhóm bảo vệ allyloxycacbonyl trên lysine ở vị trí 20 của chuỗi axit amin tuyến tính, cho phép tập hợp các biến đổi hóa học cuối cùng. Sau đó, amin chuỗi bên của lysine được tạo dẫn xuất với đoạn chứa lipid, thu được tirzepatide.
Độc tính ở người
Các thông tin về LD50 và quá liều tirzepatide còn hạn chế. Trong trường hợp quá liều, nên bắt đầu điều trị hỗ trợ thích hợp với đủ thời gian để theo dõi và điều trị, vì tirzepatide có thời gian bán hủy dài.
Các tác dụng phụ phổ biến nhất của tirzepatide bao gồm buồn nôn, nôn, tiêu chảy, chán ăn, táo bón, khó chịu vùng bụng trên và đau bụng .
Tính an toàn
Thời kỳ mang thai
Dữ liệu hiện có về việc sử dụng tirzepatide ở phụ nữ mang thai là không đủ để đánh giá nguy cơ dị tật bẩm sinh nghiêm trọng, sảy thai hoặc các kết quả bất lợi khác cho mẹ hoặc thai nhi liên quan đến thuốc. Có những rủi ro đối với mẹ và thai nhi liên quan đến bệnh đái tháo đường được kiểm soát kém trong thai kỳ.
Dựa trên các nghiên cứu về khả năng sinh sản trên động vật, có thể có rủi ro đối với thai nhi khi tiếp xúc với tirzepatide trong thời kỳ mang thai. Tirzepatide chỉ nên được sử dụng trong thời kỳ mang thai nếu lợi ích tiềm năng lớn hơn nguy cơ tiềm ẩn đối với thai nhi.
Thời kỳ cho con bú
Không có thông tin về việc sử dụng tirzepatide trên lâm sàng trong thời kỳ cho con bú. Vì tirzepatide là một phân tử peptide có trọng lượng lớn nên lượng trong sữa có thể thấp và khả năng hấp thụ khó xảy ra vì nó có thể bị phá hủy một phần trong đường tiêu hóa của trẻ sơ sinh. Tuy nhiên, vẫn nên thận trọng khi sử dụng tirzepatide trong thời kỳ cho con bú, đặc biệt là khi đang nuôi trẻ sơ sinh hoặc trẻ sinh non.
Trẻ em
Tính an toàn và hiệu quả của tirzepatide chưa được thiết lập ở bệnh nhi (dưới 18 tuổi).
Người cao tuổi
Không có sự khác biệt tổng thể nào về tính an toàn hoặc hiệu quả của tirzepatide được phát hiện giữa những bệnh nhân cao tuổi và bệnh nhân trẻ tuổi hơn, nhưng không thể loại trừ khả năng nhạy cảm cao hơn ở một số người lớn tuổi.
Suy gan
Không khuyến cáo điều chỉnh liều lượng tirzepatide cho bệnh nhân suy gan. Trong một nghiên cứu dược lý lâm sàng ở những đối tượng có mức độ suy gan khác nhau, không quan sát thấy sự thay đổi dược động học của tirzepatide.
Suy thận
Không khuyến cáo điều chỉnh liều lượng tirzepatide cho bệnh nhân suy thận. Ở những đối tượng bị suy thận bao gồm bệnh thận giai đoạn cuối (ESRD), không quan sát thấy sự thay đổi nào về dược động học của tirzepatide. Tuy nhiên, cần theo dõi chức năng thận khi bắt đầu hoặc tăng liều tirzepatide ở bệnh nhân suy thận vì đã có báo cáo các phản ứng bất lợi nghiêm trọng về đường tiêu hóa.
Ung thư
Một nghiên cứu về khả năng gây ung thư kéo dài 2 năm đã được tiến hành với tirzepatide ở chuột cống đực và cái ở liều 0,15, 0,50 và 1,5 mg/kg (0,1-, 0,4- và 1 lần MRHD là 15 mg mỗi tuần một lần dựa trên AUC) được dùng bằng cách tiêm dưới da hai lần mỗi tuần.
Sự gia tăng đáng kể về mặt thống kê của u tuyến tế bào C tuyến giáp đã được quan sát thấy ở những con đực (≥0,5 mg/kg) và con cái (≥0,15 mg/kg), và sự gia tăng đáng kể về mặt thống kê của u tuyến giáp kết hợp với tế bào C tuyến giáp đã được quan sát thấy ở cả 2 giống trong tất cả các liều kiểm tra.
Trong một nghiên cứu kéo dài 6 tháng về khả năng gây ung thư ở chuột biến đổi gen rasH2, tirzepatide ở liều 1, 3 và 10 mg/kg tiêm dưới da hai lần mỗi tuần, không phát hiện thấy khối u.
Đột biến
Tirzepatide không gây độc gen trong xét nghiệm vi nhân tủy xương chuột.
Tương tác với thuốc khác
Vì tirzepatide làm chậm quá trình làm rỗng dạ dày nên nó có khả năng ảnh hưởng đến sự hấp thu của các thuốc uống dùng đồng thời. Thông tin kê đơn của Hoa Kỳ khuyến cáo nên thận trọng khi sử dụng đồng thời tirzepatide với các loại thuốc uống khác.
Sử dụng đồng thời tirzepatide với thuốc kích thích tiết insulin hoặc insulin có thể làm tăng nguy cơ hạ đường huyết, bao gồm hạ đường huyết nghiêm trọng. Do đó, có thể cần phải giảm liều thuốc kích thích bài tiết insulin hoặc insulin.
Sử dụng tirzepatide có thể làm giảm hiệu quả của thuốc tránh thai nội tiết tố do làm chậm quá trình làm rỗng dạ dày. Sự kéo dài này rõ rệt nhất sau liều đầu tiên và giảm dần theo thời gian. Do đó, bệnh nhân sử dụng thuốc tránh thai nội tiết uống nên chuyển sang phương pháp tránh thai không uống hoặc thêm biện pháp tránh thai rào cản trong 4 tuần sau khi bắt đầu và trong 4 tuần sau mỗi lần tăng liều với tirzepatide.
Lưu ý khi sử dụng Tirzepatide
Tirzepatide không nên được sử dụng ở những người có tiền sử hoặc gia đình mắc bệnh ung thư tuyến giáp thể tủy hoặc những người mắc hội chứng đa u nội tiết loại 2.
Tirzepatide có thể gây ra khối u tế bào C tuyến giáp ở chuột và chưa được xác định có liên quan đến con người hay không. Do đó, người bệnh cần đi khám bác sĩ nếu xuất hiện các triệu chứng của khối u tuyến giáp (ví dụ: khối u ở cổ, khàn giọng kéo dài, khó nuốt hoặc khó thở).
Viêm tụy đã được báo cáo trong các thử nghiệm lâm sàng của tirzepatide, do đó cần ngừng thuốc ngay nếu nghi ngờ viêm tụy.
Tirzepatide có thể gây ra các phản ứng bất lợi ở đường tiêu hóa, đôi khi nghiêm trọng. Thuốc chưa được nghiên cứu ở những bệnh nhân mắc bệnh đường tiêu hóa nặng và do đó không được khuyến cáo ở những bệnh nhân này.
Bệnh túi mật cấp tính đã xảy ra trong các thử nghiệm lâm sàng. Nếu nghi ngờ sỏi mật, cần nghiên cứu túi mật và theo dõi lâm sàng ở các bệnh nhân này.
Người bệnh cần ngừng thuốc và đi khám bác sĩ nếu có thay đổi về thị lực trong quá trình điều trị bằng tirzepatide.
Một vài nghiên cứu của Tirzepatide trong Y học
Hiệu quả và độ an toàn của Twincretin tirzepatide mới, một chất chủ vận kép thụ thể GIP và GLP-1 trong việc quản lý bệnh đái tháo đường typ 2
Cơ sở: Cho đến nay, không có phân tích tổng hợp Cochrane nào phân tích hiệu quả và độ an toàn của tirzepatide trong bệnh đái tháo đường loại 2. Phân tích tổng hợp này được thực hiện để giải quyết lỗ hổng kiến thức này.
Phương pháp: Cơ sở dữ liệu điện tử đã được tìm kiếm cho các thử nghiệm ngẫu nhiên có kiểm soát (RCT) liên quan đến những người mắc bệnh đái tháo đường dùng tirzepatide so với giả dược/thuốc so sánh có hoạt tính. Kết cục chính là đánh giá những thay đổi về HbA1c. Kết quả phụ là đánh giá sự thay đổi đường huyết, mục tiêu đường huyết, cân nặng, lipid và các biến cố bất lợi.
Kết quả: Từ 34 bài báo được sàng lọc ban đầu, dữ liệu từ sáu RCT liên quan đến 3484 bệnh nhân đã được phân tích.
Trong 12-52 tuần, những người dùng tirzepatide đã giảm HbA1c nhiều hơn đáng kể [chênh lệch trung bình (MD) = -0,75% (khoảng tin cậy 95% (CI): -1,05 đến -0,45); p <0,01; I2 = 100%], đường huyết lúc đói [MD = -0,75 mmol/L (KTC 95%: -1,05 đến -0,45); p <0,01; I2 = 100%], glucose sau ăn 2 giờ [MD = -0,87 mmol/L (KTC 95%: -1,12 đến -0,61); p <0,01; I2 = 99%], cân nặng [MD = -8,63 kg (KTC 95%: -12,89 đến -4,36); p <0,01; I2 = 100%], chỉ số khối cơ thể [MD = -1,80 kg/m 2 (KTC 95%: -2,39 đến -1,21); p <0,01; I2 = 99%] và vòng eo [MD = -4,43 cm (KTC 95%: -5,31 đến -3,55); p <0,01; I2 = 95%] so với dulaglutide, semaglutide, degludec hoặc glargine.
Bệnh nhân dùng tirzepatide có tỷ lệ cao hơn để đạt được HbA1c <6,5% so với nhóm chứng tích cực [tỷ lệ chênh lệch (OR) = 4,39 (KTC 95%: 2,44-7,92); p <0,01; I2 = 90%]. Sử dụng Tirzepatide có tỷ lệ giảm cân cao hơn đáng kể >5% [OR = 19,18 (KTC 95%: 2,34-157,17); p <0,01; I2 = 99%], >10% [OR = 21,40 (KTC 95%: 2,36-193,94); p <0,01; I2 = 98%], và >15% [OR = 32,84 (KTC 95%: 2,27-474,33); P = 0,01; I2 = 96%] so với nhóm chứng chủ động.
Các biến cố bất lợi xuất hiện trong điều trị [tỷ lệ rủi ro (RR) = 1,43 (KTC 95%: 1,14-1,80); p <0,01; I2 = 40%] và các tác dụng phụ nghiêm trọng [RR = 1,00 (KTC 95%: 0,64-1,57); P = 1,00; I2 = 49%] không khác nhau.
Tính không đồng nhất của dữ liệu cao và sự hiện diện của khuynh hướng xuất bản đã hạn chế việc phân loại dữ liệu hiện tại từ “trung bình đến thấp”.
Kết luận: Tirzepatide có hiệu quả đường huyết ấn tượng và dữ liệu giảm cân trong 1 năm sử dụng lâm sàng. Tuy nhiên, nhu cầu về bằng chứng cấp độ cao hơn, hiệu quả lâu dài và dữ liệu an toàn của tirzepatide vẫn cần được nghiên cứu.
Tài liệu tham khảo
- Dutta D, Surana V, Singla R, Aggarwal S, Sharma M. Efficacy and safety of novel twincretin tirzepatide a dual GIP and GLP-1 receptor agonist in the management of type-2 diabetes: A Cochrane meta-analysis. Indian J Endocrinol Metab. 2021 Nov-Dec;25(6):475-489. doi: 10.4103/ijem.ijem_423_21. Epub 2022 Feb 17. PMID: 35355921; PMCID: PMC8959203.
- Drugbank, Tirzepatide, truy cập ngày 14 tháng 4 năm 2023.
- Pubchem, Tirzepatide, truy cập ngày 14 tháng 4 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
