Tenofovir
Biên soạn và Hiệu đính
Dược sĩ Phan Hữu Xuân Hạo – Khoa Dược, Trường Y Dược – Đại học Duy Tân.
Danh pháp
Tên chung quốc tế: Tenofovir .
Tên khác: PMPA, Truvada, Apropovir
Tên IUPAC: [(2 R ) -1- (6-aminopurin-9-yl) propan-2-yl] axit oxymethylphosphonic.
Loại thuốc: Thuốc ức chế men sao chép ngược.
Mã ATC:
J – Kháng khuẩn tác dụng toàn thân
J05 – Thuốc chống Virus dùng toàn thân
J05A – Thuốc chống Virus trực tiếp
J05AF – Các chất ức chế Enzym phiên mã ngược Nucleosid
J05AF07 – tenofovir disoproxil
Mã Cas: 147127-20-6
Mã Unii: W4HFE001U5
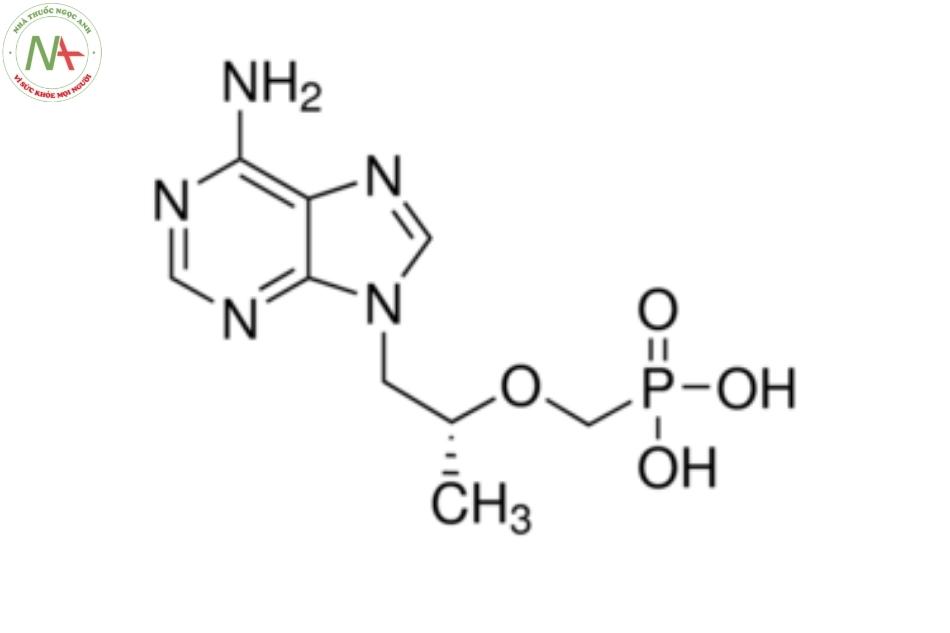
Cấu trúc phân tử
Công thức hóa học:
C9H14N5O4P
Phân tử lượng trung bình
287,21 ( g/mol)
Cấu trúc phân tử
Tenofovir (khan) thuộc nhóm axit photphonic là axit metylphosphonic, trong đó một trong các metyl hydro được thay thế bằng [(2R) -1- (6-amino-9H-purin-9-yl) propan- 2-yl] nhóm oxy.
Dạng bào chế:
Bột uống (40 mg/g);
Viên uống 150 mg; 200 mg; 25 mg; 250 mg; 300 mg
Các tính chất đặc trưng
Tenofovir là một chất tương tự diester nucleotide mạch hở của adenosine monophosphate.Nó có một nhóm photphat liên kết với bazơ nitơ, nó được xác định là một chất tương tự nucleotit thực tế. Các hoạt động kháng vi-rút của tenofovir được báo cáo lần đầu tiên vào năm 1993 và tác nhân này đã được bán trên thị trường từ năm 2008 dưới dạng tenofovir disoproxil và tenofovir alafenamide để thu được sinh khả dụng qua đường uống.
Trọng lượng phân tử chính xác: 287.07834094 (g/mol)
Diện tích bề mặt cực Topo: 136 Ų
Số lượng nguyên tử nặng: 19
Điểm sôi: 616 ºC ở 760 mmHg
Điểm nóng chảy: 297ºC
Độ hòa tan: 13,4 mg / ml
Hằng số phân ly pKa: 3,8 và 6,7
Chu kì bán hủy: 32 giờ
Khả năng liên kết với Protein huyết tương: Tenofovir liên kết yếu với protein huyết tương và chỉ khoảng 7,2% liều dùng ở trạng thái liên kết.
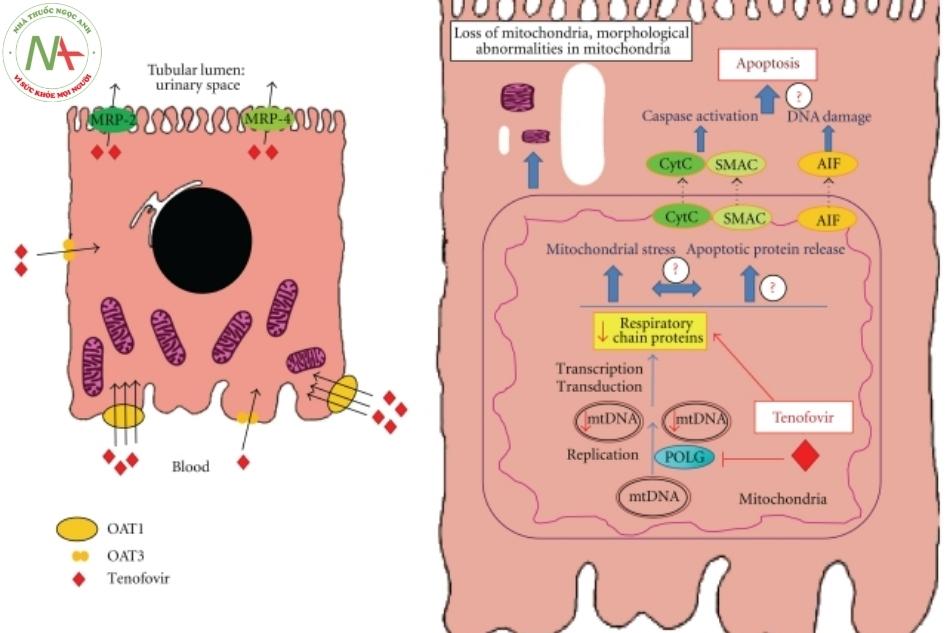
Cơ chế hoạt động
Một khi tenofovir được kích hoạt bởi phản ứng phosphoryl hóa sinh học, nó sẽ hoạt động như một phosphonate nucleoside acyclic kháng vi-rút. Nó là một chất ức chế mạnh đối với men sao chép ngược của virus với hằng số ức chế xấp xỉ 0,022 micromolar.
Khi được hoạt hóa, tenofovir hoạt động theo nhiều cơ chế khác nhau trong đó ức chế polymerase của virus gây ra sự ức chế tổng hợp virus và kết thúc chuỗi. Tất cả những hoạt động này đạt được nhờ sự cạnh tranh của nó với deoxyadenosine 5′-triphosphate trong thế hệ DNA của virus mới. Khi tenofovir được kết hợp trong chuỗi, để ức chế sự nhân lên của virus nó gây ra sự kết thúc chuỗi. Tính an toàn của tenofovir là do ái lực của nó thấp đối với polymerase DNA của tế bào bao gồm cả gamma DNA polymerase của ty thể.
Vai trò của Tenofovir trong y học
Tenofovir đóng một vai trò đặc biệt quan trọng đối với những bệnh nhân đồng nhiễm virus gây bệnh gan. Tenofovir có thể là một lựa chọn tốt để thay thế một chất tương tự nucleoside khác để tránh hoặc đảo ngược một số độc tính ở những bệnh nhân có kiểm soát virus học tốt. Thay thế các chất tương tự thymidine cho Tenofovir cải thiện cấu trúc lipid và tạo ra sự phục hồi một phần mỡ dưới da. Do đặc điểm đề kháng với Tenofovir, thuốc này tiếp tục hoạt động ở hầu hết các bệnh nhân bị một hoặc thậm chí một số trường hợp thất bại trong điều trị.
Tenofovir là một loại thuốc được sử dụng rộng rãi trong thực hành lâm sàng do sự kết hợp tuyệt vời giữa hiệu quả, độ bền và khả năng dung nạp, ngoài việc dễ sử dụng với một liều duy nhất hàng ngày, dù là trong công thức riêng lẻ của nó (Viread Thay thế các chất tương tự thymidine cho Tenofovir cải thiện cấu trúc lipid và tạo ra sự phục hồi một phần mỡ dưới da. Do đặc điểm đề kháng với Tenofovir, thuốc này tiếp tục hoạt động ở hầu hết các bệnh nhân bị một hoặc thậm chí một số trường hợp thất bại trong điều trị.
Độc tính ở người
Hiện tại chưa có báo cáo về LD50 của hợp chất gốc cũng như ảnh hưởng của việc dùng quá liều. Tuy nhiên, dựa trên các báo cáo với dẫn xuất chuyển hóa nhanh nhất thành tenofovir, tenofovir disoproxil, nên theo dõi bệnh nhân dùng quá liều.
Ngoài ra, tenofovir được biết là dễ dàng được loại bỏ hiệu quả bằng thẩm tách máu.
Sử dụng tenofovir liều cao đã được báo cáo là gây ra độc tính trên xương như nhuyễn xương và giảm mật độ khoáng của xương và gây ra độc tính thận ở một mức độ nào đó.
Tương tác với các thuốc khác
Có hơn 800 thuốc/ nhóm thuốc được tán thành là có tương tác với Tenofovir , dưới đây là 25 thuốc/ nhóm thuốc điển hình được đưa ra trên thực nghiệm.
| Alminoprofen | Alminoprofen có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Apramycin | Apramycin có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Brefeldin A | Nồng độ trong huyết thanh của Tenofovir có thể tăng lên khi nó được kết hợp với Brefeldin A. |
| Buthiazide | Buthiazide có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Carbaspirin canxi | Carbaspirin canxi có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Cefacetrile | Cefacetrile có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Cefaloridine | Cefaloridine có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Clofenamide | Clofenamide có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Clonixin | Clonixin có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Clopamide | Clopamide có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Clorexolone | Clorexolone có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Dexniguldipine | Nồng độ trong huyết thanh của Tenofovir có thể được tăng lên khi nó được kết hợp với Dexniguldipine. |
| Difenpiramide | Difenpiramide có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Dimetacrine | Tenofovir có thể làm giảm tốc độ bài tiết của Dimetacrine, dẫn đến nồng độ thuốc trong huyết thanh cao hơn. |
| Efonidipine | Efonidipine có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Etofenamate | Etofenamate có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Fenquizone | Fenquizone có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Mefruside | Mefruside có thể làm tăng tốc độ bài tiết của Tenofovir, điều này có thể làm giảm nồng độ thuốc trong huyết thanh và có khả năng làm giảm hiệu quả. |
| Neamine | Neamine có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Nifenazone | Nifenazone có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Axit niflumic | Axit niflumic có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Taxifolin | Taxifolin có thể làm giảm tốc độ bài tiết của Tenofovir, điều này có thể dẫn đến nồng độ trong huyết thanh cao hơn. |
| Tenidap | Tenidap có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
| Toloxatone | Tenofovir có thể làm giảm tốc độ bài tiết của Toloxatone, điều này có thể dẫn đến nồng độ trong huyết thanh cao hơn. |
| Zaltoprofen | Zaltoprofen có thể làm tăng các hoạt động gây độc cho thận của Tenofovir. |
Độ ổn định và bảo quản
Bảo quản trong lọ kín ở nhiệt độ 15 – 30 °C
Một vài nghiên cứu về Tenofovir trong y học
Tenofovir so với giả dược để ngăn ngừa sự lây truyền qua chu sinh của bệnh viêm gan B. Phụ nữ mang thai có tải lượng vi rút viêm gan B (HBV) cao có nguy cơ truyền bệnh cho con của họ, mặc dù trẻ sơ sinh đã nhận được globulin miễn dịch viêm gan B.
Phương pháp
Trong thử nghiệm lâm sàng mù đôi, đa trung tâm này được thực hiện ở Thái Lan, chúng tôi chỉ định ngẫu nhiên các phụ nữ mang thai dương tính với kháng nguyên viêm gan B (HBeAg) có mức alanin aminotransferase từ 60 IU trở xuống mỗi lít để nhận tenofovir disoproxil fumarate (Tenofovir) hoặc giả dược từ 28 tuần tuổi thai đến 2 tháng sau sinh. Trẻ sơ sinh được tiêm globulin miễn dịch viêm gan B khi mới sinh và vắc-xin viêm gan B khi mới sinh và 1, 2, 4 và 6 tháng. Điểm kết thúc chính là tình trạng dương tính với kháng nguyên bề mặt viêm gan B (HBsAg) ở trẻ sơ sinh, được xác nhận bởi mức HBV DNA khi trẻ được 6 tháng tuổi. Chúng tôi tính toán rằng một mẫu gồm 328 phụ nữ sẽ cung cấp cho thử nghiệm 90% sức mạnh để phát hiện sự khác biệt ít nhất là 9 điểm phần trăm trong tốc độ truyền (tỷ lệ mong đợi, 3% ở nhóm Tenofovir so với 12% ở nhóm giả dược).
Kết quả
Từ tháng 1 năm 2013 đến tháng 8 năm 2015, chúng tôi đã tuyển sinh 331 phụ nữ; 168 phụ nữ được phân ngẫu nhiên vào nhóm Tenofovir và 163 phụ nữ vào nhóm giả dược. Khi nhập học, tuổi thai trung bình là 28,3 tuần và mức HBV DNA trung bình là 8,0 log 10 IU trên mililit. Trong số 322 ca sinh nở (97% số người tham gia), có 319 ca sinh đơn, hai cặp song sinh và một thai chết lưu. Thời gian trung bình từ khi sinh đến khi tiêm globulin miễn dịch viêm gan B là 1,3 giờ, và thời gian trung bình từ khi sinh đến khi tiêm vắc-xin viêm gan B là 1,2 giờ. Trong phân tích ban đầu, không có trẻ nào trong số 147 trẻ (0%; khoảng tin cậy 95% [CI], 0 đến 2) trong nhóm Tenofovir bị nhiễm bệnh, so với 3 trong số 147 trẻ (2%; KTC 95%, 0 đến 6 ) trong nhóm giả dược (P = 0,12). Tỷ lệ các tác dụng ngoại ý không có sự khác biệt đáng kể giữa các nhóm. Tỷ lệ có mức alanin aminotransferase ở người mẹ trên 300 IU mỗi lít sau khi ngừng phác đồ thử nghiệm là 6% ở nhóm Tenofovir và 3% ở nhóm giả dược (P = 0,29).
Kết luận
Trong bối cảnh tỷ lệ lây truyền HBV từ mẹ sang con thấp khi sử dụng globulin miễn dịch viêm gan B và vắc xin viêm gan B ở trẻ sinh ra từ mẹ có HBeAg dương tính, việc mẹ sử dụng thêm Tenofovir không dẫn đến kết quả đáng kể tỷ lệ lây truyền thấp hơn.
So sánh thuốc HIV PrEP: Nghiên cứu khám phá nguy cơ tăng huyết áp ở người lớn dùng TAF so với TDF
Bởi Susha Cheriyedath, ThS.Ngày 13 tháng 9 năm 2023Được đánh giá bởi Lily Ramsey, LLM
Trong một nghiên cứu gần đây được công bố trên JAMA Network Open , một nhóm các nhà nghiên cứu đã đánh giá nguy cơ tăng huyết áp và bắt đầu sử dụng statin ở người trưởng thành bắt đầu điều trị dự phòng trước phơi nhiễm vi-rút suy giảm miễn dịch ở người (HIV) (PrEP) bằng emtricitabine/tenofovir alafenamide fumarate (TAF) so với những nghiên cứu đó. dùng emtricitabine/tenofovir disoproxil fumarate (TDF), sử dụng dữ liệu từ Kaiser Permanente Southern California (KPSC).
Lý lịch
PrEP làm giảm nguy cơ nhiễm vi rút gây suy giảm miễn dịch ở người (HIV) và đóng vai trò then chốt trong việc loại bỏ HIV ở Hoa Kỳ. Tính đến năm 2023, hai phác đồ PrEP hàng ngày đã nhận được sự chấp thuận của Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA): TDF vào năm 2012 và TAF vào năm 2019.
Trong khi cả hai đều chứng minh hiệu quả phòng ngừa HIV tương tự nhau , thử nghiệm DISCOVER cho thấy những người dùng TAF cho thấy sức khỏe xương và thận được cải thiện nhưng lại tăng cân.
Ngược lại, người dùng TDF đã giảm cholesterol. Việc sử dụng TAF để điều trị HIV cũng cho thấy cân nặng và cholesterol tăng lên, các yếu tố liên quan đến bệnh tim mạch. Thử nghiệm cho thấy không có sự khác biệt đáng kể trong việc bắt đầu sử dụng thuốc điều chỉnh lipid nhưng không đánh giá được các tình trạng chuyển hóa tim khác.
Các nghiên cứu quan sát từ cơ sở dữ liệu TriNetX cho thấy việc bắt đầu sử dụng statin và tăng huyết áp cao hơn khi dùng TAF.
Cần nghiên cứu sâu hơn do có sự mâu thuẫn giữa dữ liệu thử nghiệm lâm sàng và bằng chứng thực tế về tác dụng chuyển hóa tim của TAF và TDF, cùng với những lo ngại về việc đánh giá thấp kết quả trong các nghiên cứu quan sát.
Về nghiên cứu
Nghiên cứu hiện tại được thực hiện trên người trưởng thành bắt đầu PrEP trong hệ thống KPSC. Hệ thống chăm sóc sức khỏe tích hợp ở Nam California phục vụ nhiều đối tượng nhân khẩu học, với hành trình chăm sóc sức khỏe của các thành viên được ghi lại tỉ mỉ trong hồ sơ sức khỏe điện tử (EHR).
Các nhà nghiên cứu đã xác định những người trưởng thành bắt đầu PrEP trong khoảng thời gian từ ngày 1 tháng 10 năm 2019 đến ngày 31 tháng 5 năm 2022, ngoại trừ những người đã được chẩn đoán HIV trước đó, bệnh thận mãn tính, có dấu hiệu bất thường về thận, gan hoặc máu hoặc những người là thành viên chưa đầy 30 ngày sau khi đăng. -PrEP bắt đầu.
Hai nhóm phân tích riêng biệt xuất hiện từ nhóm đối tượng này, tập trung vào nguy cơ phát triển bệnh tăng huyết áp và việc bắt đầu sử dụng statin. Những người tham gia không có tiền sử tăng huyết áp hoặc sử dụng statin được đưa vào và sau đó được tạo thành các đoàn hệ phù hợp để phân tích sâu hơn.
Tiếp xúc chính là việc bắt đầu sử dụng PrEP với TAF hoặc TDF trong KPSC. Các nhà nghiên cứu tham khảo hồ sơ nhà thuốc ngoại trú đã xác định đơn thuốc PrEP được mua đầu tiên trong khoảng thời gian được chỉ định.
Kết quả chính được quan tâm là sự khởi phát của tăng huyết áp và bắt đầu sử dụng statin trong vòng hai năm sau khi bắt đầu PrEP. Phương tiện để xác định những kết quả này liên quan đến nhiều phương pháp khác nhau, chẳng hạn như mã chẩn đoán, đo lường ngoại trú và hồ sơ nhà thuốc.
Các biến cơ bản được xem xét trong nghiên cứu bao gồm chủng tộc, tuổi tác, giới tính, các dấu hiệu kinh tế xã hội, chi tiết bảo hiểm, số đo cơ thể, kết quả xét nghiệm và điểm rủi ro liên quan. Nghiên cứu hiện tại đã sử dụng nhiều phương pháp thống kê để phân tích dữ liệu, chẳng hạn như đối sánh điểm xu hướng, hồi quy logistic và phân tích thời gian xảy ra sự kiện.
Các phân tích độ nhạy cũng được thực hiện, đặc biệt đối với những người từ 40 tuổi trở lên, vì nhóm này có nguy cơ tăng huyết áp cao và thường được khuyến nghị bắt đầu dùng statin.
Kết quả
Nghiên cứu hiện tại đã phân tích 6.824 cá nhân đủ điều kiện bắt đầu PrEP, với độ tuổi trung bình là 34 tuổi và 97% là nam giới.
Khi so sánh những người đủ điều kiện với những người bị loại khỏi nghiên cứu, người ta nhận thấy rằng những người tham gia đủ điều kiện thường trẻ hơn, có khả năng có bảo hiểm Medicare/Medicaid thấp hơn, thường xuyên sử dụng TDF hơn và có ít vấn đề về chuyển hóa tim ban đầu hơn.
Ngoài nhóm, 5.523 người tham gia không bị tăng huyết áp khi nghiên cứu bắt đầu. Khi so sánh những người dùng TDF với những người dùng TAF, những người dùng TAF thường lớn tuổi hơn, chủ yếu là người da trắng không phải gốc Tây Ban Nha và có xác suất mắc bệnh tiểu đường cao hơn ngay từ đầu.
Tuy nhiên, họ ít có khả năng là người gốc Tây Ban Nha hoặc được bảo hiểm bởi Medicare/Medicaid hoặc các nhà cung cấp bảo hiểm thương mại. Nhóm TAF cũng có Tỷ lệ lọc cầu thận (eGFR) ước tính thấp hơn và thời gian theo dõi trung bình ngắn hơn.
Sau khi đối sánh hoàn tất, nhóm phân tích bao gồm 1.855 cá nhân sử dụng PrEP, với 20% sử dụng TAF và 80% sử dụng TDF. Quá trình đối sánh này đã giảm thiểu sự khác biệt về số liệu cơ bản giữa những người thực hiện TAF và TDF.
Điều thú vị là trong vòng hai năm kể từ khi bắt đầu PrEP, 2,2% nhóm TAF bị tăng huyết áp, so với tỷ lệ 1,3% của nhóm TDF. Điều này cho thấy việc sử dụng TAF có tương quan với nguy cơ tăng huyết áp cao hơn một chút trong vòng hai năm kể từ khi bắt đầu PrEP so với sử dụng TDF.
Nghiên cứu hiện tại cũng tiến hành phân tích độ nhạy, coi mức huyết áp cụ thể là ngưỡng chẩn đoán tăng huyết áp và xác định 3.454 cá nhân phù hợp với tiêu chí. Thử nghiệm này một lần nữa cho thấy những người dùng TAF có tỷ lệ tăng huyết áp cao hơn những người dùng TDF, hỗ trợ cho kết quả chính của nghiên cứu.
Trong một khía cạnh khác của nghiên cứu liên quan đến việc bắt đầu dùng statin, 6.149 người tham gia không có tiền sử sử dụng statin trước đó đã được xác định. Khi so sánh người dùng TDF với người dùng TAF, người dùng TAF trung bình lớn tuổi hơn, thường xuyên hơn là người da trắng không phải gốc Tây Ban Nha và ít có khả năng là người gốc Tây Ban Nha hoặc có một số loại bảo hiểm nhất định.
Họ cũng ít có khả năng bị tăng huyết áp ngay từ đầu. Tuy nhiên, những người thực hiện TAF có điểm rủi ro Bệnh xơ vữa động mạch (ASCVD) cao hơn và thời gian theo dõi trung bình ngắn hơn.
Trong số nhóm phù hợp về khía cạnh này, có 1.855 người tham gia. Trong vòng hai năm kể từ khi bắt đầu PrEP, 1,6% nhóm TAF bắt đầu điều trị bằng statin, so với tỷ lệ 1,0% của nhóm TDF.
Điều này cho thấy rằng những người dùng TAF có thể có xác suất bắt đầu dùng statin cao hơn một chút trong vòng hai năm sau khi bắt đầu PrEP. Khi chỉ tập trung vào những người tham gia từ 40 tuổi trở lên, sự chênh lệch về rủi ro liên quan đến TAF thậm chí còn rõ rệt hơn.
Tài liệu tham khảo.
- 1. Jourdain, G., Ngo-Giang-Huong, N., Harrison, L., Decker, L., Khamduang, W., Tierney, C., … & Chotivanich, N. (2018). Tenofovir versus placebo to prevent perinatal transmission of hepatitis B. New England Journal of Medicine.
- 2. Gupta, S. K., Post, F. A., Arribas, J. R., Eron Jr, J. J., Wohl, D. A., Clarke, A. E., … & Das, M. (2019). Renal safety of tenofovir alafenamide vs. tenofovir disoproxil fumarate: a pooled analysis of 26 clinical trials. AIDS (London, England), 33(9), 1455.
- 3. Pascuet, E. R., & Curran, A. (2008). Papel actual de tenofovir en la clínica. Enfermedades Infecciosas y Microbiología Clínica, 26, 45-54.
- 4. Dược thư Việt Nam, Tenofovir.
- 5. Drugs, Tenofovir, truy cập ngày 22 tháng 3 năm 2022.
- 6. Drugbank, Tenofovir, truy cập ngày 22 tháng 3 năm 2022.
- 7. Pubchem, Tenofovir, truy cập ngày 22 tháng 3 năm 2022.
Xuất xứ: Việt Nam
Xuất xứ: Canada
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Bangladesh
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam