Tegafur

Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
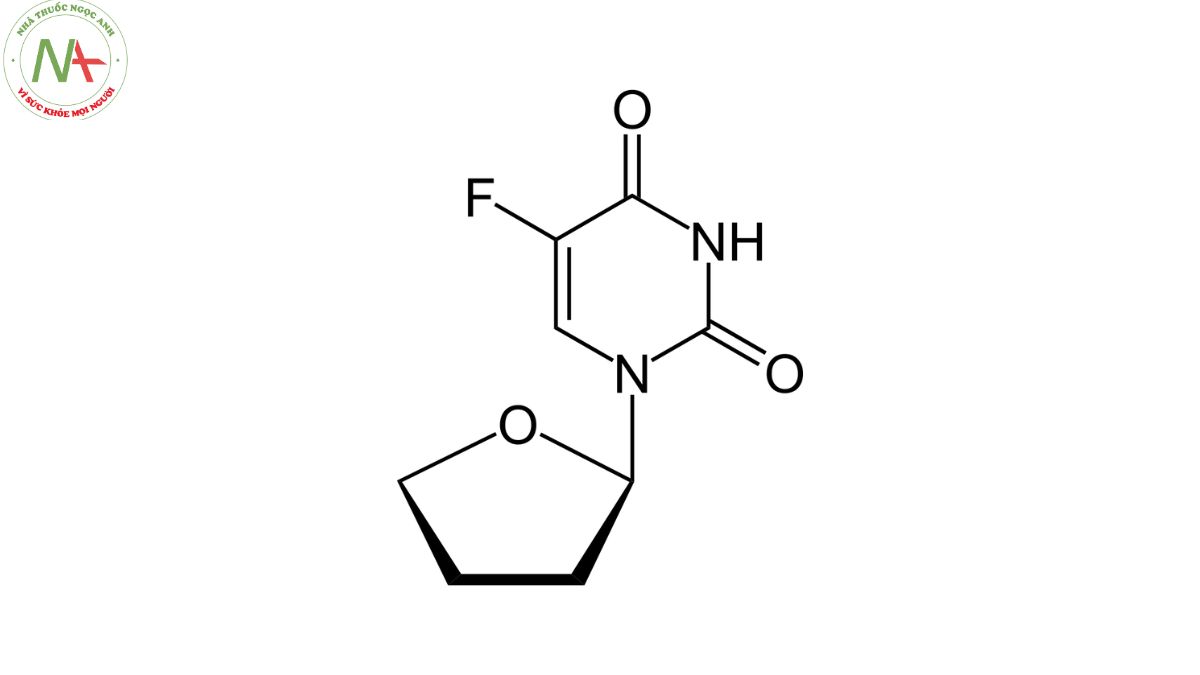
5-fluoro-1-(oxolan-2-yl)pyrimidine-2,4-dione
Nhóm thuốc
Thuốc điều trị ung thư
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01B – Chất chống chuyển hóa
L01BC – Chất tương tự pyrimidine
L01BC03 – Tegafur
Mã UNII
1548R74NSZ
Mã CAS
17902-23-7
Xếp hạng phân loại cho phụ nữ có thai
AU TGA loại: NA
US FDA loại: D
Cấu trúc phân tử
Công thức phân tử
C 8 H 9 F N 2 O 3
Phân tử lượng
200,17 g/mol
Cấu trúc phân tử
Cấu trúc của Tegafur gồm có 2 phần:
Vòng tetrahydrofuryl: Đây là một vòng bao gồm năm nguyên tử carbon và một nguyên tử oxi, tạo thành một vòng dẫn xuất của furan. Vòng này có công thức hóa học C4H7O.
5-Fluorouracil: Phần này là một dẫn xuất của uracil, một trong bốn cơ sở nitrogenous trong RNA. Trong trường hợp này, nguyên tử hydro của uracil đã được thay thế bằng nguyên tử fluor, tạo thành 5-fluorouracil, có công thức hóa học là C4H3FN2O2.
Các tính chất phân tử
Số liên kết hydro cho: 1
Số liên kết hydro nhận: 4
Số liên kết có thể xoay: 1
Diện tích bề mặt tôpô: 58,6 Ų
Số lượng nguyên tử nặng: 14
Các tính chất đặc trưng
Điểm nóng chảy: 339,8-343,4oC
Độ hòa tan trong nước: 29,9 [ug/mL]
Cảm quan
Tegafur thường tồn tại ở dạng bột màu trắng hoặc hạt màu trắng.
Tegafur không tan hoàn toàn trong nước, do đó, nó khó hòa tan và dễ tạo thành kết tủa khi tiếp xúc với nước.
Tegafur thường tan tốt trong các dung môi hữu cơ như ethanol (rượu etylic), dimethyl sulfoxide (DMSO), và dimethylformamide (DMF).
Dạng bào chế
Không có thuốc chứa dạng đơn chất Tegafur được lưu hành.
Hiện nay, chỉ có dạng viên nang kết hợp giữa Tegafur và Uracil

Độ ổn định và điều kiện bảo quản của Tegafur
Tegafur cần được bảo quản ở nhiệt độ phòng, tức là khoảng 20-25 độ C (68-77 độ F). Tránh tiếp xúc với nhiệt độ cao, ánh nắng trực tiếp, và độ ẩm cao.
Thuốc Tegafur thường được đóng gói trong hộp hoặc chai kín để bảo vệ khỏi ánh sáng mặt trời trực tiếp và bảo quản ẩm.
Để đảm bảo an toàn, nên bảo quản Tegafur ra xa tầm tay của trẻ em.
Nguồn gốc
Tegafur ban đầu được phát triển bởi một nhóm các nhà nghiên cứu thuộc Công ty Dược phẩm Chugai (Chugai Pharmaceutical Co., Ltd.) tại Nhật Bản.
Năm 1960: Những nghiên cứu đầu tiên về 5-fluorouracil (5-FU), một chất chống ung thư, đã được tiến hành nghiên cứu
Năm 1967: Tegafur được phát triển bởi Công ty Dược phẩm Chugai.
Năm 1987: Tegafur được kết hợp với gimeracil và oteracil để tạo thành S-1, một loại thuốc điều trị ung thư tiêu biểu, được phê duyệt tại Nhật Bản.
Năm 1999: S-1 được phê duyệt bởi Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) để sử dụng trong điều trị ung thư dạ dày.
Dược lý và cơ chế hoạt động
Tác động chống ung thư của Tegafur sau khi đưa vào cơ thể sẽ được kích hoạt bởi sự xuất hiện của 5-FU trong cơ thể, do quá trình chuyển hóa do Ferulic Acid Thioesterase (FT) thực hiện.
5-FU, một khi đã được chuyển hóa và đi vào tế bào ung thư, chất này thực hiện khả năng chống ung thư bằng cách tạo ra hiệu ứng ngăn chặn tổng hợp DNA và RNA.
Cơ chế hoạt động chính của 5-FU là ức chế quá trình tổng hợp ADN. Điều này xảy ra thông qua tác động đối kháng của nó đối với chất chuyển hóa FdUMP, hoạt động tương tự như dUMP.
5-FU tạo ra một phức Ternary với thymidylate và làm giảm axit folic, gây ra sự gián đoạn trong việc sản xuất ra thymidylate cần thiết cho tổng hợp ADN.
Ngoài ra, tác động của 5-FU cũng có thể ảnh hưởng đến chức năng của RNA thông qua sự biến đổi thành phần tử FUPT và việc tích hợp này vào phân tử RNA.
Điều này có thể dẫn đến rối loạn chức năng của RNA và có thể gây ngăn chặn sự tổng hợp của nó.
Cơ chế tác động của Tegafur thông qua 5-FU là một sự kết hợp phức tạp của việc ức chế tổng hợp DNA thông qua ức chế thymidylate và gây rối loạn chức năng RNA thông qua việc tích hợp FUPT vào phân tử RNA.
Điều này đóng một vai trò quan trọng trong tác động chống ung thư của nó.
Ứng dụng trong y học của Tegafur
Điều trị ung thư: Tegafur thường được sử dụng trong điều trị các loại ung thư khác nhau. Nó có thể được sử dụng đơn trị liệu hoặc kết hợp với các loại khác của thuốc chống ung thư khác để tăng hiệu suất điều trị. Các loại ung thư mà Tegafur có thể được sử dụng để điều trị bao gồm ung thư dạ dày, ung thư phổi, ung thư ruột non, ung thư vú, và nhiều loại ung thư khác.
1 thành phần của thuốc S-1: Tegafur là một phần quan trọng của S-1, một loại thuốc điều trị ung thư tiêu biểu. S-1 đã được sử dụng rộng rãi ở nhiều quốc gia để điều trị ung thư, đặc biệt là ung thư dạ dày và ruột non. S-1 kết hợp Tegafur với gimeracil và oteracil để tăng cường tác dụng của 5-fluorouracil (5-FU) trong điều trị.
Thuốc tác động lên tiêu hóa: Tegafur có thể được sử dụng trong điều trị một số bệnh lý tiêu hóa, như bệnh viêm đại tràng, dưới sự theo dõi của bác sĩ chuyên khoa.
Nghiên cứu và phát triển: Tegafur và các dẫn xuất của nó có thể được sử dụng trong nghiên cứu và phát triển các loại thuốc mới để điều trị ung thư và các bệnh khác. Các nhà nghiên cứu có thể tìm cách cải thiện hiệu suất và an toàn của Tegafur và các dạng điều trị chứa nó.
Dược động học
Hấp thụ
Tegafur thường được uống dưới dạng viên hoặc dạng lỏng.
Phân phối
Tegafur được phân phối vào cơ thể thông qua hệ tuần hoàn máu
Chuyển hóa
Tegafur trải qua một loạt các quá trình chuyển hóa trong cơ thể để tạo ra các chất con chuyển hóa, bao gồm 5-fluorouracil (5-FU).
Chuyển hóa chủ yếu diễn ra trong gan, nơi nhiều enzym tham gia vào quá trình này. 5-FU là chất chống ung thư chính và có tác động chống ung thư bằng cách ức chế tổng hợp DNA và RNA trong tế bào ung thư.
Loại bỏ
Các chất chuyển hóa của Tegafur, bao gồm 5-FU, sau đó được loại bỏ khỏi cơ thể thông qua quá trình chuyển hóa và bài tiết.
Một phần chúng có thể được bài tiết qua nước tiểu và một phần khác qua phân.
Độc tính của Tegafur
Tác dụng phụ phổ biến
Một số tác dụng phụ phổ biến của Tegafur bao gồm buồn nôn, nôn mửa, tiêu chảy, tăng men gan, thay đổi trong sự thụ động của tế bào máu (như giảm bạch cầu, tiểu cầu và tiểu bạch cầu), mệt mỏi, và giảm cân. Các tác dụng phụ này thường xuất hiện trong quá trình điều trị và có thể được quản lý bằng cách theo dõi chặt chẽ và điều chỉnh liều lượng.
Tác dụng phụ nghiêm trọng
Một số tác dụng phụ nghiêm trọng của Tegafur bao gồm tác động đến tim mạch, vấn đề về gan (như viêm gan), tác động đến thận, và tác động đến hệ thống thần kinh (như co giật và tình trạng tâm thần). Nếu có bất kỳ dấu hiệu hoặc triệu chứng nghiêm trọng nào xảy ra, người dùng cần liên hệ ngay với bác sĩ.
Tác động đối với hệ miễn dịch
Tegafur có thể ảnh hưởng đến hệ miễn dịch của cơ thể, làm cho người dùng dễ mắc nhiễm trùng. Việc theo dõi và quản lý sự yếu đuối của hệ miễn dịch là quan trọng trong quá trình điều trị.
Tác động đối với da
Tegafur có thể gây ra các vấn đề về da như phản ứng da tạp trạng và sưng đỏ. Nếu có bất kỳ biểu hiện nào trên da, người dùng nên thảo luận với bác sĩ về cách quản lý.
Tác dụng phụ khác: Tegafur cũng có thể gây ra các tác dụng phụ khác, bao gồm tác động đến tiêu hóa, mắt, và cơ bắp.
Tương tác của Tegafur với thuốc khác
Warfarin và các thuốc chống đông huyết
Tegafur có thể tăng nguy cơ chảy máu, và khi kết hợp với warfarin hoặc các thuốc chống đông huyết khác, có thể làm tăng nguy cơ chảy máu nhiều hơn.
Thuốc chống co giật (phenytoin, carbamazepine)
Tegafur có thể tăng tác động của các thuốc chống co giật và gây ra tăng nguy cơ co giật. Nếu bạn đang sử dụng thuốc chống co giật, cần thảo luận với bác sĩ về việc điều chỉnh liều lượng.
Thuốc ức chế men gan:
Một số loại thuốc có thể ức chế men gan và ảnh hưởng đến chuyển hóa Tegafur, làm tăng nồng độ của Tegafur trong cơ thể. Điều này có thể làm tăng tác dụng phụ của Tegafur.
Thuốc kháng sinh (chloramphenicol):
Một số thuốc kháng sinh có thể tương tác với Tegafur và làm tăng nguy cơ tác dụng phụ.
Thuốc ức chế bơm proton (omeprazole, lansoprazole):
Các thuốc ức chế bơm proton có thể làm giảm sự hấp thụ của Tegafur từ dạ dày, làm giảm hiệu suất của nó.
Thuốc khác điều trị ung thư:
Khi sử dụng Tegafur cùng với các loại thuốc điều trị ung thư khác, cần thận trọng để kiểm soát tác dụng phụ và đảm bảo hiệu quả điều trị.
Thuốc kháng viêm không steroid (NSAIDs):
Các loại NSAIDs có thể tăng nguy cơ chảy máu khi sử dụng cùng với Tegafur.
Lưu ý khi dùng Tegafur
Lưu ý và thận trọng chung
Kiểm tra huyết học, chức năng gan và thận
Thuốc có thể gây tác dụng phụ nghiêm trọng như ức chế tuỷ xương. Vì vậy, bệnh nhân cần thường xuyên kiểm tra huyết học, chức năng gan và thận.
Theo dõi tổn thương gan
Tegafur có thể gây rối loạn chức năng gan và viêm gan bạo phát. Do đó, quá trình theo dõi chức năng gan cần thực hiện thường xuyên, đặc biệt là trong giai đoạn đầu sử dụng thuốc để phát hiện sớm tổn thương gan.
Theo dõi triệu chứng mệt mỏi và chán ăn
Sự xuất hiện của mệt mỏi kèm theo chán ăn có thể là dấu hiệu của rối loạn chức năng gan. Biểu hiện vàng da (mắt màu vàng) cũng cần được xem xét và cần ngừng thuốc ngay lập tức nếu có.
Rủi ro mất nước và vấn đề về tiêu hóa
Sử dụng Tegafur có thể gây mất nước và gây ra viêm ruột non (ví dụ như viêm ruột non xuất huyết, viêm ruột non thiếu máu cục bộ, viêm ruột non hoại tử, v.v…). Do đó, cần phải theo dõi chặt chẽ và ngừng thuốc khi có các triệu chứng nặng như đau bụng nặng hoặc ỉa chảy, và bổ sung dịch nếu cần thiết.
Chăm sóc để tránh nhiễm khuẩn và chảy máu
Thuốc có thể làm tăng nguy cơ nhiễm khuẩn hoặc chảy máu. Việc chăm sóc da và tránh nhiễm khuẩn là quan trọng.
Tương tác với thuốc kháng virus sorivudine
Sử dụng đồng thời với sorivudine có thể gây bệnh lý huyết học nặng do sự ức chế chuyển hoá thuốc nhóm fluorouracil. Do đó, đảm bảo bệnh nhân không sử dụng sorivudine khi dùng bất kỳ thuốc nào thuộc nhóm fluorouracil.
Dùng thận trọng cho những trường hợp đặc biệt
Thuốc cần được sử dụng thận trọng cho bệnh nhân suy tủy, rối loạn chức năng gan hoặc thận, bệnh nhân đang bị nhiễm khuẩn, thuỷ đậu, triệu chứng dạ dày/tá tràng, không dung nạp glucose, và các trường hợp đặc biệt khác.
Lưu ý cho người đang mang thai
Chống chỉ định dùng Tegafur cho nhóm đối tượng này.
Lưu ý cho người đang cho con bú
Chống chỉ định dùng Tegafur cho nhóm đối tượng này.
Lưu ý cho người vận hành máy móc hay lái xe
Cần thận trọng khi dùng Tegafur cho nhóm đối tượng này.
Một vài nghiên cứu về Tegafur trong Y học
Uracil-tegafur trong ung thư biểu mô dạ dày: đánh giá toàn diện
Mục đích: Thuốc chống ung thư đường uống thế hệ thứ hai UFT, sự kết hợp giữa uracil và tegafur (TGF), dẫn đến nồng độ fluorouracil (5-FU) trong các mô khối u cao hơn so với TGF hoặc liều tương đương của 5-fluorouracil tiêm tĩnh mạch. UFT đã được nghiên cứu rộng rãi ở Nhật Bản và được sử dụng ở Phương Đông trong nhiều năm, đặc biệt đối với bệnh nhân ung thư biểu mô dạ dày. UFT gần đây đã tham gia điều tra sâu rộng ở Bắc Mỹ và Châu Âu.
Phương pháp: Các nghiên cứu liên quan đã ghi lại sự hình thành của UFT, cơ chế hoạt động, độc tính tiền lâm sàng, dược động học ở người, nghiên cứu giai đoạn I và hoạt động chống lại ung thư biểu mô dạ dày được mô tả chi tiết.
Kết quả: Uracil trong UFT làm chậm quá trình thoái hóa 5-FU bởi dihydropyrimidine dehydrogenase (DPD), dẫn đến nồng độ 5-FU được duy trì trong máu và các mô khối u. UFT được dung nạp tốt, nhưng những tác dụng độc hại như buồn nôn, nôn và tiêu chảy phụ thuộc vào liều lượng và lịch trình. Trong các nghiên cứu dược động học pha I, UFT dùng đường uống theo lịch trình 28 ngày cho kết quả nồng độ trong máu tương đương với nồng độ sau khi truyền tĩnh mạch liên tục liều thấp 5-FU. Ở những bệnh nhân ung thư biểu mô dạ dày, chỉ riêng UFT có tỷ lệ đáp ứng khoảng 20%. Trong cài đặt bổ trợ, UFT cộng với mitomycin có vẻ vượt trội hơn TGF cộng với mitomycin. Tại Nhật Bản, UFT là một phần của hóa trị bổ trợ tiêu chuẩn cho ung thư biểu mô dạ dày.
Kết luận: UFT là một trong những tiền chất 5-FU đường uống thế hệ thứ hai đầu tiên đang được nghiên cứu ở Bắc Mỹ và Châu Âu. Các tài liệu cho thấy UFT được dung nạp tốt và có ưu thế về dược động học tế bào so với tiền chất 5-FU thế hệ đầu tiên là TGF. UFT có độc tính thuận lợi hơn 5-FU tiêm tĩnh mạch. Các vấn đề về hiệu quả, sự thuận tiện cho bệnh nhân và chất lượng cuộc sống cần được nghiên cứu trong các thử nghiệm ngẫu nhiên có đối chứng.
Tài liệu tham khảo
- Drugbank, Tegafur , truy cập ngày 04/10/2023.
- Pubchem, Tegafur, truy cập ngày 04/10/2023.
- Takiuchi, H., & Ajani, J. A. (1998). Uracil-tegafur in gastric carcinoma: a comprehensive review. Journal of clinical oncology, 16(8), 2877-2885.
