Retinoids
Tác giả: Mark C. Marchitto, Sewon Kang, and Anna L. Chien.
Biên dịch: Bác sĩ Trần Phương Tường Vy.
Để tải bài viết Retinoids bôi là gì? Hướng dẫn sử dụng Retinoids trị mụn biên dịch bởi Bác sĩ Trần Phương Tường Vy file PDF mời các bạn click vào link ở đây.
Giới Thiệu
Mụn trứng cá là một tình trạng da cực kỳ phổ biến, ảnh hưởng đến khoảng 85% thanh thiếu niên với khả năng kéo dài dai dẳng đến tuổi trưởng thành [1]. Mụn trứng cá là một bệnh của đơn vị nang lông tuyến bã có đặc điểm là tăng tiết quá mức bã nhờn, bất thường sừng hóa nang lông, sự hiện diện của vi khuẩn Cutibacterium acnes và viêm [2–4]. Retinoids tại chỗ đã được thiết lập như một phương pháp điều trị đầu tiên cho comedones và mụn viêm [5, 6]. Trước khi retinoids ra đời, benzoyl peroxide (BPO) và các hợp chất chứa lưu huỳnh tại chỗ được sử dụng cho mụn trứng cá nhẹ đến trung bình, với kháng sinh tetracycline và steroid đường uống dành riêng cho các trường hợp nặng và khó chữa hơn [7-9].
Tác dụng của vitamin A đối với da lần đầu tiên được mô tả trong y văn vào đầu thế kỷ 20 [10–12]. Tuy nhiên, phải đến đầu những năm 1960 khi retinoid đầu tiên, tretinoin, được chấp thuận sử dụng trong y tế, do Albert Kligman và James Fulton của Đại học Pennsylvania đi tiên phong [13, 14]. Tretinoin vẫn là retinoid bôi tại chỗ duy nhất được chấp thuận để điều trị mụn trứng cá cho đến khi có sự phát triển của retinoid thế hệ thứ ba đa vòng thơm, adapalene và tazarotene, vào giữa đến cuối những năm 1990 [15–17]. Adapalene, một loại retinoid tổng hợp được tạo ra bởi phòng thí nghiệm Galderma ở Pháp, được phát hiện có hiệu quả tương đương với tretinoin trong điều trị mụn trứng cá với lợi ích bổ sung là khả năng kích ứng da thấp hơn và do đó khả năng dung nạp cao hơn [18, 19]. Tazarotene, cũng là một retinoid bôi ngoài da thế hệ thứ ba, xuất hiện trên thị trường trong một khoảng thời gian tương tự và đã được FDA chấp thuận để điều trị cả bệnh vẩy nến và mụn trứng cá [20, 21]. Tazarotene đã được chứng minh là có hiệu quả tương tự như các chất cùng nhóm của nó, tretinoin và adapalene, trong việc điều trị mụn trứng cá [22–25]. Trong những năm qua, một số liệu pháp kết hợp retinoids với kháng sinh tại chỗ và BPO cũng đã được phát triển và bán trên thị trường với nhiều thành công [26, 27].
Trong năm qua, một loại retinoid bôi mới đã nổi lên như một lựa chọn hiệu quả và được dung nạp tốt để điều trị mụn trứng cá. Trifarotene, một loại retinoid bôi thế hệ thứ tư, đã được chứng minh là có hiệu quả trong việc điều trị cả mụn trứng cá viêm và không viêm trên mặt và thân mình [28–30]. Retinoid này cho đến nay đã cho thông tin tác dụng phụ và khả năng dung nạp tổng thể tốt hơn so với các chất cùng nhóm cũ của nó.
Cấu Trúc Và Cơ Chế Hoạt Động
Retinoids tại chỗ có thể được phân loại gồm tự nhiên và tổng hợp. Axit retinoic all-trans (tretinoin) và tiền chất của nó là all-trans retinol là những retinoid bôi ngoài tự nhiên duy nhất được sử dụng trong điều trị mụn trứng cá. Adapalene, tazarotene và trifarotene là những retinoid tổng hợp và cơ thể không thể sản xuất nội sinh. Sự khác biệt về cấu trúc giữa tretinoin và các retinoid tổng hợp là rất rõ ràng, nhưng sự tương đồng về tác dụng của retinoid được thể hiện qua khả năng chung của chúng trong việc liên kết và kích hoạt các thụ thể retinoid (Hình 5.1).
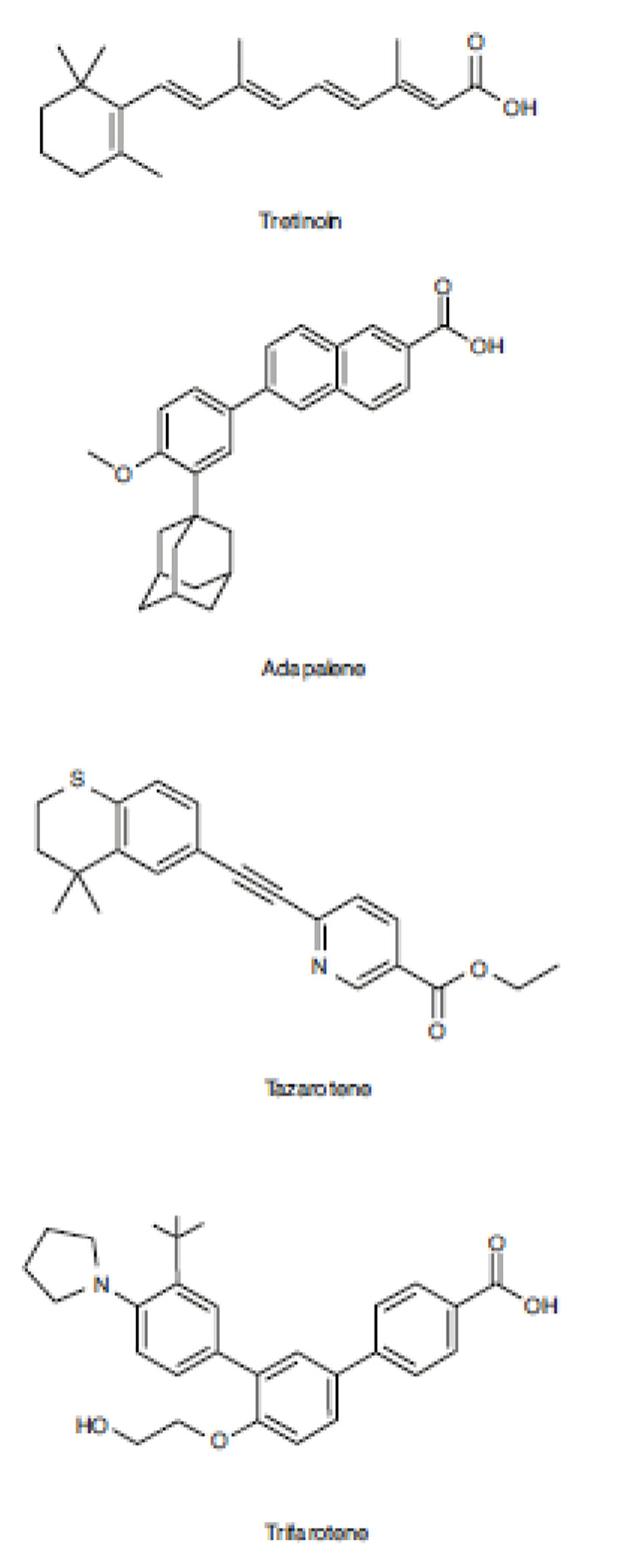
Retinoids phát huy tác dụng của chúng thông qua sự liên kết của các thụ thể retinoid được tìm thấy trong nhân của tế bào sừng biểu bì ảnh hưởng đến quá trình phiên mã gen. Có hai thụ thể retinoid trong đó retinoid bôi tại chỗ có ái lực khác nhau, thụ thể retinoic acid (RAR) và thụ thể retinoid X (RXR) [31]. RAR và RXR hình thành chất dimer với phối tử retinoid của chúng và liên kết với các yếu tố đáp ứng axit retinoid (RARE) trong vùng khởi động của các gen chịu trách nhiệm về retinoid [32–34]. Mỗi thụ thể có ba isotype (α, β và γ), với RXR-α là thụ thể axit retinoic phổ biến nhất trên da. Các cấu trúc khác nhau retinoids có các đặc tính liên kết riêng biệt với các thụ thể này (Bảng 5.1), có thể dẫn đến các tác dụng cụ thể đối với từng retinoid.
Một trong những tác dụng này ở mụn trứng cá liên quan đến việc bình thường hóa quá trình sừng hóa nang lông và sự gắn kết của các tế bào sừng biệt hóa giai đoạn cuối bao gồm lớp sừng (corneocytes). Kết quả là, các microcomedones, tổn thương sớm nhất của mụn trứng cá, không bị tích tụ lại và đào thải ra ngoài cho phép bã nhờn đi ra bề mặt da. Quá trình này làm giảm sự tắc nghẽn của đơn vị nang lông tuyến bã và hình thành các tổn thương mụn trứng cá mới [35–37]. Retinoids tại chỗ cũng có đặc tính chống viêm đáng kể, vì chúng đã được chứng minh là làm giảm sự giải phóng một số cytokine gây viêm bao gồm IL-1β, IL-6, IL-12, TNF-α và IFN-γ [38, 39] . Ngoài ra, retinoids cũng được phát hiện làm giảm sự biểu hiện của thụ thể tế bào sừng Toll-like receptor (TLR) -2, thụ thể này điều chỉnh sự tổng hợp các cytokine gây viêm khi tương tác với Cutibacterium acnes trong tổn thương mụn trứng cá [40, 41]. Cuối cùng, sử dụng retinoid tại chỗ dẫn đến teo các tuyến bã nhờn và giảm sản xuất bã nhờn, ức chế tình trạng viêm do C. acnes phụ thuộc vào bã nhờn [42-44].
Bảng 5.1 Liên kết đặc hiệu của retinoids tại chỗ với các thụ thể hạt nhân
| Retinoid | RAR-α | RAR-β | RAR-γ | RXR-α | RXR-β | RXR-γ |
| All-trans retinoic acid (tretinoin) | ++ | ++ | ++ | (-) | (-) | (-) |
| Adapalene | Yếu | ++ | ++ | (-) | (-) | (-) |
| Tazarotenic acid | + | ++ | ++ | (-) | (-) | (-) |
| Trifarotene | (-) | (-) | +++ | (-) | (-) | (-) |
Phỏng theo Wolverton [94] + Liên kết tối thiểu, ++ Liên kết trung bình, +++ Liên kết tương đối mạnh, (-) không liên kết
All-Trans Retinol và All-Trans Retinoic Acid
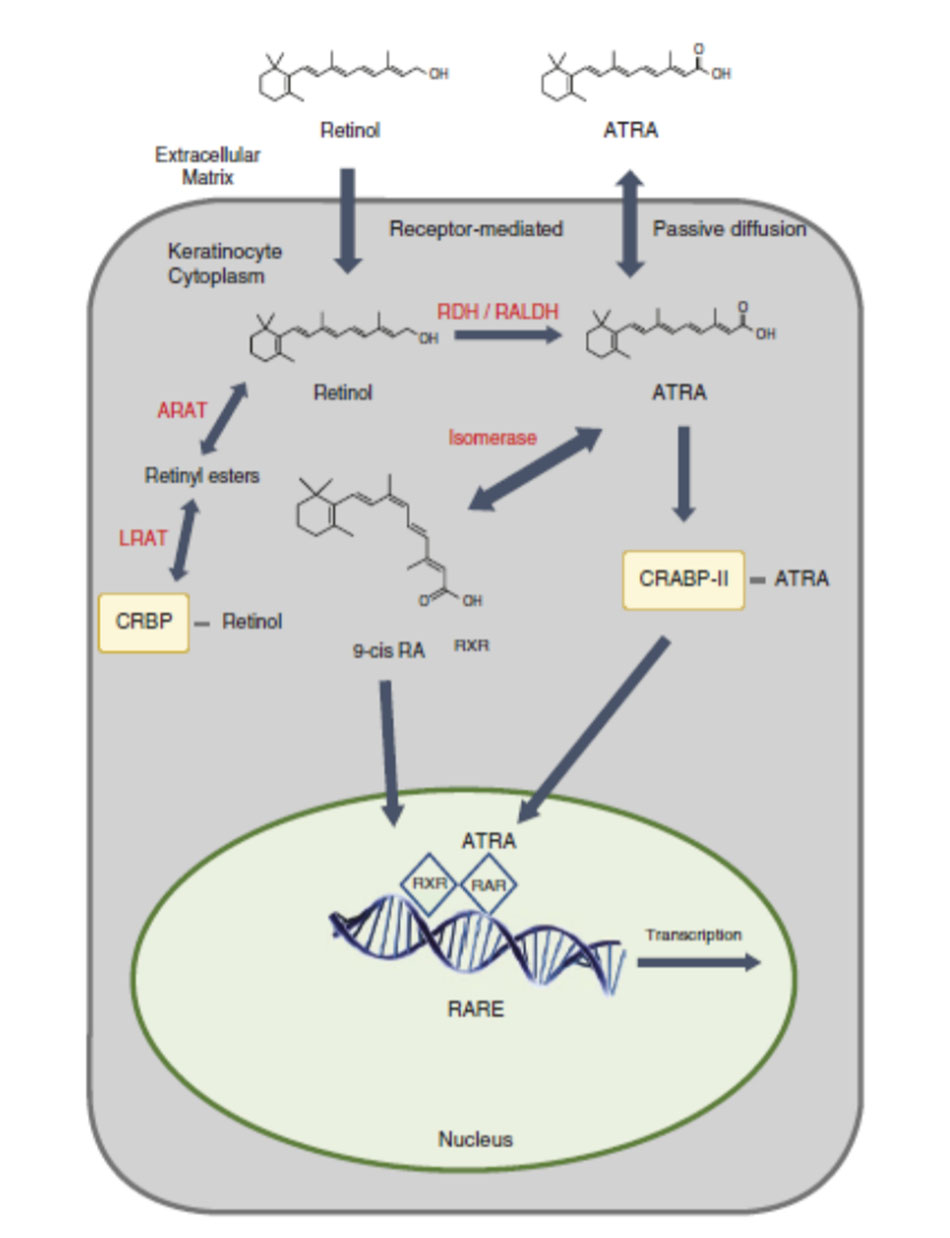
Axit retinoic all-trans, tretinoin, là một prototypic retinoid tại chỗ được sử dụng trong điều trị mụn trứng cá [45]. Con đường tác động của axit retinoic all-trans được thể hiện trong Hình 5.2. Tretinoin được tổng hợp tự nhiên trong tế bào sừng từ all-trans retinol, là dạng cồn tự nhiên của vitamin A. Retinol được lưu trữ trong gan và được vận chuyển đến da từ máu liên kết với protein liên kết retinol (RBP). Khi ở trong mạch máu của da, all-trans retinol sẽ được các tế bào sừng ở đáy hấp thụ nơi all-trans retinol tự do liên kết với protein liên kết retinol của tế bào (CRBP). Retinol có thể được lưu trữ trong lớp biểu bì dưới dạng retinyl ester [46, 47]. Hai hệ thống enzym khác biệt hoạt động để biến đổi retinol thành retinyl este, acyl CoA: retinol acyltransferase (ARAT) và lecithin: retinol acyltransferase (LRAT). ARAT hoạt động mạnh hơn ở lớp biểu bì trên và quan trọng đối với retinol bôi tại chỗ, trong khi LRAT hoạt động để chuyển đổi các nguồn nội sinh của retinol all-trans thành retinyl ester ở phần dưới của biểu bì [48].
Khi nồng độ axit retinoic thấp trong lớp biểu bì, các este retinyl bị thủy phân để giải phóng retinol, sau đó bị oxy hóa để tạo thành axit retinoic all-trans. Axit retinoic all-trans mới được tổng hợp liên kết với protein liên kết axit retinoic cytosolic (CRABP), protein liên kết chủ yếu đối với axit retinoic all-trans trong da người [49, 50]. Sau khi liên kết với CRABP II, axit retinoic all-trans sẽ chuyển vào nhân của tế bào sừng, nơi nó liên kết với các thụ thể axit retinoic. Trong khi axit retinoic all- trans không liên kết với RXRs, isomer 9-cis của axit retinoic (axit retinoic 9-cis) liên kết với ái lực cao với các thụ thể này [51]. Cùng với các phối tử tương ứng của chúng, RAR và RXR tạo thành các heterodimers liên kết với các phần tử phản ứng axit retinoid (RARE) trong vùng khởi động của các gen chịu trách nhiệm về retinoid dẫn đến các hiệu ứng hạ nguồn được đề cập ở trên.
Tretinoin bôi tại chỗ có nhiều dạng (được trình bày trong Bảng 5.2), nổi tiếng nhất là kem Retin-A (0,025%, 0,05% và 0,1%). Các dạng khác bao gồm gel và dung dịch. Nồng độ cao nhất là 0,1% kem/gel. Danh sách đầy đủ các loại retinoid bôi tại chỗ có sẵn và các chế phẩm của chúng được hiển thị trong Bảng 5.2.
Adapalene
tổng hợp thế hệ thứ ba, bền với ánh sáng, khó bị biến đổi và rất ưa mỡ. So với tretinoin, adapalene có ái lực cao hơn với RAR-β và RAR-γ với ái lực yếu đối với RAR-α. Với thực tế là RAR-β không được biểu hiện trong tế bào sừng, mục tiêu chính của nó là RAR-γ, làm cho nó trở thành retinoid chọn lọc hơn tretinoin [15–19]. Phù hợp với điều này, adapalene đã được chứng minh là gây ra biểu hiện CRABP-II mặc dù không liên kết với các protein liên kết axit retinoic của tế bào (CRABPs) [52, 53]. Điều này xảy ra bởi vì adapalene kích hoạt RAR-γ/RXR heterodimer và CRABP-II là một gen chứa RARE. Adapalene không tương tác với RXRs.
Ngoài tác dụng ức chế quá trình hóa học của bạch cầu trung tính và giải phóng các gốc tự do và oxy phản ứng có nguồn gốc từ bạch cầu trung tính, adapalene cũng có liên quan đến nhiều tác dụng chống viêm. Adapalene có liên quan đến việc giảm các chất trung gian gây viêm như leukotrienes và prostaglandin bằng cách ức chế con đường lipo-oxygenase và chuyển hóa axit arachidonic [54, 55]. Trong phần da mẫu, việc sử dụng adapalene có liên quan đến việc tăng biểu hiện CD1d của tế bào sừng, cũng như giảm biểu hiện TLR-2 và IL-10 của tế bào sừng [41].
Không giống như tretinoin, adapalene bền với ánh sáng và không dễ bị oxy hóa bởi BPO. Do đó, các công thức kết hợp cố định của adapalene với BPO đã được phát triển và được chấp thuận để điều trị mụn trứng cá viêm và không viêm.
Với bản chất ưa béo cao, adapalene được cho là thâm nhập vào nang lông nhanh hơn và hiệu quả hơn so với thế hệ đầu tiên của nó. Tính ưa mỡ của adapalene cũng góp phần vào việc hấp thu toàn thân không đáng kể, vì thuốc sẽ hòa tan trong bã nhờn sau khi thâm nhập vào nang lông. Adapalene hiện có bán không cần kê đơn dưới dạng gel 0,1%. Nó cũng có sẵn dưới dạng kem 0,1% kê đơn, dung dịch 0,1% và gel 0,3% để điều trị mụn trứng cá.
Bảng 5.2 Các chế phẩm của retinoids tại chỗ
| Tên chung | Tên thị trường | Dạng có sẵn |
| All-trans retinoic acid (tretinoin) | Atralin ®, Avita ®, Retin-A ®, Retin-A, Micro ®, Tretin-X ® | Cream: 0.025%, 0.038%, 0.05%, 0.1%; gel: 0.01%, 0.025%, 0.04%, 0.05%, 0.1% |
| Adapalene | Differin ® | Cream: 0.1%; gel: 0.1%a, 0.3%; lotion: 0.1% |
| Tazarotene | Tazorac ® | Cream: 0.05%, 0.1%; gel: 0.05%, 0.1%; foam: 0.1% |
| Trifarotene | AKLIEF ® | Cream: 0.005% |
| Tretinoin / clindamycin | Ziana ®, Veltin ® | Clindamycin phosphate 1.2%/tretinoin 0.025% gel |
| Adapalene / benzoylperoxide | Epiduo ® | Benzoyl peroxide 2.5%/adapalene 0.1, 0.3% gel |
Tazarotene
Tazarotene là một retinoid tổng hợp thế hệ thứ ba. Nó là một tiền chất trong đó tazarotene cần được thủy phân trong các mô thành chất chuyển hóa có hoạt tính của nó, axit tazarotenic. Tương tự như adapalene, axit tazarotenic liên kết chọn lọc với thụ thể nhân RAR-γ và với ái lực thấp hơn với RAR-α và RAR-β [56]. Axit tazarotenic không tương tác với các thụ thể nhân RXR. Thông qua liên kết của các thụ thể nhân RAR, axit tazarotenic hoạt động để bình thường hóa biểu mô nang lông ở da mụn trứng cá bằng cách điều chỉnh giảm biểu hiện bất thường của tế bào sừng transglutaminase I (Tgase I), thụ thể yếu tố tăng trưởng biểu bì, và tăng sinh keratins K6 và K16 [57, 58].
Như với adapalene, tazarotene bền với ánh sáng và không bị oxy hóa bởi BPO; do đó nó có thể được dùng vào buổi sáng và kết hợp với BPO. Tazarotene có sẵn ở dạng kem 0,05% và 0,1%, gel 0,05% và 0,1%, và công thức tạo bọt 0,1% Tazarotene dạng bọt (FABIOR) rất độc đáo vì nó là retinoid bôi ngoài da duy nhất được FDA chấp thuận trong phương tiện tạo bọt để điều trị mụn trứng cá. Công thức này đã được dự kiến để tăng sự tuân thủ ở một số quần thể bệnh nhân do dễ sử dụng [59, 60].
Trifarotene
Trifarotene là một loại retinoid bôi ngoài da thế hệ thứ tư mới được phát triển đã được chứng minh là có hiệu quả cao trong việc điều trị mụn trứng cá. Trifarotene là một chất chủ vận RAR-γ chọn lọc hầu như không có tác dụng trên các thụ thể RAR-β và RAR-α và không có tác dụng trên các thụ thể RXR [28, 29]. Mặc dù chưa được chứng minh, nhưng tính chọn lọc thụ thể này của trifarotene có thể tạo ra tác dụng phụ tốt hơn và khả năng dung nạp tổng thể tốt hơn so với các retinoid thế hệ đầu tương tự của nó.
CD5789 (trifarotene) đã được chứng minh là ổn định về mặt dược động học trong các tế bào sừng được nuôi cấy và được chuyển hóa nhanh chóng trong các microsome gan. Nghiên cứu ban đầu trên các mô hình động vật đã thiết lập các đặc tính anticomedogenic mạnh của trifarotene. Ở chuột rhino, việc bôi trifarotene tại chỗ đã loại bỏ gần như tất cả các comedone với liều thấp hơn 10 lần so với liều lượng cần thiết cho tazarotene và tretinoin [63]. Trifarotene cũng được phát hiện có tác dụng chống viêm đáng kể cũng như ngừa sắc tố ở in vivo nhanh chóng [63]. Tác dụng ngừa sắc tố mạnh của trifarotene có thể được chứng minh là một trong những thuộc tính lớn nhất của nó vì tăng sắc tố sau viêm (PIH) là một di chứng thường xuyên của mụn viêm với PIH thường gặp ở da sẫm màu hơn.
Ngoài tác dụng làm tan mụn, chống viêm và ngừa sắc tố, các con đường tác động mới của trifarotene đã được xác định trong các phân tích biểu hiện gen quy mô lớn bao gồm (1) điều hòa giảm các protein kết dính tế bào, chẳng hạn như dystonin, dẫn đến tăng hoạt tính phân giải mụn trứng cá, (2 ) điều chỉnh các kênh aquaporin 3 (AQP3) và hoạt động của peptidyl arginine deiminase 1 (PADI1) dẫn đến cải thiện chức năng hàng rào và hydrat hóa da, và (3) điều hòa giảm màng metalloendopeptidase (MM) dẫn đến giảm sự suy thoái của sợi elastin.
Cho đến nay, ba thử nghiệm lâm sàng giai đoạn III quy mô lớn (thử nghiệm PERFECT1 và PERFECT2 kéo dài 12 tuần và một thử nghiệm nhãn mở đa trung tâm riêng biệt kéo dài 52 tuần) đã chứng minh bằng chứng đáng kể về hiệu quả và độ an toàn của kem trifarotene 50 μg/g trong điều trị. mụn trứng cá ở mặt và hai chân vừa phải [29, 30]. Trong những thử nghiệm này, trifarotene có đặc điểm dung nạp có thể kiểm soát được. Ngứa và kích ứng da cục bộ dự kiến chỉ tồn tại trong thời gian ngắn và được cải thiện khi tiếp tục điều trị. Trifarotene hiện có sẵn dưới dạng kem 0,005% theo toa.
Liệu Pháp Kết Hợp
Retinoids tại chỗ có thể được sử dụng làm phương pháp điều trị duy nhất cho mụn trứng cá nhẹ đến trung bình, nhưng có thể đạt được hiệu quả tổng hợp khi chúng được kết hợp với một chất chống mụn trứng cá bổ sung. Việc kết hợp retinoid tại chỗ với clindamycin, BPO và/hoặc axit salicylic tại chỗ đã được chứng minh là có hiệu quả tốt hơn so với đơn trị liệu retinoid tại chỗ [26, 27]. Ưu điểm điều trị này phù hợp với cơ chế sinh bệnh đa yếu tố của mụn trứng cá [64–68]. Bằng cách nhắm mục tiêu đồng thời nhiều con đường với các thuốc phối hợp, việc loại bỏ các tổn thương có tốc độ nhanh hơn so với đơn trị liệu [69, 70]. Các liệu pháp kết hợp có sẵn của retinoids tại chỗ được liệt kê trong Bảng 5.2.
Tác Dụng Phụ
Các tác dụng ngoại ý trên da (AEs) được bệnh nhân báo lại với retinoids tại chỗ là phổ biến. Trong một số nghiên cứu, có tới 70% bệnh nhân được điều trị bằng retinoid tại chỗ đã báo cáo về các biến chứng ngoài da [71–73]. Cho đến nay, tác dụng phụ phổ biến nhất của retinoids tại chỗ là kích ứng da, đặc trưng bởi ban đỏ và da bị lột hoặc bong tróc. Tất cả các loại retinoid bôi tại chỗ đều tạo ra phản ứng này, được gọi là “viêm da retinoid”. và mức độ nghiêm trọng phụ thuộc vào độ mạnh của retinoid. Nó đã được chứng minh rằng việc giảm tạm thời tần suất, số lượng và/hoặc thời gian sử dụng retinoid giúp cải thiện ban đỏ và bong vảy. Các hiện tượng tại chỗ khác trên da bao gồm ngứa, rát, châm chích, khô và kích ứng. Việc sử dụng retinoids tại chỗ cũng dẫn đến giảm khả năng chịu bức xạ mặt trời. Do đó, việc bôi kem chống nắng phổ rộng nên được khuyến khích đặc biệt khi bệnh nhân đang được điều trị bằng các sản phẩm có chứa retinoid tại chỗ.
Bệnh nhân nên được tư vấn về những tác dụng phụ này và chúng thường là tạm thời và cải thiện khi tiếp tục sử dụng. Tình trạng bùng phát mụn trứng cá tạm thời có thể xảy ra trong những tuần đầu điều trị. Ngoài ra, bệnh nhân nên tránh sử dụng các sản phẩm bôi ngoài da gây kích ứng, xà phòng mài mòn và một số loại mỹ phẩm (tức là mỹ phẩm có chứa hạt vi hạt). Retinoids cũng được sử dụng vào buổi tối để giảm thiểu sự nhạy cảm với ánh sáng và tránh sự bất hoạt của retinoids bởi tia cực tím. Nếu không được tư vấn thích hợp, tác dụng phụ của việc sử dụng retinoid tại chỗ có thể khiến bệnh nhân không tuân thủ.
Điều quan trọng cần lưu ý là sự hấp thụ toàn thân của retinoids khi bôi tại chỗ là không đáng kể và nồng độ acid retinoic nội sinh trong máu không tăng lên khi bôi 0,025% tretinoin hai lần mỗi ngày lên hơn 40% diện tích cơ thể trong khoảng thời gian 1 tháng [74, 75]. Hơn nữa, sử dụng tretinoin tại chỗ có kiểm soát ở liều được sử dụng để điều trị mụn trứng cá (2 g gel 0,025% mỗi ngày bôi lên mặt, cổ và phần trên của ngực trong 14 ngày) ít ảnh hưởng đến nồng độ retinoid nội sinh trong huyết tương hơn so với ban ngày và các yếu tố dinh dưỡng [75]. Thật vậy, một nghiên cứu lớn dựa trên dân số đã chứng minh không có nguy cơ vượt trội về dị tật bẩm sinh ở con cái sinh ra từ những bà mẹ tiếp xúc với tretinoin tại chỗ trong thời kỳ mang thai [76]. Do đó, không có bằng chứng về khả năng gây quái thai của tretinoin tại chỗ khi sử dụng thích hợp cho người. Tuy nhiên, do khả năng gây quái thai nổi tiếng của retinoid toàn thân và mụn trứng cá không phải là tình trạng đe dọa đến tính mạng của mẹ hoặc thai nhi, nên nói chung nên ngừng điều trị retinoid tại chỗ trong thời kỳ mang thai. Tretinoin và adapalene là nhóm thai kỳ C, trong khi tazarotene thuộc nhóm thai kỳ X. Trifarotene chưa có phân loại thai nghén.
Retinoids Tại Chỗ Trong Điều Trị Di Chứng Mụn Trứng Cá
Hai di chứng được quan sát rộng rãi của mụn trứng cá bao gồm sẹo lõm và tăng sắc tố da sau viêm. Sẹo sau mụn trứng cá ảnh hưởng đến 95% số người bị mụn viêm [77]. Hơn nữa, có bằng chứng cho thấy sẹo mụn có thể là do tổn thương mụn trứng cá không viêm ban đầu [78]. Nó đã được khẳng định rõ ràng rằng retinoids tại chỗ hỗ trợ phục hồi collagen trong da bị tổn thương do ánh sáng bằng cách kích thích các nguyên bào sợi để tăng procollagen ở da, do đó bảo vệ chống lại sự mất procollagen do tia UV gây ra. [79–81]. Trong những năm gần đây, retinoids tại chỗ đã được khám phá để điều trị sẹo mụn. Peel da hóa học bằng tretinoin và điện di với tretinoin đã được chứng minh là có hiệu quả trong việc cải thiện sẹo nông liên quan đến mụn trứng cá [82–84]. Gần đây hơn, gel adapalene (0,1% và 0,3%) đã được chứng minh là cải thiện tình trạng sẹo lõm bao gồm độ mịn da và số lượng sẹo tổng thể [85–87]. Tazarotene 0,1% gel cũng được phát hiện có hiệu quả trong việc điều trị sẹo lõm sau mụn trứng cá và được ghi nhận là có hiệu quả tương tự như phi kim [88].
Tăng sắc tố sau viêm (PIH) thường xảy ra ở những bệnh nhân bị mụn trứng cá. PIH xảy ra thường xuyên hơn ở các loại da sẫm màu và có thể là một mối lo ngại về thẩm mỹ [89]. PIH liên quan đến mụn trứng cá xảy ra phổ biến hơn ở các loại da sẫm màu và được coi là phản ứng sinh lý bệnh mặc định của tế bào hắc tố đối với kích ứng hoặc viêm [90]. Cả ba loại retinoid bôi tại chỗ hiện có (tretinoin, adapalene và tazarotene) đã được chứng minh là có tác dụng ngăn ngừa và làm giảm tăng sắc tố da do mụn [91-93]. Mặc dù chưa được hiểu đầy đủ, nhưng retinoids được cho là làm giảm melanin biểu bì thông qua (1) sự ức chế trực tiếp hoạt động của tyrosinase và tyrosinase liên quan đến protein I (TRP-1), (2) giảm việc chuyển melanosomes từ melanocytes sang keratinocytes, và (3) tăng chu kỳ tế bào của các tế bào sừng chứa nhiều melanin [94].
Kết luận, retinoids tại chỗ là liệu pháp chính trong comedones bọc và mụn viêm. Chúng đã được chứng minh là an toàn và hiệu quả cao. Retinoids tại chỗ có hoạt tính chống mụn rộng và thích hợp để sử dụng lâu dài. Tretinoin, adapalene và tazarotene hiện đang được sử dụng rộng rãi dưới dạng đơn trị liệu và kết hợp với các chất chống mụn trứng cá khác. Trifarotene, một loại retinoid bôi ngoài da thế hệ thứ tư mới nổi có tác dụng chọn lọc đối với thụ thể RAR-γ, có thể cung cấp tác dụng phụ tốt hơn và khả năng dung nạp tổng thể cho bệnh nhân bị mụn trứng cá.
Tài Liệu Tham Khảo
1. Bhate K, Williams HC. Epidemiology of acne vulgaris. Br J Dermatol. 2013;168(3):474–85.
2. White GM. Recent findings in the epidemiologic evidence, classification, and subtypes of acne vulgaris. J Am Acad Dermatol. 1998;39:S34-7.
3. Goulden V, Stables GI, Cunliffe WJ. Prevalence of facial acne in adults. J Am Acad Dermatol. 1999;41:577–80.
4. Canavan TN, Chen E, Elewski BE. Optimizing non-antibiotic treatments for patients with acne: a review. Dermatol Ther (Heidelberg). 2016;6:555– 78
5. Cunliffe WJ, Holland DB, Clark SM, Stables GI. Comedogenesis: some new aetiological, clinical and therapeutic strategies. Br J Dermatol. 2000;142(6):1084–91.
6. Millikan LE. The rationale for using a topical retinoid for inflammatory acne. Am J Clin Dermatol. 2003;4(2):75–80.
7. Wilkinson RD, Adam JE, Murray JJ, Craig GE. Benzoyl peroxide and sulfur: foundation for acne management. Can Med Assoc J. 1966; 95(1):28–9.
8. Smith MA, Waterworth PM, Curwen MP. A controlled trial of oral antibiotics in the treatment of acne vulgaris. Br J Dermatol. 1962;74:86–90.
9. Maddin S. Current concepts in the management of acne vulgaris. Can Med Assoc J. 1969;100(7):340–3.
10. Wolbach SB, Howe PR. Tissue changes following deprivation of fat-soluble vitamin. J Exp Med. 1925;42:753–77.
11. Arens JF, van Dorp DA. Synthesis of some compounds possessing vitamin A activity. Nature. 1946;157:190.
12. Robeson CD, Blum WP, Dieterle JM, Cawley JD, Baxter JG. Chemistry of vitamin A. XXV. Geometrical isomers of vitamin A aldehyde and an isomer of its alpha-ionone analog. J Am Chem Soc. 1955;77:4120–5.
13. Kligman AM, Fulton JE Jr, Plewig G. Topical vitamin A acid in acne vulgaris. Arch Dermatol. 1969;99:469–76.
14. Kligman AM, Mills OH Jr, Leyden JJ, Fulton JE Jr. Postscript of vitamin A acid therapy for acne vulgaris. Arch Dermatol. 1973;107(2):296.
15. Bernard BA. Adapalene, a new chemical entity with retinoid activity. Skin Pharmacol. 1993;6(Suppl 1):61–9.
16. Shalita A, Weiss JS, Chalker DK, Ellis CN, Greenspan A, Katz HI, et al. A comparison of the efficacy and safety of adapalene gel 0.1% and tretinoin gel 0.025% in the treatment of acne vulgaris: a multicenter trial. J Am Acad Dermatol. 1996;34(3):482–5.
17. Madhu C, Duff S, Baumgarten V, Rix P, Small D, Tang-Liu D. Metabolic deesterification of tazarotene in human blood and rat and human liver microsomes. J Pharm Sci. 1997;86(8):972–4.
18. Shroot B, Michel S. Pharmacology and chemistry of adapalene. J Am Acad Dermatol. 1997;36(6 Pt 2):S96–103.
19. Verschoore M, Poncet M, Czernielewski J, Sorba V, Clucas A. Adapalene 0.1% gel has low skin-irritation potential. J Am Acad Dermatol. 1997;36(6 Pt 2):S104–9.
20. Foster RH, Brogden RN, Benfield P. Tazarotene. Drugs. 1998;55(5):705–11.
21. Tang-Liu DD, Matsumoto RM, Usansky JI. Clinical pharmacokinetics and drug metabolism of tazarotene: a novel topical treatment for acne and psoriasis. Clin Pharmacokinet. 1999;37(4):273–87.
22. Thiboutot D, Arsonnaud S, Soto P. Efficacy and tolerability of adapalene 0.3% gel compared to tazarotene 0.1% gel in the treatment of acne vulgaris. J Drugs Dermatol. 2008;7(6 Suppl):s3–10.
23. Pariser D, Colon LE, Johnson LA, Gottschalk RW. Adapalene 0.1% gel compared to tazarotene 0.1% cream in the treatment of acne vulgaris. J Drugs Dermatol. 2008;7(6 Suppl):s18–23.
24. Tanghetti E, Dhawan S, Green L, Del Rosso J, Draelos Z, Leyden J. Randomized comparison of the safety and efficacy of tazarotene 0.1% cream and adapalene 0.3% gel in the treatment of patients with at least moderate facial acne vulgaris. J Drugs Dermatol. 2010;9(5):549–58.
25. Kircik LH. Tretinoin microsphere gel pump 0.04% versus tazarotene cream 0.05% in the treatment of mild-to-moderate facial acne vulgaris. J Drugs Dermatol. 2009;8(7):650–4.
26. Tan J, Gollnick HP, Loesche C, Ma YM, Gold LS. Synergistic efficacy of adapalene 0.1%-benzoyl peroxide 2.5% in the treatment of 3855 acne vulgaris patients. J Dermatolog Treat. 2011;22(4):197–205.
27. Saihan EM, Burton JL, Meyrick G, Speller DC, Thornton E, Chestney V. The effect of a topical antibiotic preparation in acne vulgaris–a controlled clinical and laboratory study. Br J Clin Pract. 1981;35(3):106–9.
28. Thoreau E, Arlabosse JM, Bouix-Peter C, Chambon S, Chantalat L, Daver S, et al. Structure- based design of Trifarotene (CD5789), a potent and selective RARγ agonist for the treatment of acne. Bioorg Med Chem Lett. 2018;28(10):1736–41.
29. Tan J, Thiboutot D, Popp G, Gooderham M, Lynde C, Del Rosso J, et al. Randomized phase 3 evaluation of trifarotene 50 μg/g cream treatment of moderate facial and truncal acne. J Am Acad Dermatol. 2019;80(6):1691–9.
30. Blume-Peytavi U, Fowler J, Kemeny L, Draelos Z, Cook-Bolden F, Dirschka T, et al. Long-term safety and efficacy of trifarotene 50μg/g cream, a first-in-class RAR-γ selective topical retinoid, in patients with moderate facial and truncal acne. J Eur Acad Dermatol Venereol. 2020;34:166–73. https://doi.org/10.1111/jdv.15794.
31. Kang S. The mechanism of action of topical retinoids. Cutis. 2005;75(2 Suppl):10–3; discussion 13.
32. Fisher GJ, Reddy AP, Datta SC, Kang S, Yi JY, Chambon P, et al. All-trans retinoic acid induces cellular retinol-binding protein in human skin in vivo. J Invest Dermatol. 1995;105(1):80–6.
33. Meisler NT, Parrelli J, Gendimenico GJ, Mezick JA, Cutroneo KR. All-trans-retinoic acid inhibition of Pro alpha1(I) collagen gene expression in fetal rat skin fibroblasts: identification of a retinoic acid response element in the Pro alpha1(I) collagen gene. J Invest Dermatol. 1997;108(4):476– 81.
34. Li XY, Xiao JH, Feng X, Qin L, Voorhees JJ. Retinoid X receptor-specific ligands synergistically upregulate 1, 25-dihydroxyvitamin D3-dependent transcription in epidermal keratinocytes in vitro and in vivo. J Invest Dermatol. 1997;108(4):506–12.
35. Yaar M, Stanley JR, Katz SI. Retinoic acid delays the terminal differentiation of keratinocytes in suspension culture. J Invest Dermatol. 1981;76(5):363–6.
36. Schiltz JR, Lanigan J, Nabial W, Petty B, Birnbaum JE. Retinoic acid induces cyclic changes in epidermal thickness and dermal collagen and glycosaminoglycan biosynthesis rates. J Invest Dermatol. 1986;87(5):663–7.
37. Czernielewski J, Michel S, Bouclier M, Baker M, Hensby JC. Adapalene biochemistry and the evolution of a new topical retinoid for treatment of acne. J Eur Acad Dermatol Venereol. 2001;15(Suppl 3):5–12.
38. Iwata M, Eshima Y, Kagechika H. Retinoic acids exert direct effects on T cells to suppress Th1 development and enhance Th2 development via retinoic acid receptors. Int Immunol. 2003;15(8):1017–25.
39. Authier FJ, Belec L, Levy Y, Lefaucheur JP, Defer GL, Degos JD, et al. All-trans-retinoic acid in POEMS syndrome. Therapeutic effect associated with decreased circulating levels of proinflammatory cytokines. Arthritis Rheum. 1996;39(8):1423–6.
40. Liu PT, Krutzik SR, Kim J, Modlin RL. Cutting edge: all-trans retinoic acid down-regulates TLR2 expression and function. J Immunol. 2005;174(5):2467–70.
41. Tenaud I, Khammari A, Dreno B. In vitro modulation of TLR-2, CD1d and IL-10 by adapalene on nor- mal human skin and acne inflammatory lesions. Exp Dermatol. 2007;16(6):500–6.
42. Geiger JM. Retinoids and sebaceous gland activity. Dermatology. 1995;191(4):305–10.
43. Sato T, Akimoto N, Kitamura K, Kurihara H, Hayashi N, Ito A. Adapalene suppresses sebum accumulation via the inhibition of triacylglycerol biosynthesis and perilipin expression in differentiated hamster sebocytes in vitro. J Dermatol Sci. 2013;70(3):204–10.
44. Clayton RW, Gobel K, Niessen CM, Paus R, van Steensel MAM, Lim X. Homeostasis of the sebaceous gland and mechanisms of acne pathogenesis. Br J Dermatol. 2019;181:677–90. https://doi.org/10.1111/ bjd.17981.
45. Kligman AM. The treatment of acne with topical retinoids: one man’s opinions. J Am Acad Dermatol. 1997;36(6 Pt 2):S92–5.
46. Kurlandsky SB, Duell EA, Kang S, Voorhees JJ, Fisher GJ. Auto-regulation of retinoic acid biosynthesis through regulation of retinol esterification in human keratinocytes. J Biol Chem. 1996;271:15346–52.
47. O’Byrne SM, Blaner WS. Retinol and retinyl esters: biochemistry and physiology. J Lipid Res. 2013;54(7):1731–43.
48. Wongsiriroj N, Piantedosi R, Palczewski K, Goldberg IJ, Johnston TP, Li E, et al. The molecular basis of retinoid absorption: a genetic dissection. J Biol Chem. 2008;283(20):13510–9.
49. Siegenthaler G, Saurat JH, Morin C, Hotz R. Cellular retinol- and retinoic acid-binding proteins in the epidermis and dermis of normal human skin. Br J Dermatol. 1984;111(6):647–54.
50. Elder JT, Astrom A, Pettersson U, Tavakkol A, Griffiths CE, Krust A, et al. Differential regulation of retinoic acid receptors and binding proteins in human skin. J Invest Dermatol. 1992;98(5):673–9.
51. Heyman RA, Mangelsdorf DJ, Dyck JA, Stein RB, Eichele G, Evans RM, et al. 9-cis retinoic acid is a high affinity ligand for the retinoid X receptor. Cell. 1992;68(2):397–406.
52. Griffiths CE, Ancian P, Humphries J, Poncet M, Rizova E, Michel S, et al. Adapalene 0.1% gel and adapalene 0.1% cream stimulate retinoic acid receptor mediated gene transcription without significant irritative effects in the skin of healthy human volunteers. Br J Dermatol. 1998;139(Suppl 52):12–6.
53. Griffiths CE, Elder JT, Bernard BA, Rossio P, Cromie MA, Finkel LJ, et al. Comparison of CD271 (adapalene) and all-trans retinoic acid in human skin: dissociation of epidermal effects and CRABP-II mRNA expression. J Invest Dermatol. 1993;101(3):325–8.
54. Hensby C, Cavey D, Bouclier M, Chatelus A, Algate D, Eustache J, et al. The in vivo and in vitro anti-inflammatory activity of CD271: a new retinoid-like modulator of cell differentiation. Agents Actions. 1990;29(1–2):56–8.
55. Thielitz A, Krautheim A, Gollnick H. Update in retinoid therapy of acne. Dermatol Ther. 2006;19:272–9.
56. Khalil S, Bardawil T, Stephan C, Darwiche N, Abbas O, Kibbi AG, et al. Retinoids: a journey from the molecular structures and mechanisms of action to clinical uses in dermatology and adverse effects. J Dermatolog Treat. 2017;28(8):684–96.
57. Esgleyes-Ribot T, Chandraratna RA, Lew-Kaya DA, Sefton J, Duvic M. Response of psoriasis to a new topical retinoid, AGN 190168. J Am Acad Dermatol. 1994;30(4):581–90.
58. Nagpol S, Thacker SM, Patel S, Friant S, Malhotra M, Shafer J, et al. Negative regulation of two hyperproliferative keratinocytes differentiation markers by a retinoic acid recptor-specific retinoid: insight into the mechanism of retinoid action in psoriasis. Cell Growth Differ. 1996;7(12):1783–91.
59. Smith JA, Narahari S, Hill D, Feldman SR. Tazarotene foam, 0.1%, for the treatment of acne. Expert Opin Drug Saf. 2016;15(1):99–103.
60. Gregoriou S, Kritsotaki E, Katoulis A, Rigopoulos D. Use of tazarotene foam for the treatment of acne vulgaris. Clin Cosmet Investig Dermatol. 2014;7:165–70.
61. Weinstein GD, Krueger GG, Lowe NJ, Duvic M, Friedman DJ, Jegasothy BV. Tazarotene Gel, a new retinoid, for topical therapy of psoriasis: vehicle-controlled study of safety, efficacy and duration of therapeutic effect. J Am Acad Dermatol. 1997;37(1):85–92.
62. Marks R. Pharmacokinetics and safety review of tazarotene. J Am Acad Dermatol. 1998;39(4 Pt 2):S134–8.
63. Aubert J, Piwnica D, Bertino B, Blanchet- Rethore S, Carlavan I, Deret S, et al. Nonclinical and human pharmacology of the potent and selective topical retinoic acid receptor-γ agonist trifarotene. Br J Dermatol. 2018;179(2):442–56.
64. Kligman AM, Mills OH, McGinley KJ, Leyden JJ. Acne therapy with tretinoin in combination with antibiotics. Acta Derm Venereol. 1975;74(suppl):111–5.
65. Leyden JJ. A review of the use of combination therapies for the treatment of acne vulgaris. J Am Acad Dermatol. 2003;49(3 suppl):S200–10.
66. Campbell JL Jr. A comparative review of the efficacy and tolerability of retinoid-containing combination regimens for the treatment of acne vulgaris. J Drugs Dermatol. 2007;6(6):625–9.
67. Webster G. Mechanism-based treatment of acne vulgaris: the value of combination therapy. J Drugs Dermatol. 2005;4(3):281–8.
68. Weiss JS, Shavin JS. Topical retinoid and antibiotic combination therapy for acne management. J Drugs Dermatol. 2004;3(2):146–54.
69. Tan JK. Adapalene 0.1% and benzoyl peroxide 2.5%: a novel combination for treatment of acne vulgaris. Skin Therapy Lett. 2009;14(6):4–5.
70. Ochsendorf F. Clindamycin phosphate 1.2%/tretinoin 0.025%: a novel fixed-dose combination treatment for acne vulgaris. J Eur Acad Dermatol Venereol. 2015;29(Suppl 5):8–13. 5 Topical Retinoids and Acne
71. Sevimli Dikicier B. Topical treatment of acne vulgaris: efficiency, side effects, and adherence rate. J Int Med Res. 2019;47(7):2987–92.
72. Rao GR, Ghosh S, Dhurat R, Sharma A, Dongre P, Baliga VP. Efficacy, safety, and tolerability of microsphere apalene vs. conventional adapalene for acne vulgaris. Int J Dermatol. 2009;48(12):1360–5.
73. Kang S, Krueger GG, Tanghetti EA, Lew-Kaya D, Sefton J, Walker PS, et al. Tazarotene Cream in Photodamage Study Group. A multicenter, randomized, double-blind trial of tazarotene 0.1% cream in the treatment of photodamage. J Am Acad Dermatol. 2005;52(2):268–74.
74. Latriano L, Tzimas G, Wong F, Wills RJ. The percutaneous absorption of topically applied tretinoin and its effect on endogenous concentrations of tretinoin and its metabolites after single doses or long-term use. J Am Acad Dermatol. 1997;36(3 Pt 2):S37–46.
75. Buchan P, Eckhoff C, Caron D, et al. Repeated topical administration of all-trans-retinoic acid and plasma levels of retinoic acids in humans. J Am Acad Dermatol. 1994;30(3):428–34.
76. Shapiro S, Heremans A, Mays DA, Martin AL, Hernandez-Medina M, Lanes S. Use of topical tretinoin and the development of noncutaneous adverse events: evidence from a systematic review of the literature. J Am Acad Dermatol. 2011;65(6):1194–201.
77. Layton AM, Henderson CA, Cunliffe WJ. A clinical evaluation of acne scarring and its incidence. Clin Exp Dermatol. 1994;19(4):303–8.
78. Do TT, Zarkhin S, Orringer JS, Nemeth S, Hamilton T, Sachs D, et al. Computer-assisted alignment and tracking of acne lesions indicate that most inflammatory lesions arise from comedones and de novo. J Am Acad Dermatol. 2008;58(4):603–8.
79. Griffiths CE, Russman AN, Majmudar G, Singer RS, Hamilton TA, Voorhees JJ. Restoration of collagen formation in photodamaged human skin by tretinoin (retinoic acid). N Engl J Med. 1993;329:530–5.
80. Cho S, Lowe L, Hamilton TA, Fisher GJ, Voorhees JJ, Kang S. Long-term treatment of photoaged human skin with topical retinoic acid improves epidermal cell atypia and thickens the collagen band in papillary dermis. J Am Acad Dermatol. 2005;53:769–74.
81. Fisher GJ, Datta S, Wang Z, Li XY, Quan T, Chung JH. c-Jun-dependent inhibition of cutaneous procollagen transcription following ultraviolet irradiation is reversed by all-trans retinoic acid. J Clin Invest. 2000;106(5):663–70.
82. Sumita JM, Leonardi GR, Bagatin E. Tretinoin peel: a critical view. An Bras Dermatol. 2017;92(3):363–6.
83. Schmidt JB, Donath P, Hannes J, Perl S, Neumayer R, Reiner A. Tretinoin-iontophoresis in atrophic acne scars. Int J Dermatol. 1999;38:149– 53.
84. Knor T. Flattening of atrophic acne scars by using tretinoin by iontophoresis. Acta Dermatovenerol Croat. 2004;12(2):84–91.
85. Tan J, Tanghetti E, Baldwin H, Stein Gold L, Lain E. The role of topical retinoids in prevention and treatment of atrophic acne scarring: understanding the importance of early effective treatment. J Drugs Dermatol. 2019;18(3):255–60.
86. Dreno B, Bissonnette R, Gagne-Henley A, Barankin B, Lynde C, Kerrouche N, et al. Prevention and reduction of atrophic acne scars with adapalene 0.3%/benzoyl peroxide 2.5% gel in subjects with moderate or severe facial acne: results of a 6-month randomized, vehicle-controlled trial using intra-individual comparison. Am J Clin Dermatol. 2018;19(2):275–86.
87. Loss MJ, Leung S, Chien A, Kerrouche N, Fischer AH, Kang S. Adapalene 0.3% gel shows efficacy for the treatment of atrophic acne scars. Dermatol Ther (Heidelberg). 2018;8(2):245–57.
88. Afra TP, Razmi TM, Narang T, Dogra S, Kumar A. Topical tazarotene gel, 0.1%, as a novel treatment approach for atrophic postacne scars: a randomized active-controlled clinical trial. JAMA Facial Plast Surg. 2019;21(2):125–32.
89. Kenney JA Jr. Pigmentary disorders in black skin. Clin Dermatol. 1989;7:1–10.
91. Bulengo-Ransby SM, Griffiths CE, Kimbrough- Green CK, Finkel LJ, Hamilton TA, Ellis CN, et al. Topical tretinoin (retinoic acid) therapy for hyperpigmented lesions caused by inflammation of the skin in black patients. N Engl J Med. 1993;328(20):1438–43.
92. Grimes P, Callender V. Tazarotene cream for postinflammatory hyperpigmentation and acne vulgaris in darker skin: a double-blind, randomized, vehicle-controlled study. Cutis. 2006;77(1):45–50.
93. DuBois J,Ong GCW, Petkar G, Almeida LMC, Chavda R, Kerouche N, et al. Patient-Reported outcomes in ane patients with skin of color using adapalene 0.3%-benzoyl peroxide 2.5%: a prospective real-world study. J Drugs Dermatol. 2019;18(5):514.
94. Wolverton SE. Comprehensive dermatologic drug therapy. 3rd ed. Edinburgh: Saunders/Elsevier; 2013. 95. Baert B, De Spiegeleer B. Local skin pharmacokinetics of talarozole, a new retinoic acid metabolism-blocking agent. Skin Pharmacol Physiol. 2011;24(3):151–9.
95. BS, Trương Minh Tấn Vũ, Vai trò của Retinoid trong điều trị mụn trứng cá. Truy cập 18/5/2024.
Xuất xứ: Pháp
Xuất xứ: Canada
Xuất xứ: Mỹ