Ramucirumab
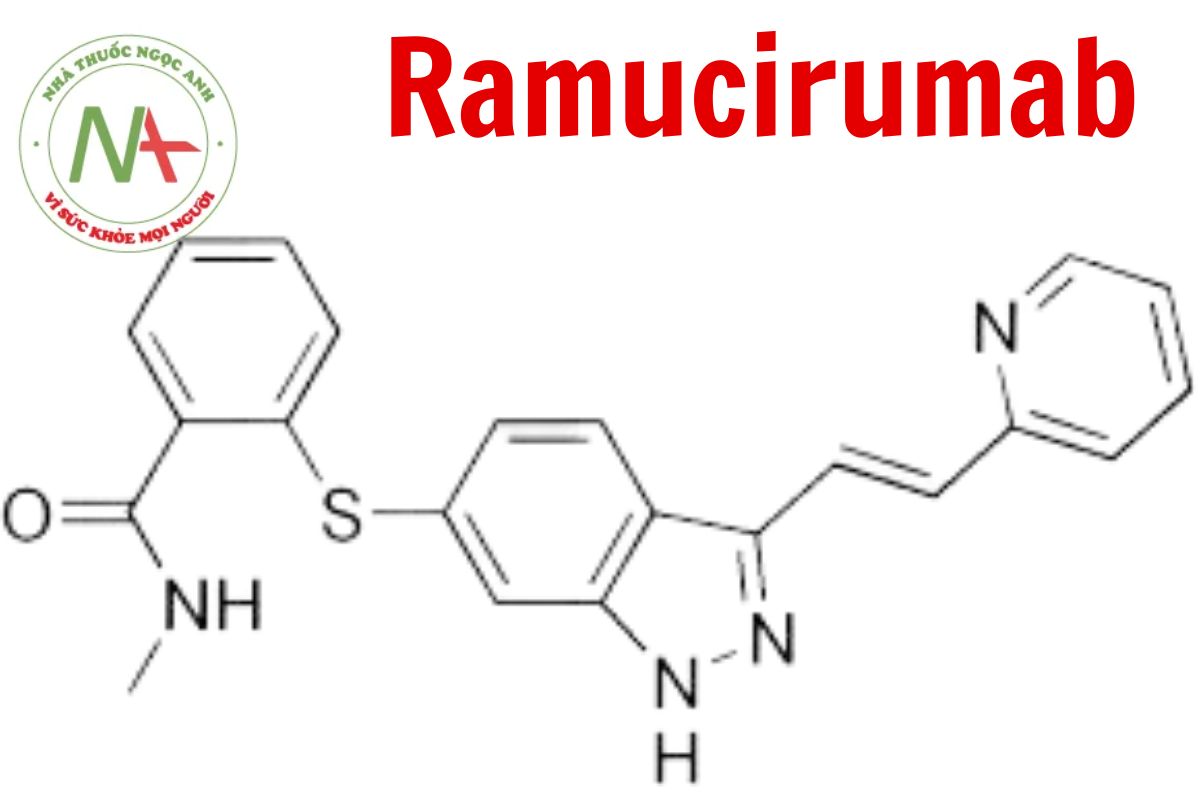
Danh pháp
Tên chung quốc tế
Nhóm thuốc
Ramucirumab thuộc nhóm nào? Thuốc chống ung thư
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Chất chống ung thư
L01F – Kháng thể đơn dòng và thuốc kháng thể liên hợp
L01FG – Chất ức chế Vegf/vegfr (yếu tố tăng trưởng nội mô mạch máu)
L01FG02 – Ramucirumab
Mã UNII
D99YVK4L0X
Mã CAS
947687-13-0
Cấu trúc phân tử
Công thức phân tử
C6374H9864N1692O1996S46
Phân tử lượng
143600
Cấu trúc phân tử
Cảm quan
Dung dịch trong suốt đến hơi trắng đục, không màu đến hơi vàng
Dạng bào chế
Thuốc tiêm: Dung dịch 100 mg/10 mL (10 mg mỗi mL), lọ liều đơn; Dung dịch 500 mg/50 mL (10 mg mỗi mL), lọ đơn liều
Nguồn gốc
Vào ngày 21 tháng 4 năm 2014, Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt Ramucirumab như một phương pháp điều trị đơn độc cho ung thư biểu mô tuyến nối dạ dày-thực quản, ung thư dạ dày tiến triển sau khi điều trị trước đó bằng hóa trị liệu có chứa fluoropyrimidine – hoặc bạch kim. Sự chấp thuận dựa trên kết quả của thử nghiệm REGARD, một nghiên cứu quốc tế, giai đoạn III, ngẫu nhiên, mù đôi, có đối chứng với giả dược, đánh giá tính an toàn và hiệu quả của Ramucirumab kết hợp với chăm sóc hỗ trợ tốt nhất so với giả dược. Thử nghiệm này đã bị chỉ trích vì sử dụng giả dược, điều này không phản ánh tiêu chuẩn chăm sóc ở hầu hết các nước phương Tây.
Ramucirumab cũng đã được nghiên cứu kết hợp với paclitaxel (một loại hóa trị liệu) và đã nhận được sự chấp thuận bổ sung của FDA vào ngày 5 tháng 11 năm 2014 như một phương pháp điều trị cho những người bị ung thư dạ dày tiến triển hoặc ung thư biểu mô tuyến GEJ sau khi điều trị trước đó bằng hóa trị liệu dựa trên fluoropyrimidine hoặc bạch kim. Sự chấp thuận dựa trên kết quả của thử nghiệm RAINBOW, so sánh Ramucirumab cộng với paclitaxel hoặc paclitaxel đơn độc.
Vào ngày 12 tháng 12 năm 2014, FDA đã phê duyệt Ramucirumab kết hợp với docetaxel để điều trị ung thư biểu mô phổi không phải tế bào nhỏ di căn (NSCLC) có tiến triển bệnh trong hoặc sau khi hóa trị liệu bước đầu có chứa bạch kim . Sự chấp thuận được dựa trên thử nghiệm REVEL.
Vào ngày 24 tháng 4 năm 2015, Ramucirumab đã được FDA chấp thuận để điều trị cho bệnh nhân ung thư đại trực tràng di căn (mCRC) tiến triển bệnh trong hoặc sau khi điều trị trước đó bằng bevacizumab , oxaliplatin và fluoropyrimidine . Sự chấp thuận dựa trên kết quả của thử nghiệm RAISE, một nghiên cứu pha III, so sánh Ramucirumab cộng với irinotecan , axit folinic và 5-fluorouracil ( FOLFIRI ) với FOLFIRI đơn độc.
Vào ngày 10 tháng 5 năm 2019, Ramucirumab đã được FDA chấp thuận là thuốc điều trị đơn trị liệu ung thư biểu mô tế bào gan (HCC) ở những bệnh nhân có alpha fetoprotein (AFP) > 400 ng/mL và đã được điều trị bằng sorafenib trước đó.] Việc phê duyệt dựa trên REACH-2 (NCT02435433), một nghiên cứu đa trung tâm, ngẫu nhiên, có đối chứng với giả dược, mù đôi đa trung tâm ở những bệnh nhân mắc HCC giai đoạn tiến triển với AFP > 400 ng/mL có tiến triển bệnh trong hoặc sau khi dùng sorafenib hoặc những người không khoan dung. Thời gian sống còn toàn bộ trung bình ước tính (HĐH) là 8,5 tháng (7,0-10,6 tháng) đối với bệnh nhân dùng Ramucirumab và 7,3 tháng (5,4-9,1 tháng) đối với những bệnh nhân dùng giả dược.
Độ ổn định và điều kiện bảo quản
Bảo quản lọ trong tủ lạnh ở 2 °C đến 8 °C (36 °F đến 46 °F) cho đến khi sử dụng, tránh ánh sáng. Không được để lọ đông lạnh hay lắc lọ.
Dược lý và cơ chế hoạt động
Ramucirumab là chất đối kháng trực tiếp VEGFR2 , liên kết với ái lực cao với miền ngoại bào của VEGFR2 và ngăn chặn sự liên kết của các phối tử VEGFR tự nhiên (VEGF-A , VEGF-C và VEGF-D ). Các phối tử này được tiết ra bởi các khối u rắn để thúc đẩy sự hình thành mạch (hình thành các mạch máu mới từ các mạch máu có sẵn) và tăng cường cung cấp máu cho khối u. Liên kết của Ramucirumab với VEGFR2 dẫn đến ức chế sự hình thành khối u qua trung gian VEGF. Ramucirumab là một kháng thể đơn dòng immunoglobulin G1 tái tổ hợp của người liên kết với miền liên kết ngoại bào của VEGFR-2 và ngăn chặn sự liên kết của các phối tử VEGFR: VEGF-A, VEGF-C và VEGF-D. Thông qua việc ngăn chặn kích hoạt VEGFR-2 bởi VEGF-A và các phối tử VEGF khác, ramucirumab ức chế các con đường hình thành mạch liên quan đến sự phát triển và tiến triển của ung thư dạ dày.
Dược động học
Hiện nay các thông tin về dược động học của Ramucirumab còn hạn chế. Thể tích phân bố trung bình ở trạng thái ổn định của Ramucirumab là 5,5 L. Ramucirumab có độ thanh thải là 0,014 L/giờ với thời gian bán thải khoảng 15 ngày.
Ứng dụng Ramucirumab trong y học
Ramucirumab là thuốc gì?
- Ramucirumab được sử dụng để điều trị ung thư đại trực tràng, điều trị ung thư dạ dày
- Dùng trong điều trị ung thư phổi.
- Ramucirumab có thể được dùng đơn trị hoặc kết hợp với các loại thuốc trị ung thư khác .
- Ramucirumab thường được dùng ở bệnh nhân bị thất bại với các phương pháp điều trị khác.
Tác dụng phụ
- Các tác dụng phụ phổ biến nhất trong một nghiên cứu điều tra đơn trị liệu bằng Ramucirumab là tiêu chảy (14% bệnh nhân, so với 9% ở nhóm dùng giả dược ), hạ natri máu (nồng độ natri trong máu thấp ; 6% so với 2%), đau đầu (9% so với 3%) và huyết áp cao (16% so với 8%).
- Ramucirumab có thể làm tăng nguy cơ chảy máu nghiêm trọng.
- Ramucirumab có thể gây ra tác dụng phụ nghiêm trọng:
- Dấu hiệu chảy máu dạ dày – đau dạ dày dữ dội
- Phân có máu
- Bệnh nhân có thể bị ho ra máu.
- Bệnh nhân bị thương nhưng không lành
- Nhức đầu , lú lẫn, thay đổi trạng thái tinh thần, giảm thị lực, co giật (co giật)
- Buồn nôn , nôn , hoặc tiêu chảy nghiêm trọng hoặc liên tục
- Tăng cân nhanh chóng.
- Giảm số lượng bạch cầu, đau họng, lở da, lở miệng, ho, sốt, khó thở
- Các vấn đề về thận – mắt sưng húp, sưng ở mắt cá chân hoặc bàn chân, tăng cân, nước tiểu có bọt
- Các triệu chứng của cục máu đông – tê hoặc yếu đột ngột (đặc biệt dễ xảy ra tình trạng đau ở một bên cơ thể), các vấn đề về thị lực, nói lắp, đau đầu dữ dội đột ngột hoặc thăng bằng
- Triệu chứng đau tim – đau hoặc tức ngực.
- Bệnh nhân có thể bị đau lan đến hàm hoặc vai
- Tiêu hóa: buồn nôn.
- Toàn thân: đổ mồ hôi.
- Các tác dụng phụ thường gặp của Ramucirumab có thể bao gồm: Vết loét hoặc mảng trắng trong hoặc xung quanh miệng, nướu đỏ hoặc sưng, khó nuốt hoặc nói, khô miệng, hôi miệng, thay đổi vị giác, cảm thấy yếu hoặc mệt mỏi, tiêu chảy, chán ăn, chảy máu mũi, số lượng bạch cầu thấp, huyết áp cao.
Độc tính ở người
Độc tính của Ramucirumab có các triệu chứng bao gồm về biến cố thuyên tắc huyết khối động mạch, tăng huyết áp, phản ứng liên quan đến truyền dịch, thủng đường tiêu hóa, tình trạng lâm sàng xấu đi ở bệnh nhân xơ gan và hội chứng bệnh não chất trắng phía sau có thể đảo ngược. Các phản ứng phổ biến nhất được quan sát thấy ở những bệnh nhân được điều trị với tỷ lệ >10% và cao hơn >2% so với giả dược là tăng huyết áp và tiêu chảy. Các phản ứng tác dụng phụ phổ biến nhất khi dùng Ramucirumab cộng với paclitaxel với tỷ lệ >30% và cao hơn >2% so với giả dược cộng với paclitaxel là mệt mỏi, giảm bạch cầu trung tính, tiêu chảy và chảy máu cam.
Các biến cố thuyên tắc huyết khối động mạch (ATE) nghiêm trọng, đôi khi gây tử vong bao gồm nhồi máu cơ tim, ngừng tim, tai biến mạch máu não và thiếu máu não đã được báo cáo trong các thử nghiệm lâm sàng. Ramucirumab đã làm tăng nguy cơ xuất huyết và xuất huyết đường tiêu hóa, bao gồm các biến cố xuất huyết nghiêm trọng và đôi khi gây tử vong. Hội chứng bệnh não chất trắng phía sau có hồi phục (RPLS) đã được báo cáo với tỷ lệ <0,1% trong các nghiên cứu lâm sàng với Cyramza.
Các nghiên cứu trên động vật cho thấy Tiêm tĩnh mạch Ramucirumab cho khỉ cynomolgus được dung nạp tốt và không quan sát thấy phản ứng phụ liên quan đến điều trị tại chỗ tiêm. Ramucirumab được dung nạp tốt trong một nghiên cứu độc tính liều lặp lại kéo dài 5 tuần trên khỉ cynomolgus ở các mức liều từ 4 đến 40 mg/kg cho 4 liều. Tấm tăng trưởng xương và thận được xác định là cơ quan đích của độc tính Ramucirumab sau khi tiêm tĩnh mạch hàng tuần cho khỉ trong 39 tuần. Không quan sát thấy tác dụng phụ nào liên quan đến điều trị trên các mô sinh sản của nam giới hoặc nữ giới trong nghiên cứu kéo dài 5 tuần hoặc 39 tuần.
Tính an toàn
- Phụ nữ có thai: Ramucirumab có thể gây hại cho thai nhi vì vậy không dùng Ramucirumab cho nhóm đối tượng này.
- Khả năng sinh sản: Ramucirumab có thể ảnh hưởng đến khả năng sinh sản.
- Phụ nữ cho con bú: không nên cho con bú trong khi sử dụng Ramucirumab.
Tương tác với thuốc khác
- Trong các nghiên cứu, không có tương tác nào được ghi nhận với paclitaxel , docetaxel hoặc irinotecan
Lưu ý khi sử dụng
- Theo sự chấp thuận của Châu Âu, liệu pháp NSCLC với Ramucirumab bị chống chỉ định khi có khối u tạo hang hoặc nếu có liên quan đến các mạch máu lớn.
- Ramucirumab có thể làm tăng nguy cơ chảy máu nghiêm trọng. Ngừng sử dụng Ramucirumab và gọi cho bác sĩ ngay nếu bạn bị đau dạ dày nghiêm trọng, phân có máu hoặc hắc ín, ho ra máu hoặc bất kỳ chảy máu nặng hoặc bất thường nào.
- Không nên sử dụng Ramucirumab nếu bệnh nhân bị cao huyết áp không kiểm soát được .
- Báo cho bác sĩ nếu bệnh nhân đã từng có:
- Huyết áp cao
- Rối loạn tuyến giáp
- Có vết mổ chưa lành từ cuộc phẫu thuật gần đây.
- Sử dụng biện pháp tránh thai để tránh mang thai trong khi bạn đang dùng Ramucirumab và trong ít nhất 3 tháng sau khi kết thúc điều trị.
- Điều trị bằng Ramucirumab nên được thực hiện thận trọng cho bệnh nhân bị rối loạn chức năng tuyến giáp. Nên đo chức năng tuyến giáp trong phòng thí nghiệm cơ bản và nếu thích hợp, nên tiến hành điều trị theo thực hành y tế tiêu chuẩn trước khi bắt đầu điều trị. Theo dõi lâm sàng chức năng tuyến giáp được khuyến cáo trong quá trình điều trị.
Một vài nghiên cứu của Ramucirumab trong Y học
Ramucirumab đơn trị liệu cho ung thư biểu mô tuyến dạ dày hoặc ung thư biểu mô tuyến nối dạ dày-thực quản tiến triển đã được điều trị trước đó (REGARD): một thử nghiệm giai đoạn 3 quốc tế, ngẫu nhiên, đa trung tâm, có đối chứng với giả dược.

Bối cảnh: Yếu tố tăng trưởng nội mô mạch máu (VEGF) và tín hiệu qua trung gian thụ thể VEGF-2 (VEGFR-2) và sự hình thành mạch có thể góp phần vào quá trình sinh bệnh và tiến triển của ung thư dạ dày. Nghiên cứu được tiến hành với mục đích đánh giá hiệu quả của Ramucirumab, một kháng thể đơn dòng đối kháng VEGFR-2, có kéo dài thời gian sống sót ở bệnh nhân ung thư dạ dày tiến triển hay không.
Phương pháp: Một thử nghiệm quốc tế đã được tiến hành ngẫu nhiên, mù đôi, kiểm soát giả dược, giai đoạn 3 từ ngày 6 tháng 10 năm 2009 đến ngày 26 tháng 1 năm 2012, tại 119 trung tâm ở 29 quốc gia ở Bắc Mỹ, Trung và Nam Mỹ, Châu Âu, Châu Á, Úc , và Châu Phi. Bệnh nhân ở độ tuổi 24-87 bị ung thư biểu mô tuyến dạ dày hoặc đoạn nối dạ dày-thực quản tiến triển và bệnh tiến triển sau hóa trị liệu bước đầu có chứa platinum hoặc fluoropyrimidine được chỉ định ngẫu nhiên (2:1), nhận chăm sóc hỗ trợ tốt nhất cộng với Ramucirumab 8 mg/kg hoặc giả dược, tiêm tĩnh mạch 2 tuần một lần. Các nghiên cứu được tiến hành mù đôi cả người tình nguyện và cán bộ nhân viên y tế đều không biết ai được nhận giả dược ai dùng thuốc điều trị. Các điểm chính là sự sống còn tổng thể.
Kết quả: 355 bệnh nhân được chỉ định dùng Ramucirumab (n=238) hoặc giả dược (n=117). Thời gian sống trung bình toàn bộ là 5•2 tháng ở những bệnh nhân trong nhóm Ramucirumab và 3•8 tháng ở những bệnh nhân trong nhóm giả dược. Lợi ích sống còn với Ramucirumab vẫn không thay đổi sau khi điều chỉnh đa biến đối với các yếu tố tiên lượng khác. Tỷ lệ tăng huyết áp ở nhóm Ramucirumab cao hơn so với nhóm giả dược, trong khi tỷ lệ các tác dụng phụ khác hầu như tương tự giữa các nhóm. Năm trường hợp tử vong ở nhóm Ramucirumab và hai trường hợp ở nhóm giả dược được coi là có liên quan đến thuốc nghiên cứu.
Giải thích: Ramucirumab là phương pháp điều trị sinh học đầu tiên được đưa ra dưới dạng một loại thuốc duy nhất có lợi ích sống còn ở những bệnh nhân ung thư biểu mô tuyến dạ dày hoặc ung thư biểu mô tuyến nối dạ dày-thực quản tiến triển sau hóa trị liệu bước đầu. Phát hiện của nghiên cứu đã xác nhận tín hiệu VEGFR-2 là mục tiêu điều trị quan trọng trong ung thư dạ dày tiến triển.
Tài liệu tham khảo
- Thư viện y học quốc gia, Ramucirumab , pubchem. Truy cập ngày 02/08/2023.
- Charles S Fuchs , Jiri Tomasek , Cho Jae Yong , Filip Dumitru. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial ,pubmed.com. Truy cập ngày 02/08/2023.
