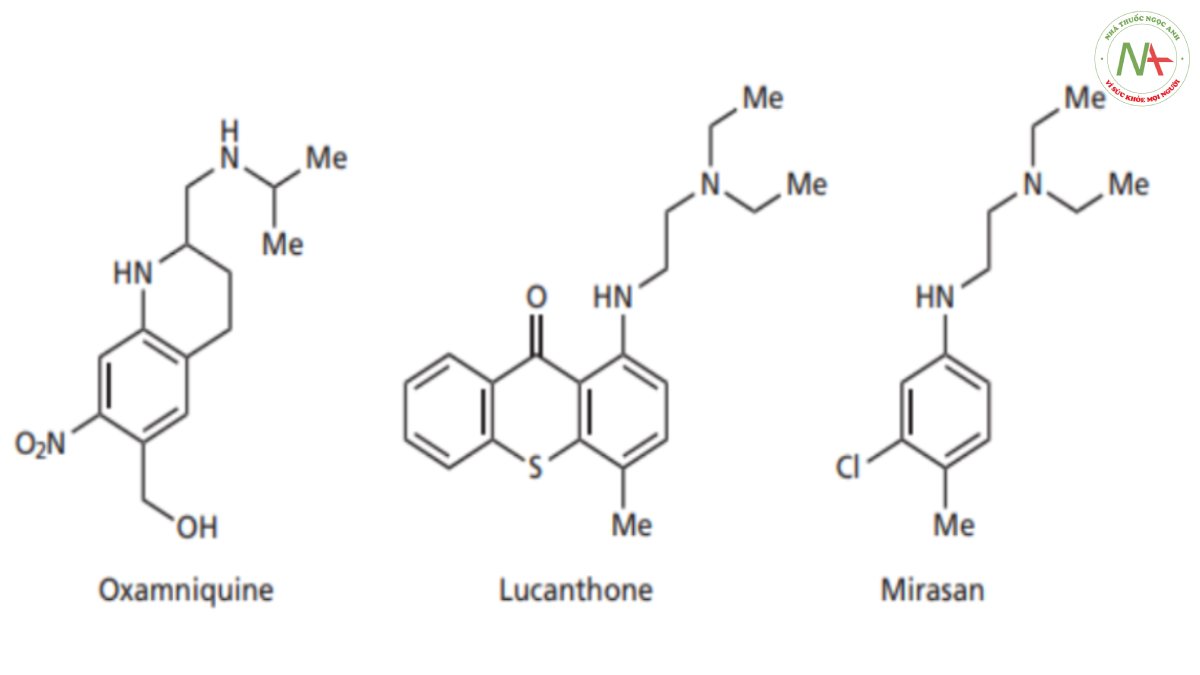
Oxamniquine
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
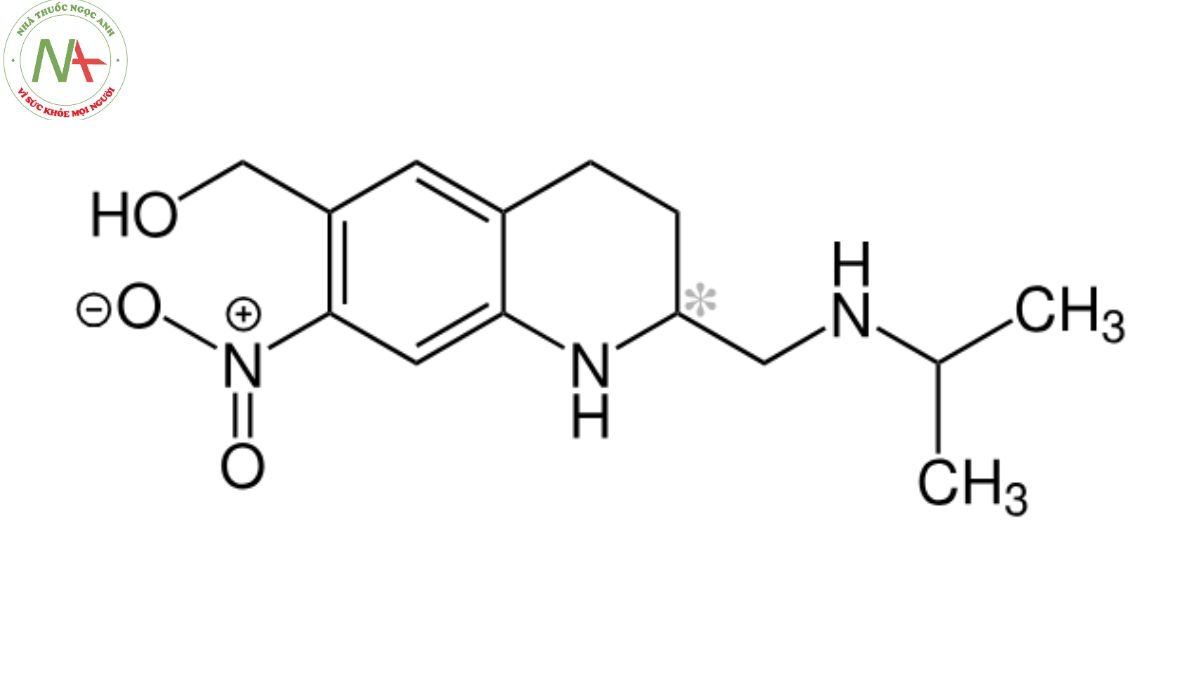
[7-nitro-2-[(propan-2-ylamino)methyl]-1,2,3,4-tetrahydroquinolin-6-yl]methanol
Nhóm thuốc
Oxamniquine thuộc nhóm nào? Thuốc trị giun sán
Mã ATC
P – Thuốc chống ký sinh trùng, côn trùng và ghẻ
P02 – Thuốc giun sán
P02B – Thuốc chữa sán lá
P02BA – Dẫn chất của Quinolin và các thuốc liên quan
P02BA02 – Oxamniquine
Mã UNII
0O977R722D
Mã CAS
21738-42-1
Cấu trúc phân tử
Công thức phân tử
C14H21N3O3
Phân tử lượng
279.33 g/mol
Cấu trúc phân tử
Oxamniquine là dẫn xuất của nhóm quinolin, có cấu trúc là 1,2,3,4-tetrahydroquinoline được thay thế ở vị trí 2, 6 và 7 bằng các nhóm (isopropylamino)metyl, hydroxymetyl và nitro tương ứng. Nó là dẫn xuất của quinolines, hợp chất C-nitro, hợp chất amino thứ cấp và rượu nguyên chất thơm.

Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 5
Số liên kết có thể xoay: 4
Diện tích bề mặt tôpô: 90.1Ų
Số lượng nguyên tử nặng: 20
Các tính chất đặc trưng
Điểm nóng chảy: 147-149 °C
Điểm sôi: 443.6±45.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.2±0.1 g/cm3
Độ pH: 8-10
Độ tan trong nước: 820mg/L
Hằng số phân ly pKa: 9.89
Dạng bào chế
Viên nang 250 mg
Sirô 250 mg/5 ml
Độ ổn định và điều kiện bảo quản
Bảo quản thuốc trong lọ kín, tránh ánh sáng.
Nguồn gốc
Oxamniquine là thuốc gì? Oxamniquine, một hợp chất đột phá trong lĩnh vực y học nhiệt đới, được Kaye và Woolhouse lần đầu tiên giới thiệu vào năm 1972. Phát hiện này mở ra một chương mới khi xác định oxamniquine là một chất chuyển hóa của UK 3883, một hợp chất nổi bật với cấu trúc hóa học đặc biệt là 2-isopropylaminomethyl-6-methyl-7-nitro-1,2,3,4-tetrahydroquinoline. Quá trình tổng hợp ban đầu của hợp chất này được thực hiện thông qua phương pháp hydroxyl hóa enzyme, sử dụng nấm Aspergillus sclerotiorum, một cách tiếp cận sáng tạo.
Công trình nghiên cứu này đã được ghi nhận xứng đáng. Vào năm 1979, Pfizer tại Sandwich đã được vinh danh bằng Giải thưởng Nữ hoàng về Thành tựu Công nghệ, nhằm tôn vinh những đóng góp quan trọng của MANSIL (oxamniquine) trong lĩnh vực y học nhiệt đới, đánh dấu một bước tiến quan trọng trong việc phát triển sức khỏe cộng đồng ở lĩnh vực này.
Dược lý và cơ chế hoạt động
Oxamniquin, một loại thuốc bán tổng hợp hiệu quả trong việc điều trị sán máng, phát huy tác dụng đối với cả dạng trưởng thành và chưa trưởng thành của loại sán Schistosoma mansoni. Đáng chú ý, oxamniquin không có khả năng tiêu diệt ấu trùng và không tác động lên các loài Schistosoma khác.
Mặc dù Oxamniquine cơ chế hoạt động cụ thể trong việc loại bỏ sán chưa được làm rõ ràng, nhiều giả thuyết cho rằng nó có thể hoạt động bằng cách ức chế quá trình tổng hợp DNA.
Thú vị là, sán máng đực trưởng thành dễ bị ảnh hưởng bởi thuốc hơn so với sán máng cái. Oxamniquin có khả năng thúc đẩy sán di chuyển từ tĩnh mạch mạc treo ruột đến gan. Tại gan, sán đực, vốn hấp thụ thuốc nhiều hơn, chết đi, trong khi sán cái có thể trở lại mạc treo ruột nhưng mất khả năng sinh sản.
Tuy nhiên, sự phát triển của kháng thuốc là một vấn đề cần lưu ý. Hiện nay, praziquantel thường được ưu tiên sử dụng hơn do sự phát triển của kháng oxamniquin ở một số khu vực như Nam Mỹ và hiệu quả tương đối thấp hơn của oxamniquin so với praziquantel.
Sau một liều điều trị thích hợp, tỷ lệ khỏi bệnh của oxamniquin ít nhất là 60%, thường đạt hơn 90%. Bên cạnh đó, lượng trứng trong phân của những người không khỏi bệnh có thể giảm hơn 80%, và thường giảm hơn 90% sau một năm điều trị.
Ứng dụng trong y học
Oxamniquine là một loại thuốc được sử dụng trong lĩnh vực y học để điều trị nhiễm ký sinh trùng Schistosoma mansoni, một loại ký sinh trùng gây ra bệnh béo phì gan Schistosomiasis, còn được gọi là bệnh giun sán gan. Bệnh này là một vấn đề sức khỏe quan trọng, đặc biệt ở các khu vực nhiệt đới và cận nhiệt đới, và có thể gây ra những biến chứng nghiêm trọng nếu không được điều trị đúng cách. Oxamniquine đã được phát triển như một công cụ hiệu quả trong việc kiểm soát và điều trị bệnh Schistosomiasis.
Ứng dụng chính của Oxamniquine trong y học bao gồm:
Điều trị Schistosomiasis: Oxamniquine là một loại anthelminthic, có khả năng tiêu diệt ký sinh trùng Schistosoma mansoni trong cơ thể người. Khi con người bị nhiễm ký sinh trùng này qua tiếp xúc với nước bị nhiễm, họ có thể phát triển bệnh Schistosomiasis. Bệnh này có thể gây ra các triệu chứng như sốt, đau bụng, và các vấn đề về gan và ruột. Oxamniquine được sử dụng để loại bỏ ký sinh trùng khỏi cơ thể và điều trị bệnh, giúp cải thiện sức khỏe của bệnh nhân.
Kiểm soát dịch bệnh: Oxamniquine cũng được sử dụng trong các chương trình kiểm soát dịch bệnh ở các khu vực nhiễm ký sinh trùng Schistosoma mansoni. Việc sử dụng thuốc này có thể giúp ngăn ngừa sự lây lan của bệnh trong cộng đồng và giảm nguy cơ nhiễm trùng cho người dân.
Nghiên cứu và phát triển: Oxamniquine cũng đóng vai trò quan trọng trong nghiên cứu và phát triển về điều trị Schistosomiasis. Các nhà nghiên cứu sử dụng nó để hiểu rõ hơn về cơ chế hoạt động của thuốc và tìm kiếm các biện pháp điều trị tiềm năng khác cho bệnh này.
Dược động học
Hấp thu
Khi được uống, Oxamniquin cho thấy khả năng hấp thu tốt, tuy nhiên, quá trình hấp thu này có thể giảm hiệu quả khi có sự hiện diện của thức ăn. Đáng chú ý, nồng độ đỉnh của oxamniquin trong huyết tương thường được ghi nhận trong khoảng 1 – 3 giờ sau khi uống liều thông thường, và thuốc này có nửa đời thải trừ khá ngắn, chỉ từ 1 đến 2,5 giờ.
Phân bố
Thông tin chi tiết về sự phân bố của oxamniquin trong các mô và dịch cơ thể vẫn còn là một ẩn số. Đồng thời, chưa rõ liệu oxamniquin có khả năng vượt qua nhau thai hoặc có mặt trong sữa mẹ hay không.
Chuyển hóa
Trong quá trình chuyển hóa, oxamniquin được biến đổi thành nhiều chất chuyển hóa không hoạt tính, trong đó chủ yếu là dẫn chất 6-carboxy, và chúng được bài tiết chủ yếu qua nước tiểu.
Thải trừ
Khoảng 70% liều của oxamniquin được thải trừ dưới dạng chất chuyển hóa 6-carboxy trong vòng 12 giờ sau khi uống. Ngoài ra, một lượng nhỏ của chất chuyển hóa 2-carboxy cũng được phát hiện trong nước tiểu, góp phần làm sáng tỏ quá trình chuyển hóa phức tạp của thuốc này.
Độc tính ở người
Oxamniquine tác dụng phụ? Trong liều lượng dùng để điều trị, oxamniquin thường được dung nạp tốt, mặc dù mối liên hệ giữa liều dùng và mức độ cũng như tỷ lệ phản ứng có hại vẫn chưa được hiểu rõ. Tuy nhiên, có thể nhận thấy rằng, các phản ứng có hại thường xuất hiện nhiều hơn ở những bệnh nhân sử dụng liều cao. Điều đáng chú ý là những phản ứng này thường tạm thời và dao động từ nhẹ đến trung bình.
Các phản ứng phổ biến, xảy ra ở hơn 1/100 bệnh nhân, bao gồm:
- Hệ thần kinh: Chóng mặt, buồn ngủ, đau đầu, với tỷ lệ 30 – 50% bệnh nhân gặp phải.
- Hệ tiêu hóa: Các triệu chứng như buồn nôn, nôn mửa, tiêu chảy, đau bụng.
- Da: Ngứa và mày đay.
Ở mức ít gặp hơn, tức 1/1 000 < ADR < 1/100, các phản ứng bao gồm:
- Mất ngủ, khó chịu, ảo giác, thay đổi hành vi.
- Nước tiểu đổi màu (cam hoặc đỏ), protein niệu, huyết niệu vi thể và giảm tạm thời lượng bạch cầu và lympho bào.
Trong những trường hợp hiếm gặp, với tỷ lệ ADR < 1/1 000, có thể gặp phải cơn động kinh, thường xảy ra trong vài giờ sau khi uống thuốc, đặc biệt ở những người có tiền sử mắc bệnh động kinh.
Tính an toàn
Oxamniquin có khả năng vượt qua nhau thai, nhưng đến nay, vẫn chưa rõ ràng về những tác động tiềm ẩn của nó đối với phụ nữ mang thai. Các nghiên cứu trên động vật, bao gồm thỏ và chuột thí nghiệm, đã chỉ ra rằng oxamniquin có thể gây hại cho phôi thai ở những liều cao, vượt quá 10 lần liều lượng thường dùng cho con người. Do đó, việc hoãn điều trị bằng oxamniquin cho phụ nữ mang thai cho đến sau khi sinh là khuyến nghị được ưa chuộng, trừ trường hợp điều trị cấp thiết là cần thiết.
Mặt khác, cũng chưa có thông tin cụ thể về việc liệu oxamniquin có được bài tiết vào sữa mẹ hay không. Do đó, để đảm bảo an toàn, khuyến cáo không sử dụng oxamniquin cho phụ nữ đang cho con bú được đưa ra như một biện pháp phòng ngừa.
Tương tác với thuốc khác
Chưa có báo cáo.
Lưu ý khi sử dụng Oxamniquine
Sử dụng oxamniquin có thể dẫn đến một số tác dụng phụ như buồn ngủ, chóng mặt, đau đầu và co giật. Do đó, người bệnh được khuyến cáo không nên lái xe hoặc thao tác với các thiết bị máy móc trong quá trình điều trị bằng thuốc này để tránh nguy cơ tai nạn.
Đối với những người có tiền sử bệnh co giật, việc sử dụng oxamniquin cần được tiếp cận một cách thận trọng. Trong trường hợp này, việc cân nhắc việc sử dụng các loại thuốc chống co giật trước khi bắt đầu điều trị bằng oxamniquin là hết sức cần thiết.
Đặc biệt, trong trường hợp của bệnh nhân có tiền sử mắc chứng động kinh, việc theo dõi chặt chẽ và chuẩn bị các biện pháp cần thiết để xử lý những cơn động kinh có thể xảy ra trong quá trình điều trị là quan trọng. Việc sử dụng thuốc chống co giật cũng cần được xem xét một cách cẩn thận.
Liều dùng oxamniquin được xác định dựa trên yếu tố địa lý nơi bệnh nhân nhiễm bệnh và cân nặng của họ. Liều lượng này có thể thay đổi từ 15 mg/kg trong một liều duy nhất đến 60 mg/kg mỗi ngày, chia làm 2 – 3 ngày, với một liều đơn không vượt quá 20 mg/kg. Để tối ưu hóa sự dung nạp và giảm thiểu tác dụng phụ, oxamniquin nên được uống sau bữa ăn.
Một vài nghiên cứu của Oxamniquine trong Y học
Thuốc điều trị nhiễm Schistosoma mansoni
Đặt vấn đề: Schistosoma mansoni là một bệnh nhiễm ký sinh trùng phổ biến ở vùng nhiệt đới và cận nhiệt đới. Bệnh mãn tính và tiến triển bao gồm đau bụng, tiêu chảy, máu trong phân, xơ gan, tăng áp lực tĩnh mạch cửa và tử vong sớm.
Mục tiêu: Đánh giá tác dụng của thuốc kháng sán máng, dùng riêng lẻ hoặc kết hợp, trong điều trị nhiễm S. mansoni.
Phương pháp tìm kiếm: Chúng tôi đã tìm kiếm MEDLINE, EMBASE và LILACS từ khi bắt đầu đến tháng 10 năm 2012, không hạn chế về ngôn ngữ. Chúng tôi cũng tìm kiếm Sổ đăng ký chuyên ngành của Nhóm bệnh truyền nhiễm Cochrane, CENTRAL (Thư viện Cochrane 2012) và mRCT. Danh sách tài liệu tham khảo của các bài báo đã được xem xét và liên hệ với các chuyên gia về các nghiên cứu chưa được công bố.
Tiêu chí lựa chọn: Các thử nghiệm ngẫu nhiên có đối chứng về thuốc kháng sán máng, sử dụng đơn độc hoặc kết hợp, so với giả dược, các loại thuốc kháng sán máng khác nhau hoặc các liều lượng khác nhau của cùng một loại thuốc kháng sán máng để điều trị nhiễm S. mansoni.
Thu thập và phân tích dữ liệu: Một tác giả đã trích xuất dữ liệu và đánh giá tính đủ điều kiện cũng như nguy cơ sai lệch trong các nghiên cứu được đưa vào, được tác giả thứ hai kiểm tra độc lập. Chúng tôi đã kết hợp các kết quả phân đôi bằng cách sử dụng tỷ lệ rủi ro (RR) và chênh lệch trung bình có trọng số dữ liệu liên tục (WMD); chúng tôi đã trình bày cả hai với khoảng tin cậy (CI) 95%. Chúng tôi đã đánh giá chất lượng của bằng chứng bằng cách sử dụng phương pháp GRADE.
Kết quả chính: Bao gồm 52 thử nghiệm với 10.269 người tham gia. Bằng chứng có chất lượng trung bình hoặc thấp do các phương pháp thử nghiệm và số lượng nhỏ người tham gia.
Praziquantel: So với giả dược, praziquantel 40 mg/kg có thể làm giảm thất bại điều trị ký sinh trùng sau một tháng điều trị (RR 3,13, CI 95% 1,03 đến 9,53, hai thử nghiệm, 414 người tham gia, bằng chứng có chất lượng trung bình). So với liều tiêu chuẩn này, liều thấp hơn có thể kém hơn (30 mg/kg: RR 1,52, CI 95% 1,15 đến 2,01, ba thử nghiệm, 521 người tham gia, bằng chứng chất lượng thấp; 20 mg/kg: RR 2,23, CI 95% 1,64 đến 3.02, hai thử nghiệm, 341 người tham gia, bằng chứng chất lượng thấp); và liều cao hơn, lên tới 60 mg/kg, dường như không cho thấy bất kỳ lợi ích nào (bốn thử nghiệm, 783 người tham gia, bằng chứng chất lượng vừa phải). Tỷ lệ chữa khỏi ký sinh trùng tuyệt đối trong một tháng với praziquantel 40 mg/kg thay đổi đáng kể qua các nghiên cứu, dao động từ 52% ở Senegal năm 1993 đến 92% ở Brazil năm 2006/2007.
Oxamniquine: So với giả dược, oxamniquine 40 mg/kg có thể làm giảm thất bại điều trị ký sinh trùng sau ba tháng (RR 8,74, CI 95% 3,74 đến 20,43, hai thử nghiệm, 82 người tham gia, bằng chứng chất lượng vừa phải). Liều thấp hơn 40 mg/kg có thể kém hơn sau một tháng (30 mg/kg: RR 1,78, CI 95% 1,15 đến 2,75, bốn thử nghiệm, 268 người tham gia, bằng chứng chất lượng thấp; 20 mg/kg: RR 3,78, CI 95% 2,05 đến 6,99, hai thử nghiệm, 190 người tham gia, bằng chứng chất lượng thấp) và liều cao hơn, chẳng hạn như 60 mg/kg, không cho thấy lợi ích nhất quán (bốn thử nghiệm, 317 người tham gia, bằng chứng chất lượng thấp). Những thử nghiệm này hiện đã hơn 20 năm và chỉ có rất ít thông tin được cung cấp về thiết kế và phương pháp nghiên cứu.
Praziquantel so với oxamniquine: Chỉ có một nghiên cứu nhỏ so sánh trực tiếp praziquantel 40 mg/kg với oxamniquine 40 mg/kg và chúng tôi không chắc phương pháp điều trị nào hiệu quả hơn trong việc giảm sự thất bại về ký sinh trùng (một thử nghiệm, 33 người tham gia, bằng chứng chất lượng rất thấp). Thêm 10 thử nghiệm nữa so sánh oxamniquine ở liều 20, 30 và 60 mg/kg với praziquantel 40 mg/kg và không cho thấy bất kỳ sự khác biệt rõ rệt nào về tỷ lệ thất bại hoặc tỷ lệ giảm trứng.
Điều trị kết hợp: Chúng tôi không chắc chắn liệu việc kết hợp praziquantel với artesunate có làm giảm thất bại so với chỉ dùng praziquantel trong một tháng hay không (một thử nghiệm, 75 người tham gia, bằng chứng chất lượng rất thấp). Hai thử nghiệm cũng so sánh sự kết hợp praziquantel và oxamniquine ở các liều khác nhau, nhưng không tìm thấy sự khác biệt có ý nghĩa thống kê về thất bại (hai thử nghiệm, 87 người tham gia).
Các kết quả và phân tích khác: Trong các thử nghiệm báo cáo sự cải thiện lâm sàng đánh giá liều thấp hơn (20 mg/kg và 30 mg/kg) so với liều tiêu chuẩn 40 mg/kg đối với cả praziquantel hoặc oxamniquine, liều lượng không có tác dụng nào được chứng minh trong việc giải quyết cơn đau bụng, tiêu chảy, máu trong phân, gan to và lách to (theo dõi sau 1, 3, 6, 12 và 24 tháng; 3 thử nghiệm, 655 người tham gia).
Các tác dụng phụ không được báo cáo đầy đủ nhưng hầu hết được mô tả là nhỏ và thoáng qua.
Trong một phân tích bổ sung về thất bại điều trị ở nhóm điều trị của các nghiên cứu riêng lẻ được phân loại theo độ tuổi, tỷ lệ thất bại với cả praziquantel và oxamniquine 40 mg/kg đều cao hơn ở trẻ em.
Kết luận của tác giả: Praziquantel 40 mg/kg là phương pháp điều trị chuẩn cho nhiễm trùng S. mansoni là phù hợp với bằng chứng. Oxamniquine, một loại thuốc thay thế bị loại bỏ phần lớn, cũng có vẻ hiệu quả. Nghiên cứu sâu hơn sẽ giúp tìm ra chế độ dùng thuốc tối ưu của cả hai loại thuốc này ở trẻ em. Liệu pháp kết hợp, lý tưởng nhất là với các loại thuốc có cơ chế tác dụng không liên quan và nhắm vào các giai đoạn phát triển khác nhau của sán máng ở vật chủ người nên được theo đuổi như một lĩnh vực nghiên cứu trong tương lai.
NGHIÊN CỨU PHÁT TRIỂN THUỐC OXAMNIQUINE
Sự phát triển oxamniquine của dược phẩm Pfizer là một ví dụ điển hình về cách có thể sử dụng các chiến lược truyền thống trong việc phát triển một loại thuốc mà mục tiêu phân tử chưa xác định. Nó cũng chứng tỏ rằng các chiến lược có thể được sử dụng theo bất kỳ trình tự nào và có thể được sử dụng nhiều lần.
Oxamniquine là thuốc quan trọng ở các nước đang phát triển, được sử dụng trong điều trị bệnh sán máng (bilharzia). Sau bệnh sốt rét, căn bệnh này là bệnh ký sinh trùng phổ biến nhất trên thế giới, ảnh hưởng đến khoảng 200 triệu người và gây ra gần 500.000 ca tử vong mỗi năm. Bệnh này do giun dẹp nhỏ gọi là sán máng lây nhiễm khi bơi, lội trong nước bị nhiễm bẩn. Ký sinh trùng có thể nhanh chóng xâm nhập vào da người ở dạng ấu trùng và khi vào máu, ấu trùng sẽ phát triển thành giun dẹp trưởng thành. Sau đó, con cái đẻ ra trứng và bị mắc kẹt trong các cơ quan và mô, dẫn đến viêm nhiễm và gây suy nhược kéo dài, có thể kéo dài tới 20 năm. Trong trường hợp nghiêm trọng, bệnh nhân có thể gây tử vong. Có ba loài ký sinh trùng gây bệnh— Schistosoma mansoni, S. haematobium và S. japonicum.
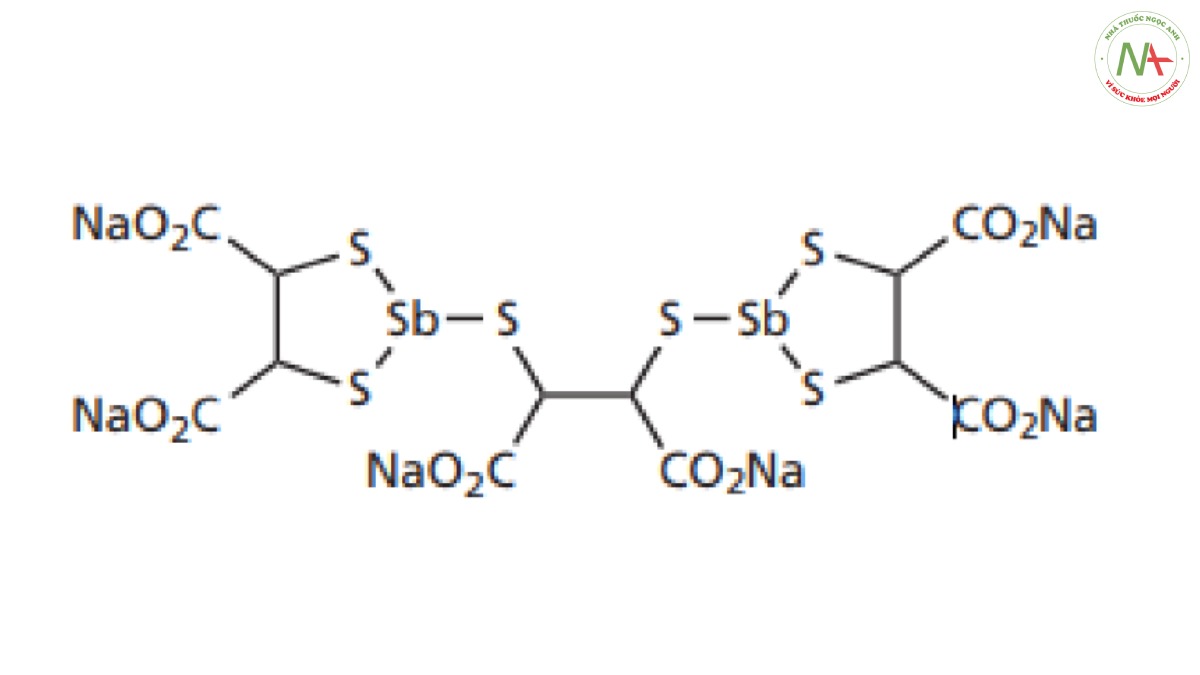
Vào đầu những năm 1960, loại thuốc duy nhất hiện có là lucanthone cấu trúc ba vòng và antimonials, chẳng hạn như stibocaptate. Tuy nhiên, stibocaptate và lucanthone có những hạn chế nghiêm trọng trong vai trò điều trị. Stibocaptate không có tác dụng khi dùng đường uống, trong khi cả hai loại thuốc này đều yêu cầu chế độ dùng thuốc thường xuyên và gây ra độc tính.
Ví dụ, lucanthone phải được dùng 3-5 lần mỗi ngày và có thể gây buồn nôn và nôn. Nghiêm trọng hơn, nó có thể gây ra tác dụng độc hại nghiêm trọng đối với tim và hệ thần kinh trung ương. Cuối cùng, nó không có hiệu quả đối với cả ba chủng gây bệnh.
Năm 1964, Pfzer khởi xướng một dự án nhằm phát triển một loại thuốc không độc, có hoạt tính khi dùng đường uống, có hiệu quả với một liều duy nhất chống lại cả ba chủng gây bệnh và có giá cả phải chăng cho bệnh nhân ở các nước đang phát triển. Cuối cùng, nghiên cứu này đã dẫn đến việc phát hiện ra oxamniquine, đáp ứng tất cả ngoại trừ một trong những mục tiêu đó.
Lucanthone được chọn làm hợp chất dẫn đường vì nó có tác dụng qua đường uống; người ta đã quyết định thử đơn giản hóa cấu trúc để xem hệ ba vòng có thực sự cần thiết cho tác dụng hay không. Một số hợp chất đã được tạo ra – cấu trúc thú vị nhất là cấu trúc có hai vòng nhìn thấy ở bên trái trong hình trên đã bị loại bỏ. Điều này tạo ra một hợp chất gọi là mirasan (Hình CS4.1 ), hợp chất này giữ lại vòng thơm bên phải chứa nhóm thế methyl và P-aminoethylamino ở vị trí para với nhau.Việc thay đổi các nhóm thế cho thấy rằng nhóm thế clo có độ âm điện lớn, được đặt ở vị trí thay thế cho nguyên tử lưu huỳnh thì có lợi cho hoạt tính. Mirasan có hoạt tính chống lại ký sinh trùng bilharzia ở chuột nhưng không có tác dụng ở người. Hiện tại người ta lý giải rằng mạch nhánh P-aminoethylamino đóng vai trò quan trọng trong việc liên kết thuốc với vị trí liên kết của mục tiêu phân tử khi nó tồn tại ở một cấu dạng phù hợp để liên kết hiệu quả. Tuy nhiên cấu dạng này chỉ là một trong rất nhiều cấu dạng có thể có của phân tử linh hoạt như mirasan, và do đó xác suất để Mirasan liên kết với mục tiêu phân tử bị hạn chế đi rất nhiều. Do đó, người ta đã quyết định hạn chế số lượng cấu dạng bằng cách tạo vòng cho mạch nhánh. Điều này sẽ làm tăng khả năng phân tử có cấu dạng chính xác khi tiếp cận vị trí liên kết trên mục tiêu phân tử. Tuy nhiên,vẫn tồn tại nguy cơ cấu trúc hoạt động sẽ trở lên cứng nhắc khi không được quay tự do khi dùng chiến thuật cố định cấu trúc này do đó, thay vì kết hợp toàn bộ mạch nhánh vào một vòng thì ban đầu người ta thiết kế các hợp chất mà trong đó chỉ 1 phần mạch nhánh tham gia đóng vòng.
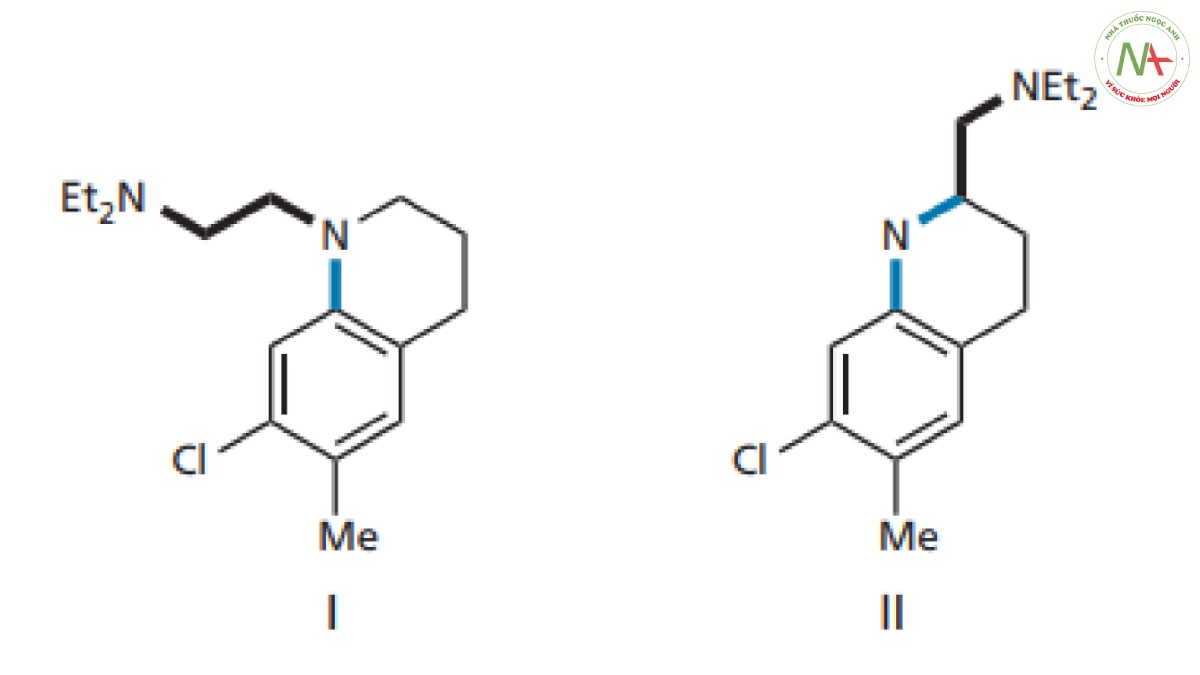
Cấu trúc hai vòng (I trong Hình CS4.3 ) chứa một trong các liên kết của mạch nhánh đã được cố định trong một vòng để ngăn cản sự quay xung quanh liên kết đó. Người ta thấy rằng điều này đã mang lại sự cải thiện đáng kể về hoạt tính. Hợp chất này vẫn chưa có tác dụng ở người, nhưng không giống như mirasan, nó có tác dụng ở khỉ. Điều này mang lại hy vọng rằng các nhà hóa học đã đi đúng hướng. Sự cứng nhắc hơn nữa đã dẫn đến cấu trúc II trong Hình. CS4.3, trong đó hai liên kết chuỗi bên bị cản quay. Hợp chất này thậm chí có hoạt tính mạnh hơn trong các nghiên cứu trên chuột và người ta quyết định tập trung vào hợp chất này.
Đến nay cấu trúc của hợp chất đã bị thay đổi đáng kể so với mirasan. Trong trường hợp này, nên kiểm tra xem kết quả trong quá khứ có còn đúng hay không. Ví dụ, nhóm chloro vẫn phải ortho với nhóm methyl phải không? Nhóm chloro có thể được thay đổi thành nhóm nào khác? Các cấu trúc mới có thể có vị trí liên kết hơi khác so với hợp chất dẫn đường, do đó các nhóm liên kết không còn ở vị trí tối ưu để liên kết.
Do đó, cấu trúc II đã được biến đổi bằng cách thay đổi các nhóm thế và vị trí thế trên vòng thơm và bằng cách thay đổi các nhóm thế alkyl trên các nhóm amino. Mạch nhánh cũng được mở rộng để tìm kiếm các vùng liên kết có thể có khác. Các kết quả và kết luận có thể có như sau.
- Có thể thay đổi các nhóm thế trên vòng thơm, nhưng vị trí nhóm thế không thể thay đổi và rất cần thiết cho hoạt tính. Việc thay đổi vị trí nhóm thế có lẽ sẽ đặt các nhóm liên kết thiết yếu ra khỏi vị trí so với các vùng liên kết của chúng.
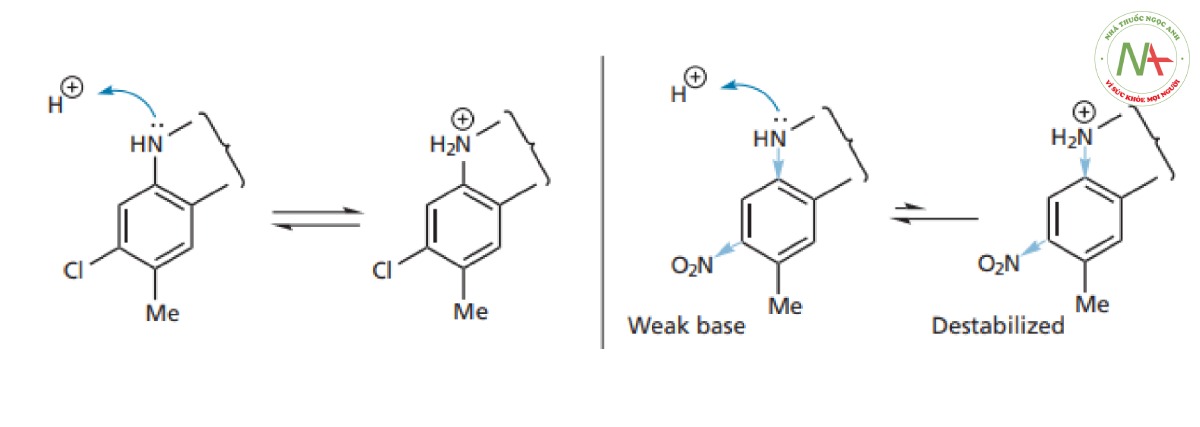
- Việc thay đổi nhóm thế clo bằng các nhóm thế có độ âm điện cao hơn đã cải thiện hoạt tính, trong đó nhóm nitro là nhóm thế tốt nhất. Vì vậy, vòng thơm thiếu electron sẽ có lợi cho hoạt tính. Một lời giải thích khả dĩ cho điều này có thể là ảnh hưởng của vòng thơm lân cận dựa trên tính bazơ của nguyên tử nitơ gắn trên vòng. Vòng thơm thiếu hụt electron mạnh sẽ hút cặp electron đơn độc của nitơ vào vòng, do đó làm giảm tính bazơ của nó ( Hình CS4.4 ). Điều này có thể làm thay đổi pKa của thuốc sao cho nó ít bị ion hóa hơn và có thể đi qua màng tế bào niêm mạc ruột và tế bào đích dễ dàng hơn. Hiệu ứng điện tử của nhóm thế lên nhóm chức ở xa là một chiến lược hữu ích trong thiết kế cấu trúc thuốc
– Các dẫn chất có hoạt tính mạnh nhất được tìm thấy khi nhóm amino trên mạch nhánh là amin bậc hai chứ không phải bậc một hoặc bậc ba.
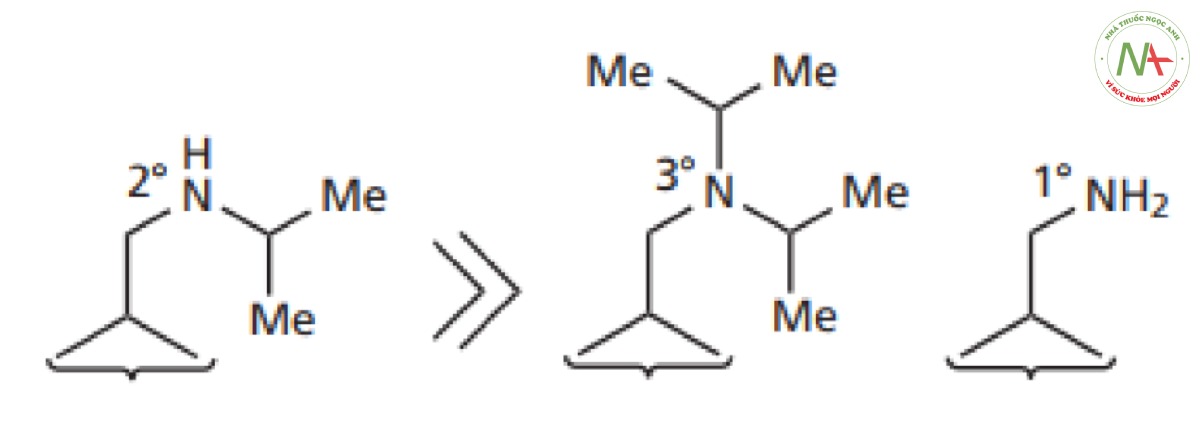
Nhóm alkyl trên nitơ này có thể tăng lên tới bốn đơn vị cacbon với mức tăng hoạt tính tương ứng. Mạch dài hơn cho thấy giảm hoạt tính. Kết quả thứ hai có thể hàm ý rằng các nhóm thế lớn quá cồng kềnh và khiến thuốc không thể lồng khớp với vị trí gắn kết.
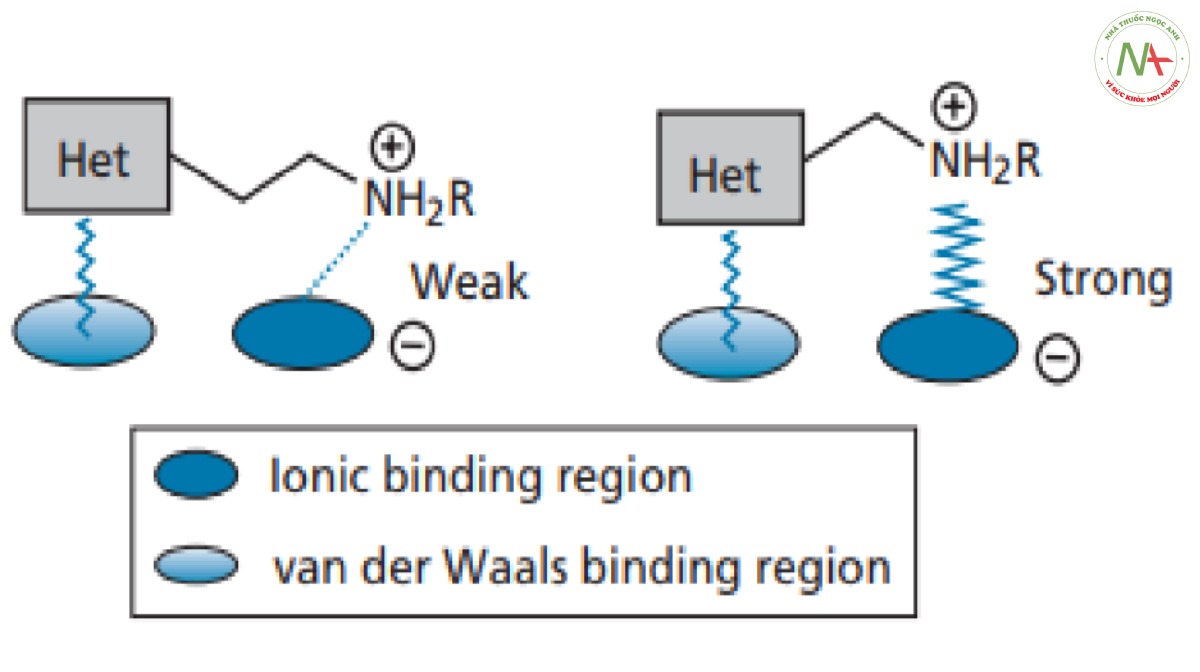
Các nhóm Acyl sau khi tách loại hoàn toàn cho dẫn chất có hoạt tính, nhấn mạnh tầm quan trọng của nguyên tử nitơ này. Rất có thể, nó bị ion hóa và tương tác với vị trí liên kết thông qua liên kết ion (Hình CS4.6).
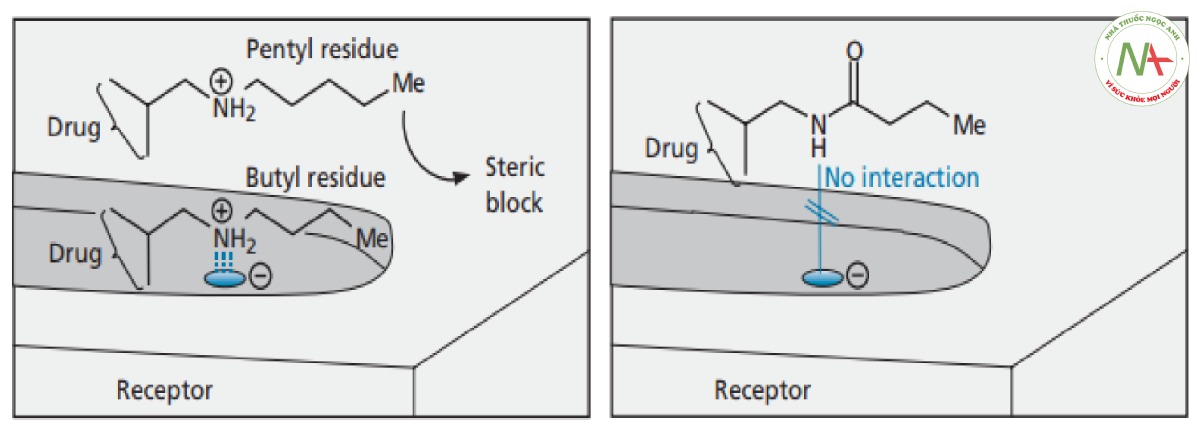
Sự phân nhánh của chuỗi alkyl làm tăng hoạt tính. Một lời giải thích khả dĩ là sự phân nhánh làm tăng tương tác van der Waals với vùng kỵ nước tại vị trí liên kết (Hình CS4.7). Ngoài ra, tính thân lipid của thuốc có thể tăng lên, cho phép thuốc di chuyển dễ dàng hơn qua màng tế bào.
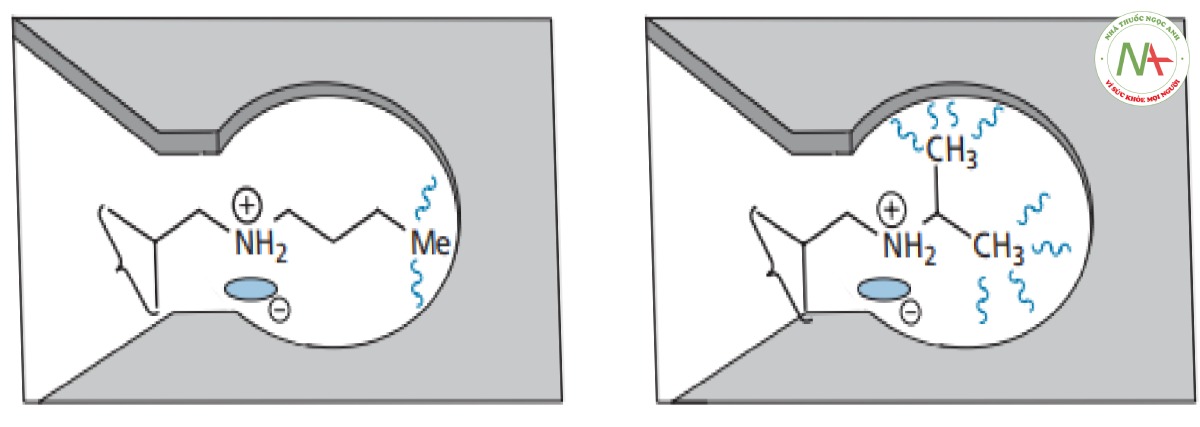
Đưa nhóm methyl vào mạch nhánh sẽ gây mất hoạt tính (Hình CS4.8). Nhóm methyl được cho là cồng kềnh so với proton và có thể nó ngăn cản mạch nhánh tồn tại ở cấu dạng phù hợp để liên kết chính xác.
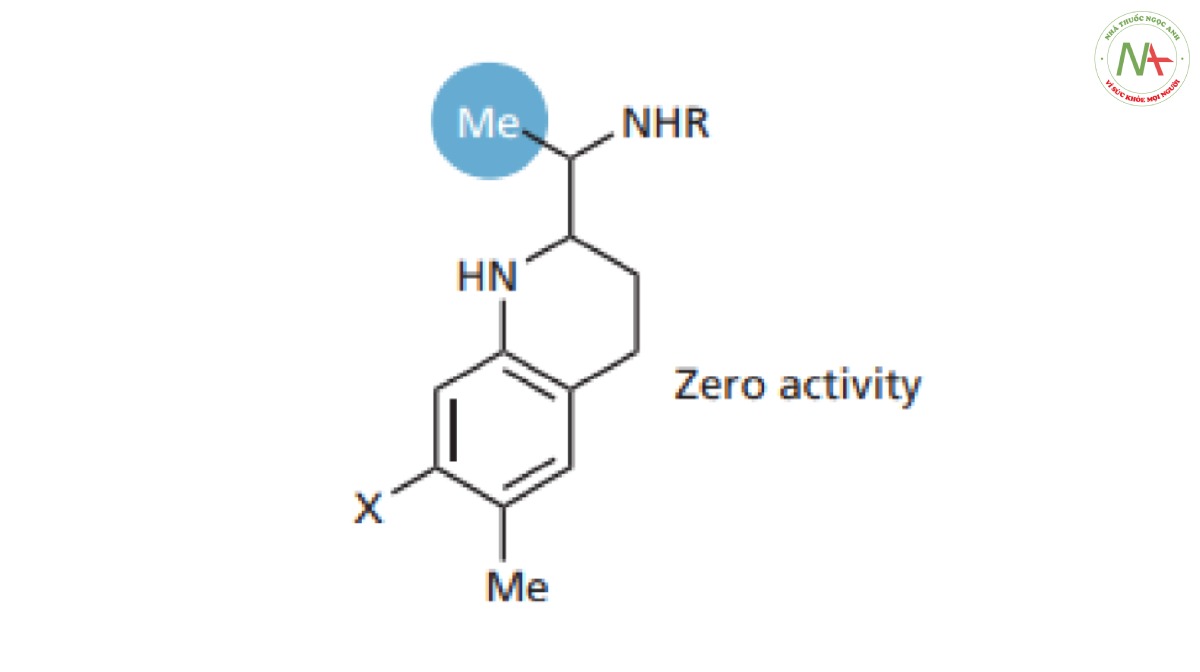
– Tăng chiều dài của mạch nhánh được sử dụng trong trường hợp các nhóm liên kết cách nhau không đủ xa để tạo được liên kết tối ưu . Tuy nhiên, trong tình huống này lại cho kết quả ngược lại.
Cấu trúc tối ưu dựa trên các kết quả này là cấu trúc III ( Hình CS4.10 ). Nó có một trung tâm bất đối như chúng ta có thể dự đoán, hoạt tính của một đồng phân đối quang này mạnh hơn nhiều so với hoạt tính của đồng phân kia.
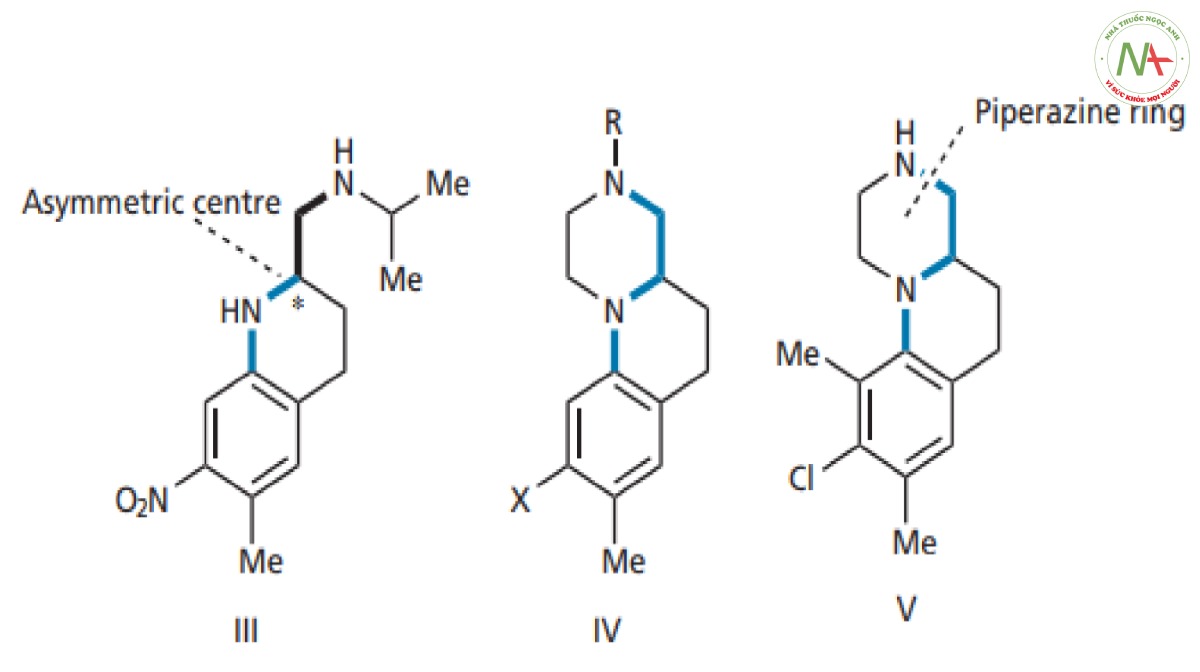
– Cấu trúc ba vòng IV (Hình CS4.10 ) cũng được thiết kế. Trong hợp chất này, mạch nhánh được đóng vòng hoàn toàn, hạn chế đáng kể số lượng cấu dạng có thể có. Như đã đề cập trước đó, có nguy cơ cấu hình có hoạt tính sẽ không còn được phép quay tự do nữa, nhưng trong trường hợp này vẫn mang hoạt tính tốt. Các dẫn chất tương tự được tổng hợp để chứng tỏ rằng amin bậc hai là cần thiết và cần có nhóm hút điện tử trên vòng thơm. Tuy nhiên, một số kết quả thu được mâu thuẫn khi so sánh với các kết quả đã có với cấu trúc III. Nhóm thế clo trên vòng thơm tốt hơn nhóm nitro và nó có thể ở một trong hai vị trí ortho so với nhóm metyl. Những kết quả này chứng minh rằng việc tối ưu hóa các nhóm thế trong một cấu trúc không nhất thiết có nghĩa là chúng sẽ tối ưu trong một cấu trúc khác. Một lời giải thích khả dĩ cho việc nhóm thế chloro tốt hơn nitro là cần một nhóm thế hút điện tử yếu hơn để tạo ra hợp chất có tính bazơ tối ưu cho tính thấm qua màng tế bào (Giá trị pka phù hợp để không bị ion hóa trong điều kiện sinh lý).
– Khi gắn thêm một nhóm metyl nữa vào vòng thơm để làm tăng hoạt tính của cấu trúc (V) (Hình CS4.10). Người ta đề xuất rằng nhóm methyl cồng kềnh có thể tương tác với vòng piperazine, khiến nó lệch ra khỏi mặt phẳng của hai vòng còn lại. Kết quả thực nghiệm cho thấy có sự gia tăng hoạt tính và khẳng định hoạt tính mạnh hơn với cấu dạng thu được tại vị trí liên kết.
Hợp chất V hoạt tính mạnh gấp ba lần cấu trúc III. Tuy nhiên, cấu trúc III đã được chọn để phát triển tiếp. Việc lựa chọn III thay vì V dựa trên kết quả thử nghiệm sơ bộ độc tính, cũng như thực tế là việc tổng hợp nó rẻ hơn. Cấu trúc III là một phân tử đơn giản hơn nên sẽ dễ tổng hợp hơn và rẻ hơn.
Các nghiên cứu sâu hơn về quá trình chuyển hóa các hợp chất liên quan sau đó cho thấy nhóm metyl thơm trên các hợp chất này bị oxy hóa thành nhóm hydroxymethylene và các chất chuyển hóa thu được là những hợp chất hoạt tính mạnh hơn. Điều này gợi ý rằng cấu trúc III hoạt động như một tiền thuốc. Do đó, nhóm methyl trên III được thay thế bằng nhóm hydroxymethylene để tạo ra oxamniquine.
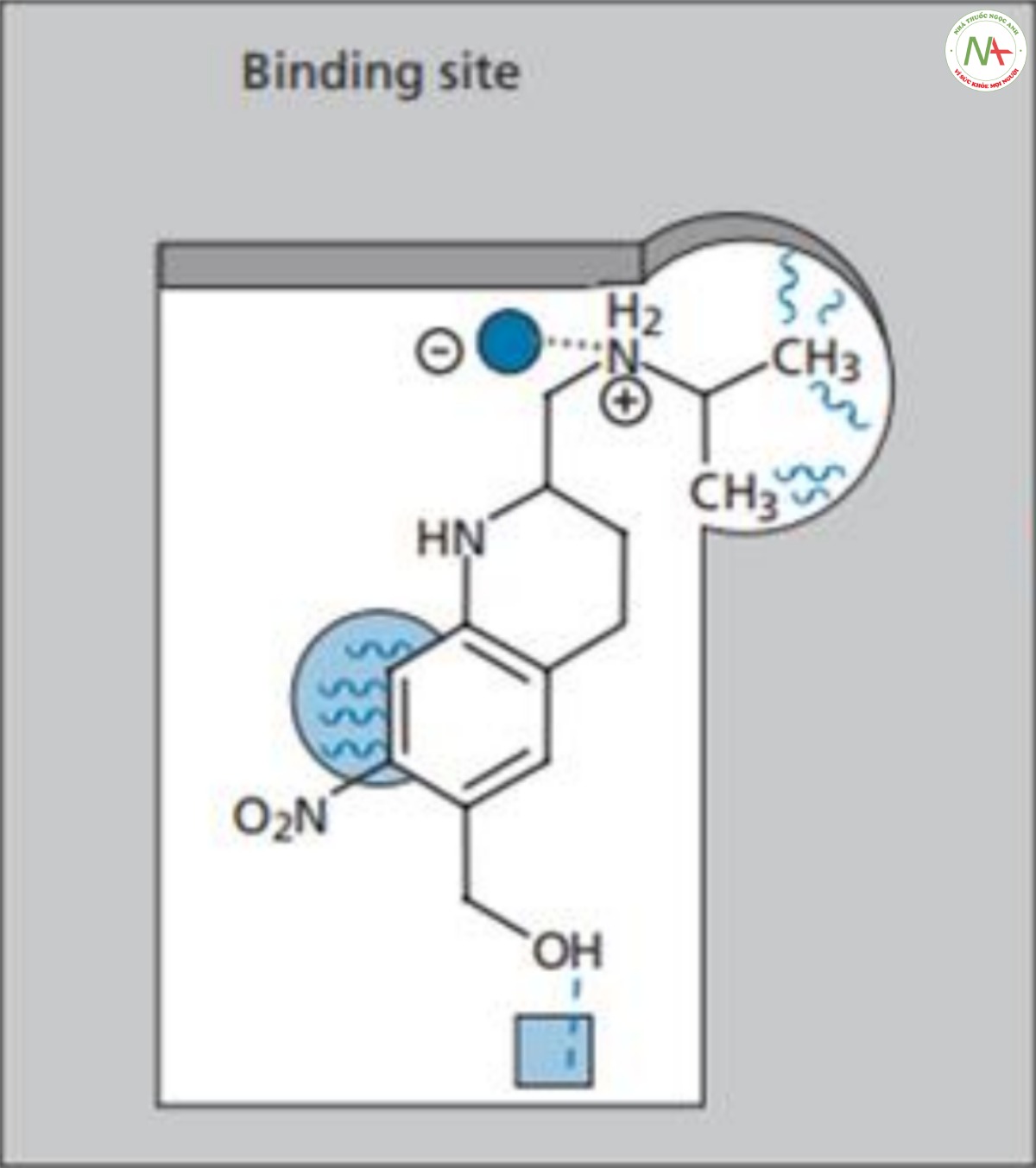
Người ta đề xuất rằng nhóm hydroxyl mới có thể tham gia vào tương tác liên kết hydro bổ sung tại vùng liên kết trên mục tiêu phân tử. Thuốc này được đưa ra thị trường vào năm 1975, 11 năm sau khi dự án bắt đầu. Oxamniquine có hiệu quả khi dùng liều duy nhất để điều trị nhiễm trùng S. mansoni. Tác dụng phụ tương đối nhẹ so với lucanthone, thường gặp nhất là chóng mặt, buồn ngủ và đau đầu, có thể kéo dài vài giờ sau khi dùng. Mặc dù loại thuốc này không có hiệu quả chống lại cả ba chủng ký sinh trùng nhưng nó đã đáp ứng tất cả các mục tiêu khác của dự án và được chứng minh là một loại thuốc rất thành công. Ngày nay nó vẫn được sử dụng ở các nước như Brazil. Sự đóng góp của loại thuốc này đối với y học nhiệt đới đã mang lại cho Pfzer Giải thưởng Nữ hoàng về Thành tựu Công nghệ năm 1979
Cơ chế tác dụng của Oxammiquine
Khi oxamniquine đang được phát triển, cơ chế tác dụng và vị trí liên kết trên mục tiêu phân tử của nó vẫn chưa được biết rõ. Oxamniquine hiện được biết là có tác dụng ức chế tổng hợp axit nucleic trong tế bào sán máng. Cơ chế tác dụng được cho là liên quan đến việc hoạt hóa tiền thuốc bằng enzyme sulphotransferase có trong tế bào ký sinh trùng, nhưng enzyme này không có trong tế bào động vật có vú. Khi oxamniquine liên kết với vị trí hoạt động trên enzyme của sán máng, nhóm hydroxyl sẽ được chuyển thành este sulfat (Hình CS4.12).
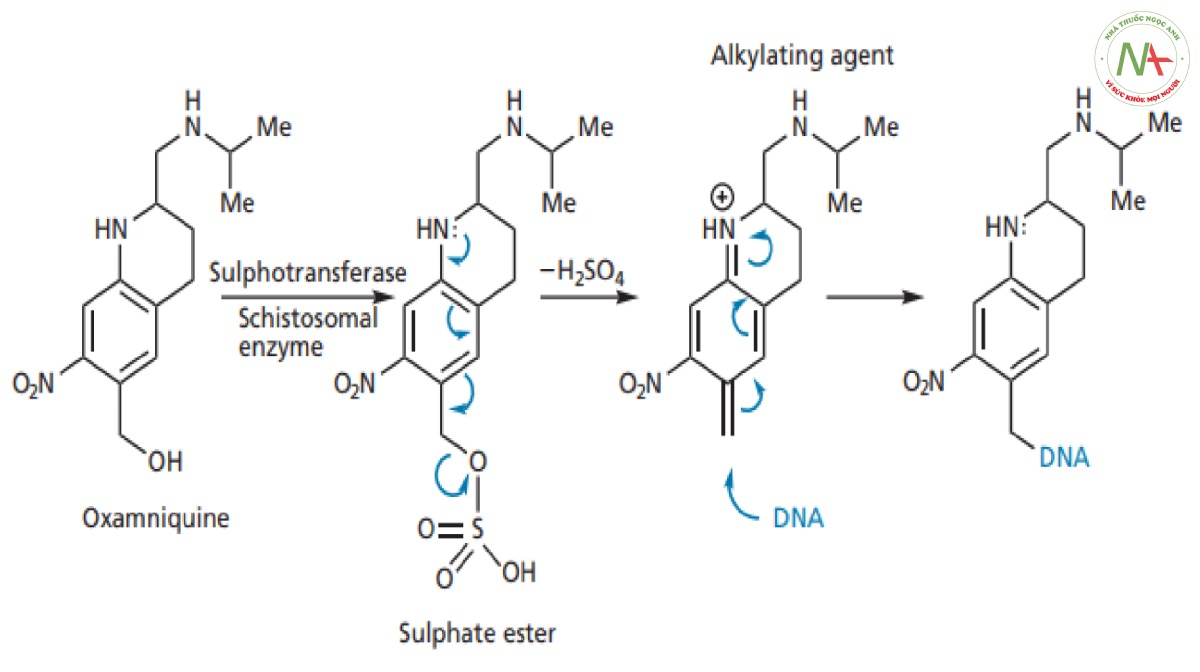
Nhóm este sulfat là nhóm rời tốt hơn nhiều so với nhóm hydroxyl ban đầu và do đó phân tử hiện được thiết lập để phân ly. Điều này được hỗ trợ bởi nitơ ở vị trí para do có hiệu ứng đẩy cặp electron đơn độc của nó vào vòng thơm làm ổn định cation mới hình thành. Cấu trúc được hình thành là một tác nhân alkyl hóa giúp alkyl hóa DNA của ký sinh trùng và ngăn cản sự sao chép DNA. Lý thuyết này rất phù hợp với các kết quả về mối quan hệ cấu trúc-hoạt tính (SAR) được mô tả trước đây, trong đó nhấn mạnh tầm quan trọng của nhóm hydroxyl, amin thơm và vòng thơm nghèo điện tử. Nó cũng giải thích tại sao tác nhân này gây độc tính chọn lọc trên ký sinh trùng hơn là tế bào động vật có vú. Vì vậy, oxamniquine hoạt động như một tiền thuốc , được hoạt hóa bởi enzyme sulphotransferase của ký sinh trùng.
Một số hoạt chất khác
Như đã biết nhóm CH2OH đóng vai trò rất quan trọng đối với hoạt tính và cơ chế tác dụng của oxamniquine điều này dẫn đến các nghiên cứu sâu hơn về lucanthone và mirasan. Các nghiên cứu cho thấy lucanthone đã bị oxy hóa in vivo thành chất chuyển hóa có tên là hycanthone (Hình CS4.13 ), chất này sau đó hoạt động như một tiền thuốc theo cách tương tự như oxamniquine.
Hycanthone được chứng minh là có hoạt tính mạnh hơn lucanthone và thay thế nó để điều trị nhiễm trùng sán máng. Nó được sử dụng rộng rãi vào những năm 1970, tại thời điểm đó nó được coi là phương pháp điều trị tốt nhất hiện có. Tuy nhiên, nó có độc tính tương tự như lucanthone và bị nghi ngờ là gây ung thư nhẹ. Nó dần dần bị rút khỏi thị trường để thay thế bằng các chất an toàn hơn và có tác dụng mạnh hơn, chẳng hạn như oxamniquine.
Mirasan cũng được phát hiện bị oxy hóa in vivo thành chất chuyển hóa (Hình CS4.13) được chứng minh là có hoạt tính ở nhiều loài. Tuy nhiên, chất chuyển hóa chưa bao giờ được sử dụng trên lâm sàng. Có khả năng là sự bất hoạt quan sát được của mirasan ở khỉ là do nó có khả năng ức chế quá trình oxy hóa trao đổi chất ở loài đó.
Praziquantel (Hình CS4.13) hiện nay là phương pháp điều trị được khuyên dùng cho bệnh sán máng ở Anh, vì nó có hoạt tính chống lại cả ba chủng ký sinh trùng. Nhưng giá thành đắt hơn oxamniquine nên hạn chế sử dụng ở các quốc gia kém phát triển hơn. Các tác nhân mới được kỳ vọng, nhưng thuốc diệt sán máng không hấp dẫn về mặt kinh tế đối với ngành dược phẩm.
Tài liệu tham khảo
- Danso-Appiah A, Olliaro PL, Donegan S, Sinclair D, Utzinger J. Drugs for treating Schistosoma mansoni infection. Cochrane Database Syst Rev. 2013 Feb 28;2013(2):CD000528. doi: 10.1002/14651858.CD000528.pub2. PMID: 23450530; PMCID: PMC6532716.
- Drugbank, Oxamniquine, truy cập ngày 16 tháng 11 năm 2023.
- Pubchem, Oxamniquine, truy cập ngày 16 tháng 11 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội.
