Octreotide
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
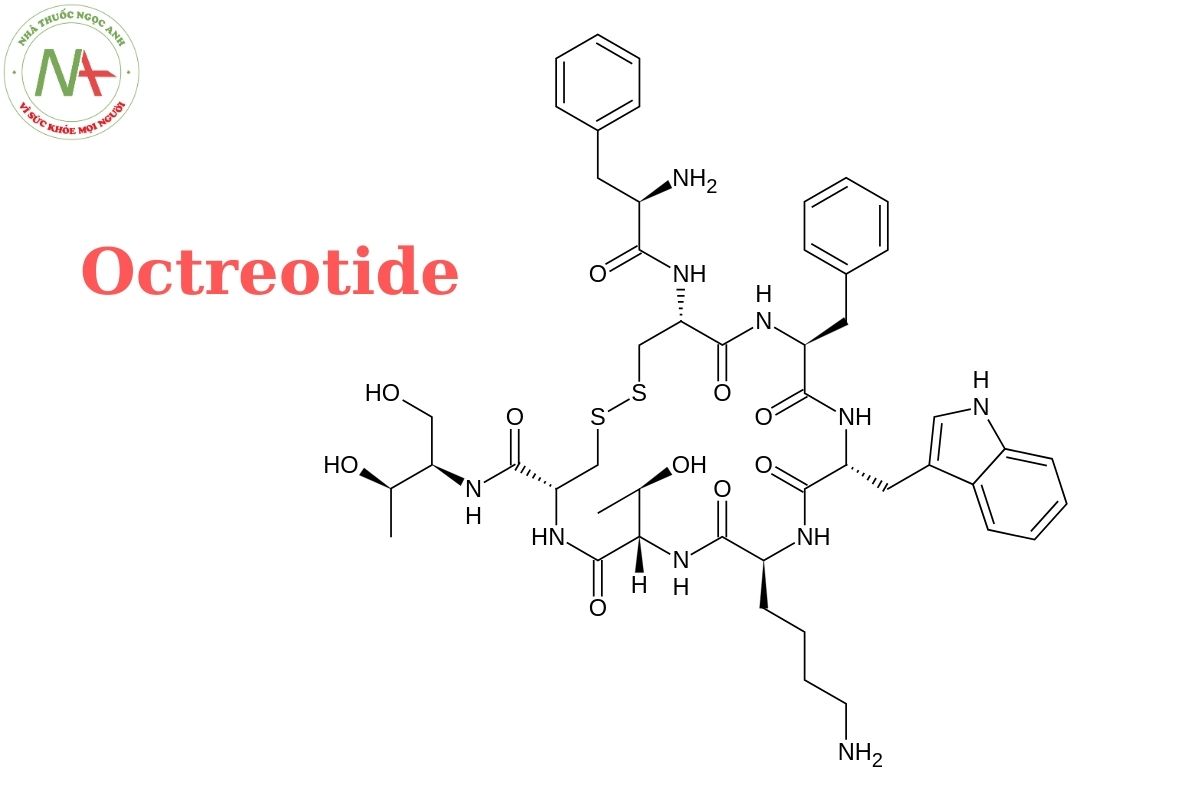
(4R,7S,10S,13R,16S,19R)-10-(4-aminobutyl)-19-[[(2R)-2-amino-3-phenylpropanoyl]amino]-16-benzyl-N-[(2R,3R)-1,3-dihydroxybutan-2-yl]-7-[(1R)-1-hydroxyethyl]-13-(1H-indol-3-ylmethyl)-6,9,12,15,18-pentaoxo-1,2-dithia-5,8,11,14,17-pentazacycloicosane-4-carboxamide
Nhóm thuốc
Polypeptid tổng hợp ức chế tăng trưởng, thuốc tương tự somatostatin (một hormon hạ đồi).
Mã ATC
H – Các chế phẩm nội tiết tố hệ thống, không bao gồm hormone giới tính và insulin
H01 – Hormon tuyến yên và vùng dưới đồi và các chất tương tự
H01C – Hormon vùng dưới đồi
H01CB – Somatostatin và chất tương tự
H01CB02 – Octreotide
Mã UNII
RWM8CCW8GP
Mã CAS
83150-76-9
Xếp hạng phân loại cho phụ nữ có thai
AU TGA loại: C
US FDA loại: B
Cấu trúc phân tử
Công thức phân tử
C49H66N10O10S2
Phân tử lượng
1019.2 g/mol
Cấu trúc phân tử
Octreotide là thuốc gì? Octreotide là một peptit nhân tạo dẫn xuất từ somatostatin, một hormone tồn tại tự nhiên trong cơ thể. Cấu trúc phân tử của Octreotide chứa 8 amino acid H-D-Phe-Cys-Phe-D-Trp-Lys-Thr-Cys-Thr(ol)
Các tính chất phân tử
Số liên kết hydro cho: 12
Số liên kết hydro nhận: 14
Số liên kết có thể xoay: 17
Diện tích bề mặt tôpô: 383 Ų
Số lượng nguyên tử nặng: 71
Các tính chất đặc trưng
Điểm nóng chảy: 153-156oC
Điểm sôi: 1447oC
Cảm quan
Octreotide thường được dùng dưới dạng liên kết muối (octreotide acetate) hoặc dạng dạng tự do thường xuất hiện dưới dạng bột khô hoặc dạng dung dịch. Octreotide không tan trong nước tính chất của chuỗi peptit chứa các nhóm chức năng không phân cực. Octreotide có thể hòa tan trong một số dung môi hữu cơ như dioxane, acetonitrile và methanol.
Dạng bào chế
Dung dịch tiêm: hộp 5 ống tiêm x 1mL, lọ đa liều 5mL.
Mỗi ống: Octreotide 0,05mg, Octreotide 0,1mg hoặc Octreotide 0,5mg (dưới dạng peptide tự do).
Mỗi lọ: Octreotide 1mg (dưới dạng peptide tự do) hay Octreotide 100mcg/ml
Độ ổn định và điều kiện bảo quản của Octreotide
Octreotide cần được bảo quản ở nhiệt độ thấp, thường là trong khoảng từ 2°C đến 8°C (36°F đến 46°F). Điều này giúp hạn chế quá trình phân huỷ và giữ cho Octreotide ổn định trong thời gian dài.
Octreotide nên được bảo quản trong điều kiện tối mát, tránh ánh sáng mặt trời trực tiếp hoặc ánh sáng mạnh, vì ánh sáng có thể gây phân huỷ hoặc làm suy giảm độ ổn định của thuốc.
Đảm bảo bảo quản Octreotide trong bao bì của kín khí.
Nguồn gốc
Vào năm 1979, nhà hóa học Wilfried Bauer đã thực hiện quá trình tổng hợp thành công của Octreotide, mở ra một chương mới trong nghiên cứu hóa học y tế. Đặc biệt, Octreotide có khả năng tương tác chủ yếu với các thụ thể somatostatin SSTR2 và SSTR5, mở ra cánh cửa cho những ứng dụng tiềm năng trong kiểm soát tiết hormone.
Sau quá trình nghiên cứu và phát triển, vào năm 1988, Octreotide đã chính thức nhận được sự phê duyệt để sử dụng tại Hoa Kỳ, đánh dấu một bước quan trọng trong việc áp dụng y học.
Vào năm 2022, Octreotide dưới tên thương hiệu Mycapssa đã nhận được sự chấp thuận để sử dụng trong lĩnh vực y tế tại Liên minh Châu Âu. Đây là một bước tiến quan trọng, mở ra cơ hội mới trong điều trị và quản lý các vấn đề y tế.
Tháng 6 năm 2020, Octreotide dưới tên Mycapssa đã đạt một thành tựu quan trọng khi trở thành thuốc đầu tiên và duy nhất có chất tương tự somatostatin đường uống (SSA) được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận. Điều này chứng tỏ sự tiến bộ trong lĩnh vực nghiên cứu và ứng dụng y học.
Dược lý và cơ chế hoạt động
Octreotide cơ chế hoạt động tương tự như somatostatin, một loại hormone tự nhiên. Octreotide thể hiện khả năng ức chế hormone tăng trưởng và glucagon, từ đó điều chỉnh quá trình phát triển mô khi bị rối loạn và cân bằng insulin ở những bệnh nhân chịu ảnh hưởng của bệnh to cực.
Thêm vào đó, Octreotide giảm triệu chứng đỏ bừng mặt và triệu chứng tiêu chảy liên quan đến các khối u đường tiêu hóa bằng cách làm giảm lưu lượng máu nội tạng và ngăn cản hoạt động của các hormone đường tiêu hóa liên quan đến tiêu chảy.
Octreotide kết nối với các thụ thể somatostatin thông qua protein G, tương tác này kích hoạt phospholipase C và gây hiện tượng co cơ trơn trong các mạch máu.
Bằng cách ức chế phospholipase C, Octreotide gây ra sự sản xuất inositol triphosphate 1,4,5 và cũng tác động lên kênh canxi loại L, tạo điều kiện để kiểm soát hormone tăng trưởng và cân bằng các tác động chuyển hóa và hormone tăng trưởng đa dạng của bệnh to đầu chi.
Octreotide còn ngăn chặn sự sản xuất hormone tạo hoàng thể (LH), giảm lưu lượng máu trong cơ quan nội tạng, và đồng thời ức chế các hormone serotonin, gastrin, peptide vận mạch đường ruột, secretin, motilin và polypeptide tuyến tụy.
Điều này đóng góp vào việc giảm triệu chứng về tiêu hóa và đỏ bừng mặt do các khối u carcinoid và/hoặc VIPoma gây ra.
Ứng dụng trong y học của Octreotide
Kiểm soát tiết hormone tăng trưởng (GH)
Octreotide được sử dụng để kiểm soát tiết hormone tăng trưởng quá mức ở các bệnh nhân mắc bệnh tăng tiết hormone tăng trưởng.
Bằng cách ức chế sự sản xuất hormone tăng trưởng, Octreotide giúp điều chỉnh quá trình tăng trưởng dư thừa và liên quan đến các vấn đề sức khỏe.
Điều trị u vú
Octreotide được sử dụng trong việc điều trị u vú, đặc biệt là u vú tiết hormone. Thuốc giúp kiểm soát tiết hormone tạo hoàng thể (LH) và prolactin, từ đó giảm các triệu chứng liên quan đến u vú như sưng đau và tiết sữa không cần thiết.
Kiểm soát hormone glucagon
Octreotide được sử dụng để kiểm soát tiết hormone glucagon trong một số tình trạng y tế như glucagonoma, một loại u ác tính ở tuyến tụy.
Bệnh to các viễn cực
Octreotide được sử dụng để điều trị bệnh to cực, một tình trạng liên quan đến tăng tiết hormone tuyến giáp, gây ra sự phát triển mô bất thường và tăng kích thước các cơ quan trong cơ thể.
Giảm triệu chứng khối u carcinoid
Octreotide giúp giảm các triệu chứng như đỏ bừng mặt, tiêu chảy, và triệu chứng liên quan đến khối u carcinoid, một loại khối u tạo ra hormone ở hệ tiêu hóa.
Điều trị các khối u neuroendocrine
Octreotide cũng được sử dụng để điều trị các khối u neuroendocrine khác nhau, bao gồm cả các khối u pheochromocytoma và khối u VIPoma.
Octreotide trong xuất huyết tiêu hóa
Octreotide có thể giảm triệu chứng đỏ bừng mặt, tiêu chảy và triệu chứng khác liên quan đến các khối u đường tiêu hóa như u carcinoid và VIPoma. Bệnh cạnh đó còn có tác dụng trong làm giảm xuất huyết đường tiêu hóa do tăng áp lực lên các tĩnh mạch cửa, Do đó cần làm giãm áp lực lên cách tĩnh mạch cửa. Liều dùng Octreotide trong xuất huyết tiêu hóa nhằm giảm áp lực tĩnh mạch cửa: bolus 50 µg tiêm tĩnh mạch, và tiêm tĩnh mạch liên tục 25µg/h.
Dược động học
Hấp thu
Sau liều tiêm dưới da, octreotide được hấp thu hoàn toàn khi dùng. Sau khi uống viên nang giải phóng chậm, nồng độ đỉnh được tìm thấy thấp hơn 33% so với sau khi tiêm dưới da.
Cmax đạt được sau 1,67–2,5 giờ sau khi uống so với 30 phút đối với đường tiêm dưới da.
Ở liều 20 mg hai lần một ngày ở bệnh nhân mắc bệnh to cực, nồng độ đỉnh là 2,5 mg/nL so với 5,30 ng/mL ở liều 40 mg hai lần một ngày. AUC tăng tỷ lệ thuận với liều dùng, bất kể đường dùng.
Phân bố
Trong một nghiên cứu dược động học, thể tích phân bố là 13,6 L ở người tình nguyện khỏe mạnh.
Một nghiên cứu dược động học cho thấy thể tích phân bố dao động từ 18,1-30,4L sau khi tiêm tĩnh mạch ở người tình nguyện khỏe mạnh
Chuyển hóa
Khoảng 65% liều dùng gắn kết với lipoprotein và albumin trong huyết tương.
Octreotide được chuyển hóa mạnh ở gan.
Đào thải
Khoảng 32% liều octreotide uống được bài tiết qua nước tiểu, 10% và 30-40% được bài tiết qua gan vào phân.
Khoảng 11% thuốc gốc không biến đổi được tìm thấy trong nước tiểu và 2% thuốc gốc không biến đổi có thể được tìm thấy trong phân.
Sau khi tiêm dưới da, thời gian bán hủy trong huyết tương ước tính là 0,2 giờ.
Thời gian bán thải trung bình khi dùng đường tiêm dưới da và đường uống dao động từ 2,3 – 2,7 giờ và không khác biệt đáng kể.
Phương pháp sản xuất
Quá trình sản xuất Octreotide bắt đầu bằng việc tổng hợp peptit – chuỗi các amino acid theo thứ tự cụ thể.
Điều này có thể thực hiện bằng cách sử dụng các phương pháp hóa học tổng hợp, trong đó từng phần amino acid được thêm vào chuỗi một cách tuần tự.
Trong quá trình tổng hợp, những nhóm hữu cơ có thể được sử dụng để bảo vệ những phần của peptit khỏi sự tác động của các chất hóa học khác.
Các phần amino acid được kết hợp với nhau thông qua các phản ứng hợp nhất, tạo nên chuỗi peptit ngày càng dài và chính xác hơn.
Sau khi tạo ra chuỗi peptit, những nhóm bảo vệ được loại bỏ bằng cách sử dụng các phản ứng hóa học chọn lọc.
Để tăng tính ổn định và hòa tan, Octreotide thường được sản xuất dưới dạng dạng liên kết muối như octreotide acetate. Quá trình này liên quan đến việc tạo liên kết với một muối để tạo ra dạng có khả năng hòa tan tốt hơn.
Sau khi sản xuất, Octreotide cần phải trải qua các bước tinh chế và kiểm tra chất lượng để đảm bảo tính chất và hiệu suất của sản phẩm cuối cùng. Các phép thử về tinh chất, độ tinh khiết, và hiệu quả y tế thường được thực hiện.
Độc tính của Octreotide
Có rất ít thông tin liên quan đến các trường hợp quá liều octreotide ngoài các báo cáo về trường hợp quá liều octreotide dạng tiêm.
Liều dao động từ 2,4 mg/ngày đến 6 mg/ngày dùng bằng cách tiêm truyền liên tục hoặc tiêm dưới da 1,5 mg ba lần mỗi ngày.
Tác dụng phụ khi dùng quá liều octreotide có thể bao gồm hạ huyết áp, thiếu oxy não, rối loạn nhịp tim, ngừng tim, nhiễm toan lactic, viêm tụy, gan to, tiêu chảy, đỏ bừng mặt, hôn mê và suy nhược.
Tương tác của Octreotide với thuốc khác
Các chất có cấu trúc tương tự somatostatin có thể gây tác động đến việc chuyển hóa các hợp chất qua cytochrom P450.
Khi người bệnh được cấp dịch dinh dưỡng và sử dụng Octreotide đồng thời, có thể gây tăng nồng độ kẽm trong huyết tương và làm suy giảm quá trình hấp thu của các thuốc uống khác.
Trong trường hợp bệnh nhân đái tháo đường đang điều trị insulin, việc kết hợp Octreotide có thể dẫn đến giảm đường huyết do Octreotide ảnh hưởng tiết glucagon.
Sự phối hợp với bromocriptin có thể làm tăng khả năng hấp thu của bromocriptin, vì vậy có thể cần giảm liều bromocriptin.
Sự kết hợp với ciclosporin có thể dẫn đến giảm nồng độ ciclosporin trong huyết tương, nên trong trường hợp này, có thể cần tăng liều ciclosporin. Tuy nhiên, khi ngưng sử dụng Octreotide sau khi đã kết hợp, cần giảm liều ciclosporin.
Tránh sử dụng Octreotide cùng lúc với một số thành phần như thioridazin, nilotinib, ziprasidon, tetrabenazin.
Octreotide có thể tương tác và làm tăng nồng độ hoặc tác dụng của các thuốc như Codein, tetrabenazin, pegvisomant, ziprasidon, thioridazin.
Tương tác với thực phẩm
Octreotide có thể tác động đến sự hấp thu chất béo. Sử dụng viên nang phóng thích chậm cùng với thức ăn có thể làm giảm sự hấp thu AUC và Cmax tới 90%.
Lưu ý khi dùng Octreotide
Lưu ý và thận trọng chung
Việc sử dụng Octreotide có khả năng gây ra tác động tương tự như somatostatin tự nhiên đối với chức năng và hoạt động của dạ dày – ruột, gan mật, quá trình hấp thu glucose và một số chức năng nội tiết khác.
Điều này làm nổi bật tầm quan trọng của việc theo dõi và kiểm tra thường xuyên tình trạng của bệnh nhân khi họ đang sử dụng Octreotide.
Những bệnh nhân đang điều trị kéo dài với Octreotide, phản ứng lâm sàng và sinh hóa đối với thuốc có thể bị suy giảm ở một mức độ cụ thể.
Lưu ý cho người đang mang thai
Hiện chưa có đủ dữ liệu về tác động của Octreotide đối với thai kỳ. Do đó, việc sử dụng Octreotide trong thời kỳ mang thai chỉ nên xem xét khi lợi ích dự kiến hơn rủi ro tiềm ẩn.
Lưu ý cho người đang cho con bú
Hiện chưa rõ liệu Octreotide có tiết ra qua sữa mẹ hay không, và tác động của nó đối với trẻ sơ sinh. Việc sử dụng Octreotide trong thời kỳ cho con bú cũng cần được xem xét kỹ lưỡng, và bác sĩ cần được tham khảo để đưa ra quyết định phù hợp nhằm đảm bảo sức khỏe của cả mẹ và bé.
Lưu ý cho người vận hành máy móc hay lái xe
Octreotide có thể gây chói mắt, chói mắt nhạt hoặc hoa mắt ở một số người. Người dùng Octreotide nên thận trọng khi tham gia vào các hoạt động đòi hỏi tập trung tối đa như vận hành máy móc nặng hoặc lái xe.
Một vài nghiên cứu về Octreotide trong Y học
Lu-Dotatate cộng với octreotide tác dụng kéo dài so với octreotide tác dụng kéo dài liều cao ở bệnh nhân có khối u thần kinh nội tiết ruột giữa (NETTER-1): tỷ lệ sống sót tổng thể cuối cùng và kết quả an toàn lâu dài từ một thử nghiệm nhãn mở, ngẫu nhiên, có kiểm soát, giai đoạn 3 sự thử nghiệm
Bối cảnh: Phân tích chính của thử nghiệm NETTER-1 giai đoạn 3 cho thấy sự cải thiện đáng kể về tỷ lệ sống sót không tiến triển khi sử dụng 177 Lu-Dotatate cộng với octreotide tác dụng kéo dài so với octreotide tác dụng kéo dài liều cao đơn thuần ở những bệnh nhân có khối u thần kinh nội tiết ruột giữa tiến triển. Ở đây, chúng tôi báo cáo phân tích cuối cùng được xác định trước về kết quả sống sót tổng thể và an toàn lâu dài.
Phương pháp: Thử nghiệm ngẫu nhiên, nhãn mở, giai đoạn 3 này thu hút bệnh nhân từ 41 địa điểm ở 8 quốc gia trên khắp Châu Âu và Hoa Kỳ. Bệnh nhân từ 18 tuổi trở lên có khối u thần kinh nội tiết ruột giữa dương tính với thụ thể somatostatin tiến triển cục bộ hoặc di căn (điểm trạng thái hoạt động Karnofsky ≥60) và bệnh tiến triển khi dùng octreotide tác dụng kéo dài với liều cố định. Bệnh nhân được phân ngẫu nhiên (1:1) thông qua hệ thống phản ứng dựa trên web tương tác để tiêm tĩnh mạch 177 Lu-Dotatate 7·4 GBq (200 mCi) mỗi 8 tuần (bốn chu kỳ) cộng với tiêm bắp octreotide tác dụng kéo dài 30 mg ( 177Nhóm Lu-Dotatate) hoặc octreotide tác dụng kéo dài liều cao 60 mg mỗi 4 tuần (nhóm đối chứng). Tiêu chí chính về khả năng sống sót không tiến triển bệnh đã được báo cáo trước đây; ở đây, chúng tôi báo cáo tiêu chí phụ quan trọng của tỷ lệ sống sót chung trong nhóm dân số có chủ định điều trị. Phân tích tỷ lệ sống sót tổng thể cuối cùng được xác định trước là xảy ra sau 158 trường hợp tử vong hoặc 5 năm sau khi bệnh nhân cuối cùng được chọn ngẫu nhiên, tùy điều kiện nào xảy ra trước. Trong quá trình theo dõi lâu dài, các tác dụng phụ được đặc biệt quan tâm chỉ được báo cáo ở nhóm 177 Lu-Dotatate. Thử nghiệm này được đăng ký với ClinicTrials.gov, NCT01578239 .
Kết quả: Từ ngày 6 tháng 9 năm 2012 đến ngày 14 tháng 1 năm 2016, 231 bệnh nhân đã được ghi danh và được chỉ định điều trị ngẫu nhiên. Phân tích cuối cùng được xác định trước diễn ra 5 năm sau khi bệnh nhân cuối cùng được phân ngẫu nhiên (khi đã xảy ra 142 trường hợp tử vong); thời gian theo dõi trung bình là 76·3 tháng (trong khoảng 0·4-95·0) ở nhóm 177 Lu-Dotatate và 76·5 tháng (0·1-92·3) ở nhóm đối chứng. Tiêu chí phụ của tỷ lệ sống sót chung không được đáp ứng: tỷ lệ sống sót tổng thể trung bình là 48·0 tháng (KTC 95% 37·4-55·2) ở nhóm 177 Lu-Dotatate và 36·3 tháng (25·9-51·7 ) trong nhóm đối chứng (HR 0·84 [95% CI 0·60-1·17]; hai mặt p=0·30). Trong quá trình theo dõi lâu dài, các tác dụng phụ nghiêm trọng liên quan đến điều trị từ độ 3 trở xuống được ghi nhận ở 3% (3%) trong số 111 bệnh nhân ở nhóm nghiên cứu.177 nhóm Lu-Dotatate, nhưng không có tác dụng phụ nghiêm trọng mới liên quan đến điều trị nào được báo cáo sau khi dừng phân tích an toàn. Hai (2%) trong số 111 bệnh nhân được dùng 177 Lu-Dotatate đã phát triển hội chứng rối loạn sinh tủy, một trong số họ đã chết 33 tháng sau khi phân nhóm ngẫu nhiên (người này là trường hợp duy nhất được báo cáo là trường hợp tử vong liên quan đến điều trị với 177 Lu-Dotatate). Không có trường hợp mới nào về hội chứng loạn sản tủy hoặc bệnh bạch cầu dòng tủy cấp tính được báo cáo trong quá trình theo dõi lâu dài.
Giải thích: Điều trị bằng Lu-Dotatate không cải thiện đáng kể tỷ lệ sống sót tổng thể trung bình so với octreotide tác dụng kéo dài liều cao. Mặc dù tỷ lệ sống sót tổng thể cuối cùng không đạt được ý nghĩa thống kê, nhưng sự khác biệt 11·7 tháng về tỷ lệ sống sót tổng thể trung bình khi điều trị bằng 177 Lu-Dotatate so với chỉ dùng octreotide tác dụng kéo dài liều cao có thể được coi là có ý nghĩa lâm sàng. Không có tín hiệu an toàn mới nào được báo cáo trong thời gian theo dõi dài hạn.
Tài liệu tham khảo
- Dược thư quốc gia Việt Nam, truy cập ngày 26/08/2023.
- Drugbank, Octreotide , truy cập ngày 26/08/2023.
- Pubchem, Octreotide, truy cập ngày 26/08/2023.
- Strosberg, J. R., Caplin, M. E., Kunz, P. L., Ruszniewski, P. B., Bodei, L., Hendifar, A., … & Krenning, E. P. (2021). 177Lu-Dotatate plus long-acting octreotide versus high‑dose long-acting octreotide in patients with midgut neuroendocrine tumours (NETTER-1): final overall survival and long-term safety results from an open-label, randomised, controlled, phase 3 trial. The Lancet Oncology, 22(12), 1752-1763.
Xuất xứ: Austria
Xuất xứ: Việt Nam