Lenvatinib
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
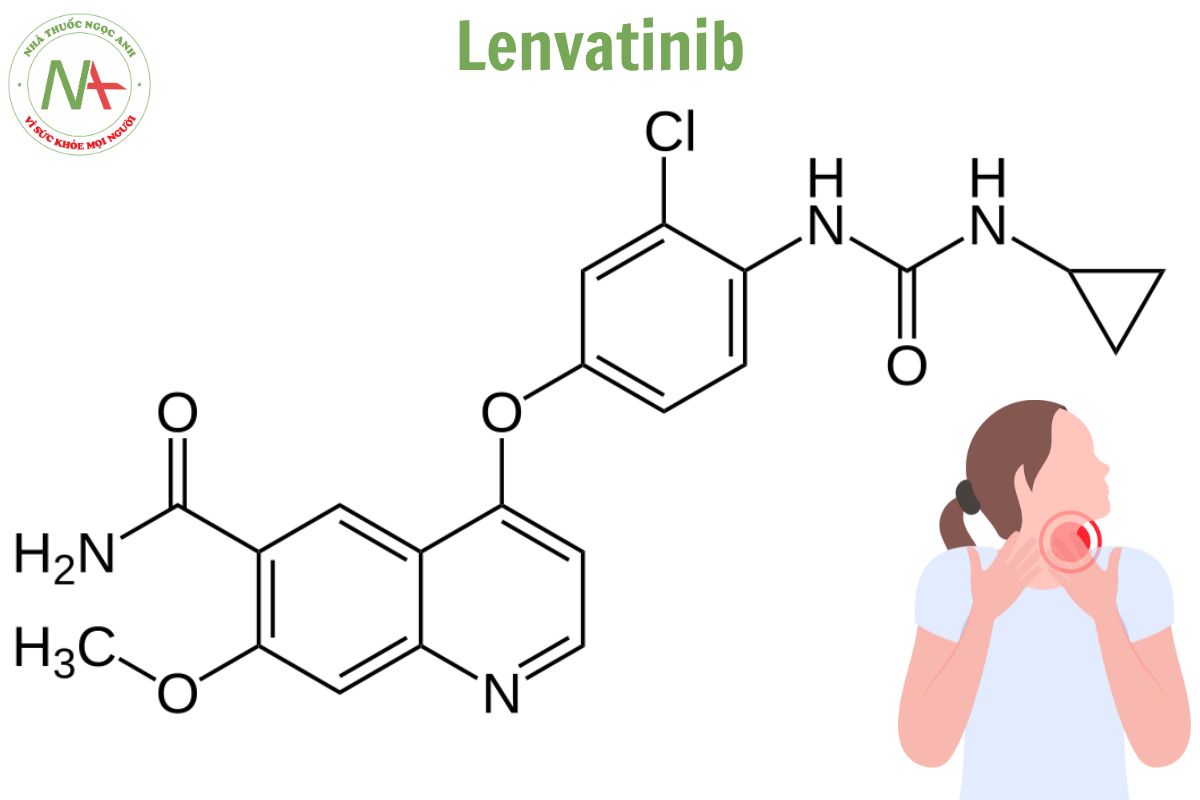
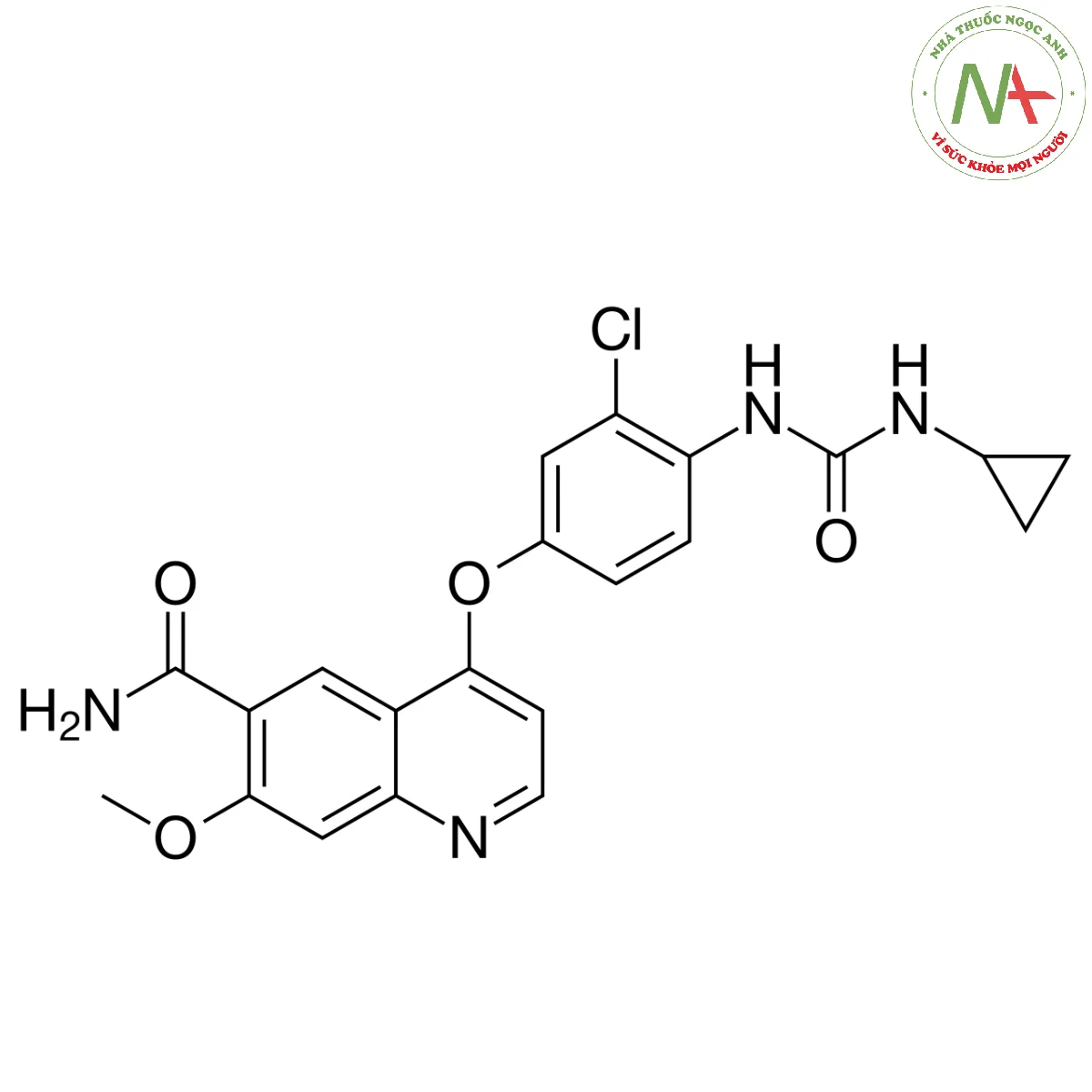
4-[3-chloro-4-(cyclopropylcarbamoylamino)phenoxy]-7-methoxyquinoline-6-carboxamide
Nhóm thuốc
Thuốc chống ung thư
Mã ATC
L – Chất chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01E – Chất ức chế protein kinase
L01EX – Chất ức chế protein kinase khác
L01EX08 – Lenvatinib
Mã UNII
EE083865G2
Mã CAS
417716-92-8
Cấu trúc phân tử
Công thức phân tử
C21H19ClN4O4
Phân tử lượng
426.9 g/mol
Cấu trúc phân tử
Lenvatinib là thành viên của nhóm quinoline là carboxamide của axit 4-{3-chloro-4-[(cyclopropylcarbamoyl)amino]phenoxy}-7-methoxyquinoline-6-carboxylic.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 5
Số liên kết có thể xoay: 6
Diện tích bề mặt cực tôpô: 116
Số lượng nguyên tử nặng: 30
Liên kết cộng hóa trị: 1
Nguồn gốc
- Một thử nghiệm lâm sàng giai đoạn I ở bệnh nhân ung thư đã được thực hiện vào năm 2006.
- Lenvatinib đã được cấp tư cách thuốc mồ côi để điều trị nhiều loại ung thư tuyến giáp không đáp ứng với iốt phóng xạ ở Mỹ và Nhật Bản vào năm 2012 và ở Châu Âu vào năm 2013.
- Vào tháng 2 năm 2015, FDA Hoa Kỳ đã phê duyệt lenvatinib để điều trị ung thư tuyến giáp biệt hóa tiến triển, kháng iod phóng xạ. Vào tháng 5 năm 2015, Cơ quan Dược phẩm Châu Âu (EMA) đã phê duyệt loại thuốc này cho cùng một chỉ định.
- Vào tháng 5 năm 2016, FDA đã phê duyệt thuốc này (kết hợp với everolimus) để điều trị ung thư biểu mô tế bào thận.
- Vào tháng 8 năm 2018, FDA đã phê duyệt lenvatinib để điều trị bước một cho những người mắc ung thư biểu mô tế bào gan (HCC) không thể cắt bỏ
Dạng bào chế
Viên nang cứng: thuốc Lenvatinib 4mg,…

Dược lý và cơ chế hoạt động
Lenvatinib phát huy cơ chế hoạt động thông qua việc ức chế nhiều thụ thể của tyrosine kinase: VEGFR-1 (FLT1), VEGFR-2(KDR), VEGFR-3 (FLT4), FGFR-1, FGFR-2, FGFR-3, FGFR- 4, PDGFRa, RET và c-KIT. Sự phát triển của khối u phụ thuộc vào sự phát triển và tăng sinh của các mạch máu mới (tân mạch). Sự phát triển khối u và sự hình thành mạch xảy ra khi các phối tử liên kết với các thụ thể tyrosine kinase tương ứng của chúng trong màng tế bào, bắt đầu một tầng phosphoryl hóa truyền tín hiệu nội bào thúc đẩy sự hình thành mạch và tăng sinh tế bào.
Sự ức chế thụ thể VEGF ngăn ngừa sự hình thành mạch khối u và sự ức chế FGFR, RET, PDGFRα và KIT ngăn chặn sự tăng sinh thêm của các tế bào ác tính. Sự ức chế đồng thời của cả hai con đường thụ thể dẫn đến ức chế truyền tín hiệu hạt nhân và đồng thời ức chế hoạt động của các yếu tố liên quan đến sự phát triển của khối u.
Dược động học
- Lenvatinib được hấp thu nhanh chóng qua ruột, đạt nồng độ đỉnh trong huyết tương sau một đến bốn giờ (ba đến bảy giờ nếu dùng cùng với thức ăn). Thời gian đạt nồng độ đỉnh trong huyết tương xảy ra từ 1 đến 4 giờ sau khi dùng thuốc. Dùng cùng với thức ăn không ảnh hưởng đến mức độ hấp thu nhưng làm giảm tốc độ hấp thu và làm chậm Tmax trung bình từ 2 giờ xuống còn 4 giờ. Chất này gần như liên kết hoàn toàn (98–99%) với protein huyết tương, chủ yếu là albumin.
- Lenvatinib được chuyển hóa bởi CYP3A và aldehyd oxyase, và được chuyển hóa tiếp thành quinolinone M2′ và M3′ bởi aldehyde oxidase (AO).
- Lenvatinib được chuyển hóa thành desmethyl-lenvatinib (M2) bởi enzyme gan CYP3A4 . Bản thân M2 và lenvatinib bị oxy hóa bởi aldehyde oxidase (AO) thành các chất gọi là M2′ và M3′, các chất chuyển hóa chính trong phân. Một chất chuyển hóa khác, cũng qua trung gian enzyme CYP, là N -oxide M3. Sự chuyển hóa không enzyme cũng xảy ra, dẫn đến khả năng tương tác thấp với các chất ức chế và cảm ứng enzyme.
- Thời gian bán hủy cuối cùng là 28 giờ, với khoảng 2/3 được bài tiết qua phân và 1/4 qua nước tiểu
Ứng dụng trong y học
- Lenvatinib là một chất ức chế tyrosine kinase đa thụ thể chứng tỏ đặc tính chống ung thư mạnh được chỉ định là liệu pháp đơn trị liệu hoặc phối hợp đối với một số khối u ác tính. Lenvatinib được FDA phê chuẩn để lenvatinib điều trị ung thư gan biểu mô tế bào tiến triển, ung thư tuyến giáp biệt hóa và ung thư biểu mô tế bào thận tiến triển.
- Lenvatinib đã được phê duyệt để sử dụng trong bệnh ung thư tuyến giáp biệt hóa sau một nghiên cứu Giai đoạn III ngẫu nhiên, đa trung tâm, kiểm soát giả dược (SELECT). Thử nghiệm bao gồm 392 người tham gia mắc bệnh DIC chịu lửa bằng iốt phóng xạ và được phân ngẫu nhiên vào nhóm điều trị 24 mg lenvatinib mỗi ngày một lần hoặc nhóm giả dược với tỷ lệ 2 trên 1. Nhóm điều trị đã chứng minh tỷ lệ sống sót không tiến triển trung bình (PFS) là 18,3 tháng và tỷ lệ đáp ứng (RR) là 64,8% so với nhóm giả dược, lần lượt là 3,6 tháng và 1,5%. Tỷ lệ sống sót chung (OS) của cả hai nhóm không cho thấy sự khác biệt đáng chú ý, có thể là do sự chuyển đổi từ nhóm dùng giả dược sang nhóm điều trị.Lenvatinib cũng đã được nghiên cứu để sử dụng trong bệnh ung thư tuyến giáp mất biệt hóa nhưng hiện không được FDA chấp thuận cho chỉ định này.
- Thử nghiệm ngẫu nhiên, không thua kém, giai đoạn III REFLECT đã chứng minh việc sử dụng lenvatinib trong HCC là không thua kém sorafenib, một chất ức chế kinase được phê duyệt để điều trị HCC. Thử nghiệm cũng chứng minh lenvatinib kéo dài thời gian sống sót không tiến triển thêm 7,3 tháng và tỷ lệ đáp ứng khách quan (ORR) lần lượt là 24% so với sorafenib, 3,6 tháng và 9%. Kết quả hiệu quả của thử nghiệm REFLECT Giai đoạn III đã được FDA chấp thuận cho sử dụng làm liệu pháp đầu tiên trong điều trị ung thư biểu mô tế bào gan giai đoạn tiến triển hoặc không thể cắt bỏ ở những bệnh nhân chưa được điều trị trước đó.
- Lenvatinib cũng đã được phê duyệt là liệu pháp kết hợp với everolimus cho RCC dựa trên thử nghiệm ngẫu nhiên giai đoạn II. Thử nghiệm đã so sánh lenvatinib 24 mg dưới dạng đơn trị liệu với everolimus 5 mg đơn trị liệu và lenvatinib 24 mg và everolimus 5 mg dưới dạng liệu pháp kết hợp. Nhóm kết hợp đã chứng minh thời gian sống sót không tiến triển kéo dài là 14,6 tháng so với 5,5 tháng của đơn trị liệu bằng everolimus và đơn trị liệu bằng lenvatinib trong 7,4 tháng. Liệu pháp phối hợp cũng cho thấy OS kéo dài hơn so với đơn trị liệu.
Sử dụng được FDA chấp thuận
- Ung thư tuyến giáp biệt hóa
- Ung thư biểu mô tế bào gan tiến triển không thể cắt bỏ hoặc tiến triển
- Ung thư biểu mô tế bào thận tiến triển
Tác dụng phụ
- Tiêu hóa: Buồn nôn và ói mửa, tiêu chảy, táo bón, đau bụng
- Thần kinh: Đau đầu, mệt mỏi
- Giảm cân
- Chứng khó phát âm
- Chứng loạn vị giác
- Phát ban
- Đau cơ
- Rối loạn chức năng tim
- Biến cố huyết khối động mạch
- Nhiễm độc gan
- Suy thận hoặc suy thận
- Protein niệu
- Thủng đường tiêu hóa
- Sự hình thành lỗ rò
- Kéo dài QT
- Hội chứng bệnh não chất trắng sau có thể đảo ngược
- Hạ canxi máu
- Rối loạn chức năng tuyến giáp
- Biến chứng lành vết thương
Tăng huyết áp là một trong những tác dụng phụ phổ biến nhất của liệu pháp lenvatinib và nổi bật hơn ở những đối tượng trên 75 tuổi. Trong các thử nghiệm SELECT giai đoạn III đối với DIC chịu lửa bằng iốt phóng xạ, các bệnh nhân trong nhóm điều trị đã báo cáo rằng có sự hình thành lỗ rò gây chảy máu từ khối u. Tác dụng phụ của điều trị nên được quản lý hỗ trợ bằng cách điều chỉnh liều lượng và ngừng điều trị nếu cần thiết
Độc tính ở người
Tác hại đối với thai nhi đã được quan sát thấy trong các thử nghiệm trên động vật trong quá trình sử dụng lenvatinib với liều lượng dưới mức khuyến cáo. Hiện tại, chưa có nghiên cứu sinh sản nào được thực hiện để phân tích độc tính ở người. Phụ nữ mang thai cần được tư vấn và thông báo về khả năng gây độc cho thai nhi. Lenvatinib cũng có thể xuất hiện trong thời kỳ cho con bú và nên ngừng cho con bú trong khoảng một tuần sau liều cuối cùng.
Liều dùng
Lenvaitnib có sẵn ở dạng viên nang 4 mg và thuốc Lenvatinib 10mg
- Ung thư tuyến giáp biệt hóa kháng iốt phóng xạ: 24 mg uống mỗi ngày một lần.
- Ung thư biểu mô tế bào thận tiến triển: Điều trị đầu tiên: 20 mg uống mỗi ngày một lần kết hợp với pembrolizumab trong tối đa hai năm; sau đó có thể được dùng dưới dạng đơn trị liệu.
- Bệnh đã điều trị trước đó: 18 mg uống mỗi ngày một lần kết hợp với everolimus.
- Liều Ung thư biểu mô tế bào gan không thể cắt bỏ (HCC): Liều đề nghị nên được xác định dựa trên trọng lượng cơ thể của bệnh nhân: 12 mg uống mỗi ngày một lần đối với trọng lượng cơ thể của bệnh nhân lớn hơn hoặc bằng 60 kg. 8 mg uống mỗi ngày một lần cho bệnh nhân nặng dưới 60 kg.
- Ung thư nội mạc tử cung tiến triển: 20 mg uống mỗi ngày một lần; đối với những bệnh nhân mắc bệnh tiến triển không có độ ổn định cao không phải vi vệ tinh (MSI-H) hoặc thiếu sửa chữa không khớp (dMMR) không phù hợp với liệu pháp tia X hoặc phẫu thuật chữa bệnh, hãy sử dụng với pembrolizumab.
- Việc điều chỉnh liều là cần thiết đối với bệnh nhân suy gan và suy thận. Lenvatinib được chuyển hóa nhờ enzyme ở gan bởi CYP450 isoform CYP3A và aldehyd oxidase và được bài tiết ra khỏi cơ thể dưới dạng phân và nước tiểu. Thời gian bán hủy của lenvatinib là 28 giờ. Khoảng 2/3 lượng thuốc được thải trừ qua phân, với khoảng 25% được thải trừ qua nước tiểu. Bệnh nhân bị rối loạn chức năng thận nặng (độ thanh thải creatinine từ 15 đến 29 mL/phút) có thể bị giảm độ thanh thải thuốc và tăng nồng độ lenvatinib trong huyết tương; do đó, nên giảm liều ở đối tượng này.
Chống chỉ định
Lenvatinib được chuyển hóa ở gan bởi CYP3A4 và aldehyd oxyase. Các tác nhân gây ra hoặc ức chế hệ thống CYP-450 có thể làm thay đổi nồng độ lenvatinib trong huyết tương, nhưng không có tương tác thuốc-thuốc có ý nghĩa lâm sàng nào được báo cáo.
Lưu ý khi sử dụng
- Do độc tính, một số đối tượng được điều trị bằng lenvatinib có thể bị giảm liều hoặc ngừng thuốc. Lúc đầu, creatinine, xét nghiệm mang thai cho bệnh nhân nữ, khám miệng, huyết áp và xét nghiệm protein trong nước tiểu được khuyến khích. Nên theo dõi thường xuyên chức năng thận và chức năng gan. Nếu hội chứng thận hư xảy ra, nên ngừng điều trị ngay lập tức. Theo dõi ECG cũng nên được thực hiện thường xuyên vì suy tim và kéo dài khoảng QT là tác dụng phụ liên quan đến việc sử dụng lenvatinib. Cần theo dõi chức năng tuyến giáp hàng tháng vì suy giáp cũng có thể xảy ra khi đang điều trị. Theo dõi huyết áp 24 giờ cũng được khuyên dùng để phát hiện chứng tăng huyết áp do sử dụng lenvatinib.
- Các thử nghiệm lâm sàng về lenvatinib thường cho thấy nồng độ aminotransferase trong huyết thanh tăng cao, xảy ra ở 52% bệnh nhân. Tuy nhiên, các giá trị vượt quá năm lần giới hạn trên của mức bình thường (ULN) chỉ xuất hiện ở 3% đến 5% đối tượng. Tương tự, mức độ phosphatase kiềm trong huyết thanh cũng phổ biến, xảy ra ở 28% bệnh nhân, nhưng cao hơn ba lần ULN chỉ ở 2%.
- Lenvatinib là một chất ức chế tyrosine kinase đa thụ thể được FDA phê chuẩn và chỉ định để điều trị ung thư tuyến giáp biệt hóa kháng iốt phóng xạ (DTC), ung thư biểu mô tế bào gan không thể cắt bỏ (HCC) và ung thư biểu mô tế bào thận tiến triển (RCC). Việc chăm sóc những bệnh nhân mắc các khối u ác tính như vậy đòi hỏi sự chăm sóc đặc biệt từ đội ngũ chuyên gia chăm sóc sức khỏe đa chuyên môn. Chẩn đoán và quản lý sớm có thể làm giảm các biến chứng suốt đời, tăng chất lượng cuộc sống và giảm tỷ lệ tử vong. Nhóm thông dịch viên bao gồm bác sĩ lâm sàng chăm sóc chính, bác sĩ ung thư, y tá và dược sĩ.
Một vài nghiên cứu của Lenvatinib trong Y học
Liều lượng, hiệu quả và độ an toàn của Lenvatinib trong điều trị nhiều khối u ác tính.
Giới thiệu: Lenvatinib là thuốc ức chế tyrosine kinase đa mục tiêu bằng đường uống đã cho thấy hiệu quả và độ an toàn có thể kiểm soát được đối với nhiều loại ung thư. Liều khởi đầu được khuyến nghị cho lenvatinib khác nhau tùy theo loại ung thư và chỉ định dựa trên việc nó được sử dụng dưới dạng đơn trị liệu hay liệu pháp kết hợp.
Các lĩnh vực được đề cập: Đánh giá này bao gồm các thử nghiệm lâm sàng đã thiết lập mô hình dùng thuốc và hiệu quả của lenvatinib và xác định hồ sơ tác dụng phụ của nó là đơn trị liệu; hoặc kết hợp với chất ức chế mTOR, everolimus; hoặc kháng thể kháng PD-1, pembrolizumab; và/hoặc hóa trị.
Ý kiến chuyên gia: Lenvatinib đã được thiết lập như là phương pháp chăm sóc tiêu chuẩn dưới dạng đơn trị liệu hoặc kết hợp với các thuốc chống ung thư khác để điều trị ung thư biểu mô tuyến giáp biệt hóa kháng iốt phóng xạ, ung thư biểu mô tế bào gan, ung thư biểu mô tế bào thận và ung thư biểu mô nội mạc tử cung và đang được nghiên cứu sâu hơn trên một số các loại khối u khác. Các chiến lược quản lý liều lượng và tác dụng phụ của lenvatinib đã được phát triển thông qua kinh nghiệm thử nghiệm lâm sàng sâu rộng. Nói chung, dữ liệu cung cấp lý do căn bản để bắt đầu dùng lenvatinib ở liều khuyến cáo, sau đó tạm dừng hoặc giảm liều khi cần thiết để đạt được cường độ liều cần thiết nhằm mang lại lợi ích tối đa cho bệnh nhân. Hồ sơ tác dụng phụ của lenvatinib phù hợp với hồ sơ tác dụng phụ của các chất ức chế tyrosine kinase khác
Tài liệu tham khảo
- Thư viện y học quốc gia, Lenvatinib, pubchem. Truy cập ngày 09/09/2023.
- Inderbir S. Padda; Mayur Parmar. Lenvatinib,pubmed.com. Truy cập ngày 09/09/2023.
- Robert J Motzer, Matthew H Taylor, Thomas R Jeffry Evans (52022), Lenvatinib dose, efficacy, and safety in the treatment of multiple malignancies,pubmed.com. Truy cập ngày 09/09/2023.
