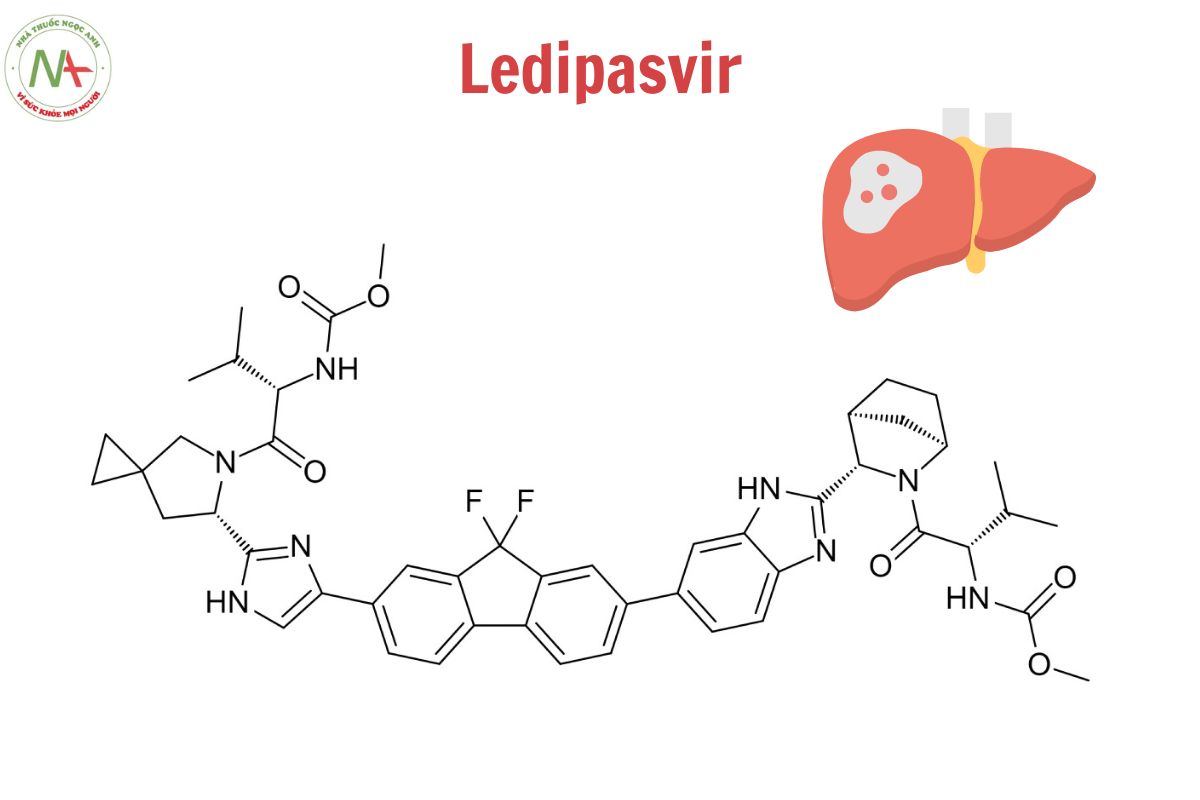
Ledipasvir
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
methyl N-[(2S)-1-[(6S)-6-[5-[9,9-difluoro-7-[2-[(1R,3S,4S)-2-[(2S)-2-(methoxycarbonylamino)-3-methylbutanoyl]-2-azabicyclo[2.2.1]heptan-3-yl]-3H-benzimidazol-5-yl]fluoren-2-yl]-1H-imidazol-2-yl]-5-azaspiro[2.4]heptan-5-yl]-3-methyl-1-oxobutan-2-yl]carbamate
Ledipasvir thuộc nhóm nào?
Ledipasvir là thuốc gì? Thuốc kháng vi-rút để điều trị nhiễm HCV
Mã ATC
J Thuốc kháng khuẩn hệ thống
J05 Kháng virus dùng trong hệ thống
J05A Thuốc kháng virus trực tiếp
J05AP Thuốc kháng vi-rút để điều trị nhiễm HCV
J05AP51 Sofosbuvir và ledipasvir
Mã UNII
013TE6E4WV
Mã CAS
1256388-51-8
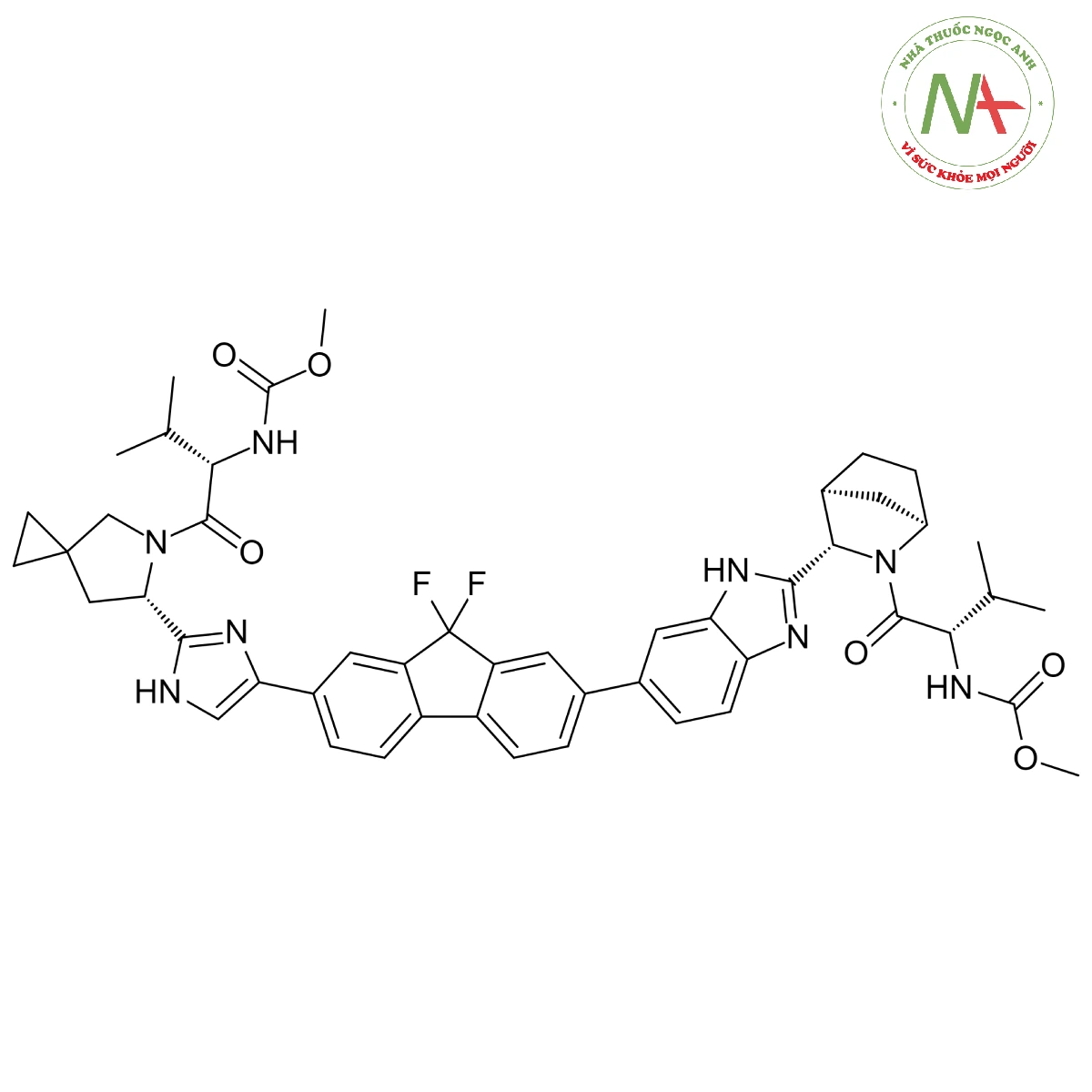
Cấu trúc phân tử
Công thức phân tử
C49H54F2N8O6
Phân tử lượng
889.0 g/mol
Cấu trúc phân tử
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 10
Số liên kết có thể xoay: 12
Diện tích bề mặt cực tôpô: 175
Số lượng nguyên tử nặng: 65
Số lượng nguyên tử trung tâm xác định được: 6
Liên kết cộng hóa trị: 1
Dạng bào chế
Viên nang mềm: sofosbuvir/ledipasvir,..
Viên nén bao phim: thuốc ledipasvir 90mg/sofosbuvir 400mg,..
Dược lý và cơ chế hoạt động
Ledipasvir có tác dụng chống lại HCV và được phân loại là thuốc chống vi rút tác dụng trực tiếp (DAA). Với liều 120 mg hai lần mỗi ngày (gấp 2,67 lần liều khuyến cáo tối đa), ledipasvir không kéo dài khoảng QTc đến bất kỳ mức độ nào có ý nghĩa lâm sàng.
Ledipasvir có khả năng ức chế các thành phần protein NS5A của các virus gây bệnh viêm gan C, đây là những thành phần protein không thể thiếu trong quá trình lắp ráp các virion và chop quá trình sao chép của RNA của các virus do đó ngăn chặn quá trình tăng sinh và tiêu diệt các virus gây bệnh HCV này.
Dược động học
Hấp thu
Khi dùng đường uống, ledipasvir đạt nồng độ tối đa trong huyết tương trong khoảng 4 đến 4,5 giờ với nồng độ tối đa (Cmax) là 323 ng/mL.
Chuyển hóa
Trong ống nghiệm, không phát hiện được sự chuyển hóa của ledipasvir bởi CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6 và CYP3A4 ở người. Đã có bằng chứng về sự chuyển hóa oxy hóa chậm thông qua một cơ chế chưa được biết đến. Sau một liều duy nhất 90 mg [14C]-ledipasvir, mức phơi nhiễm toàn thân hầu như chỉ xảy ra với thuốc gốc (>98%). Ledipasvir không biến đổi là loài chính hiện diện trong phân.
Thải trừ
Sau khi uống một liều duy nhất 90 mg [14C]-ledipasvir, tổng lượng phục hồi trung bình của hoạt tính phóng xạ [14C] trong phân và nước tiểu là khoảng 87%, với hầu hết liều phóng xạ được phục hồi từ phân (khoảng 86%). Ledipasvir không biến đổi được bài tiết qua phân chiếm trung bình 70% liều dùng và chất chuyển hóa oxy hóa M19 chiếm 2,2% liều dùng. Những dữ liệu này chỉ ra rằng sự bài tiết qua mật của ledipasvir không biến đổi là con đường thải trừ chính, trong đó bài tiết qua thận là một con đường phụ (khoảng 1%).Thời gian bán hủy trung bình của ledipasvir là 47 giờ.
Ứng dụng trong y học
Ledipasvir thường được dùng kết hợp với sofosbuvir để điều trị bệnh viêm gan C mãn tính kiểu gen 1 cho bệnh nhân.
Tác dụng phụ
Theo các thử nghiệm lâm sàng, ledipasvir/sofosbuvir được dung nạp rất tốt với các tác dụng phụ thường gặp nhất là mệt mỏi và đau đầu
Độc tính ở người
Có rất ít độc tính liên quan đến việc sử dụng ledipasvir trong các sản phẩm kết hợp. Các phản ứng phụ thường gặp nhất là nhức đầu và mệt mỏi.
Tương tác với thuốc khác
- Ledipasvir có thể làm tăng nồng độ everolimus, etoposide trong máu.
- Ledipasvir có thể làm tăng nồng độ tenofovir trong máu, một thành phần phổ biến của nhiều chế độ điều trị HIV.
Lưu ý khi sử dụng
- Nếu bạn đã từng bị viêm gan B , bệnh có thể hoạt động hoặc trở nên nặng hơn khi sử dụng hoặc sau khi bạn ngừng sử dụng ledipasvir và sofosbuvir.
- Hãy cho bác sĩ nếu bệnh nhân đã từng bị viêm gan B, các vấn đề về gan khác ngoài viêm gan (bao gồm cả ghép gan ); bệnh thận (hoặc nếu đang chạy thận nhân tạo); HIV hoặc AIDS; vấn đề về nhịp tim phải dùng thuốc gọi là amiodarone hoặc nếu bạn sử dụng thuốc làm loãng máu ( warfarin , Coumadin , Jantoven ) và thực hiện xét nghiệm “INR” hoặc thời gian protrombin định kỳ.
- Ledipasvir và sofosbuvir cũng có thể được sử dụng kết hợp với thuốc ribavirin trong điều trị cho cả nam và nữ vì vậy trong quá trình dùng thuốc cả bệnh nhân nam và nữ đều cần có các biện pháp tránh thai hiệu quả vì ribavirin là thuốc có thể gây hại cho thai nhi như dị tật bẩm sinh nếu cả bố hoặc mẹ đứa trẻ dùng thuốc này. Sau khi kết thúc liều dùng ribavirin cuối cùng, bệnh nhân vẫn cần có biện pháp tránh thai sau ít nhất 6 tháng và nếu trong quá trình dùng thuốc bệnh nhân có thai thì cần báo ngay cho bác sĩ.
- Khi dùng ledipasvir và sofosbuvir nên có biện pháp tránh thai hợp lí cho cả nam và nữ.
- Ledipasvir chưa được chứng minh an toàn cho phụ nữ cho con bú vì vậy nên hỏi ý kiến bác sĩ trước khi dùng Ledipasvir cho nhóm đối tượng này.
- Không dùng Ledipasvir cho đối tượng bệnh nhân < 3 tuổi.
Một vài nghiên cứu của Ledipasvir trong Y học
Nghiên cứu 1
Dược động học lâm sàng và Dược lực học của Ledipasvir/Sofosbuvir, viên nén kết hợp liều cố định để điều trị viêm gan C

Ledipasvir/sofosbuvir, viên kết hợp liều cố định gồm ledipasvir ức chế NS5A và sofosbuvir ức chế NS5B polymerase, được phê duyệt ở Hoa Kỳ, Liên minh Châu Âu, Canada và các khu vực khác để điều trị nhiễm virus viêm gan C mãn tính ở người lớn. Sau khi hấp thu, ledipasvir đạt nồng độ tối đa trong huyết tương (T max ) sau 4-4,5 giờ sau khi dùng thuốc và được thải trừ với thời gian bán hủy cuối cùng (t 1/2 ) là 47 giờ. Sofosbuvir trải qua quá trình kích hoạt nội bào thành triphosphate hoạt tính GS-461203 (không được phát hiện trong huyết tương) và cuối cùng thành GS-331007, một chất chuyển hóa lưu hành chiếm ưu thế, là chất phân tích chính được quan tâm trong các nghiên cứu dược lý lâm sàng. Sofosbuvir được hấp thu và thải trừ nhanh chóng khỏi huyết tương (Ttối đa : 0,8-1 giờ; t 1/2 : 0,5 giờ). Nồng độ đỉnh trong huyết tương của GS-331007 đạt được trong khoảng từ 3,5 đến 4 giờ sau liều dùng; sự loại bỏ t 1/2đối với GS-331007 là 27 giờ. Ledipasvir/sofosbuvir thể hiện đặc tính dược lý lâm sàng thuận lợi; nó có thể được dùng một lần mỗi ngày mà không cần quan tâm đến thức ăn và không cần điều chỉnh liều ở bệnh nhân nhiễm virus viêm gan C bị suy gan hoặc suy thận nhẹ đến trung bình. Đặc tính dược động học của ledipasvir, sofosbuvir và GS-331007 (chất chuyển hóa lưu hành chủ yếu của sofosbuvir) không bị ảnh hưởng đáng kể bởi các biến số nhân khẩu học; Các phân tích dược động học/dược lực học cho thấy không có mối quan hệ phơi nhiễm-đáp ứng về hiệu quả hoặc độ an toàn. Tổng quan này tóm tắt các phân tích dược động học lâm sàng, dược lực học và dược động học/dược lực học của ledipasvir/sofosbuvir.
Nghiên cứu 2
Ledipasvir/Sofosbuvir có hiệu quả khi điều trị duy nhất bệnh Porphyria Cutanea Tarda với bệnh viêm gan C mãn tính
Bối cảnh và mục đích: Viêm gan C mãn tính [CHC] là một yếu tố nguy cơ gây bệnh porphyria cutanea tarda [PCT]. Để đánh giá liệu ledipasvir/sofosbuvir có hiệu quả trong điều trị cả PCT và CHC hay không, chúng tôi đã điều trị cho bệnh nhân mắc CHC + PCT chỉ bằng ledipasvir/sofosbuvir và theo dõi họ trong ít nhất 1 năm để đánh giá khả năng chữa khỏi CHC và thuyên giảm PCT.
Phương pháp: Từ tháng 9 năm 2017 đến tháng 5 năm 2020, 15 trong số 23 bệnh nhân PCT + CHC được sàng lọc đã đủ điều kiện và đăng ký. Tất cả đều được điều trị bằng ledipasvir/sofosbuvir với liều lượng và thời gian khuyến nghị, tùy theo giai đoạn bệnh gan của họ. Chúng tôi đã đo porphyrin trong huyết tương và nước tiểu lúc ban đầu và hàng tháng trong 12 tháng đầu tiên và lúc 16, 20 và 24 tháng. Chúng tôi đo HCV RNA huyết thanh lúc ban đầu, 8-12 và 20-24 tháng. Chữa khỏi HCV được định nghĩa là không phát hiện được HCV RNA huyết thanh ≥ 12 tuần sau khi kết thúc điều trị (EOT). Sự thuyên giảm PCT được xác định trên lâm sàng là không có mụn nước hoặc bọng nước mới và về mặt sinh hóa là lượng porphyrin uro-cộng với hepta-carboxyl trong nước tiểu ≤ 100 mcg/g creatinine.
Kết quả: Tất cả 15 bệnh nhân, trong đó có 13 nam giới, nhiễm HCV kiểu gen 1. 2/15 bệnh nhân rút lui hoặc không theo dõi được. Trong số 13 trường hợp còn lại, 12 trường hợp đã khỏi bệnh CHC; 1 có đáp ứng virus hoàn toàn, sau đó là tái phát HCV sau khi dùng ledipasvir/sofosbuvir nhưng sau đó được chữa khỏi bằng điều trị bằng sofosbuvir/velpatasvir. Trong số 12 bệnh nhân được chữa khỏi CHC, tất cả đều đạt được sự thuyên giảm lâm sàng lâu dài của PCT.
Kết luận: Ledipasvir/sofosbuvir [và có thể là các thuốc kháng vi-rút tác dụng trực tiếp khác] là phương pháp điều trị hiệu quả đối với HCV khi có PCT và dẫn đến thuyên giảm lâm sàng của PCT mà không cần phẫu thuật cắt tĩnh mạch bổ sung hoặc điều trị bằng hydroxychloroquine liều thấp.
Tài liệu tham khảo
- Thư viện y học quốc gia, Ledipasvir , pubchem. Truy cập ngày 01/09/2023.
- Herbert L Bonkovsky, Sean P Rudnick , Christopher D Ma, Jessica R Overbey, Kelly Vương, Denise Faust, Csilla Hallberg, Karli Hedstrom, Hetanshi Naik, Akshata Moghe, Karl E Anderson(2023), Ledipasvir/Sofosbuvir Is Effective as Sole Treatment of Porphyria Cutanea Tarda with Chronic Hepatitis C ,pubmed.com. Truy cập ngày 01/09/2023.
- Polina German, Anita Mathias, Diana Brainard, Brian P Kearney (2016), Clinical Pharmacokinetics and Pharmacodynamics of Ledipasvir/Sofosbuvir, a Fixed-Dose Combination Tablet for the Treatment of Hepatitis C,pubmed.com. Truy cập ngày 01/09/2023.
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ