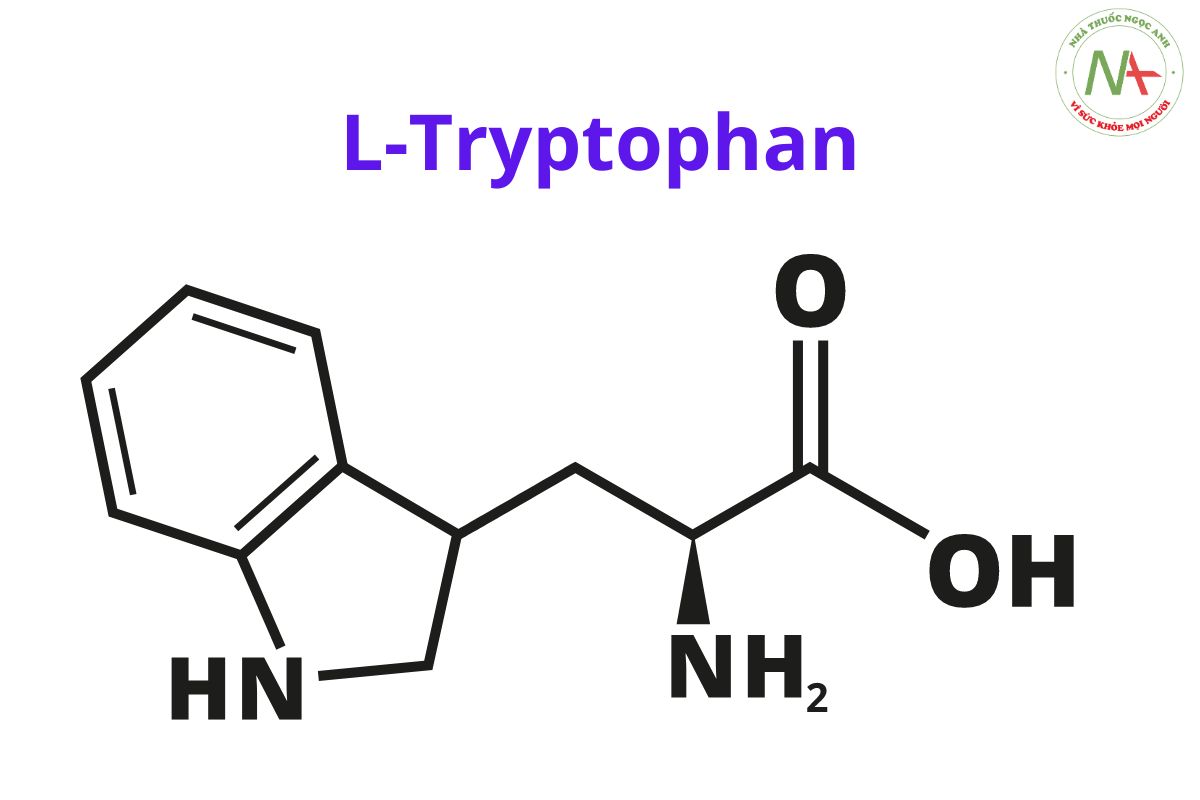
L-Tryptophan
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
(2S)-2-amino-3-(1H-indol-3-yl)propanoic acid
Nhóm thuốc
Thuốc Tryptophan là gì? Thuốc chống trầm cảm
Mã ATC
N – Hệ thần kinh
N06 – Phân tâm học
N06A – Thuốc chống trầm cảm
N06AX – Thuốc chống trầm cảm khác
N06AX02 – Tryptophan
Mã UNII
8DUH1N11BX
Mã CAS
73-22-3
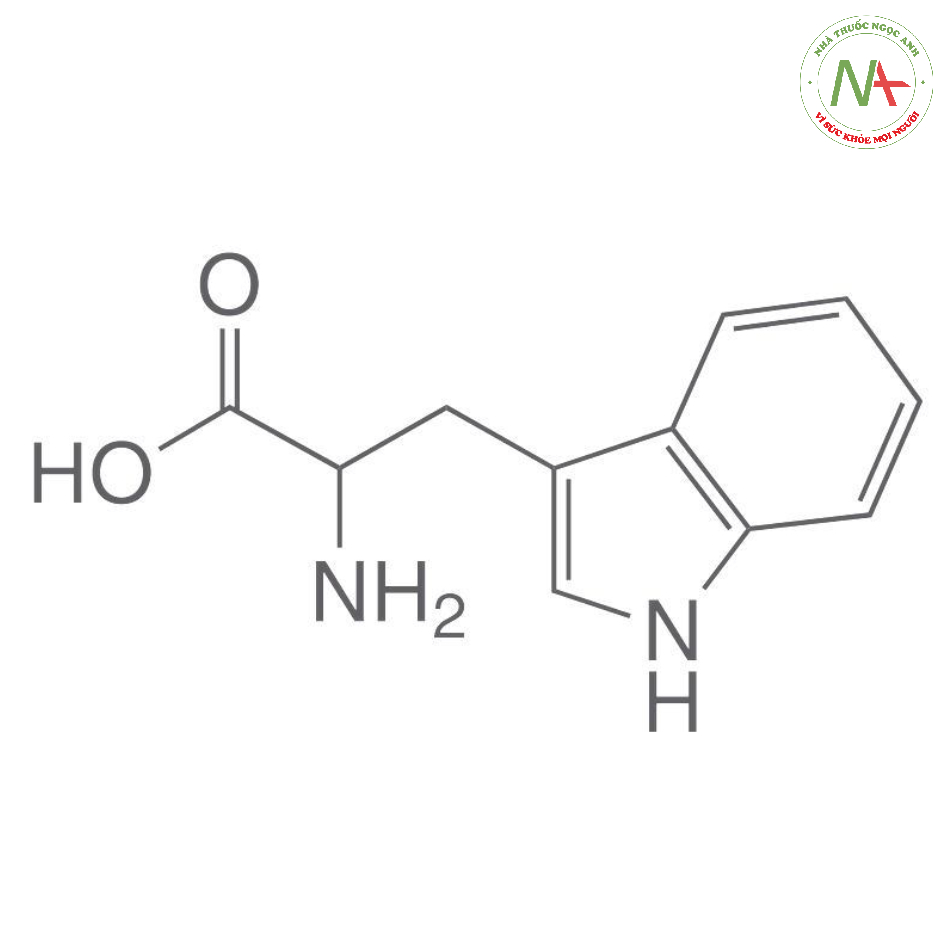
Cấu trúc phân tử
Công thức phân tử
C11H12N2O2
Phân tử lượng
204,22 g/mol
Cấu trúc phân tử
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 3
Số liên kết có thể xoay: 3
Diện tích bề mặt cực tôpô: 79,1
Số lượng nguyên tử nặng: 15
Số lượng nguyên tử trung tâm xác định được: 1
Liên kết cộng hóa trị: 1
Tính chất
L-tryptophan là chất rắn không mùi, màu trắng đến hơi vàng trắng hay ở dạng bột màu trắng có vị nhạt là một axit amin thiết yếu; xảy ra ở dạng đồng phân. Điểm nóng chảy 554 đến 558 °F. Độ hòa tan 1 đến 5 mg/mL ở 68 °F. Ít tan trong axit axetic, etanol; không hòa tan trong ete etylic. Khi đun nóng để phân hủy, nó thải ra khói độc của oxit nitric. Dung dịch 1% trong nước có độ pH từ 5,5 đến 7.
Dạng bào chế
Viên nang cứng, viên nang mềm, viên nén bao phim, dung dịch truyền tiêm tĩnh mạch, cốm.
Nguồn gốc
- Giống như các axit amin khác, tryptophan là một hợp chất chuyển hóa ở pH sinh lý tại đó nhóm amin bị proton hóa ( –NH+3; pK a = 9,39) và axit cacboxylic bị khử proton ( –COO − ; pK a = 2,38).
- Tryptophan có ở đâu? Con người và nhiều loài động vật không thể tổng hợp tryptophan: chúng cần lấy nó thông qua chế độ ăn uống, khiến nó trở thành một axit amin thiết yếu. Năm 2023, quang phổ phát xạ của tryptophan được phát hiện trong khí giữa các vì sao của cụm sao IC 348.
- Tryptophan là tiền chất quan trọng của niacin đối với con người. Chính vì lý do này mà chế độ ăn nhiều ngô dẫn đến thiếu hụt lâm sàng (pellagra) niacin, ngô đặc biệt thiếu tryptophan.
Tryptophan có trong thực phẩm nào?
Tryptophan có mặt trong hầu hết các loại thực phẩm dựa trên protein hoặc protein ăn kiêng. Nó đặc biệt dồi dào trong sô cô la, yến mạch, chà là khô, Tryptophan trong sữa, sữa chua, phô mai, thịt đỏ, trứng, cá, thịt gia cầm, vừng, đậu xanh, hạnh nhân, hạt hướng dương, hạt bí ngô, hạt gai dầu, kiều mạch, tảo xoắn và đậu phộng. Trái ngược với niềm tin phổ biến bằng gà tây đã nấu chín chứa rất nhiều tryptophan, hàm lượng tryptophan trong gà tây là điển hình của gia cầm
Dược lý và cơ chế hoạt động
L-Tryptophan, một axit amin không thể thiếu, đóng vai trò là tiền chất của một số phân tử nhỏ có ý nghĩa chức năng bao gồm vitamin niacin, chất dẫn truyền thần kinh serotonin, chất chuyển hóa tryptamine và hormone tuyến tùng melatonin. Tăng tryptophan đã được chứng minh là làm tăng tổng hợp chất dẫn truyền thần kinh trong não, máu và các cơ quan khác của cơ thể.
Một số phản ứng phụ quan trọng xảy ra trong quá trình dị hóa tryptophan trên con đường thành acetoacetate. Enzyme đầu tiên của con đường dị hóa là một oxyase porphyrin sắt mở vòng indole. Enzym thứ hai rất dễ cảm ứng, nồng độ của nó tăng gần gấp 10 lần trong chế độ ăn nhiều tryptophan. Kynurenine là điểm trung gian quan trọng đầu tiên trong lộ trình. Kynurenine trải qua quá trình khử amin trong phản ứng chuyển hóa tiêu chuẩn tạo ra axit kynurenic. Axit Kynurenic và các chất chuyển hóa đã được chứng minh là có tác dụng chống kích thích và chống co giật. Phản ứng nhánh bên thứ hai tạo ra axit antraniliccộng với alanin. Một chất tương đương khác của alanine được sản xuất xa hơn dọc theo con đường dị hóa chính, và chính việc sản xuất các dư lượng alanine này cho phép tryptophan được phân loại giữa các axit amin glucogen và ketogen. Điểm nhánh quan trọng thứ hai chuyển đổi kynurenine thành 2-amino-3-carboxymuconic semialdehyde, có hai số phận. Dòng chảy chính của các nguyên tố carbon từ chất trung gian này là glutarate. Một phản ứng phụ quan trọng ở gan là sự chuyển hóa và một số sắp xếp lại để tạo ra một lượng axit nicotinic hạn chế, dẫn đến sản xuất một lượng nhỏ NAD +và NADP +.
Cơ chế phân hủy protein nội bào, theo đó protein bị thủy phân thành các axit amin tự do, phức tạp hơn và không được đặc trưng ở cấp độ cơ học như ở cấp độ tổng hợp. Trong tế bào có rất nhiều loại enzim khác nhau có khả năng phân cắt liên kết peptit. Tuy nhiên, phần lớn quá trình phân giải protein của tế bào dường như được chia sẻ giữa hai hệ thống đa enzym: hệ thống lysosomal và proteasomal. Lysosome là một túi có màng bao bọc bên trong tế bào chứa nhiều loại enzyme phân giải protein và hoạt động chủ yếu ở pH axit. Thể tích của tế bào chất bị nhấn chìm (autophagy) và sau đó chịu tác dụng của các enzym protease ở nồng độ cao. Hệ thống này được cho là tương đối không chọn lọc trong hầu hết các trường hợp, mặc dù nó cũng có thể làm suy giảm các protein nội bào cụ thể. Hệ thống này được điều chỉnh cao bởi các hormone như insulin và glucocorticoid, và bởi các axit amin. Hệ thống thứ hai làHệ thống ubiquitin-proteasome phụ thuộc ATP, hiện diện trong tế bào chất. Bước đầu tiên là kết hợp các phân tử ubiquitin, một peptit gồm 76 axit amin cơ bản, với các gốc lysine trong protein mục tiêu. Một số enzyme tham gia vào quá trình này, chúng nhắm mục tiêu chọn lọc các protein để phân hủy bởi thành phần thứ hai, proteasome.
Các phát hiện chỉ ra rằng tốc độ luân chuyển serotonin tăng lên do (L)-tryptophan tạo ra và sự hạn chế về thể chất có liên quan đến việc ức chế hormone kích thích tuyến giáp (TSH) và kích thích giải phóng prolactin từ thùy trước tuyến yên ở chuột.
Dược động học
Hấp thu
Tryptophan được hấp thu dễ dàng từ đường tiêu hóa. (L)-Tryptophan với dầu thực vật trong viên nang mềm gelatin cho phép với liều lượng thấp hơn so với dạng bào chế thông thường. Lượng tryptophan tự do tối đa trong huyết thanh đạt được trong giờ đầu tiên trong khi lượng này cần gấp 4-5 lần với viên nén hoặc viên nang gelatin cứng.
Chuyển hóa
Tryptophan được chuyển hóa ở gan bởi tryptophan pyrrolase và tryptophan hydroxylase. Các chất chuyển hóa bao gồm hydroxytryptophan, sau đó được chuyển thành serotonin và các dẫn xuất kynurenine. Một số tryptophan được chuyển thành axit nicotinic và nicotinamide. Pyridoxine và axit ascorbic lần lượt là các đồng yếu tố trong quá trình decarboxyl hóa và hydroxyl hóa tryptophan; pyridoxine dường như ngăn chặn sự tích tụ của các chất chuyển hóa kynurenine.Nó được chuyển hóa thành serotonin và các chất chuyển hóa khác, bao gồm các dẫn xuất kynurenine. Pyridoxine và axit ascorbic dường như có liên quan đến quá trình chuyển hóa của nó.
Trong bệnh Hartnup: tryptophane xuất hiện trong nước tiểu do khiếm khuyết trong việc hấp thụ tryptophane ở thận và ruột. Nó là một chất chuyển hóa trung gian trong quá trình tổng hợp serotonin ( 5 -hydroxytryptamine ) và axit axetic 5-hydroxyindole (HIAA).
Phân bố
Tryptophan liên kết chặt chẽ với albumin huyết thanh.
Thải trừ
L-Tryptophan và các chất chuyển hóa của nó được bài tiết qua nước tiểu. Bệnh nhân bị ung thư bàng quang bài tiết nhiều hơn đáng kể axit kynurenic, acetylkynurenine, kynurenine và 3-hydroxykynurenine sau khi uống một liều L-tryptophan so với đối tượng kiểm soát không mắc bệnh. Thời gian bán hủy sinh học của tryptophan được báo cáo là 15,8 giờ.
L-Tryptophan có tác dụng gì?
Trầm cảm
Vì tryptophan được chuyển đổi thành 5-hydroxytryptophan (5-HTP), sau đó được chuyển đổi thành chất dẫn truyền thần kinh serotonin, người ta đã đề xuất rằng việc tiêu thụ tryptophan hoặc 5-HTP có thể cải thiện các triệu chứng trầm cảm bằng cách tăng mức độ serotonin trong não. Tryptophan được bán không cần kê đơn tại Hoa Kỳ (sau khi bị cấm ở các mức độ khác nhau từ năm 1989 đến 2005 ) và Vương quốc Anh như một chất bổ sung chế độ ăn uống để sử dụng làm thuốc chống trầm cảm, giải lo âu và hỗ trợ giấc ngủ . Nó cũng được bán trên thị trường như một loại thuốc theo toa ở một số nước châu Âu để điều trịtrầm cảm lớn . Có bằng chứng cho thấy nồng độ tryptophan trong máu khó có thể thay đổi khi thay đổi chế độ ăn uống, nhưng tiêu thụ tryptophan tinh khiết làm tăng mức serotonin trong não, trong khi ăn thực phẩm có chứa tryptophan thì không. [28]
Năm 2001, một bài đánh giá của Cochrane về tác dụng của 5-HTP và tryptophan đối với bệnh trầm cảm đã được công bố. Các tác giả chỉ bao gồm các nghiên cứu có độ chính xác cao và bao gồm cả 5-HTP và tryptophan trong bài đánh giá của họ do dữ liệu hạn chế về cả hai. Trong số 108 nghiên cứu về 5-HTP và tryptophan về bệnh trầm cảm được xuất bản từ năm 1966 đến năm 2000, chỉ có hai nghiên cứu đáp ứng các tiêu chuẩn chất lượng của tác giả để đưa vào, với tổng số 64 người tham gia nghiên cứu. Các chất này hiệu quả hơn giả dược trong hai nghiên cứu nhưng các tác giả tuyên bố rằng “bằng chứng không đủ chất lượng để kết luận” và lưu ý rằng “bởi vì các thuốc chống trầm cảm thay thế tồn tại đã được chứng minh là có hiệu quả và an toàn, nên tính hữu dụng lâm sàng của 5-HTP và tryptophan hiện tại bị hạn chế”. [29]Việc sử dụng tryptophan như một liệu pháp bổ sung ngoài điều trị tiêu chuẩn cho rối loạn tâm trạng và lo âu không được hỗ trợ bởi các bằng chứng khoa học.
Mất ngủ
Khuyến cáo không nên sử dụng tryptophan trong điều trị chứng mất ngủ do hiệu quả kém.
Tryptophan đã được sử dụng trong y học để điều trị đau mặt, giảm chứng nghiến răng, hỗ trợ hiệu quả điều trị các triệu chứng của hội chứng rối loạn khó chịu tiền kinh nguyệt, cải thiện thành tích thể thao.
Tác dụng phụ
Các tác dụng phụ tiềm ẩn của việc bổ sung tryptophan bao gồm buồn nôn, tiêu chảy, buồn ngủ, chóng mặt, nhức đầu, khô miệng, mờ mắt, an thần, hưng phấn và rung giật nhãn cầu
Độc tính ở người
Chuột nhắt có LD 50 > 16 gm/kg. Được điều tra như một tác nhân gây khối u, gây đột biến, tác nhân sinh sản. Các triệu chứng quá liều bao gồm kích động, nhầm lẫn, tiêu chảy, sốt, phản xạ hoạt động quá mức, phối hợp kém, bồn chồn, run rẩy, đổ mồ hôi, nói chuyện hoặc hành động với sự phấn khích mà bạn không thể kiểm soát, run rẩy hoặc run rẩy, co giật và nôn mửa.
Một số phản ứng phụ quan trọng xảy ra trong quá trình dị hóa tryptophan trên con đường thành acetoacetate. Enzyme đầu tiên của con đường dị hóa là một oxyase porphyrin sắt mở vòng indole. Enzym thứ hai rất dễ cảm ứng, nồng độ của nó tăng gần gấp 10 lần trong chế độ ăn nhiều tryptophan. Kynurenine là điểm trung gian quan trọng đầu tiên trong lộ trình. Kynurenine trải qua quá trình khử amin trong phản ứng chuyển hóa tiêu chuẩn tạo ra axit kynurenic. Axit Kynurenic và các chất chuyển hóa đã được chứng minh là có tác dụng chống kích thích và chống co giật. Phản ứng nhánh bên thứ hai tạo ra axit antraniliccộng với alanin. Một chất tương đương khác của alanine được sản xuất xa hơn dọc theo con đường dị hóa chính, và chính việc sản xuất các dư lượng alanine này cho phép tryptophan được phân loại giữa các axit amin glucogen và ketogen. Điểm nhánh quan trọng thứ hai chuyển đổi kynurenine thành 2-amino-3-carboxymuconic semialdehyde, có hai số phận. Dòng chảy chính của các nguyên tố carbon từ chất trung gian này là glutarate. Một phản ứng phụ quan trọng ở gan là sự chuyển hóa và một số sắp xếp lại để tạo ra một lượng axit nicotinic hạn chế, dẫn đến sản xuất một lượng nhỏ NAD +và NADP +
Các triệu chứng thừa tryptophan bao gồm kích động, nhầm lẫn, tiêu chảy, sốt, phản xạ hoạt động quá mức, phối hợp kém, bồn chồn, run rẩy, đổ mồ hôi, nói chuyện hoặc hành động với sự phấn khích mà bạn không thể kiểm soát, run rẩy hoặc run rẩy, co giật và nôn mửa.
Tính an toàn
- Tryptophan được coi là không an toàn khi sử dụng trong thời kỳ mang thai.
- Người ta không biết liệu L-tryptophan có đi vào sữa mẹ hay liệu nó có thể gây hại cho trẻ bú mẹ hay không.
Tương tác với thuốc khác
- Axit acetylsalicylic làm giảm sự gắn kết tryptophan trong huyết thanh với protein ở người, gây ra sự gia tăng tryptophan tự do trong huyết thanh. Những thay đổi trong mô hình trao đổi chất cũng xảy ra, với việc tăng bài tiết axit xanthurenic và 3-hydroxylkynurenine qua nước tiểu và giảm bài tiết axit 3-hydroxyanthranilic.
- Mặc dù tryptophan đã được dùng cho bệnh nhân dùng MAOI với niềm tin rằng hiệu quả lâm sàng có thể được cải thiện, nhưng cần lưu ý rằng các tác dụng phụ cũng có thể tăng lên.
- Sử dụng tryptophan với các loại thuốc ức chế tái hấp thu serotonin có thể làm trầm trọng thêm tác dụng phụ của thuốc sau và thúc đẩy hội chứng serotonin.
- Đôi khi có báo cáo về sự mất ức chế tình dục ở những bệnh nhân dùng tryptophan với phenothiazin hoặc benzodiazepin.
Sinh tổng hợp và sản xuất công nghiệp
Thực vật và vi sinh vật thường tổng hợp tryptophan từ axit shikimic hoặc anthranilate : anthranilate ngưng tụ với phosphoribosylpyrophosphate (PRPP), tạo ra pyrophosphate dưới dạng sản phẩm phụ. Vòng của nửa ribose được mở ra và bị khử carboxyl hóa, tạo ra indole-3-glycerol phosphate; điều này, đến lượt nó, được chuyển thành indole . Ở bước cuối cùng,tryptophan synthase xúc tác sự hình thành tryptophan từ indole và axit amin serine
Quá trình sản xuất công nghiệp tryptophan cũng là quá trình tổng hợp sinh học và dựa trên quá trình lên men serine và indole bằng cách sử dụng vi khuẩn hoang dại hoặc vi khuẩn biến đổi gen như B. amyloliquefaciens, B. subtilis, C. glutamicum hoặc E. coli . Các chủng này mang các đột biến ngăn chặn sự tái hấp thu các axit amin thơm hoặc nhiều/được biểu hiện quá mức operon trp . Quá trình chuyển đổi được xúc tác bởi enzyme tryptophan synthase
Một vài nghiên cứu của L-Tryptophan trong Y học
Tác dụng của L-tryptophan đối với thời gian ngủ ban ngày ở người bình thường: tương quan với nồng độ trong máu

L-Tryptophan, một axit amin thiết yếu, dễ dàng chuyển đổi thành serotonin, được cho là rất quan trọng để biểu hiện giấc ngủ sóng chậm và có thể là giấc ngủ chuyển động mắt nhanh (REM). Có rất nhiều tài liệu nhưng thường gây nhầm lẫn về tác dụng của L-tryptophan đối với việc tạo ra, duy trì hoặc thay đổi giấc ngủ. Trong nghiên cứu này đã đo lường tác động của L-tryptophan đối với các biện pháp đo lường khách quan (độ trễ nhiều giấc ngủ) và chủ quan [Thang đo buồn ngủ Stanford (SSS)] và kiểm tra mối quan hệ của chúng với nồng độ L-tryptophan trong máu. Mười tình nguyện viên khỏe mạnh (tám nam và hai nữ; tuổi trung bình +/- SD 34 +/- 10 tuổi) nhận giả dược hoặc 1,2 hoặc 2,4 g hoặc L-tryptophan vào những ngày riêng biệt theo kiểu mù đôi ngẫu nhiên. Độ trễ giấc ngủ và SSS được đo ban đầu và sau 60 và 120 phút sau khi uống. Máu và nước tiểu được thu thập đều đặn. So với giả dược, cả hai liều L-tryptophan đều làm giảm độ trễ của giấc ngủ sau 1 giờ, với mức giảm kéo dài sau 2 giờ chỉ với liều 2,4 g (p nhỏ hơn 0,05). Có một mối tương quan tích cực giữa các biện pháp buồn ngủ chủ quan và khách quan nhưng chỉ với liều 2,4 g (rs = 0,76, p nhỏ hơn 0,01). Có mối tương quan rất có ý nghĩa giữa L-tryptophan trong máu và độ trễ của giấc ngủ ở 0, 60 và 120 phút ở tất cả các đối tượng đối với mọi tình trạng dùng thuốc (r = 0,276, df = 79, p = 0,013). Một lượng rất nhỏ L-tryptophan tự do hoặc các chất chuyển hóa của nó được tìm thấy trong nước tiểu, ngoại trừ axit kynurenic. Kết luận rằng L-tryptophan luôn làm giảm độ trễ của giấc ngủ ở người bình thường và điều này tương quan với nồng độ trong máu. với sự giảm kéo dài trong 2 giờ chỉ với liều 2,4 g (p nhỏ hơn 0,05).
Tài liệu tham khảo
- Thư viện y học quốc gia, Tryptophan, pubchem. Truy cập ngày 11/08/2023.
- C F George 1, T W Millar, P J Hanly, M H Kryger (1989), The effect of L-tryptophan on daytime sleep latency in normals: correlation with blood level, ,pubmed.com. Truy cập ngày 11/08/2023.
Xuất xứ: Việt Nam
Xuất xứ: Thụy Điển
Xuất xứ: Đức
Xuất xứ: Belgium
Xuất xứ: Belgium
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Úc
Xuất xứ: Mỹ
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Nga
Xuất xứ: Hàn Quốc
Xuất xứ: Việt Nam
Xuất xứ: Nhật Bản
Xuất xứ: Đài Loan