Imatinib
Biên soạn và Hiệu đính
Dược sĩ Xuân Hạo
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
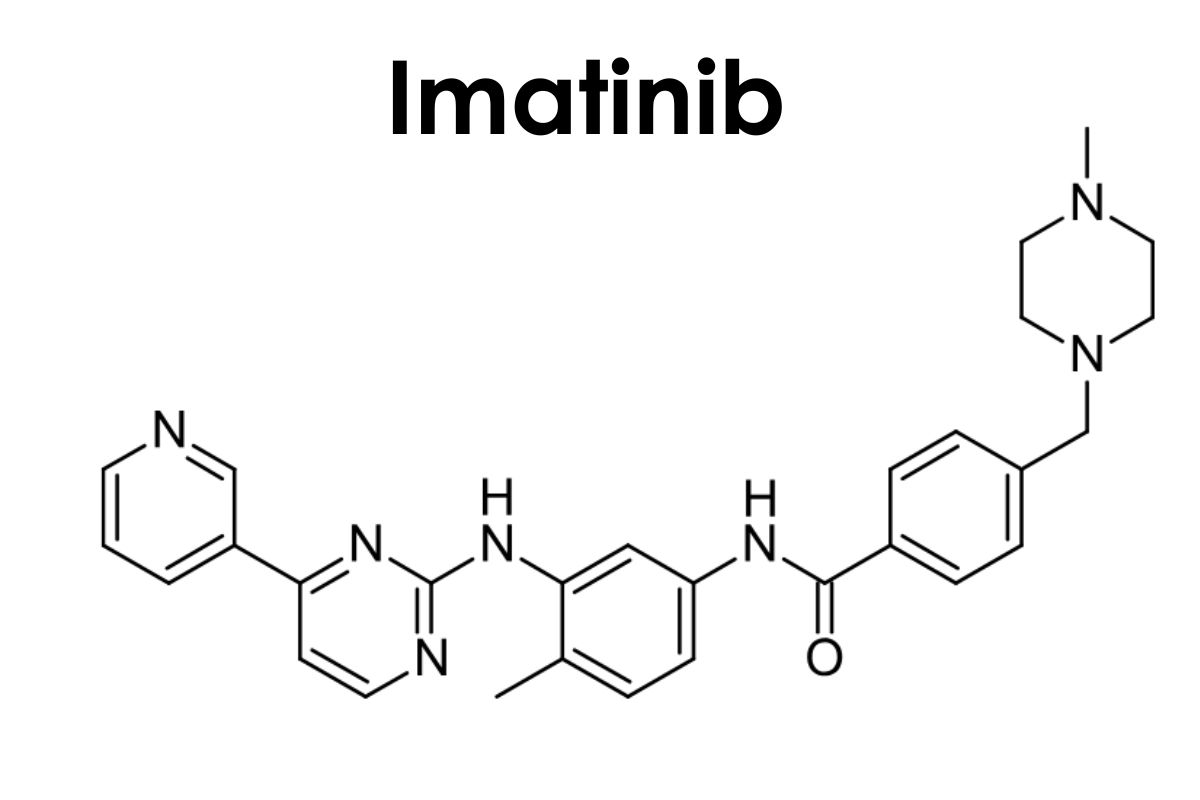
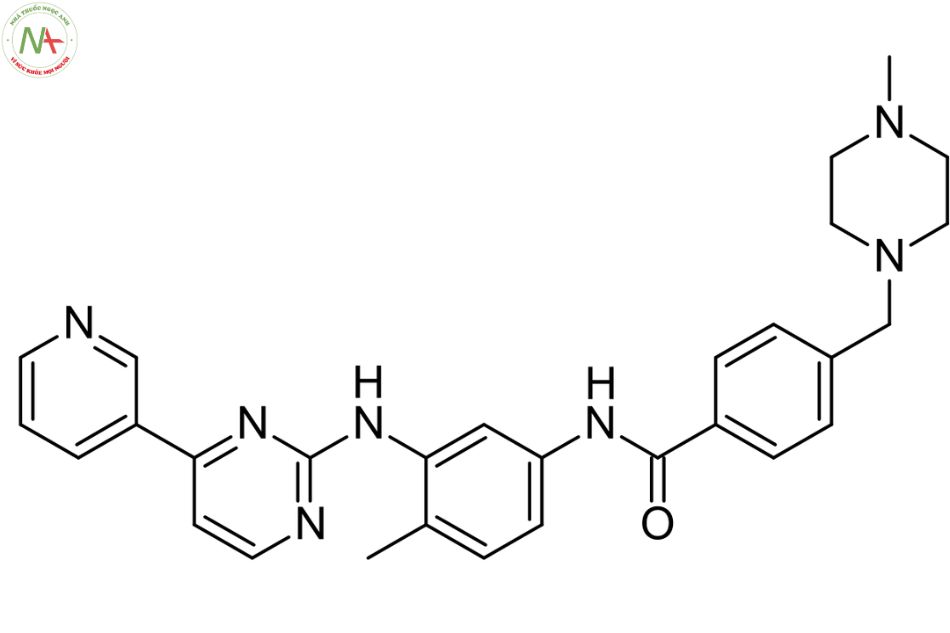
4-[(4-methylpiperazin-1-yl)methyl]-N-[4-methyl-3-[(4-pyridin-3-ylpyrimidin-2-yl)amino]phenyl]benzamide
Nhóm thuốc
Thuốc điều trị ung thư
Mã ATC
L — Các tác nhân chống tổn thương và điều chế miễn dịch
L01 — Tác nhân kháng sinh
L01E — Tác nhân ức chế protein kinase
L01EA — Tác nhân ức chế tyrosine kinase BCR-ABL
L01EA01 — Imatinib
Mã UNII
BKJ8M8G5HI
Mã CAS
152459-95-5
Cấu trúc phân tử
Công thức phân tử
C29H31N7O
Phân tử lượng
493.6 g/mol
Cấu trúc phân tử
Imatinib là một benzamide thu được bằng cách ngưng tụ chính thức nhóm carboxy của axit 4-[(4-methylpiperazin-1-yl)methyl]benzoic với nhóm amin thơm chính của 4-methyl-N(3)-[4-(pyridin -3-yl)pyrimidin-2-yl]benzen-1,3-diamin.
Nó là một N-methylpiperazin , một thành viên của pyridine, một thành viên của benzamide, một amin thơm và một thành viên của pyrimidine.
Các tính chất phân tử
Số liên kết hydro cho: 2
Số liên kết hydro nhận: 7
Số liên kết có thể xoay: 7
Diện tích bề mặt tôpô: 86,3 Ų
Số lượng nguyên tử nặng: 37
Các tính chất đặc trưng
Điểm nóng chảy: 226 °C (muối mesylat)
Độ hòa tan trong nước: 1,46e-02 g/L
LogP: 3
Sinh khả dụng: 98%
Khả năng liên kết protein: 95%
Thời gian bán hủy: 18 giờ (imatinib), 40 giờ (chất chuyển hóa có hoạt tính)
Cảm quan
Imatinib thường được dùng dưới dạng muối mesylat, xuất hiện với dạng bột rắn, rất tan trong nước.
Dạng bào chế
Viên nén bao phim hàm lượng: 100 mg, 400 mg
Dung dịch uống hàm lượng: 80 mg/ml

Độ ổn định và điều kiện bảo quản của Imatinib
Cần bảo quản Imatinib ở bất kì dạng bào chế nào ở nhiệt độ từ 15 đến 30oC, tránh ẩm ướt và tránh ánh sáng.
Nguồn gốc
Imatinib , được bán dưới nhãn hiệu Gleevec và Glivec (cả hai đều được bán trên toàn thế giới bởi Novartis ) trong số những nhãn hiệu khác, là một loại thuốc điều trị nhắm mục tiêu đường uống được sử dụng để điều trị ung thư .
Imatinib được phát minh vào cuối những năm 1990 bởi các nhà khoa học tại Ciba-Geigy.
Khi Novartis thử nghiệm imatinib trên chuột cống, chuột nhắt, thỏ, chó và khỉ vào năm 1996, người ta thấy rằng nó có một số tác dụng độc hại; đặc biệt, kết quả cho thấy tổn thương gan ở chó gần như ngừng phát triển thuốc hoàn toàn.
Thử nghiệm lâm sàng đầu tiên của Imatinib diễn ra vào năm 1998, sau khi Novartis miễn cưỡng tổng hợp và đưa ra một vài gam thuốc cho Druker, đủ để ông tiến hành thử nghiệm trên khoảng một trăm bệnh nhân. Loại thuốc này đã nhận được sự chấp thuận của FDA vào tháng 5 năm 2001, chỉ hai năm rưỡi sau khi đơn đăng ký thuốc mới được nộp.
Một đơn đăng ký bằng sáng chế của Thụy Sĩ đã được nộp cho imatinib và các loại muối khác nhau vào tháng 4 năm 1992, sau đó được nộp tại EU, Hoa Kỳ và các quốc gia khác vào tháng 3 và tháng 4 năm 1993.
Dược lý và cơ chế hoạt động
Imatinib là dẫn xuất 2- phenyl amino pyrimidine có chức năng ức chế đặc hiệu một số enzym tyrosine kinase. Nó chiếm vị trí hoạt động của TK , dẫn đến giảm hoạt động.
Có một số lượng lớn các enzym TK trong cơ thể, bao gồm cả thụ thể insulin . Imatinib dành riêng cho miền TK trong abl (proto-oncogene Abelson), c-kit và PDGF-R ( thụ thể yếu tố tăng trưởng có nguồn gốc từ tiểu cầu ).
Trong bệnh bạch cầu dòng tủy mãn tính , nhiễm sắc thể Philadelphia dẫn đến một protein tổng hợp của abl với bcr ( vùng cụm điểm dừng ), được gọi là bcr-abl . Vì đây hiện là một tyrosine kinase hoạt động cấu thành nên imatinib được sử dụng để giảm hoạt động bcr-abl .
Mỗi vị trí hoạt động của tyrosine kinase đều có một vị trí liên kết với ATP . Hoạt tính enzym được xúc tác bởi một tyrosine kinase là sự chuyển gốc phosphate cuối cùng từ ATP sang gốc tyrosine trên cơ chất của nó , một quá trình được gọi là quá trình phosphoryl hóa tyrosine protein . Imatinib hoạt động bằng cách liên kết gần với vị trí liên kết ATP của bcr-abl , khóa nó trong một cấu trúc khép kín hoặc tự ức chế, và do đó ức chế hoạt động enzym của protein một cách bán cạnh tranh . Thực tế này giải thích tại sao nhiều đột biến BCR-ABL có thể gây ra tình trạng kháng imatinib bằng cách chuyển trạng thái cân bằng của nó sang dạng mở hoặc hoạt động.
Imatinib khá chọn lọc đối với bcr-abl , mặc dù nó cũng ức chế các mục tiêu khác được đề cập ở trên (c-kit và PDGF-R), cũng như ABL2 (ARG) và DDR1 tyrosine kinase và NQO2 – một oxidoreductase. Imatinib cũng ức chế protein abl của các tế bào không phải ung thư, nhưng những tế bào này thường có thêm tyrosine kinase dư thừa, cho phép chúng tiếp tục hoạt động ngay cả khi abl tyrosine kinase bị ức chế. Tuy nhiên, một số tế bào khối u có sự phụ thuộc vào bcr-abl . Ức chế bcr-abltyrosine kinase cũng kích thích sự xâm nhập của nó vào trong nhân, nơi nó không thể thực hiện bất kỳ chức năng chống apoptopic bình thường nào của nó , dẫn đến cái chết của tế bào khối u.
Các con đường khác bị ảnh hưởng
Con đường Bcr-Abl có nhiều con đường xuôi dòng bao gồm:
con đường Ras/MapK , dẫn đến tăng sinh do tăng trưởng tế bào không phụ thuộc vào yếu tố tăng trưởng.
Nó cũng ảnh hưởng đến con đường Src/Pax/Fak/Rac . Điều này ảnh hưởng đến khung tế bào, dẫn đến tăng khả năng vận động của tế bào và giảm độ bám dính.
Con đường PI/PI3K/AKT/BCL-2 cũng bị ảnh hưởng. BCL-2 chịu trách nhiệm giữ cho ty thể ổn định; điều này ngăn chặn sự chết của tế bào bằng quá trình tự hủy và tăng khả năng sống sót.
Con đường cuối cùng mà Bcr-Abl ảnh hưởng là con đường JAK/STAT , chịu trách nhiệm cho sự tăng sinh.
Ứng dụng trong y học của Imatinib
Imatinib được sử dụng để điều trị bệnh bạch cầu dòng tủy mãn tính (CML), khối u mô đệm đường tiêu hóa (GIST) và một số khối u ác tính khác . Vào năm 2006, FDA đã mở rộng việc sử dụng đã được phê duyệt để bao gồm các bệnh protuberans dermatofibrosarcoma (DFSP), bệnh loạn sản tủy /tăng sinh tủy (MDS/MPD) và bệnh tế bào mast hệ thống tích cực (ASM).
Imatinib được coi là một phương pháp điều trị CML rất hiệu quả và đã được chứng minh là cải thiện kết quả cho những người mắc loại bệnh bạch cầu này. Nó cũng có thể được sử dụng để điều trị một số loại TẤT CẢ, nhưng không được coi là tiêu chuẩn chăm sóc cho TẤT CẢ. Trong nhiều trường hợp, Imatinib có thể tạo ra phản ứng di truyền tế bào hoàn toàn (CCyR) và phản ứng phân tử chính (MMR) và nhiều bệnh nhân có thể thuyên giảm lâu dài. Nó cũng được sử dụng để duy trì sự thuyên giảm ở bệnh nhân CML giai đoạn mãn tính.
Điều quan trọng cần lưu ý là mặc dù Imatinib là một phương pháp điều trị rất hiệu quả đối với CML và một số loại TẤT CẢ, nhưng nó không phải là phương pháp chữa trị bệnh bạch cầu. Thay vào đó, nó là một liệu pháp mãn tính giúp kiểm soát bệnh và ngăn không cho bệnh tiến triển. Một số bệnh nhân có thể cần tiếp tục dùng Imatinib trong một thời gian dài để duy trì sự thuyên giảm và một số bệnh nhân cuối cùng có thể cần các lựa chọn điều trị bổ sung.
Lưu ý: Đây không phải là thuốc chữa bệnh, đây là biện pháp hiệu quả để kiểm soát và ngăn chặn bệnh tiến triển.
Bệnh bạch cầu dòng tủy mãn tính
Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã phê duyệt imatinib là phương pháp điều trị đầu tiên cho bệnh CML dương tính với nhiễm sắc thể Philadelphia , cả ở người lớn và trẻ em. Thuốc được phê duyệt trong nhiều bối cảnh của bệnh CML dương tính với nhiễm sắc thể Philadelphia, bao gồm cả sau khi cấy ghép tế bào gốc, trong cuộc khủng hoảng bệnh đạo ôn và mới được chẩn đoán.
Một phần do sự phát triển của imatinib và các loại thuốc liên quan, tỷ lệ sống sót sau 5 năm của những người mắc bệnh bạch cầu dòng tủy mãn tính đã tăng từ 31% vào năm 1993, lên 59% vào năm 2009, lên 70% vào năm 2016. từ năm 2011, rõ ràng là những bệnh nhân CML tiếp tục đáp ứng với imatinib có tuổi thọ tương đương hoặc gần như tương đương với dân số nói chung.
Các khối u mô đệm đường tiêu hóa
FDA lần đầu tiên cấp phép cho bệnh nhân GIST giai đoạn cuối vào năm 2002. Vào ngày 1 tháng 2 năm 2012, imatinib đã được chấp thuận sử dụng sau khi phẫu thuật cắt bỏ khối u dương tính với KIT để giúp ngăn ngừa tái phát. Thuốc cũng được phê duyệt trong GIST dương tính với KIT không thể phát hiện được.
Dermatofibrosarcoma protuberans (DFSP)
FDA đã cấp phép điều trị cho bệnh nhân sarcoma dermatofibrosarcoma protuberans (DFSP) vào năm 2006. Cụ thể là những bệnh nhân trưởng thành mắc bệnh dermatofibrosarcoma protuberans (DFSP) không thể cắt bỏ, tái phát và/hoặc di căn . Trước khi phê duyệt DFSP được coi là không đáp ứng với các phương pháp điều trị hóa trị .
Ứng dụng khác
FDA đã phê duyệt imatinib để sử dụng cho người lớn mắc bệnh bạch cầu lymphoblastic cấp tính dương tính với nhiễm sắc thể Philadelphia (Ph+ ALL) tái phát hoặc kháng trị, bệnh loạn sản tủy / tăng sinh tủy liên quan đến sự sắp xếp lại gen của thụ thể yếu tố tăng trưởng có nguồn gốc từ tiểu cầu , bệnh tế bào mast hệ thống xâm lấn mà không có hoặc không xác định c-D816V. KIT, hội chứng tăng bạch cầu ái toan và/hoặc bệnh bạch cầu tăng bạch cầu ái toan mạn tính có FIP1L1-PDGFRα kinase dung hợp (xóa alen CHIC2) hoặc kinase dung hợp FIP1L1-PDGFRα âm tính hoặc không xác định, không thể phát hiện, tái phát và/hoặc sarcoma sarcoma da di căn. Vào ngày 25 tháng 1 năm 2013, Gleevec đã được chấp thuận sử dụng cho trẻ em bị Ph+ ALL.
Để điều trị u xơ thần kinh dạng đám rối tiến triển liên quan đến u xơ thần kinh loại I , nghiên cứu ban đầu đã cho thấy tiềm năng sử dụng đặc tính ngăn chặn c-KIT tyrosine kinase của imatinib. Theo một thử nghiệm nhỏ, imatinib là một loại thuốc hiệu quả ở một số bệnh nhân mắc bệnh u xơ ác tính .
Dược động học
Hấp thu
Sau khi uống, imatinib được hấp thu tốt và có sinh khả dụng trung bình tuyệt đối là 98%. Nồng độ đỉnh trong huyết tương đạt được trong vòng 2-4 giờ sau khi uống
Phân bố
Khoảng 95% imatinib liên kết với protein huyết tương, chủ yếu là albumin và α 1- acid glycoprotein.
Chuyển hóa
Imatinib được chuyển hóa bởi cytochrom P450, chủ yếu là isoenzym CYP3A4, và cũng chuyển hóa bởi CYP1A2, CYP2D6, CYP2C9 và CYP2C19. Dẫn chất N-demethyl piperazin là chất chuyển hóa chính của imatinib do vai trò của CYP3A4 và chiếm khoảng 15% tổng lượng thuốc trong huyết tương.
Đào thải
Nửa đời thải trừ của imatinib là 18 giờ và của chất chuyển hóa chính là 40 giờ. Trong vòng 7 ngày sau khi uống, khoảng 81% liều uống imatinib được thải trừ, trong đó 68% được bài tiết qua phân và 13% được bài tiết qua nước tiểu.
Độc tính của Imatinib
Các phản ứng bất lợi được báo cáo thường xuyên nhất (>30%) là phù nề, buồn nôn, nôn, chuột rút cơ, đau cơ xương, tiêu chảy, phát ban, mệt mỏi và đau bụng.
Trong một nghiên cứu về khả năng sinh sản, chuột đực được cho dùng liều trong 70 ngày trước khi giao phối và chuột cái được cho dùng 14 ngày trước khi giao phối và cho đến ngày thứ 6 của thai kỳ. Trọng lượng tinh hoàn và mào tinh hoàn và phần trăm tinh trùng di động đã giảm ở mức 60 mg/kg, xấp xỉ ba phần tư liều lâm sàng tối đa là 800 mg/ngày dựa trên BSA. Điều này không thấy ở liều thấp hơn hoặc bằng 20 mg/kg (1/4 liều tối đa ở người là 800 mg).
Khả năng sinh sản không bị ảnh hưởng trong nghiên cứu về khả năng sinh sản tiền lâm sàng và sự phát triển phôi sớm mặc dù tinh hoàn và trọng lượng mào tinh hoàn thấp hơn, cũng như số lượng tinh trùng di động giảm, đã được quan sát thấy ở những con chuột đực dùng liều cao.
Tương tác của Imatinib với thuốc khác
Việc sử dụng nó được khuyên không nên sử dụng ở những người đang sử dụng các chất ức chế CYP3A4 mạnh như clarithromycin , chloramphenicol , ketoconazole , ritonavir và nefazodone do sự phụ thuộc vào CYP3A4 để chuyển hóa. Tương tự như vậy, nó là chất ức chế CYP3A4 , CYP2D6 và CYP2C9 và do đó điều trị đồng thời với cơ chất của bất kỳ enzym nào trong số này có thể làm tăng nồng độ trong huyết tương của các loại thuốc nói trên. Vì imatinib chủ yếu được chuyển hóa qua enzym gan CYP3A4, các chất ảnh hưởng đến hoạt động của enzym này làm thay đổi nồng độ thuốc trong huyết tương. Một ví dụ về thuốc làm tăng hoạt động của imatinib và do đó có tác dụng phụ do ngăn chặn CYP3A4 là ketoconazole . Điều tương tự cũng có thể xảy ra với itraconazole , clarithromycin , nước ép bưởi , trong số những loại khác. Ngược lại, các chất dẫn truyền CYP3A4 như rifampicin và St John’s Wort làm giảm hoạt tính của thuốc, gây nguy cơ thất bại trong điều trị. Imatinib cũng là một chất ức chế CYP3A4, 2C9 và 2D6, làm tăng nồng độ trong huyết tương của một số loại thuốc khác như simvastatin ,metoprolol , pimozide , ciclosporin ,warfarin , và có thể cả paracetamol. Thuốc cũng có khả năng làm giảm nồng độ levothyroxin có trong huyết tương.
Cũng như các chất ức chế miễn dịch khác, chống chỉ định sử dụng vắc-xin sống vì các vi sinh vật trong vắc-xin có thể nhân lên và lây nhiễm cho bệnh nhân. Vắc-xin bất hoạt và độc tố không có nguy cơ này, nhưng có thể không hiệu quả khi điều trị bằng imatinib.
Lưu ý khi dùng Imatinib
Lưu ý và thận trọng chung
Sử dụng Imatinib ở trẻ em: Thiếu thông tin về độ an toàn khi dùng cho trẻ em dưới 2 tuổi. Buồn nôn và đau cơ là những ADR phổ biến nhất ở trẻ em đã sử dụng Imatinib.
Imatinib được chuyển hóa qua gan nên bệnh nhân suy gan đang điều trị bằng Imatinib cần được theo dõi cẩn thận các chỉ số chức năng gan (transaminase, bilirubin, phosphatase kiềm).
Bệnh nhân cao tuổi hoặc những người có tiền sử bệnh tim có nguy cơ bị suy tim nặng hoặc rối loạn chức năng tâm thất trái khi điều trị bằng Imatinib. Vì vậy, cần đánh giá, theo dõi và điều trị cẩn thận bất kỳ trường hợp nào có dấu hiệu suy tim.
Bệnh nhân điều trị bằng Imatinib có thể biểu hiện độc tính từng dòng hoặc từng dòng tế bào nên theo dõi công thức máu hàng tuần trong tháng đầu điều trị và tháng thứ 2, xét nghiệm định kỳ 2-3 tháng/lần trong các tháng tiếp theo .
Các trường hợp suy giáp đã được báo cáo ở những bệnh nhân được cắt bỏ tuyến giáp thay thế bằng levothyroxin trong khi đang điều trị bằng Imatinib. Mức độ hormone kích thích tuyến giáp (TSH) nên được theo dõi chặt chẽ ở những bệnh nhân này.
Các trường hợp ứ dịch nặng (tràn dịch màng phổi, phù nề, phù phổi, báng bụng, phù ngoại vi) đã được ghi nhận ở khoảng 2,5% bệnh nhân CML mới được chẩn đoán khi sử dụng Imatinib. Vì vậy, bệnh nhân nên được cân thường xuyên. Cần điều tra kỹ tình trạng tăng cân nhanh và nếu cần thiết thì áp dụng các biện pháp chăm sóc hỗ trợ và điều trị thích hợp.
Lưu ý đối với phụ nữ có thai
Cho đến nay chưa có nghiên cứu thích hợp về độc tính đối với thai nhi ở người. Trên thực nghiệm trên động vật, thuốc gây độc cho thai, gây dị tật hoặc chết thai, nên tránh dùng cho phụ nữ có thai. Trong trường hợp dùng cho phụ nữ có thai, cần báo trước nguy cơ gây độc cho thai nhi.
Lưu ý đối với phụ nữ đang cho con bú
Thí nghiệm trên chuột cho thấy Imatinib và các chất chuyển hóa của nó phân bố vào sữa mẹ. Ngừng cho con bú trong thời gian người mẹ được điều trị bằng Imatinib do nguy cơ gây độc cho trẻ bú mẹ.
Lưu ý khi lái xe và vận hành máy móc
Bệnh nhân cần được thông báo rằng họ có thể gặp các tác dụng không mong muốn như chóng mặt, mờ mắt hoặc buồn ngủ khi điều trị bằng Imatinib. Vì vậy, nên thận trọng khi lái xe hoặc vận hành máy móc.
Một vài nghiên cứu về Imatinib trong Y học
Hiệu quả của Dasatinib so với Imatinib trong điều trị bệnh bạch cầu lymphoblastic cấp tính nhiễm sắc thể dương tính ở trẻ em Philadelphia: Một thử nghiệm lâm sàng ngẫu nhiên
Tầm quan trọng: Một thử nghiệm lâm sàng ngẫu nhiên là cần thiết để xác định xem liệu chất ức chế Abl-tyrosine kinase dasatinib thế hệ thứ hai có hiệu quả hơn chất ức chế imatinib mesylate thế hệ thứ nhất đối với bệnh bạch cầu nguyên bào lympho cấp tính nhiễm sắc thể Philadelphia dương tính (ALL) hay không.
Mục tiêu: Để xác định xem liệu dasatinib được cung cấp với liều hàng ngày là 80 mg/m2 có hiệu quả hơn imatinib mesylate với liều hàng ngày là 300 mg/m2 để cải thiện khả năng sống sót không có biến cố của trẻ mắc ALL dương tính với nhiễm sắc thể Philadelphia trong bối cảnh điều trị tích cực hóa trị mà không cần chiếu xạ sọ dự phòng.
Thiết kế, bối cảnh và người tham gia: Thử nghiệm lâm sàng ngẫu nhiên giai đoạn 3, nhãn mở này được tiến hành tại 20 bệnh viện ở Trung Quốc. Quá trình đăng ký diễn ra từ ngày 1 tháng 1 năm 2015 đến ngày 18 tháng 9 năm 2018 và quá trình phân ngẫu nhiên bị dừng vào ngày 4 tháng 10 năm 2018, khi đáp ứng tiêu chí dừng sớm của thử nghiệm. Bệnh nhân từ 0 đến 18 tuổi đã được tuyển dụng. Trong số 225 bệnh nhân được chẩn đoán, 35 người từ chối tham gia và 1 người chết trước khi điều trị, còn lại 189 bệnh nhân để phân tích. Dữ liệu được phân tích từ ngày 1 tháng 1 đến ngày 4 tháng 8 năm 2019.
Can thiệp: Bệnh nhân được chọn ngẫu nhiên để nhận dasatinib hàng ngày (n = 92) hoặc imatinib (n = 97) liên tục trong toàn bộ thời gian điều trị TẤT CẢ kể từ thời điểm chẩn đoán được thực hiện trong quá trình thuyên giảm cho đến khi kết thúc điều trị tiếp tục.
Kết quả chính và biện pháp: Kết quả chính là tỷ lệ sống sót không có biến cố, được phân tích dựa trên ý định điều trị. Các kết quả phụ là tái phát, tử vong do tác dụng độc hại và sống sót chung.
Kết quả: Trong số 189 người tham gia (136 nam [72,0%]; tuổi trung bình, 7,8 [khoảng tứ phân vị (IQR), 5,2-11,3] năm) và thời gian theo dõi trung bình là 26,4 (IQR, 16,3-34,1) tháng, 4 năm tỷ lệ sống sót không có biến cố và tỷ lệ sống sót chung lần lượt là 71,0% (95% CI, 56,2%-89,6%) và 88,4% (95% CI, 81,3%-96,1%), ở nhóm dasatinib và 48,9% (95% CI , 32,0%-74,5%; P = 0,005, kiểm tra thứ hạng log) và 69,2% (KTC 95%, 55,6% -86,2%; P = 0,04, kiểm tra thứ hạng log), tương ứng, trong nhóm imatinib. Nguy cơ tích lũy trong 4 năm của bất kỳ lần tái phát nào là 19,8% (95% CI, 4,2% -35,4%) ở nhóm dasatinib và 34,4% (95% CI, 15,6% -53,2%) ở nhóm imatinib (P = 0,01 , Grey test), trong khi nguy cơ tích lũy trong 4 năm của tái phát hệ thống thần kinh trung ương đơn độc là 2,7% (95% CI, 0,0%-8,1%) ở nhóm dasatinib và 8,4% (95% CI, 1,2% -15,6% ) trong nhóm imatinib (P = 0,06, Kiểm tra màu xám). Không có sự khác biệt đáng kể về tần suất tác dụng độc nghiêm trọng giữa 2 nhóm điều trị.
Kết luận và mức độ liên quan: Hóa trị liệu chuyên sâu bao gồm dasatinib với liều 80 mg/m2 mỗi ngày mang lại kết quả vượt trội trong điều trị ALL dương tính với nhiễm sắc thể Philadelphia so với imatinib mesylate với liều 300 mg/m2 mỗi ngày và mang lại khả năng kiểm soát tuyệt vời cho bệnh nhân trung ương. bệnh bạch cầu hệ thần kinh mà không cần sử dụng chiếu xạ sọ dự phòng.
Tài liệu tham khảo
- Drugbank, Imatinib, truy cập ngày 21/03/2023.
- Pubchem, Imatinib , truy cập ngày 21/03/2023.
- Shen, S., Chen, X., Cai, J., Yu, J., Gao, J., Hu, S., … & Pui, C. H. (2020). Effect of dasatinib vs imatinib in the treatment of pediatric Philadelphia chromosome–positive acute lymphoblastic leukemia: A randomized clinical trial. JAMA oncology, 6(3), 358-366.
