IgM

Danh pháp
Igm viết tắt của từ gì? Immunoglobulin M
Cấu trúc phân tử
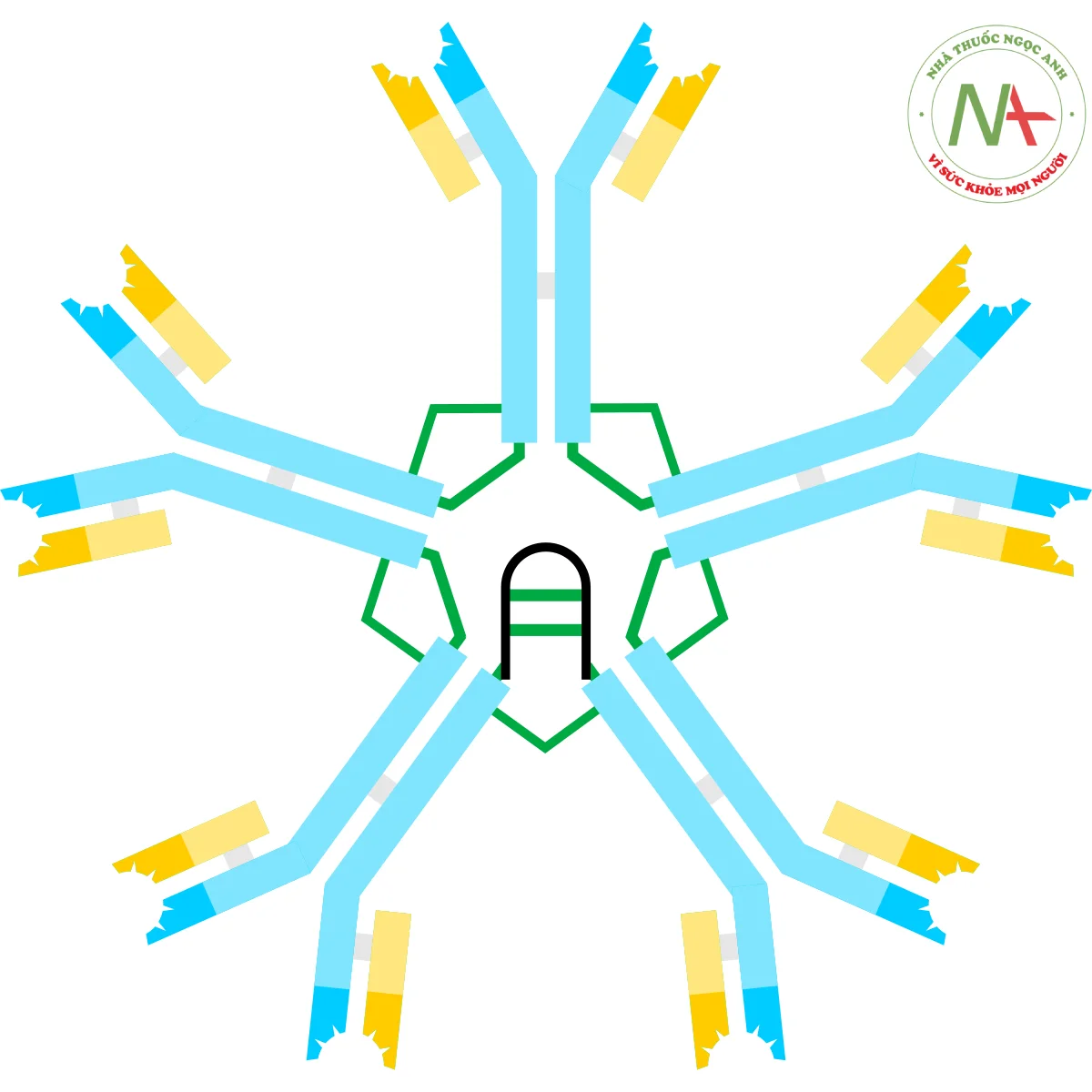
(bộ năm)
IgM là gì?
Globulin miễn dịch M ( IgM ) là một trong số các globulin miễn dịch được sản xuất bởi động vật có xương sống. IgM là kháng thể lớn nhất và nó là kháng thể đầu tiên xuất hiện trong phản ứng tiếp xúc ban đầu với kháng nguyên. Ở người và các động vật có vú khác đã được nghiên cứu, nguyên bào huyết tương cư trú trong lá lách là nguồn sản xuất IgM đặc hiệu chính
Cấu trúc
Globulin miễn dịch bao gồm chuỗi nhẹ và chuỗi nặng. Chuỗi nhẹ (λ hoặc κ) là một protein gồm ~220 axit amin, bao gồm một miền biến đổi, VL (một đoạn gồm khoảng 110 axit amin) và một miền cố định, CL (cũng dài khoảng 110 axit amin). Chuỗi nặng μ của IgM là một protein gồm ~576 axit amin, và bao gồm một miền biến đổi (VH ~110 axit amin), bốn miền vùng hằng định riêng biệt (Cµ1, Cµ2, Cµ3, Cµ4, mỗi vùng ~110 axit amin) và một “phần đuôi” của ~20 axit amin. Chuỗi nặng µ mang oligosacarit ở năm gốc asparagine. Các oligosacarit trên IgM của chuột và người đã được đặc trưng một phần bằng nhiều kỹ thuật khác nhau, bao gồm NMR, liên kết với lectin, các hệ thống sắc ký khác nhau và độ nhạy enzym (được xem xét trong). Cấu trúc của các oligosacarit ở mỗi vị trí khác nhau một cách chi tiết và các oligosacarit chiếm ưu thế – hai cánh, ba cánh và mannose cao – khác nhau giữa các vị trí
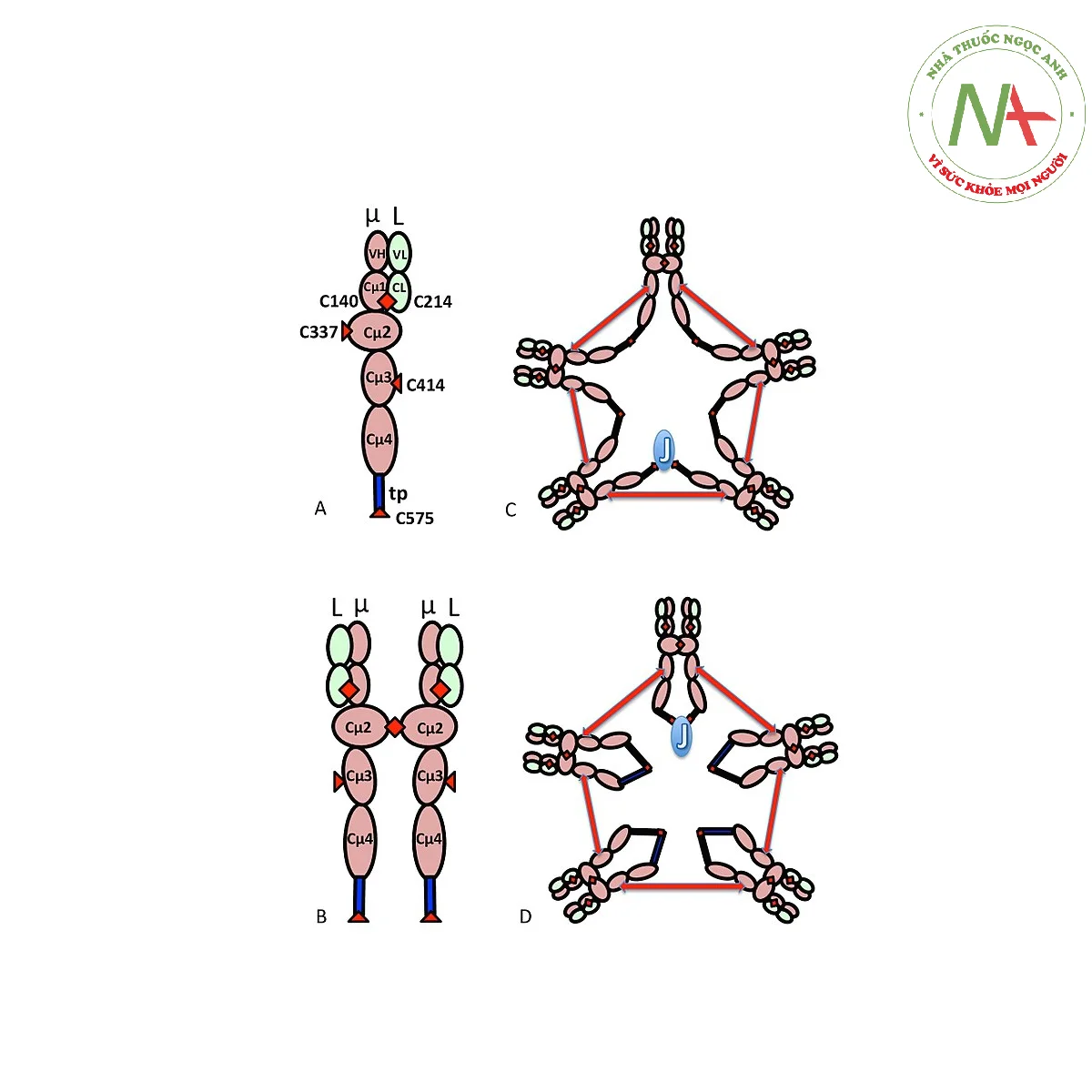
Cấu trúc đa phân tử của IgM được thể hiện dưới dạng sơ đồ trong Hình 1. Hình 1A cho thấy “heterodime” bao gồm một chuỗi nhẹ, ký hiệu là L, và một chuỗi nặng, ký hiệu là µ. Các chuỗi nặng và nhẹ được liên kết với nhau bằng cả liên kết disulfua (được mô tả bằng các hình tam giác màu đỏ) và bằng các tương tác không cộng hóa trị.
Hình 1B cho thấy hai đơn vị μL được liên kết bằng liên kết disulfua trong miền Cµ2; cấu trúc (µL)2 này thường được gọi là “monome” IgM, vì nó tương tự theo một số cách với cấu trúc của globulin miễn dịch G (IgG).
Trên cơ sở tốc độ lắng đọng và sự xuất hiện của nó trong các vi ảnh điện tử, người ta suy ra rằng IgM thường xuất hiện dưới dạng “pentamer”, nghĩa là, một polyme bao gồm năm “monome” [(µL)2]5, và ban đầu được mô tả bởi các mô hình trong Hình 1C và 1D, với các liên kết disulfua giữa các miền Cµ3 và giữa các phần đuôi. Cũng cho thấy rằng IgM ngũ sắc bao gồm protein thứ ba, chuỗi J. Chuỗi J (J để nối) được phát hiện là một thành phần liên kết cộng hóa trị của IgA và IgM cao phân tử. Chuỗi J là một protein nhỏ (~137 axit amin), có tính axit. Như được minh họa, chuỗi J nối với hai chuỗi µ thông qua các liên kết disulfua liên quan đến cystein ở các phần đuôi
Nguồn gốc
Năm 1937, một kháng thể được siêu miễn dịch với polysacarit phế cầu đã được quan sát thấy ở ngựa có kích thước lớn hơn nhiều so với γ-globulin điển hình của thỏ, với trọng lượng phân tử là 990.000 dalton. Theo kích thước lớn hơn của nó, kháng thể mới ban đầu được gọi là γ-macroglobulin, và sau đó được gọi là IgM cho “macro”. Miền V của globulin miễn dịch bình thường rất không đồng nhất, phản ánh vai trò của chúng trong việc bảo vệ chống lại nhiều loại vi khuẩn truyền nhiễm và sự không đồng nhất này cản trở phân tích cấu trúc chi tiết của IgM. Hai nguồn IgM đồng nhất sau đó đã được phát hiện. Đầu tiên, protein trọng lượng phân tử cao được sản xuất bởi một số bệnh nhân đa u tủy được công nhận là một γ-macroglobulin do khối u tạo ra và vì khối u là một bản sao nên IgM mà nó tạo ra là đồng nhất. Vào những năm 1960, các phương pháp đã được phát triển để tạo ra các khối u sản xuất globulin miễn dịch (plasmacytomas) ở chuột, do đó cung cấp một nguồn globulin miễn dịch đồng nhất của nhiều kiểu hình khác nhau, bao gồm cả IgM (được xem xét trong ). Gần đây hơn, sự biểu hiện của các gen globulin miễn dịch đã được xử lý công nghệ trong nuôi cấy mô có thể được sử dụng để tạo ra IgM với những thay đổi cụ thể và do đó để xác định các yêu cầu phân tử đối với các đặc điểm quan tâm
Dược lý và cơ chế hoạt động
Globulin miễn dịch là các dị vòng bao gồm hai chuỗi nặng và hai chuỗi nhẹ liên kết với nhau bằng liên kết cộng hóa trị. Globulin miễn dịch là các phân tử hình chữ Y chứa hai vùng Fab nhận biết kháng nguyên và một phần đuôi Fc xác định hoạt tính sinh học của kháng thể. Ở người, locus chuỗi nặng nằm trên nhiễm sắc thể 14 và hai locus chuỗi nhẹ thay thế, được gọi là kappa và lambda, lần lượt nằm trên nhiễm sắc thể 2 và 22. Globulin miễn dịch, hoặc kháng thể ở dạng tiết ra, được tạo ra bởi sự tái tổ hợp DNA soma trong các tế bào lympho B phát triển trong tủy xương, cơ quan bạch huyết chính cho sự phát triển của tế bào lympho B. Tái tổ hợp soma là một chiến lược được sử dụng bởi hệ thống miễn dịch thích nghi để tạo ra hàng nghìn tỷ globulin miễn dịch và thụ thể tế bào T khác nhau bằng cách tổ hợp lại các phân đoạn DNA mã hóa protein khác nhau theo cách khá ngẫu nhiên. IgM đơn phân và IgD đóng vai trò là BCR để các tế bào lympho B nghỉ ngơi không được kích thích bởi sự nhận dạng kháng nguyên.
Khi nhận ra kháng nguyên, IgM pentameric là kháng thể ban đầu được tiết ra bởi các tế bào B để đáp ứng với thách thức kháng nguyên. IgM được tiết ra trong phản ứng sơ cấp có xu hướng có ái lực thấp hơn với kháng nguyên ngoại lai so với các isotypes được tiết ra trong các lần gặp tiếp theo, hoặc phản ứng thứ cấp, đối với kháng nguyên ngoại lai. Tuy nhiên, do cấu trúc ngũ sắc của nó, IgM được tiết ra có ái lực cao hơn, hoặc sức mạnh tổng thể của liên kết với kháng nguyên, do sự hiện diện của mười vị trí liên kết kháng nguyên trên mỗi phân tử IgM ngũ sắc. Tính ái lực của IgM tăng lên rất quan trọng để liên kết mầm bệnh với các epitope lặp đi lặp lại, chẳng hạn như trên vỏ vi khuẩn. IgM hiện diện chủ yếu trong máu, mặc dù nó cũng có thể xuất hiện trong bạch huyết và cũng có thể được tiết ra trên bề mặt niêm mạc. Chuỗi J là một protein nhỏ 15 kDa được liên kết với IgM ngũ sắc và IgA dimeric được tiết ra. Pentameric IgM được ổn định bởi các liên kết cộng hóa trị, disulfua giữa các vùng Fc của phân tử IgM, cũng như các liên kết disulfua giữa chuỗi J và các vùng Fc của IgM. IgM hexameric ở người ít đặc trưng hơn IgM ngũ sắc, và IgM hexameric lắp ráp độc lập với chuỗi J. Sự hiện diện của chuỗi J bảo vệ IgM và IgA được tiết ra khỏi protease và cũng tạo điều kiện vận chuyển chúng qua biểu mô niêm mạc để cung cấp sự bảo vệ miễn dịch cho bề mặt niêm mạc. liên kết disulfua giữa các vùng Fc của phân tử IgM, cũng như liên kết disulfua giữa chuỗi J và vùng Fc của IgM. IgM hexameric ở người ít đặc trưng hơn IgM ngũ sắc, và IgM hexameric lắp ráp độc lập với chuỗi J. Sự hiện diện của chuỗi J bảo vệ IgM và IgA được tiết ra khỏi protease và cũng tạo điều kiện vận chuyển chúng qua biểu mô niêm mạc để cung cấp sự bảo vệ miễn dịch cho bề mặt niêm mạc. liên kết disulfua giữa các vùng Fc của phân tử IgM, cũng như liên kết disulfua giữa chuỗi J và vùng Fc của IgM. IgM hexameric ở người ít đặc trưng hơn IgM ngũ sắc, và IgM hexameric lắp ráp độc lập với chuỗi J. Sự hiện diện của chuỗi J bảo vệ IgM và IgA được tiết ra khỏi protease và cũng tạo điều kiện vận chuyển chúng qua biểu mô niêm mạc để cung cấp sự bảo vệ miễn dịch cho bề mặt niêm mạc.
Dạng bào chế
Dung dịch thuốc tiêm
Chức năng
Các kháng thể IgM do các tế bào B tiết ra tham gia vào cả quá trình trung hòa và loại bỏ mầm bệnh ngoài việc bắt đầu các phản ứng viêm chống lại mầm bệnh thông qua con đường bổ sung. IgM là kháng thể chiếm ưu thế trong quá trình thử thách chính đối với kháng nguyên và đối với một số kháng nguyên không phải peptide, IgM có thể là kiểu mẫu duy nhất của kháng thể được tiết ra trong các lần tiếp xúc tiếp theo với kháng nguyên. Phản ứng miễn dịch thể dịch cơ bản đối với mầm bệnh mới thường cần gần một tuần trước khi một lượng IgM đáng kể xuất hiện trong máu và phản ứng miễn dịch bẩm sinh là cần thiết để chống lại nhiễm trùng cho đến khi tạo ra tế bào T và tế bào plasma tiết kháng thể nhân rộng vô tính. chống lại mầm bệnh với số lượng đủ. Trung hòa đề cập đến khả năng của các kháng thể bảo vệ chống lại nhiễm trùng bằng cách liên kết các kháng nguyên mầm bệnh quan trọng để tuân thủ các mô chủ. Khả năng vô hiệu hóa mầm bệnh của các kháng thể là lợi ích bảo vệ chính của vắc-xin, vì nó ngăn mầm bệnh bắt đầu lây nhiễm bằng cách liên kết với tế bào chủ. IgM có thể vô hiệu hóa mầm bệnh, mặc dù không hiệu quả bằng các kiểu hình IgG hoặc IgA, rất có thể là do tính linh hoạt tăng lên của các kiểu hình này được cung cấp bởi vùng bản lề.
IgM chủ yếu đóng vai trò là chất kích hoạt mạnh mẽ con đường bổ sung cổ điển trong hệ thống tuần hoàn. Phức hợp C1 được yêu cầu để kích hoạt con đường cổ điển của bổ thể và bao gồm protein C1q hexameric liên kết với một tetramer protease, hai phân tử C1r và hai phân tử C1s. Cả IgG và IgM đều có thể kích hoạt con đường cổ điển của bổ thể thông qua việc gắn C1q với các phần Fc của IgG và IgM. Tuy nhiên, một phân tử IgM ngũ giác duy nhất liên kết với mầm bệnh là đủ để kích hoạt C1q, trong khi hai phân tử IgG độc lập được yêu cầu để nhận ra mầm bệnh để kích hoạt C1q. C1q phải liên kết với hai vùng Fc của globulin miễn dịch để được kích hoạt. Trái ngược với các phân tử IgG có chứa một miền Fc, IgM ngũ sắc có năm miền Fc khác nhau trên cùng một phân tử, tạo điều kiện kích hoạt bổ thể nhanh chóng khi một phân tử IgM đơn lẻ nhận ra mầm bệnh. C1q không liên kết với IgM hòa tan do cấu tạo của IgM không liên kết che lấp các phần Fc của phân tử từ C1q. Việc C1q nhận ra các kháng thể liên kết dẫn đến việc kích hoạt các protease C1r và C1s của phức hợp C1, phức hợp này sau đó tách C4 và C2, dẫn đến sự lắng đọng của C4b2a C3 convertase trên bề mặt mầm bệnh. Sự hình thành của một convertase C3 trên bề mặt mầm bệnh dẫn đến sự phân cắt của C3, tạo ra C3a và C3b, và các bước hoạt hóa bổ thể tiếp theo là khá giống nhau giữa các con đường cổ điển, thay thế và lectin của bổ thể. C3a có chức năng như một chất độc phản vệ và chiêu mộ các tế bào gây viêm như bạch cầu trung tính đến vị trí nhiễm trùng. C3b là một opsonin mạnh, và sự lắng đọng của C3b trên mầm bệnh trong máu bằng cách kích hoạt IgM của hệ thống bổ thể dẫn đến việc làm sạch mầm bệnh bởi các đại thực bào ở lá lách và gan. Cuối cùng, hoạt hóa bổ thể cũng có thể dẫn đến sự hình thành C5 convertase, và sự gắn kết của C5 trên bề mặt mầm bệnh dẫn đến việc thu hút các phân tử C5, C6, C7, C8 và C9 trên bề mặt mầm bệnh, thúc đẩy sự hình thành của phức hợp tấn công màng (MAC). MAC tạo thành một lỗ trên bề mặt mầm bệnh, dẫn đến mất khả năng kiểm soát thẩm thấu dẫn đến chết do ly giải tế bào. thúc đẩy sự hình thành phức hợp tấn công màng tế bào (MAC). MAC tạo thành một lỗ trên bề mặt mầm bệnh, dẫn đến mất khả năng kiểm soát thẩm thấu dẫn đến chết do ly giải tế bào. thúc đẩy sự hình thành phức hợp tấn công màng tế bào (MAC). MAC tạo thành một lỗ trên bề mặt mầm bệnh, dẫn đến mất khả năng kiểm soát thẩm thấu dẫn đến chết do ly giải tế bào.Neisseria sp. và hồng cầu, đặc biệt, dễ bị chết do ly giải qua trung gian MAC. Bằng cách đóng vai trò là chất kích hoạt bổ sung mạnh mẽ, IgM đóng vai trò là chất kích hoạt bổ sung mạnh mẽ và giúp kích hoạt quá trình viêm, opsonin hóa và tiêu diệt mầm bệnh đã xâm nhập vào hệ thống tuần hoàn. IgM đặc biệt quan trọng để loại bỏ vi khuẩn có vỏ bọc, chẳng hạn như S. pneumoniae, H. influenzae, Neisseria meningitidis, Klebsiella pneumoniae và Pseudomonas aeruginosa.
Do kích thước lớn, IgM không thể dễ dàng rời khỏi hệ thống tuần hoàn và đi vào các mô so với IgG, IgE và IgA đơn phân. Mặc dù IgM chủ yếu liên quan đến việc bảo vệ mạch máu, IgM cũng có khả năng bảo vệ bề mặt niêm mạc, mặc dù thường không ở mức độ lớn như IgA. Cả IgM pentameric và IgA dimeric đều có thể được vận chuyển qua các lớp biểu mô niêm mạc thông qua thụ thể immunoglobulin cao phân tử (thụ thể poly-Ig). Thụ thể poly-Ig nằm trên bề mặt đáy bên của các lớp biểu mô niêm mạc và liên kết với IgM ngũ sắc hoặc IgA dimeric thông qua tương tác với chuỗi J, dẫn đến sự chuyển mã qua lớp biểu mô niêm mạc và giải phóng kháng thể từ bề mặt đỉnh. IgA là kháng thể chiếm ưu thế được sử dụng để bảo vệ các bề mặt niêm mạc như ruột hoặc phổi. Chưa, Sự bài tiết IgM ở niêm mạc cũng xảy ra và có thể được điều chỉnh tăng đột ngột nếu sự bài tiết IgA không đủ, điều này giải thích tại sao nhiều người bị thiếu hụt IgA chọn lọc không bị ảnh hưởng nghiêm trọng do sự tăng tiết các isotype khác trên bề mặt niêm mạc như IgM. Cơ chế bảo vệ kháng thể chính trong lòng ruột hoặc phổi là trung hòa. Cuối cùng, IgM có thể phục vụ như một opsonin, mặc dù opsonin không mạnh bằng C3b, IgG1 hoặc IgG3 và IgM dường như có các đặc tính bổ sung. IgM dường như tạo thuận lợi cho việc loại bỏ các tế bào chết theo chương trình và phục vụ các đặc tính điều hòa miễn dịch khác thông qua hai thụ thể bổ sung cho IgM, thụ thể FcμR (FCMR) đặc hiệu cho IgM (FCMR) và thụ thể Fc nhận ra cả IgM và IgA, Fcα/μR.
Việc phát hiện IgM hoặc IgG ở một cá nhân có thể chứng minh rằng người đó đã tiếp xúc với mầm bệnh. Tuy nhiên, việc phát hiện các kháng thể IgM hoặc IgG chống lại mầm bệnh không thể cho biết liệu một người có còn mang mầm bệnh cụ thể hay không hoặc liệu cơ thể có thể loại bỏ thành công mầm bệnh hay không, vì các tế bào plasma tồn tại lâu dài là một thành phần của bộ nhớ miễn dịch có thể tạo ra các kháng thể chống lại mầm bệnh vi phạm rất lâu sau khi loại bỏ thành công mầm bệnh. Trong một số trường hợp, chẳng hạn như bệnh Lyme, bệnh nhân có thể tìm kiếm sự chăm sóc y tế do các triệu chứng trong những ngày đầu tiên nhiễm bệnh trước khi hệ thống miễn dịch dịch thể có khả năng sản xuất IgM như một phần của phản ứng miễn dịch cơ bản đối với mầm bệnh. Hơn nữa, việc không có kháng thể IgM hoặc IgG trực tiếp chống lại mầm bệnh có thể gây khó khăn trong việc giải thích liệu cá nhân đó có bị suy giảm miễn dịch bẩm sinh hoặc mắc phải hay không. Việc phát hiện IgM để xác định phơi nhiễm với mầm bệnh đặc biệt hữu ích cho trẻ sơ sinh. Nếu phụ nữ mang thai bị phơi nhiễm mầm bệnh, điều quan trọng là phải xác định xem đứa trẻ sơ sinh cũng bị phơi nhiễm hay không. Việc phát hiện IgG ở trẻ sơ sinh không hữu ích cho mục đích này, vì IgG dễ dàng được chuyển qua nhau thai để bảo vệ thai nhi chống lại mầm bệnh mà người mẹ mang thai đã tiếp xúc trước đó. IgG được truyền thụ động cho trẻ sơ sinh sẽ dần dần bị phân hủy trong sáu tháng đầu đời. IgM là globulin miễn dịch đầu tiên được sản xuất ở trẻ sơ sinh. Vì thế, do cấu tạo lớn hơn, IgM ngũ sắc có thể ngưng kết hồng cầu một cách hiệu quả hoặc gây ra hiện tượng vón cục hồng cầu, một quá trình được gọi là quá trình ngưng kết hồng cầu. Các kháng thể IgM trực tiếp chống lại các kháng nguyên glycolipid liên quan đến nhóm máu ABO là một yếu tố cực kỳ quan trọng khi truyền máu, ví dụ như một người thuộc nhóm máu O nhận máu nhóm A hoặc B sẽ bị tán huyết nội mạch do kích hoạt bổ thể qua trung gian IgM. trên hồng cầu của người cho, dẫn đến sốc và đông máu nội mạch lan tỏa. Huyết sắc tố được giải phóng từ các hồng cầu bị ly giải gây độc cho thận và có thể dẫn đến suy thận cấp tính và có thể dẫn đến tử vong nếu truyền sai nhóm máu. Các agglutinin như kháng thể nhóm máu chống A hoặc chống B liên kết với các kháng nguyên glycolipid Nhóm A và B tương ứng và gây ngưng kết; tài sản này rất hữu ích trong việc xác định nhóm máu ABO của một cá nhân. Trước khi truyền máu, huyết thanh của bệnh nhân được ủ với các tế bào máu của người hiến tiềm năng như một sàng lọc cuối cùng để phát hiện sự ngưng kết, có thể phát hiện xem máu và người nhận có tương thích hay không. Cuối cùng, vì các kháng nguyên ABO được biểu hiện cao trên các mô có mạch máu như thận, nên việc sàng lọc các kháng thể IgM không tương thích có hại trực tiếp chống lại các kháng nguyên nhóm máu được thực hiện trước khi ghép thận để ngăn chặn sự đào thải cấp tính của thận được ghép. huyết thanh của bệnh nhân được ủ với các tế bào máu của người hiến tiềm năng như một sàng lọc cuối cùng để phát hiện sự ngưng kết, có thể phát hiện xem máu và người nhận có tương thích hay không. Cuối cùng, vì các kháng nguyên ABO được biểu hiện cao trên các mô có mạch máu như thận, nên việc sàng lọc các kháng thể IgM không tương thích có hại trực tiếp chống lại các kháng nguyên nhóm máu được thực hiện trước khi ghép thận để ngăn chặn sự đào thải cấp tính của thận được ghép. huyết thanh của bệnh nhân được ủ với các tế bào máu của người hiến tiềm năng như một sàng lọc cuối cùng để phát hiện sự ngưng kết, có thể phát hiện xem máu và người nhận có tương thích hay không. Cuối cùng, vì các kháng nguyên ABO được biểu hiện cao trên các mô có mạch máu như thận, nên việc sàng lọc các kháng thể IgM không tương thích có hại trực tiếp chống lại các kháng nguyên nhóm máu được thực hiện trước khi ghép thận để ngăn chặn sự đào thải cấp tính của thận được ghép.
Xét nghiệm IgM là gì?
IgM là xét nghiệm để đo lượng kháng thể IgM, cũng có khả năng đánh giá hệ thống miễn dịch giúp phát hiện tình trạng thiếu hụt hay dư thừa các Immunoglobulin khác. Các xét nghiệm IgA, IgG và IgM thường được tiến hành cùng nhau.
Giá trị IgM bình thường như sau:
| Độ tuổi | IgM bình thường |
| 0 – < 1 tuổi | 0 – 145 mg/dL |
| 1 -3 tuổi | 19 – 146 mg/dL |
| 4 – 6 tuổi | 24 – 210 mg/dL |
| 7 – 9 tuổi | 31 – 208 mg/dL |
| 10 – 11 tuổi | 31 – 179 mg/dL |
| 12 – 13 tuổi | 35 – 239 mg/dL |
| 14 – 15 tuổi | 15 – 188 mg/dL |
| 16 – 19 tuổi | 23 – 259 mg/dL |
| Người lớn | 40 – 230 mg/dL |
IgM dương tính là gì? Có nhiều bệnh lí cần làm các xét nghiệm IgM và IgG để chẩn đoán bệnh ví dụ như bệnh nhân bị sốt xuất huyết khi cho kết quả
- IgM dương tính, IgG dương tính nghĩa là bẹnh nhân bị nhiễm sốt xuất huyết Dengue thứ phát.
- Còn nếu IgG âm tính, IgM âm tính: bệnh nhân không mắc sốt xuất huyết Dengue
Tài liệu tham khảo
- Wikipedia, Immunoglobulin M, pubchem. Truy cập ngày 23/08/2023
- Abha Sathe ; John K. Cusick,Biochemistry, Immunoglobulin M, pubmed.com. Truy cập ngày 23/08/2023
Xuất xứ: Úc
Xuất xứ: Hàn Quốc
Xuất xứ: Hàn Quốc