Gefitinib
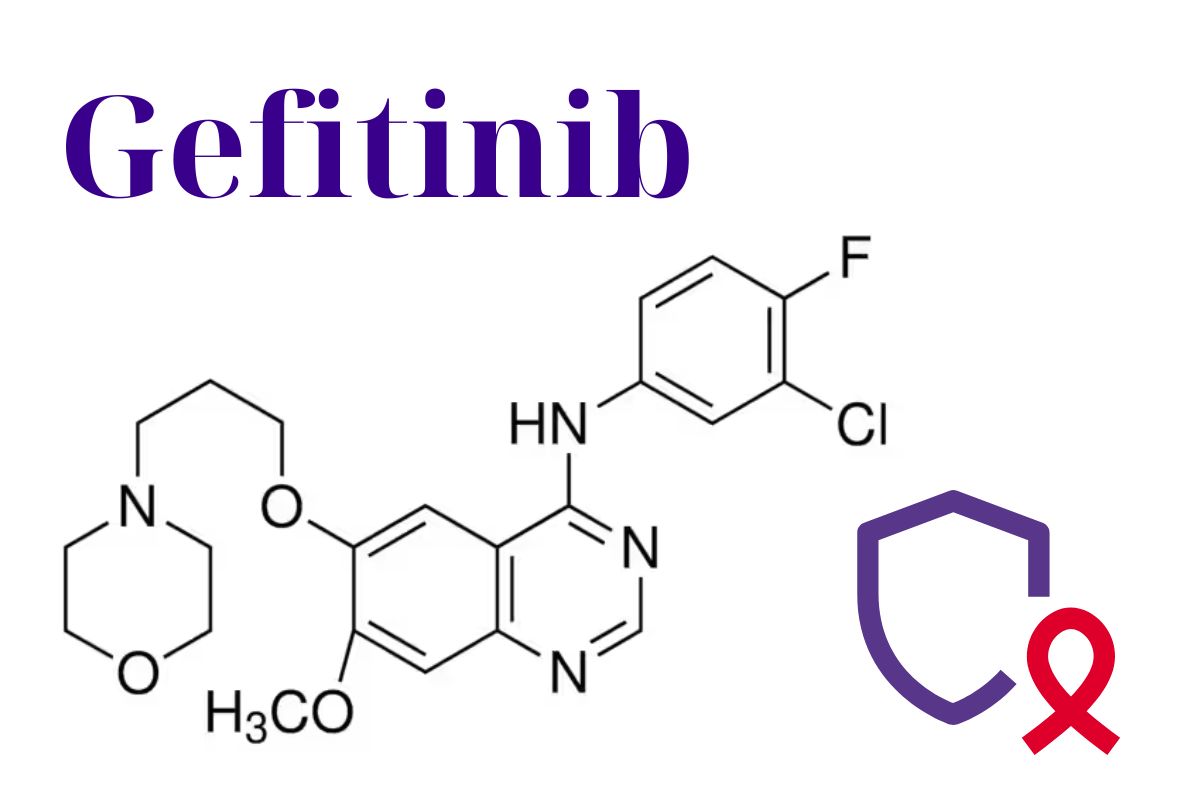
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
N-(3-chloro-4-fluorophenyl)-7-methoxy-6-(3-morpholin-4-ylpropoxy)quinazolin-4-amine
Nhóm thuốc
Thuốc Gefitinib là thuốc gì? Thuốc chống ung thư và điều hòa miễn dịch
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Chất chống ung thư
L01E – Chất ức chế protein kinase
L01EB – Chất ức chế thụ thể yếu tố tăng trưởng biểu bì (egfr) tyrosine kinase
L01EB01 – Gefitinib
Mã UNII
S65743JHBS
Mã CAS
184475-35-2
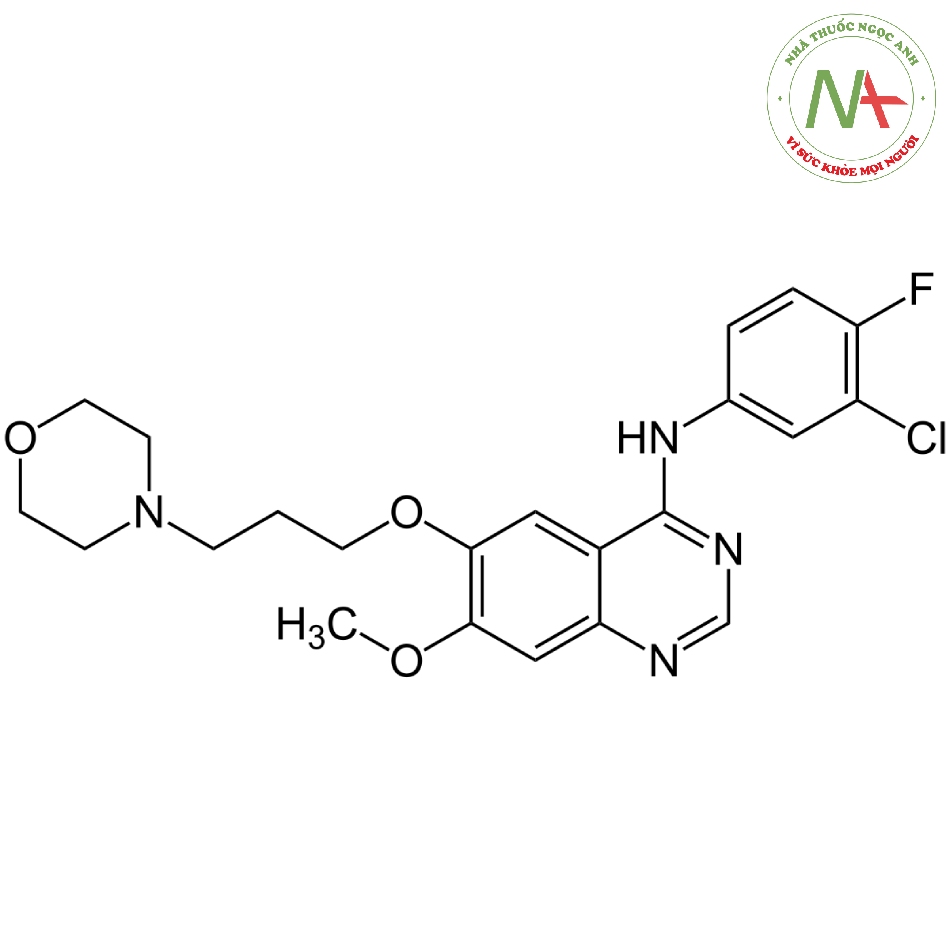
Cấu trúc phân tử
Công thức phân tử
C22H24ClFN4O3
Phân tử lượng
446,9 g/mol
Cấu trúc phân tử
Các tính chất phân tử
Số liên kết hydro cho: 1
Số liên kết hydro nhận: 8
Số liên kết có thể xoay: 8
Diện tích bề mặt cực tôpô: 68,7
Số lượng nguyên tử nặng: 31
Liên kết cộng hóa trị: 1
Các tính chất đặc trưng
Gefitinib là một thành viên của nhóm quinazoline là quinazoline được thay thế bởi nhóm (3-chloro-4-fluorophenyl)nitrilo, nhóm 3-(morpholin-4-yl)propoxy và nhóm methoxy ở vị trí 4,6 và 7, tương ứng.
Tính chất
Chất rắn, ít tan
Dạng bào chế
Viên nén bao phim: Gefitinib 250mg
Dược lý và cơ chế hoạt động
Các thụ thể yếu tố tăng trưởng biểu bì được biểu hiện quá mức trong nhiều loại ung thư biểu mô ở người bao gồm ung thư phổi, tuyến tụy và ung thư vú. Sự biểu hiện quá mức này dẫn đến việc kích hoạt quá mức tầng tín hiệu Ras chống apoptotic, dẫn đến quá trình tổng hợp DNA và tăng sinh tế bào không kiểm soát được. Các nghiên cứu đã tiết lộ rằng tyrosine kinase của EGFR chịu trách nhiệm kích hoạt tầng tín hiệu Ras này. Khi liên kết các phối tử như Yếu tố tăng trưởng biểu bì, EGFR làm giảm dần và tự phosphoryl hóa một số gốc tyrosine tại miền đầu C của nó. Chính những dư lượng tyrosine được phosphoryl hóa này sẽ kích hoạt sự kích hoạt xuôi dòng của các protein tín hiệu khác và các tầng tín hiệu tiếp theo. Gefitinib ức chế EGFR tyrosine kinase bằng cách liên kết với vị trí liên kết ATP nằm trong miền kinase. Dư lượng Lys 745, Leu 788, Ala 743, Thr 790, Gln 791, Met 193, Pro 794, Gly 796, Asp 800, Ser 719, Glam 762, & Met 766 liên kết chặt chẽ với chất ức chế. Không thể liên kết ATP, EGFR không có khả năng tự phosphoryl hóa các tyrosine ở đầu C của nó và tín hiệu tăng sinh tế bào không được kiểm soát bị chấm dứt
Dược động học
Hấp thu
Hấp thu chậm với sinh khả dụng trung bình là 60% sau khi uống. Nồng độ đỉnh xảy ra sau 3-7 giờ trong huyết tương sau khi dùng. Thức ăn không ảnh hưởng đến sinh khả dụng của gefitinib.
Chuyển hóa
Gefitinib thuốc chuyển hóa chủ yếu qua gan thông qua CYP3A4. Ba vị trí biến đổi sinh học đã được xác định: chuyển hóa nhóm N-propoxymorpholino, khử methyl của nhóm thế methoxy trên quinazoline và khử flo oxy hóa của nhóm phenyl halogen hóa. Gefitinib đã biết các chất chuyển hóa ở người bao gồm 4-Defluoro-4-hydroxy Gefitinib và O-Desmethyl Gefitinib .
Phân bố
Thể tích phân bố 1400 L. Liên kết Protein: 90% chủ yếu là albumin huyết thanh và glycoprotein alpha 1-acid (không phụ thuộc vào nồng độ thuốc).
Thải trừ
Gefitinib bài tiết qua phân, chủ yếu qua phân (86%), với lượng Gefitinib và các chất chuyển hóa thải trừ qua thận chiếm dưới 4% liều dùng.Thời gian bán bán thảu khoảng 48 giờ.
Ứng dụng trong y học
Gefitinib được sử dụng trong các liệu pháp phối hợp để điều trị ung thư
Tác dụng phụ
Gefitinib có thể gây ra tác dụng phụ nghiêm trọng: phát ban da đỏ hoặc tím lan rộng vàng da (vàng da hoặc mắt); dấu hiệu chảy máu dạ dày – ho ra máu, mắt nhạy cảm hơn với ánh sáng; đau hoặc khó chịu ở ngực đột ngột,ho mới hoặc nặng hơn kèm theo sốt, đau mắt hoặc đỏ mắt, các vấn đề về gan– buồn nôn , tiêu chảy nặng hoặc liên tục, khó thở; mờ mắt, chảy nước mắt, đau dạ dày trên, phân màu đất sét, ngứa, cảm giác mệt mỏi, sưng mặt hoặc lưỡi, nóng rát trong mắt, đau dạ dày dữ dội, chán ăn, nước tiểu sẫm màu, phân có máu hoặc hắc ín,
Các tác dụng phụ thường gặp của gefitinib có thể bao gồm: ngứa hoặc phát ban da, da khô; hoặc bệnh tiêu chảy; mụn
Độc tính ở người
Độc tính cấp tính của gefitinib lên đến 500 mg trong các nghiên cứu lâm sàng là thấp. Trong các nghiên cứu tiền lâm sàng, một liều duy nhất 12.000 mg/m2 ( gấp khoảng 80 lần liều khuyến cáo trên lâm sàng tính theo mg/m2 ) đã gây chết chuột. Một nửa liều lượng này không gây tử vong ở chuột. Các triệu chứng quá liều bao gồm tiêu chảy và phát ban da.
Nhiễm độc gan: Trong các thử nghiệm lâm sàng lớn ban đầu, sự gia tăng nồng độ aminotransferase trong huyết thanh xảy ra ở 9% đến 13% bệnh nhân được điều trị bằng liều gefitinib tiêu chuẩn và 2% đến 4% bệnh nhân phải ngừng điều trị do nồng độ cao hơn 5 lần giới hạn trên của mức bình thường. . Tăng men huyết thanh thường phát sinh sau 4 đến 12 tuần điều trị với mô hình tế bào gan. Các đặc điểm miễn dịch dị ứng và tự miễn dịch chưa được mô tả, nhưng phát ban thường gặp ở những bệnh nhân dùng gefitinib. Hầu hết các trường hợp tổn thương gan do gefitinib trong tài liệu đều ít hoặc không có triệu chứng, và tổn thương sẽ được giải quyết trong vòng 1 đến 2 tháng sau khi ngừng thuốc. Việc bắt đầu lại điều trị thường nhưng không phải lúc nào cũng xảy ra sau đó là sự tái phát nhanh chóng của tình trạng tăng men huyết thanh và liệu pháp corticosteroid dường như không ngăn được sự tái phát này. Trong một số trường hợp, liều thấp hơn được dung nạp với mức tăng ALT tối thiểu hoặc không có. Nên theo dõi định kỳ các xét nghiệm gan trong quá trình điều trị. Mặc dù tần suất tăng aminotransferase huyết thanh trong khi điều trị bằng gefitinib, nhưng các trường hợp tổn thương gan rõ ràng trên lâm sàng kèm theo vàng da là rất hiếm. Các trường hợp nhiễm độc gan nghiêm trọng và gây tử vong đã được báo cáo cho nhà tài trợ và nên theo dõi các xét nghiệm về gan trong quá trình điều trị.
Tính an toàn
- Phụ nữ cho con bú: Không có thông tin về việc sử dụng lâm sàng gefitinib trong thời kỳ cho con bú.
- Không sử dụng gefitinib nếu bạn đang mang thai. Nó có thể gây hại cho thai nhi.
Tương tác với thuốc khác
- Tránh dùng thuốc giảm axit dạ dày, thuốc kháng axit ( Zantac, Pepcid, Prevacid, Nexium, Prilosec và các loại khác) trong vòng 6 giờ trước hoặc 6 giờ sau khi bạn dùng gefitinib. Những loại thuốc khác này có thể làm cho gefitinib kém hiệu quả hơn nhiều khi dùng cùng một lúc.
- Bằng cách giảm nồng độ axit trong dạ dày, các loại thuốc như canxi cacbonat có thể cản trở quá trình hấp thụ gefitinib vào máu và làm giảm hiệu quả của thuốc. Nói chung, tốt nhất là tránh sử dụng các loại thuốc này cùng nhau khi có thể. Tuy nhiên, nếu bạn không có lựa chọn thay thế nào khác để điều trị, bạn nên dùng gefitinib 6 giờ trước hoặc 6 giờ sau canxi cacbonat để giúp giảm thiểu tác động của sự tương tác.
- Ciprofloxacin, DilTIAZem có thể làm tăng nồng độ trong máu và tác dụng của gefitinib. Bạn có thể cần bác sĩ điều chỉnh liều lượng hoặc theo dõi thường xuyên hơn để sử dụng cả hai loại thuốc một cách an toàn.
Một vài nghiên cứu của Gefitinib trong Y học
Nghiên cứu 1
Gefitinib

Gefitinib (ZD1839) là một chất ức chế chọn lọc hoạt động bằng đường uống của thụ thể tyrosine kinase của yếu tố tăng trưởng biểu bì, một loại enzyme điều chỉnh các con đường truyền tín hiệu nội bào liên quan đến sự tăng sinh và sống sót của các tế bào ung thư. Trong các dòng tế bào ung thư phổi không phải tế bào nhỏ (NSCLC) ở người và xenograft, gefitinib ức chế sự tăng sinh tế bào và sự phát triển của khối u một cách phụ thuộc vào liều, đồng thời làm tăng tác dụng gây độc tế bào của hóa trị và/hoặc xạ trị. Gefitinib có sinh khả dụng qua đường uống và được đào thải qua con đường cytochrom P450 3A4. Ở những bệnh nhân dùng gefitinib (50 đến 700 mg/ngày) trong các thử nghiệm pha I, nồng độ huyết tương ở trạng thái ổn định đạt được sau 7 đến 10 ngày. Ở những bệnh nhân mắc NSCLC tiên tiến đã thất bại một hoặc hai lần hóa trị liệu trước đó, gefitinib 250 hoặc 500 mg một lần mỗi ngày gây ra phản ứng khách quan ở khoảng 19% bệnh nhân trong một thử nghiệm mù đôi (n = 210). Trong một thử nghiệm mù đôi khác bao gồm 216 bệnh nhân mắc NSCLC đã thất bại từ hai lần hóa trị liệu trở lên trước đó, gefitinib 250 hoặc 500mg một lần mỗi ngày tạo ra phản ứng khách quan ở 11,8 và 8,8% bệnh nhân, tương ứng; khoảng 40% cho thấy sự cải thiện các triệu chứng liên quan đến bệnh. Gefitinib nhìn chung được dung nạp tốt và tác dụng phụ phổ biến nhất là phát ban da nhẹ và tiêu chảy
Nghiên cứu 2
Gefitinib dùng để ung thư phổi không phải tế bào nhỏ tiến triển

Bối cảnh: Vai trò của gefitinib trong điều trị ung thư phổi không phải tế bào nhỏ giai đoạn cuối (NSCLC). Nghiên cứu đã tiến hành tổng quan hệ thống để đánh giá bằng chứng sẵn có từ tất cả các thử nghiệm ngẫu nhiên.
Mục tiêu: Để xác định tính hiệu quả và an toàn của gefitinib như là phương pháp điều trị đầu tiên, thứ hai hoặc duy trì đối với NSCLC tiên tiến.
Tiêu chí lựa chọn: Nghiên cứu bao gồm các thử nghiệm đánh giá gefitinib, đơn độc hoặc kết hợp với phương pháp điều trị khác, so với giả dược hoặc các phương pháp điều trị khác trong phương pháp điều trị đầu tiên hoặc kế tiếp cho bệnh nhân mắc NSCLC
Thu thập và phân tích dữ liệu: Nghiên cứu sử dụng phương pháp Cochrane tiêu chuẩn. Nghiên cứu đã thực hiện tất cả các phân tích trên cơ sở cố ý điều trị. Nghiên cứuđã ghi lại dữ liệu kết quả sau: tỷ lệ sống sót chung, tỷ lệ sống sót không tiến triển, độc tính, phản ứng của khối u và chất lượng cuộc sống. Nghiên cứu cũng đã thu thập dữ liệu cho các nhóm nhỏ sau: Dân tộc châu Á và đột biến thụ thể yếu tố tăng trưởng biểu bì dương tính.
Kêt quả: Nghiên cứu bao gồm 35 thử nghiệm ngẫu nhiên có kiểm soát (RCT) đủ điều kiện, đã kiểm tra 12.089 bệnh nhân.Phần lớn dùng Gefitinib không cải thiện về mặt thống kê tỷ lệ sống sót chung khi so sánh với giả dược hoặc hóa trị liệu ở môi trường tuyến một hoặc tuyến hai. Gefitinib dòng thứ hai kéo dài thời gian dẫn đến thất bại điều trị khi so sánh với giả dược. Gefitinib duy trì đã cải thiện khả năng sống sót không bệnh tiến triển sau khi điều trị bước đầu. Các nghiên cứu ở bệnh nhân dân tộc châu Á hoặc đã tiến hành phân tích nhóm nhỏ Gefitinib dòng thứ hai kéo dài thời gian sống sót chung so với giả dược . Trong bối cảnh điều trị đầu tay, khả năng sống sót không bệnh tiến triển được cải thiện với gefitinib so với hóa trị đơn thuần . Gefitinib được sử dụng kết hợp với chế độ hóa trị liệu đã cải thiện khả năng sống sót không bệnh tiến triển so với chỉ sử dụng gefitinib hoặc hóa trị liệu . Trong bối cảnh điều trị tuyến hai, bệnh nhân dùng gefitinib có tỷ lệ sống không bệnh tiến triển cao hơn so với giả dược hoặc hóa trị liệu . Khi điều trị duy trì, gefitinib đã cải thiện khả năng sống sót không bệnh tiến triển khi so sánh với giả dược . Các nghiên cứu ở bệnh nhân có khối u dương tính với đột biến EGFR cho thấy sự cải thiện về khả năng sống sót không bệnh tiến triển có lợi cho gefitinib so với hóa trị liệu bậc một và bậc hai. Gefitinib là liệu pháp duy trì sau hóa trị liệu đã cải thiện tỷ lệ sống sót toàn bộ và không bệnh tiến triển trong một nghiên cứu pha III khi so với giả dược. Độc tính từ gefitinib bao gồm phát ban da, tiêu chảy và rối loạn men gan. Độc tính từ hóa trị liệu bao gồm thiếu máu, giảm bạch cầu trung tính và nhiễm độc thần kinh. Về chất lượng cuộc sống,
Kết luận: Tổng quan hệ thống này cho thấy rằng gefitinib, khi so sánh với liệu pháp duy trì hoặc hóa trị liệu bậc một hoặc bậc hai tiêu chuẩn, có thể có tác dụng có lợi đối với sự sống còn không bệnh tiến triển và chất lượng cuộc sống ở một số quần thể bệnh nhân được chọn, đặc biệt là những người có khối u mang đột biến EGFR nhạy cảm. Bệnh nhân có đột biến EGFR sống lâu hơn khi được dùng gefitinib duy trì so với những bệnh nhân được dùng giả dược. Tất cả các nghiên cứu khác không phát hiện bất kỳ lợi ích nào đối với tỷ lệ sống sót chung. Dữ liệu được phân tích trong tổng quan này rất không đồng nhất. Nghiên cứubị hạn chế về số lượng dữ liệu có thể được tổng hợp, phần lớn là do các biến thể trong thiết kế nghiên cứu. Nguy cơ sai lệch trong hầu hết các nghiên cứu là vừa phải, với một số nghiên cứu không đề cập đầy đủ đến việc lựa chọn tiềm năng, tiêu hao và báo cáo sai lệch. Sự không đồng nhất này có thể ảnh hưởng đến khả năng ứng dụng của các kết quả. Kết hợp gefitinib với hóa trị liệu dường như vượt trội hơn trong việc cải thiện khả năng sống sót không bệnh tiến triển so với chỉ dùng gefitinib hoặc hóa trị liệu, tuy nhiên cần có thêm dữ liệu và nghiên cứu pha III trong các bối cảnh này. Gefitinib có độc tính thuận lợi hồ sơ khi so sánh với các chế độ hóa trị liệu hiện tại. Mặc dù không có sự cải thiện nào về tỷ lệ sống sót chung, nhưng gefitinib so sánh thuận lợi với hóa trị liệu gây độc tế bào ở những bệnh nhân có đột biến EGFR với thời gian sống sót không tiến triển kéo dài hơn và ít tác dụng phụ hơn. Sự không đồng nhất này có thể ảnh hưởng đến khả năng ứng dụng của các kết quả. Kết hợp gefitinib với hóa trị liệu dường như vượt trội hơn trong việc cải thiện khả năng sống sót không bệnh tiến triển so với chỉ dùng gefitinib hoặc hóa trị liệu, tuy nhiên cần có thêm dữ liệu và nghiên cứu pha III trong các bối cảnh này. Gefitinib có độc tính thuận lợi hồ sơ khi so sánh với các chế độ hóa trị liệu hiện tại. Mặc dù không có sự cải thiện nào về tỷ lệ sống sót chung, nhưng gefitinib so sánh thuận lợi với hóa trị liệu gây độc tế bào ở những bệnh nhân có đột biến EGFR với thời gian sống sót không tiến triển kéo dài hơn và ít tác dụng phụ hơn. Sự không đồng nhất này có thể ảnh hưởng đến khả năng ứng dụng của các kết quả. Kết hợp gefitinib với hóa trị liệu dường như vượt trội hơn trong việc cải thiện khả năng sống sót không bệnh tiến triển so với chỉ dùng gefitinib hoặc hóa trị liệu, tuy nhiên cần có thêm dữ liệu và nghiên cứu pha III trong các bối cảnh này. Gefitinib có độc tính thuận lợi hồ sơ khi so sánh với các chế độ hóa trị liệu hiện tại. Mặc dù không có sự cải thiện nào về tỷ lệ sống sót chung, nhưng gefitinib so sánh thuận lợi với hóa trị liệu gây độc tế bào ở những bệnh nhân có đột biến EGFR với thời gian sống sót không tiến triển kéo dài hơn và ít tác dụng phụ hơn. tuy nhiên cần có thêm dữ liệu và nghiên cứu pha III ở những nơi này. Gefitinib có đặc tính độc tính thuận lợi khi so sánh với các phác đồ hóa trị liệu hiện tại. Mặc dù không có sự cải thiện nào về tỷ lệ sống sót chung, nhưng gefitinib so sánh thuận lợi với hóa trị liệu gây độc tế bào ở những bệnh nhân có đột biến EGFR với thời gian sống sót không tiến triển kéo dài hơn và ít tác dụng phụ hơn. tuy nhiên cần có thêm dữ liệu và nghiên cứu pha III ở những nơi này. Gefitinib có đặc tính độc tính thuận lợi khi so sánh với các phác đồ hóa trị liệu hiện tại. Mặc dù không có sự cải thiện nào về tỷ lệ sống sót chung, nhưng gefitinib so sánh thuận lợi với hóa trị liệu gây độc tế bào ở những bệnh nhân có đột biến EGFR với thời gian sống sót không tiến triển kéo dài hơn và ít tác dụng phụ hơn.
Tài liệu tham khảo
- Thư viện y học quốc gia,Gefitinib, pubchem. Truy cập ngày 10/09/2023.
- Christine R Culy, Diana Faulds (2002) Gefitinib ,pubmed.com. Truy cập ngày 10/09/2023.
- Ian A Yang, Richard Wood-Baker, Rayleen V Bowman, Kwun M Fong(2018) Gefitinib for advanced non-small cell lung cancer ,pubmed.com. Truy cập ngày 10/09/2023.
