Flutamide
Biên soạn và Hiệu đính
Dược sĩ Phan Hữu Xuân Hạo – Khoa Dược, Trường Y Dược – Đại học Duy Tân.
Danh pháp
Tên chung quốc tế
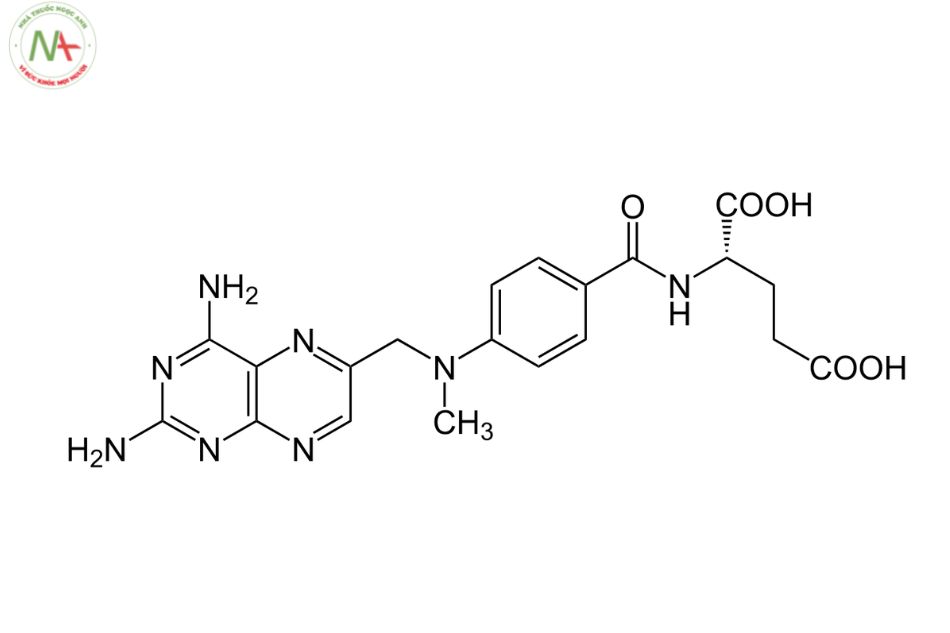
Methotrexate
Tên danh pháp theo IUPAC
(2 S ) -2 – [[4 – [(2,4-diaminopteridin-6-yl) metyl-metylamino] benzoyl] amino] axit pentanedioic
Nhóm thuốc
Liều cao dùng chống ung thư và liều thấp dùng trong ức chế miễn dịch.
Mã ATC
L01BA01
L: Chất có tác dụng chống ung thư và các tác nhân điều hòa miễn dịch
L01: Chất có tác dụng chống ung thư
L01B: Các chất có tác dụng chống chuyển hóa
L01BA: Các chất có bản chất tương tự acid folic
L01BA01: Methotrexat
Mã UNII
YL5FZ2Y5U1
Mã CAS
59-05-2
Cấu trúc phân tử
Công thức phân tử
C20H22N8O5
Phân tử lượng
454.4 g/ mol
Cấu trúc phân tử
Các tính chất phân tử
Số liên kết hydro cho: 5
Số liên kết hydro nhận: 12
Số liên kết có thể xoay: 9
Diện tích bề mặt tôpô: 211 Ų
Số lượng nguyên tử nặng: 33
Phần trăm các nguyên tử: C 52.86%, H 4.88%, N 24.66%, O 17.60%
Các tính chất đặc trưng
Điểm nóng chảy (° C): 195oC
Độ hòa tan: dưới 1 mg / mL ở 66 ° F
Áp suất hơi: 2.1X10-19 mm Hg ở 25 ° C
LogP: -1,85
Hằng số định luật Henry: 1,5X10-31 atm-cu m / mol ở 25 ° C
Chu kì bán hủy: 3- 10 giờ đối với liều thấp, 8- 15 giờ đối với liều cao
Cảm quan
Methotrexate có dạng chất bột kết tinh, rắn, không mùi từ màu vàng đến nâu cam. Nó là một loại thuốc hóa trị can thiệp vào quá trình tổng hợp DNA và RNA.
Thực tế Methotrexat không hòa tan trong nước , rượu, chloroform , ete. Tan ít trong acid clohydric loãng. Tan được trong các dung dịch hydroxit kiềm loãng và muối cacbonat loãng.
Dạng bào chế
- Methotrexat được bào chế dưới dạng viên nén với hàm lượng lần lượt là 2,5 mg; 5,0 mg; 7,5 mg; 10,0 mg và 15 mg.
- Dạng thuốc tiêm: 25 mg/ml không có chất bảo quản vưới dung tích 2 ml; 4 ml; 8 ml; 10 ml, 40 ml.
- Thuốc tiêm 25 mg/ml có chất bảo quản với dung tích 2 ml, 10 ml.
- Methotrexat còn dược bào chế thành dạng bột đông khô pha tiêm với hàm lượng 20 mg, 50 mg và 1 g.
- Dung dịch tiêm truyền 25 mg/ml và tiêm truyền đậm đặc 100 mg/ml.
- Ngoài ra, Methotrexat còn làm tá dược cho thuốc tiêm: Cồn benzylic, natri hydroxide.
Độ ổn định và điều kiện bảo quản của Methotrexat
Dung dịch methotrexat sau khi được pha loãng sẽ giữ được 90% tác dụng khi bảo quản ở nhiệt độ 21 – 25 o C trong 24 giờ.
Tuy nhiên chỉ nên pha loãng dung dịch không có chất bảo quản trước khi dùng và bỏ khi không dùng đến nữa ( không tái sử dụng).
Dung dịch pha loãng với nước dùng tiêm có các chất kìm khuẩn chứa paraben, methylparaben hoặc cồn benzylic có độ ổn định trong vòng 4 tuần ở 25 o C.
Methotrexat sau khi được pha loãng sẽ bị ánh sáng phân hủy mặc dù đã có báo cáo là bị ánh sáng phân hủy không đáng kể. Ion hydrocarbonat xúc tác cho phản ứng phân hủy này vì thế cần tránh pha trộn.
Bảo quản thuốc Methotrexat tránh ánh sáng và tốt nhất ở nhiệt độ 15 – 30 o C
Nguồn gốc
Methotrexat là một dẫn xuất folate ức chế một số enzyme chịu trách nhiệm tổng hợp nucleotide. Sự ức chế này dẫn đến ngăn sự phân chia tế bào cũng như ngăn chặn chặn quá trình viêm. Do những tác dụng này, methotrexat thường được sử dụng để điều trị chứng viêm do viêm khớp hoặc để kiểm soát sự phân chia tế bào trong các bệnh ung thư như ung thư vú và ung thư hạch không Hodgkin.
Do tác dụng độc hại của methotrexat, nó được chỉ định để điều trị một số dạng viêm khớp và bệnh vẩy nến nặng chỉ khi điều trị bước đầu không thành công hoặc bệnh nhân không dung nạp được các phương pháp điều trị đó.
Methotrexat lần đầu tiên được sản xuất vào năm 1947 và ban đầu được dùng trong điều trị ung thư, vì độc tính của nó ít hơn các phương pháp điều trị hiện tại.
Methotrexat đã được FDA chấp thuận vào ngày 7 tháng 12 năm 1953.
Vào năm 1956, Methotrexat đã cung cấp các phương pháp chữa trị đầu tiên của bệnh ung thư di căn. Methotrexat được nằm trong Danh sách Thuốc thiết yếu của Tổ chức Y tế Thế giới và Methotrexat có sẵn dưới dạng thuốc gốc .
Năm 2019, Methotrexat là loại thuốc được kê đơn phổ biến đứng thứ 111 ở Hoa Kỳ, với hơn 5 triệu đơn thuốc được bán ra.
Dược lý và cơ chế hoạt động
Đối kháng với acid folic
Methotrexat là một chất đối kháng với acid folic, được dùng trong điều trị chống ung thư.
Do Methotrexat có ái lực với enzym dihydrofolat reductase mạnh hơn acid folic
nội sinh nên các thuốc ức chế acid folic sẽ chuyển thành dạng acid tetrahydrofolic
(một chất cần thiết trong tổng hợp nhân purin và pyrimidin) nhờ đó dẫn tới sự ức chế sinh tổng hợp ADN và ARN, làm ngưng quá trình gián phân. Chính vì vậy methotrexat ức chế đặc hiệu ở pha S của chu kỳ tế bào.
Các mô gây tăng sinh mạnh như các tế bào ung thư phân chia nhanh, tế bào thai nhi, biểu mô da (bệnh vảy nến), tủy xương, niêm mạc đường tiêu hóa là những tế bào nhạy cảm nhất với methotrexat.
Ảnh hưởng đến sự tích lũy Adenosine ngoại bào
Adenosine là một chất trung gian chống viêm mạnh hoạt động thông qua tương tác với nhiều loại phụ tế bào miễn dịch bao gồm bạch cầu trung tính, đại thực bào và tế bào T và điều chỉnh một loạt các chức năng sinh lý.
Vai trò của adenosine như một chất trung gian của hoạt động chống viêm MTX đã được đề xuất kể từ khi quan sát thấy tác dụng ức chế của Methotrexat polyglutamated trên 5-aminoimidazole-4-carboxamide ribonucleotide (AICAR) formyltransferase (ATIC), một loại enzyme cần thiết cho de novo purine tổng hợp.
Sự ức chế ATIC của Methotrexat dẫn đến sự tích tụ trong tế bào của AICAR và các chất chuyển hóa của nó, là chất ức chế hai enzym quan trọng liên quan đến quá trình dị hóa adenosine và adenosine monophosphate (AMP): adenosine deaminase (ADA) và AMP deaminase (AMPD) . Bằng cách giảm sự dị hóa của adenosine và AMP, nồng độ adenosine ngoại bào tăng cả trực tiếp và gián tiếp (bằng cách khử phosphoryl của tăng nucleotide adenine).
Tác dụng ức chế miễn dịch
Methotrexat còn có tác dụng ức chế miễn dịch và được sử dụng trong điều trị viêm khớp dạng thấp. Cơ chế chữa viêm khớp dạng thấp của Methotrexat gồm các tác dụng ức chế miễn dịch và/hoặc tác dụng chống viêm. Tác dụng ức chế miễn dịch cũng được ứng dụng để ngăn chặn các phản ứng chống lại mảnh ghép của vật chủ sau khi thực hiện ghép tủy xương.
Khả năng kháng methotrexat là có thể xảy ra và nó có liên quan đến sự giảm hấp thu thuốc của tế bào và làm tăng hoạt tính của dihydrofolat reductase (liên quan với tăng tổng hợp enzym), hoặc nó làm giảm khả năng liên kết của methotrexat với dihydrofolat reductase (do protein dihydrofolat reductase bị đột biến) và làm giảm nồng độ các chất chuyển hóa polyglutamylat của thuốc trong tế bào.
Ứng dụng trong y học của Methotrexate
Dung dịch uống Methotrexat được chỉ định cho các bệnh nhân mắc bạch cầu nguyên bào lympho cấp tính (kể cả trẻ em) và bệnh viêm khớp vô căn ở cả trẻ vị thành niên.
Thuốc tiêm methotrexat được sử dụng dưới da, chỉ định cho các trường hợp viêm khớp dạng thấp trong các hoạt động nặng, viêm khớp vô căn ở các trẻ vị thành niên có nhiều tế bào và bệnh vẩy nến nặng, tàn tật, khó chịu.
Các dạng bào chế khác được chỉ định dùng trong điều trị ung thư biểu mô tuyến vú trong thời kỳ mang thai, ung thư epidermoid ở đầu và cổ, ung thư các biểu mô màng đệm, ung thư vú, nốt ruồi hydatiform, ung thư phổi, thuốc diệt nấm sợi cơ tiến triển, và ung thư hạch không Hodgkin tiến triển.
Methotrexat cũng được chỉ định dùng trong việc duy trì bệnh bạch cầu lymphocytic cấp tính.
Methotrexat cũng được dùng trước khi sử dụng leucovorin trong điều trị để kéo dài thời gian sống sót không tái phát sau khi phẫu thuật cắt bỏ khối u trong bệnh u xương không di căn.
Dược động học
Hấp thu
Methotrexat có sinh khả dụng 64-90%, mặc dù điều này giảm ở liều uống trên 25mg do bão hòa chất vận chuyển qua trung gian của methotrexat. Methotrexat có T tối đa từ 1 đến 2 giờ. 1 liều uống 10-15µg đạt nồng độ trong huyết thanh 0,01-0,1µM.
Phân bố
Thể tích phân bố của methotrexat ở trạng thái ổn định là khoảng 1L / kg.
Methotrexat liên kết với protein huyết tương là 46,5-54%. Sau khi phân phối, Methotrexat chủ yếu tập trung ở gan, thận và lá lách dưới dạng các polyglutamat có thể được lưu lại sau nhiều tuần hoặc vài tháng.
Thời gian bán thải trung bình là 6-7 giờ. Thời gian bán thải có thể kéo dài đến 4 lần ở những bệnh nhân có khoang phân bố thứ ba ( như tràn dịch màng phổi hay cổ trướng).
Chuyển hóa
Methotrexat được chuyển hóa bởi folylpolyglutamate tổng hợp thành methotrexat polyglutamate trong gan cũng như trong các mô. Gamma-glutamyl hydrolase thủy phân các chuỗi glutamyl của các polyglutamat methotrexat chuyển chúng trở lại thành methotrexat. Một lượng nhỏ methotrexat cũng được chuyển thành 7-hydroxymethotrexat
Thải trừ
Methotrexat được thải trừ> 80% dưới dạng thuốc không thay đổi và khoảng 3% dưới dạng chất chuyển hóa 7-hydroxyl hóa. Methotrexat được bài tiết chủ yếu qua nước tiểu với 8,7-26% liều tiêm tĩnh mạch xuất hiện trong mật.
Thời gian bán thải của methotrexat liều thấp là 3 đến 10 giờ ở người lớn. Thời gian bán thải đối với methotrexat dùng liều cao là 8 đến 15 giờ. Bệnh nhân nhi dùng methotrexat cho bệnh thiếu máu nguyên bào lympho cấp tính có thời gian bán thải cuối là 0,7 đến 5,8 giờ. Bệnh nhân nhi dùng methotrexat điều trị viêm khớp vô căn vị thành niên có thời gian bán hủy từ 0,9 đến 2,3 giờ.
Độc tính của Methotrexat
Độc tính của Methotrexat được tìm thấy ở động vật
LD 50 qua đường miệng ở chuột cống là 135 mg / kg và ở chuột nhắt là 146mg / kg.
Độc tính của Methotrexat được tìm thấy ở người
Độc tính khi dùng Methotrexat quá liều thông thường
Các triệu chứng quá liều bao gồm các phản ứng huyết học và tiêu hóa như giảm bạch cầu, giảm tiểu cầu, thiếu máu, giảm tiểu cầu, ức chế tủy xương, viêm niêm mạc, viêm miệng, loét miệng, buồn nôn, nôn, loét đường tiêu hóa và xuất huyết tiêu hóa.
Trong trường hợp quá liều, bệnh nhân nên được điều trị bằng glucarpidase và không được dùng leucovorin trong 2 giờ trước hoặc sau khi dùng glucarpidase.
Tổn thương thận cấp tính khi dùng Methotrexat ở liều cao
Độc tính trên thận do Methotrexat liều cao (HDMTX) phát sinh thông qua bệnh thận tinh thể, xảy ra khi methotrexat và các chất chuyển hóa của nó kết tủa trong ống thận. Vì methotrexat có tính acid, các tinh thể thuốc không có trong nước tiểu có pH kiềm, vì quá trình kiềm hóa làm tăng đáng kể khả năng hòa tan và bài tiết của methotrexat. Bệnh thận do tinh thể biểu hiện ban đầu là tăng creatinin huyết thanh không có triệu chứng, sau đó tiến triển thành hoại tử ống thận và tổn thương thận nặng hơn.
Vì suy giảm thể tích và nước tiểu có tính acid là những yếu tố nguy cơ chính đối với tổn thương thận cấp tính (AKI), do đó, việc tăng thể tích và kiềm hóa nước tiểu là bắt buộc trong quá trình điều trị bằng Methotrexat liều cao (được thảo luận thêm trong phần về các biện pháp chăm sóc hỗ trợ).
Lưu ý và thận trọng khi dùng Methotrexat
Lưu ý và thận trọng chung
Trước khi sử dụng Methotrexat, bệnh nhân cần được kiểm tra chức năng gan, thận.
Khi điều trị bằng Methotrexat, bệnh nhân cần được làm xét nghiệm chức năng phối nếu cần. Nếu có triệu chứng lạ liên quan đến chức năng phổi, cần phải ngừng dùng thuốc ngay.
Methotrexat có khả năng làm giảm phản ứng của các vaccine, do đó nó có thể làm ảnh hưởng đến kết quả xét nghiệm miễn dịch.
Những bệnh nhân dùng methotrexat ở liều thấp cũng có thể mắc u lympho ác tính.
Khi gặp các tình trạng gây mất nước khi đang điều trị bằng Methotrexat như nôn mửa hay tiêu chảy hoặc viêm miệng phải ngừng dùng Methotrexat cho đến khi các triệu chứng biến mất hoàn toàn.
Lưu ý dùng Methotrexat cho phụ nữ đang mang thai
Chống chỉ định dùng Methotrexat cho phụ nữ mang thai trong các chỉ định không phải ung thư học.
Nếu trong thời gian điều trị với methotrexat và đến sáu tháng sau đó mà mang thai, bệnh nhân cần được tư vấn y tế về nguy cơ có hại đối với đứa trẻ khi điều trị và nên thực hiện siêu âm kiểm tra sự phát triển bình thường của thai nhi.
Methotrexat đã được chứng minh là có độc tính đối với thai nhi, đặc biệt là trong ba tháng đầu mang thai và có thể gây quái thai, gây chết thai, sẩy thai hoặc có các biến chứng bất thường bẩm sinh.
Trong một số trược hợp bắt buộc đặc biệt, cần cân nhắc giữa lợi ích của việc điều trị với nguy cơ có thể xảy ra cho thai nhi.
Lưu ý dùng Methotrexat cho phụ nữ đang cho con bú
Methotrexat có thể vượt qua hàng rào sinh lý để đi vào sữa mẹ và có thể gây độc cho trẻ bú. Do đó, chống chỉ định dùng Methotrexat trong thời kỳ cho con bú. Nếu việc sử dụng trong thời kỳ cho con bú là bắt buộc hoặc cần thiết, phải ngừng cho con bú trước khi điều trị bằng Methotrexat.
Lưu ý khi dùng Methotrexat cho người lái xe hoặc vận hành máy móc
Methotrexate có khả năng gây ra các rối loạn trên hệ thần kinh trung ương như mệt mỏi, chóng mặt, buồn ngủ. Điều này có thể gây nguy hiểm khi người bệnh đang tham gia giao thông hoặc vận hành máy móc.
Tương tác với thuốc khác
Không phối hợp dùng Methotrexat với các thuốc: Thuốc chống viêm không steroid (Nsaids) như diclofenac, ketoprofen, naproxen, ketorolac, azapropazone, indomethacin, ibuprofen, probenecid, các dẫn chất của salicylat và pyrimethamin hay vaccine.
Một số thuốc khi dùng chung với methotrexat cần phải điều chỉnh liều gồm: penicillin, mercaptopurine, theophylline.
Dùng chung các kháng sinh đường uống như tetracyclin, cloramphenicol và các kháng sinh phổ rộng không hấp thu ( chủ yếu qua đường tiêu hóa) với Methotrexat có thể làm giảm sự hấp thu và chuyển hóa của Methotrexat.
Điều trị với trimethoprim/sulfamethoxazol ngay sau khi điều trị bằng methotrexat trong một số trường hợp có thể gây thiếu máu nguyên hồng cầu khổng lồ, thiếu toàn thể huyết cầu ở một vài bệnh nhân.
Tương tác của Methotrexat với thực phẩm
Tránh dùng quá nhiều đồ uống có chứa caffeine hoặc theophylline (có trong cà phê, trà,…) trong khi đang điều trị bằng methotrexat.
Một vài nghiên cứu của Methotrexat trong Y học
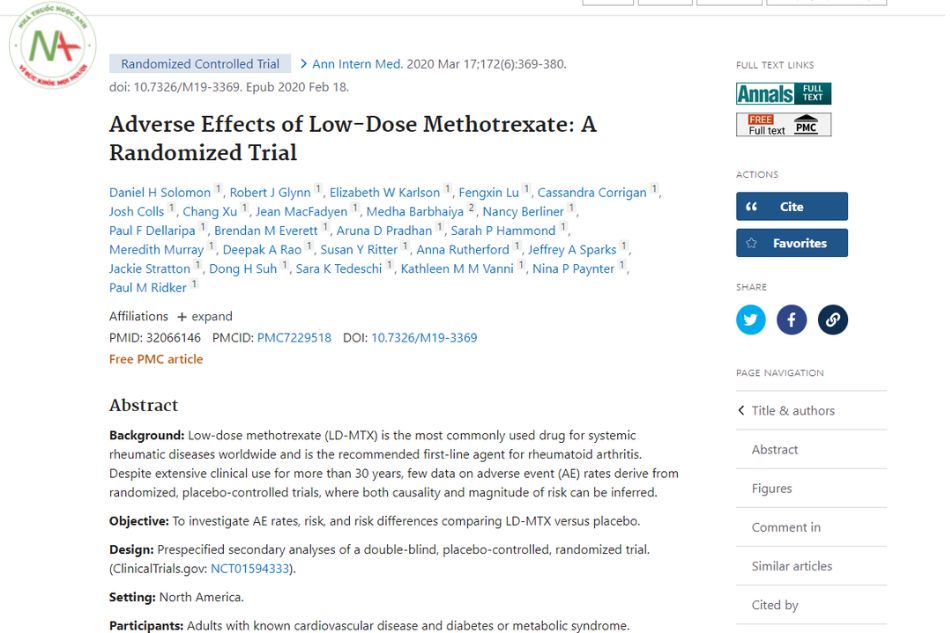
Tác dụng ngoại ý của Methotrexate liều thấp: Thử nghiệm ngẫu nhiên
Cơ sở
Methotrexate liều thấp (LD-MTX) là loại thuốc được sử dụng phổ biến nhất cho các bệnh thấp khớp toàn thân trên toàn thế giới và là thuốc đầu tay được khuyến cáo cho bệnh viêm khớp dạng thấp. Mặc dù được sử dụng rộng rãi trên lâm sàng trong hơn 30 năm, rất ít dữ liệu về tỷ lệ tác dụng ngoại ý (AE) thu được từ các thử nghiệm ngẫu nhiên, có đối chứng với giả dược, nơi có thể suy ra cả quan hệ nhân quả và mức độ rủi ro.
Mục tiêu
Để điều tra sự khác biệt về tỷ lệ AE, nguy cơ và rủi ro so sánh LD-MTX so với giả dược.
Thiết kế
Các phân tích thứ cấp được chỉ định trước của một thử nghiệm ngẫu nhiên mù đôi, có đối chứng với giả dược. (ClinicalTrials.gov: NCT01594333 ).
Đối tượng tham gia
Người lớn mắc bệnh tim mạch và tiểu đường hoặc hội chứng chuyển hóa đã biết.
Can thiệp
Phân bổ ngẫu nhiên cho LD-MTX (≤20 mg / tuần) hoặc giả dược. Tất cả những người tham gia đều nhận được axit folic, 1 mg / ngày, 6 ngày mỗi tuần.
Đo lường
Rủi ro đối với các AE quan tâm cụ thể, cũng như đối với tất cả các AE, được so sánh giữa các nhóm điều trị sau khi xét xử mù.
Kết quả
Sau một thời gian hoạt động tích cực, 6158 bệnh nhân đã được ghi danh và 4786 được phân ngẫu nhiên vào một nhóm; thời gian theo dõi trung bình là 23 tháng và liều lượng trung bình 15 mg / tuần. Trong số những người tham gia được phân công ngẫu nhiên, 81,2% là nam giới, độ tuổi trung bình là 65,7 tuổi và chỉ số khối cơ thể trung bình là 31,5 kg / m2. Trong số 2391 người tham gia được chỉ định cho LD-MTX, 2080 (87,0%) có AE quan tâm, so với năm 1951 là 2395 (81,5%) được chỉ định cho giả dược (tỷ lệ nguy cơ [HR], 1,17 [95% CI, 1,10 đến 1,25]) . Các mối nguy tương đối về đường tiêu hóa (HR, 1,91 [CI, 1,75 đến 2,10]), phổi (HR, 1,52 [CI, 1,16 đến 1,98]), nhiễm trùng (HR, 1,15 [CI, 1,01 đến 1,30]) và huyết học (HR , 1,15 [CI, 1,07 đến 1,23]) AE tăng đối với LD-MTX so với giả dược. Ngoại trừ nguy cơ gia tăng ung thư da (HR, 2,05 [CI, 1,28 đến 3,28]), các nhóm điều trị không khác nhau về nguy cơ mắc các bệnh ung thư khác hoặc các bệnh về da niêm mạc, tâm thần kinh hoặc cơ xương. AE thận giảm ở nhóm LD-MTX (HR, 0,85 [CI, 0,78 đến 0,93]).
Giới hạn
Thử nghiệm được thực hiện ở những bệnh nhân không mắc bệnh thấp khớp dung nạp LD-MTX trong thời gian hoạt động.
Kết luận
Việc sử dụng LD-MTX có liên quan đến việc tăng nguy cơ ung thư da và các bệnh về đường tiêu hóa, nhiễm trùng, phổi và huyết học, trong khi các AE thận giảm.
Tài liệu tham khảo
- 1. Drugbank, Methotrexate, truy cập ngày 12 tháng 8 năm 2022.
- 2. Pubchem, Methotrexate, truy cập ngày 12 tháng 8 năm 2022.
- 3. Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
- 4. Howard, S. C., McCormick, J., Pui, C. H., Buddington, R. K., & Harvey, R. D. (2016). Preventing and managing toxicities of high-dose methotrexate. The oncologist, 21(12), 1471-1482.
- 5. Solomon, D. H., Glynn, R. J., Karlson, E. W., Lu, F., Corrigan, C., Colls, J., … & Ridker, P. M. (2020). Adverse effects of low-dose methotrexate: a randomized trial. Annals of internal medicine, 172(6), 369-380.
Biên soạn và Hiệu đính
Dược sĩ Phan Hữu Xuân Hạo – Khoa Dược, Trường Y Dược – Đại học Duy Tân.
Danh pháp
Tên chung quốc tế
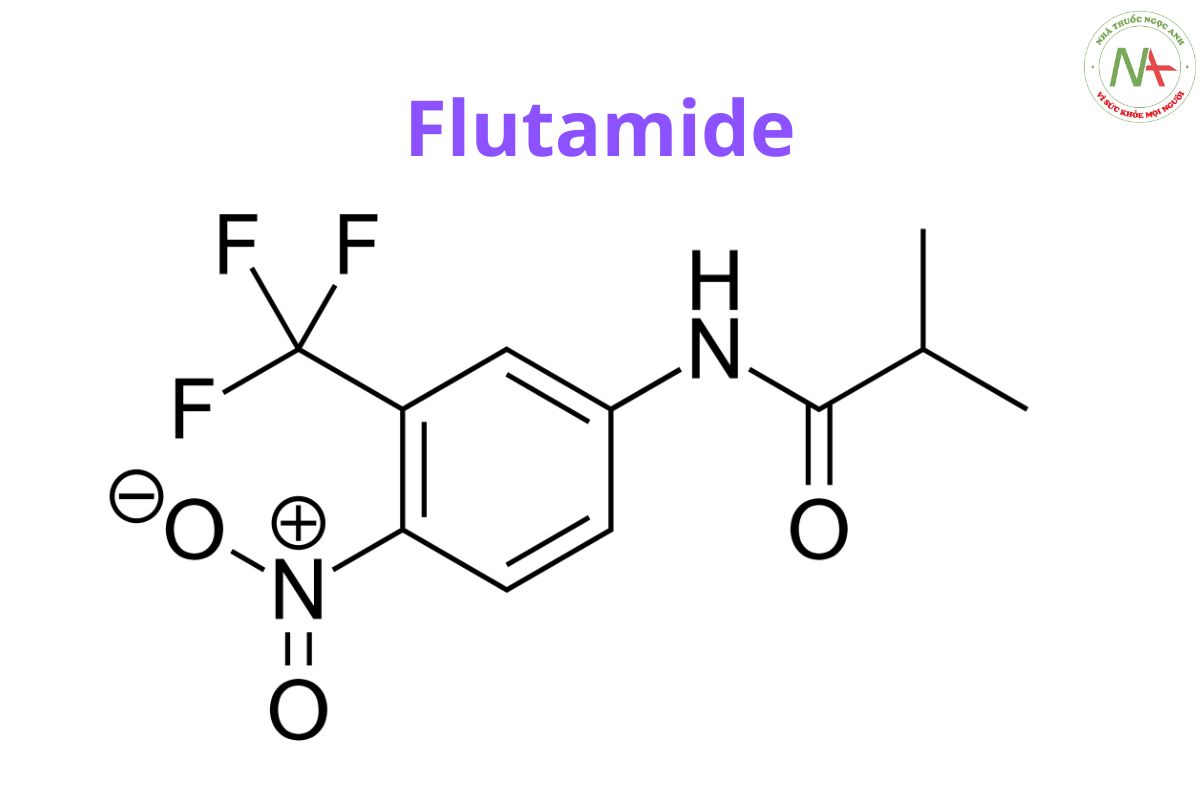
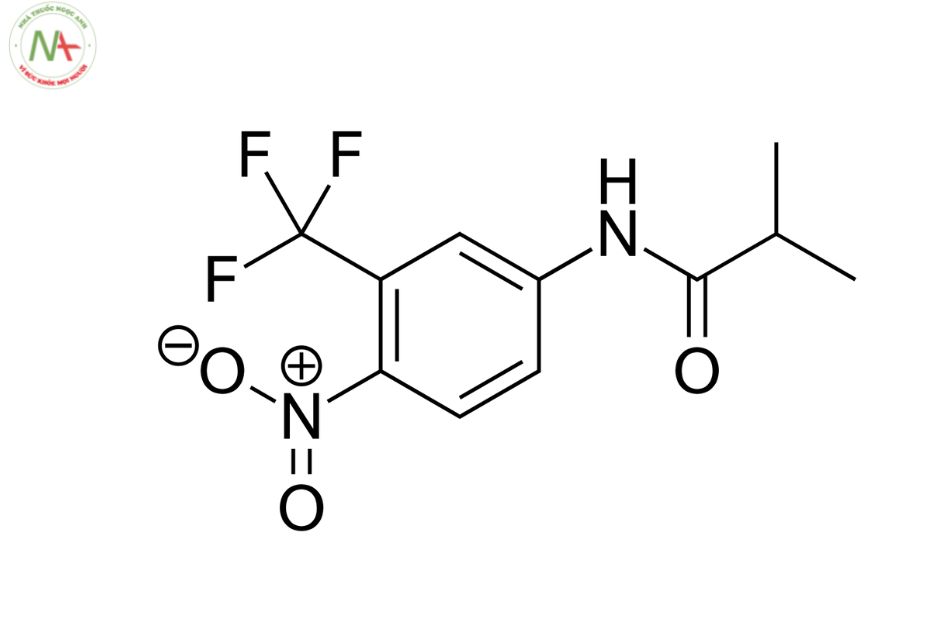
Flutamide
Tên danh pháp theo IUPAC
2-methyl-N-[4-nitro-3-(trifluoromethyl)phenyl]propanamide
Nhóm thuốc
Thuốc chống ung thư nhóm kháng androgen
Mã ATC
L – Chất chống ung thư và tác nhân điều hòa miễn dịch
L02 – Liệu pháp nội tiết tố
L02B – Hormone antagonists và các tác nhân liên quan
L02BB – Chống Androgen
L02BB01 – Flutamide
Mã UNII
76W6J0943E
Mã CAS
13311-84-7
Cấu trúc phân tử
Công thức phân tử
C11H11F3N2O3
Phân tử lượng
276.21 g/mol
Cấu trúc phân tử
Flutamide là một dẫn xuất toluidine và là một chất kháng androgen không steroid có cấu trúc liên quan đến bicalutamide và nilutamide.
Các tính chất phân tử
Số liên kết hydro cho: 1
Số liên kết hydro nhận: 6
Số liên kết có thể xoay: 2
Diện tích bề mặt tôpô: 74.9 Ų
Số lượng nguyên tử nặng: 19
Các tính chất đặc trưng
Điểm nóng chảy: 111.5 – 112.5°C
Điểm sôi: 400.3°C
Tỷ trọng riêng: 195.9 g/mL
Phổ hồng ngoại: Đạt cực đại tại 1136cm-1
Độ tan trong nước: 9.45 mg/L
Chu kì bán hủy: 6 giờ
Khả năng liên kết với Protein huyết tương: 94 – 96%
Cảm quan
Flutamide có dạng bột kết tinh màu vàng, ít tan trong nước.
Dạng bào chế
Viên nén: 250 mg.
Viên nang: 125 mg.
Độ ổn định và điều kiện bảo quản
Các dạng bào chế của flutamide nên được bảo quản trong đồ bao gói kín, tránh ẩm, tránh ánh sáng, có thể để ở nhiệt độ từ 2 – 30°C.
Nguồn gốc
Flutamide lần đầu tiên được tổng hợp bởi Neri và các đồng nghiệp tại Schering Plough Corporation vào năm 1967. Ban đầu thuốc được tổng hợp như một chất kìm khuẩn, nhưng sau đó tình cờ được phát hiện có hoạt tính kháng androgen. Theo đó, tên mã của flutamide trong quá trình phát triển là SCH-13521.
Nghiên cứu lâm sàng về flutamide bắt đầu vào năm 1971 và thuốc được bán lần đầu tiên trên thị trường vào năm 1983, cụ thể là ở Chile với tên thương hiệu Drogenil và ở Tây Đức với tên thương hiệu Flugerel.
Flutamide đã không được giới thiệu ở Hoa Kỳ cho đến năm 1989 khi FDA phê duyệt cụ thể để điều trị ung thư tuyến tiền liệt di căn kết hợp với một chất tương tự hormone giải phóng gonadotropin (GnRH).
Cũng vào năm 1989, flutamide lần đầu tiên được nghiên cứu để điều trị chứng rậm lông ở phụ nữ và đây cũng là “thuốc kháng androgen tinh khiết” đầu tiên được nghiên cứu để điều trị chứng rậm lông.
Flutamide là thuốc kháng androgen không steroid đầu tiên được giới thiệu, tiếp theo là nilutamide vào năm 1989 và sau đó là bicalutamide vào năm 1995.
Dược lý và cơ chế hoạt động
Flutamide là một hợp chất không steroid, có tác dụng kháng androgen nhưng sau khi hấp thu, flutamide được chuyển hóa thành 2-hydroxyflutamide, một chất chính có tác dụng kháng androgen gấp 1,5 lần flutamide. Về cấu trúc và tác dụng dược lý, flutamide có liên quan hai hợp chất khác là bicalutamide và nilutamide.
Flutamide có hoạt tính kháng androgen đơn thuần và chọn lọc, ngoài ra không có bất cứ hoạt tính hormon nội tại nào khác. Cơ chế của hoạt tính này là do flutamide ức chế cạnh tranh với thụ thể androgen của nhân tế bào, ở các mô đích như tuyến tiền liệt, túi tinh, vỏ thượng thận.
Theo đó, flutamide phong bế sự liên kết của dihydrotestosterone vào thụ thể androgen và ngăn cản các tế bào đích thu giữ androgen, sau đó làm giảm số lượng thụ thể androgen trong tuyến tiền liệt thông qua ngăn cản sự chuyển đoạn phức hợp androgen – thụ thể vào nhân tế bào.
Hơn nữa, flutamide cũng ức chế thụ thể androgen trong các tế bào u, làm ngừng phát triển hoặc giảm u do ức chế tổng hợp protein và DNA ở các tế bào ung thư phát triển phụ thuộc vào androgen.
Ở người bệnh ung thư tuyến tiền liệt đã cắt bỏ tinh hoàn và sử dụng flutamide, dehydroepiandrosterone (một tiền chất của testosteron ở vỏ thượng thận) bị chuyển hóa nhanh thành các chất không còn hoạt tính.
Flutamide thường được sử dụng phối hợp với chất tương tự hormon giải phóng GnRH như goserelin, leuprorelin, để điều trị ung thư tuyến tiền liệt.
Ứng dụng trong y học
Ung thư tuyến tiền liệt
Flutamide đã được phát hiện là có hiệu quả tương tự với bicalutamide trong điều trị ung thư tuyến tiền liệt, mặc dù đã có ghi nhận về các dấu hiệu cho thấy hiệu quả kém hơn, bao gồm tăng bù đắp mức testosterone và giảm nồng độ PSA nhiều hơn so với bicalutamide.
Flutamide với liều lượng 750mg/ngày (250mg x 3 lần/ngày) cũng đã được chứng minh là có hiệu quả tương đương với cyproterone acetate 250mg/ngày (đường uống) như một liệu pháp đơn độc trong điều trị ung thư tuyến tiền liệt ở quy mô thử nghiệm lâm sàng lớn trên 310 bệnh nhân. Mặc dù tác dụng phụ và độc tính của flutamide (bao gồm nữ hóa tuyến vú, tiêu chảy, buồn nôn, chán ăn và rối loạn gan) được cho là tồi tệ hơn đáng kể so với cyproterone acetate.
Mặt khác, flutamide với liều 750mg/ngày gần như tương đương về hiệu quả với bicalutamide 50mg/ngày khi được sử dụng như thành phần kháng androgen trong liệu pháp phong tỏa androgen kết hợp để điều trị ung thư tuyến tiền liệt giai đoạn cuối.
Hơn nữa, sự kết hợp của flutamide với một estrogen như ethinylestradiol sulfonate đã được sử dụng như một hình thức phong tỏa androgen kết hợp và cũng là một sự thay thế cho sự kết hợp của flutamide với phẫu thuật hoặc thiến.
Ngoài ra, flutamide cũng đã được sử dụng để ngăn chặn tác động của sự bùng phát testosterone khi mới bắt đầu điều trị bằng thuốc chủ vận GnRH ở nam giới bị ung thư tuyến tiền liệt.
Tình trạng da và tóc
Flutamide đã được nghiên cứu và sử dụng rộng rãi để điều trị các tình trạng da và tóc phụ thuộc androgen ở phụ nữ bao gồm mụn trứng cá, tăng tiết bã nhờn, rậm lông, rụng tóc da đầu và bệnh hyperandrogenism.
Theo đó, flutamide có hiệu quả trong việc cải thiện các triệu chứng của những tình trạng này với liều lượng sử dụng thấp hơn so với liều lượng sử dụng trong điều trị ung thư tuyến tiền liệt. Mặc dù flutamide vẫn tiếp tục được sử dụng cho những chỉ định này nhưng việc sử dụng thuốc trong những năm gần đây đã bị hạn chế do nguy cơ nhiễm độc gan có thể gây tử vong. Do đó, flutamide không còn được khuyến cáo như một liệu pháp điều trị đầu tay hoặc thứ hai.
Mặt khác, bicalutamide cũng được phát hiện là có hiệu quả tương đương với flutamide trong điều trị chứng rậm lông ở phụ nữ nhưng có nguy cơ độc tính gan thấp hơn và ít nghiêm trọng hơn.
Ngoài nguy cơ gây độc cho gan và bên cạnh các thuốc kháng androgen không steroid khác, người ta cho rằng flutamide có khả năng là loại thuốc kháng androgen thường được sử dụng tốt nhất để điều trị các triệu chứng phụ thuộc androgen ở phụ nữ. Điều này có liên quan đến hiệu quả cao và tác dụng phụ tối thiểu của thuốc.
Mụn trứng cá và tăng tiết bã nhờn
Trong một số nghiên cứu, flutamide đã được phát hiện có hiệu quả trong điều trị mụn trứng cá và tăng tiết bã nhờn ở phụ nữ.
Theo đó, trong một nghiên cứu dài hạn trên 230 phụ nữ bị mụn trứng cá, 211 người trong số họ cũng bị tăng tiết bã nhờn, việc dùng flutamide với liều rất thấp hoặc kết hợp với thuốc tránh thai đã làm giảm rõ rệt mụn trứng cá và tình trạng tăng tiết bã nhờn sau 6 tháng điều trị. Hơn nữa, hiệu quả tối đa sau 1 năm điều trị và được duy trì trong những năm sau đó. 97% phụ nữ cho biết họ hài lòng với việc kiểm soát mụn trứng cá bằng flutamide.
Trong một nghiên cứu khác, flutamide làm giảm đến 80% điểm số mụn trứng cá và tình trạng tăng tiết bã nhờn chỉ trong 3 tháng. Ngược lại, spironolactone chỉ làm giảm các triệu chứng khoảng 40% trong cùng một khoảng thời gian. Điều này cho thấy hiệu quả vượt trội của flutamide đối với những chỉ định này.
Nhìn chung, flutamide đã được chứng minh là làm giảm các triệu chứng của mụn trứng cá lên tới 90% ngay cả ở liều lượng thấp và một số nghiên cứu cho thấy mụn trứng cá sạch hoàn toàn.
Rậm lông
Flutamide đã được phát hiện là có hiệu quả trong việc điều trị chứng rậm lông trong nhiều nghiên cứu. Theo đó, thuốc có hiệu quả vừa phải đối với chỉ định này và chất lượng tổng thể của bằng chứng được coi là trung bình.
Flutamide cho thấy hiệu quả tương đương hoặc vượt trội hơn so với các thuốc kháng androgen khác bao gồm spironolactone, cyproterone acetate và finasteride trong điều trị chứng rậm lông, mặc dù nguy cơ nhiễm độc gan tương đối cao khiến flutamide không có lợi so với các lựa chọn khác.
Thuốc đã được sử dụng để điều trị chứng rậm lông với liều lượng từ 62,5mg/ngày đến 750mg/ngày. Tuy nhiên, mặc dù một nghiên cứu cho thấy rằng nhiều liều dùng flutamide làm giảm đáng kể triệu chứng rậm lông ở phụ nữ mắc hội chứng buồng trứng đa nang nhưng lại không có sự khác biệt đáng kể về hiệu quả đối với các mức liều 125mg/ngày, 250mg/ngày và 375mg/ngày.
Ngoài ra, một nghiên cứu cho thấy việc kết hợp flutamide 125mg/ngày với finasteride không có hiệu quả hơn flutamide 125mg/ngày đơn độc trong điều trị rậm lông. Những phát hiện này ủng hộ việc sử dụng flutamide ở liều thấp để điều trị chứng rậm lông mà không làm giảm hiệu quả, đồng thời có thể giúp giảm nguy cơ nhiễm độc gan. Tuy nhiên, nguy cơ vẫn tồn tại ngay cả ở liều lượng rất thấp.
Rụng tóc da đầu
Flutamide đã được phát hiện có hiệu quả trong điều trị rụng tóc ở phụ nữ trong một số nghiên cứu.
Theo đó, trong một nghiên cứu trên 101 phụ nữ trước và sau mãn kinh, flutamide đơn độc hoặc kết hợp với thuốc tránh thai đã làm giảm rõ rệt điểm số rụng tóc sau 1 năm điều trị, với hiệu quả tối đa đạt được sau 2 năm điều trị và lợi ích được duy trì trong 2 năm nữa.
Trong một nghiên cứu nhỏ về flutamide với thuốc tránh thai, loại thuốc này đã làm gia tăng mật độ tóc được chấp nhận về mặt thẩm mỹ ở 6 trong số 7 phụ nữ bị rụng tóc lan tỏa trên da đầu.
Trong một nghiên cứu so sánh, flutamide giúp cải thiện đáng kể sự phát triển của tóc trên da đầu (giảm 21% điểm số Ludwig) ở phụ nữ mắc hyperandrogenic sau 1 năm điều trị, trong khi cyproterone acetate và finasteride không có hiệu quả.
Liệu pháp hormone chuyển giới
Flutamide đã được sử dụng như một phần của liệu pháp hormone nữ hóa cho phụ nữ chuyển giới và có ít nhất hai trung tâm đã được báo cáo về việc sử dụng flutamide cho mục đích này. Tuy nhiên, việc sử dụng thuốc cho những mục đích như vậy, cũng như ở phụ nữ chuyển giới bị bệnh da liễu phụ thuộc androgen, không được khuyến khích vì đã có các báo cáo về độc tính trên gan ở nam giới bị ung thư tuyến tiền liệt sử dụng flutamide với mức liều tương đương.
Dược động học
Hấp thu
Flutamide được hấp thu nhanh và hoàn toàn qua đường tiêu hóa. Nồng độ đỉnh của thuốc trong huyết tương đạt được sau khi uống khoảng 1 giờ.
Phân bố
Flutamide và chất chuyển hóa có hoạt tính 2-hydroxyflutamide đều có tỉ lệ liên kết với protein huyết tương trên 90%, phân bố vào các mô có nồng độ cao nhất sau khi uống 6 giờ.
Chuyển hóa
Flutamide được chuyển hóa mạnh và nhanh với hơn 10 chất chuyển hóa trong huyết tương đã được tìm thấy. Trong đó, chất chuyển hóa chính là 2-hydroxyflutamide có tác dụng kháng androgen mạnh hơn flutamide và nồng độ đỉnh đạt được sau khi uống flutamide 2 giờ.
Thải trừ
Flutamide được đào thải chủ yếu qua nước tiểu với chất chuyển hóa chính là 2-amino-5-nitro-4-trifluoromethyl-phenol, ngoài ra chỉ một lượng rất nhỏ được thải trừ qua phân.
Thời gian bán thải của chất chuyển hóa 2-hydroxyflutamide là khoảng 6 giờ ở người trẻ và 8 giờ ở người cao tuổi.
Phương pháp sản xuất
Trong công nghiệp, flutamide có thể được sản xuất bằng cách cho axit isobutyric phản ứng với clorua cyanuric và N-methylmorpholine để tạo thành este (3) hoạt động ở 0 – 5°C, sau đó xử lý bằng 3-aminobenzotrifluoride (4) ở 25°C để tạo ra amide tương ứng (5). Amide này cuối cùng, trên quá trình nitrat hóa tạo ra sản phẩm mong muốn là flutamide, 2-methyl-N-[4-nitro-3- (trifluoromethyl) phenyl] propionamide (6).
Sản phẩm phụ 2,4,6-trihydroxy-1,3,5-triazine (7) được chuyển thành nguyên liệu ban đầu hữu ích là cyanuric clorua (1) bằng cách hồi lưu với N, N-diethylamine và POCl3.
Độc tính ở người
Trong các nghiên cứu trên động vật chỉ dùng flutamide, các dấu hiệu quá liều bao gồm giảm hoạt động, rối loạn nhịp tim, hô hấp chậm, mất điều hòa và/hoặc chảy nước mắt, chán ăn, an thần, nôn và methemoglobinemia.
Tính an toàn
Độ an toàn và hiệu quả của flutamide chưa được xác định ở phụ nữ và trẻ em, do đó không dùng thuốc cho phụ nữ và trẻ em.
Tương tác với thuốc khác
Flutamide làm tăng tác dụng của warfarin.
Rượu làm tăng tình trạng đỏ bừng, nóng mặt khi điều trị với flutamide.
Các chất ức chế CYP1A2, CYP3A4 và dasatinib có thể làm tăng tác dụng của flutamide.
Các chất làm tăng enzym cảm ứng CYP1A2, CYP3A4 và deferasirox có thể làm giảm tác dụng của flutamide.
Lưu ý khi sử dụng Flutamide
Flutamide chỉ được sử dụng khi có chỉ định và sự theo dõi chặt chẽ của thầy thuốc, kể cả khi muốn ngừng thuốc hoặc giảm liều.
Flutamide có thể gây tổn thương gan, nhiều khi rất nặng và thậm chí có thể tử vong. Vì vậy, trước khi bắt đầu điều trị, trong 4 tháng đầu tiên của đợt điều trị và định kỳ hàng tháng sau đó, phải định lượng aminotransferase (transaminase). Nếu hoạt độ ALT lớn hơn 2 lần giới hạn trên của mức bình thường thì không được sử dụng flutamide nữa.
Bệnh nhân bị suy thận mạn tính dùng một lần liều 250mg, không cho thấy ảnh hưởng đến Cmax cũng như AUC của flutamide và 2-hydroxyflutamide. Ở người có Clcr < 29 ml/phút, nửa đời thải trừ của 2-hydroxyflutamide chỉ kéo dài hơn chút ít. Vì vậy, không cần phải hiệu chỉnh liều ở các bệnh nhân này. Cần định kỳ xác định nồng độ kháng nguyên đặc hiệu tuyến tiền liệt (PSA). Bình thường, khi bệnh tiến triển tốt, PSA sẽ giảm. Tuy nhiên, nếu bệnh có dấu hiệu nặng lên cùng với sự tăng PSA, thì có thể cân nhắc chỉ nên dùng thuốc tương tự GnRH và ngừng tạm thời flutamide. Trong những trường hợp này, nhiều khi ngừng flutamide thì PSA lại giảm. Mặc dù cơ chế của đáp ứng này chưa được biết rõ, nhưng có thể liên quan đến đột biến thụ thể androgen. Với người bệnh tim mạch, flutamide có thể giữ nước, gây phù và tăng huyết áp. Nếu có biểu hiện xanh tím, cần tìm methemoglobin (metHb) huyết hoặc sulfhemoglobin (sulfHb) huyết. Đặc biệt, phải ngừng thuốc nếu thấy metHb huyết > 5% hoặc sulfHb huyết > 1%.
Một vài nghiên cứu của Flutamide trong Y học
Điều trị chứng rụng tóc do tăng androgen ở phụ nữ
Mục tiêu: Xác định hiệu quả của các loại thuốc kháng androgen khác nhau trong điều trị phụ nữ tiền mãn kinh mắc chứng rụng tóc do hyperandrogenic.
Phương pháp: Thử nghiệm ngẫu nhiên đối chứng của ba phương pháp điều trị ở 36 phụ nữ rụng tóc hyperandrogenic và quan sát, không điều trị ở 12 bệnh nhân tương tự khác.
Tổng số 48 phụ nữ hyperandrogenic bị rụng tóc và 30 đối chứng phù hợp với tuổi và cân nặng để đánh giá nồng độ androgen.
Phân ngẫu nhiên cyproterone acetate (50mg) với ethinyl estradiol (EE) trong một phác đồ tuần tự ngược lại; flutamide (250mg) hoặc finasteride (5mg) mỗi ngày; tất cả trong 1 năm. Mười hai bệnh nhân tương tự đã được quan sát mà không cần điều trị trong 1 năm.
Điểm Ludwig về độ mỏng tóc cũng như đánh giá của bệnh nhân và điều tra viên về hiệu quả điều trị.
Kết quả: Flutamide làm giảm 21% điểm số của Ludwig (2,3 +/- 0,2 xuống 1,8 +/- 0,1). Các hiệu quả điều trị khác không có ý nghĩa thống kê. Đánh giá bệnh nhân và điều tra viên cho thấy một xu hướng tương tự.
Kết luận: Flutamide với liều 250mg mỗi ngày gây ra sự cải thiện khiêm tốn về chứng rụng tóc sau 1 năm, trong khi cyproterone acetate và finasteride không có hiệu quả. Có thể phải điều trị hơn 1 năm để có kết quả tốt hơn.
Tài liệu tham khảo
- 1. Carmina, E., & Lobo, R. A. (2003). Treatment of hyperandrogenic alopecia in women. Fertility and sterility, 79(1), 91–95. https://doi.org/10.1016/s0015-0282(02)04551-x
- 2. Drugbank, Flutamide, truy cập ngày 17 tháng 8 năm 2022.
- 3. Pubchem, Flutamide, truy cập ngày 17 tháng 8 năm 2022.
- 4. Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
