Evusheld
Biên soạn và Hiệu đính
Dược sĩ Phan Hữu Xuân Hạo – Khoa Dược, Trường Y Dược – Đại học Duy Tân.
Danh pháp
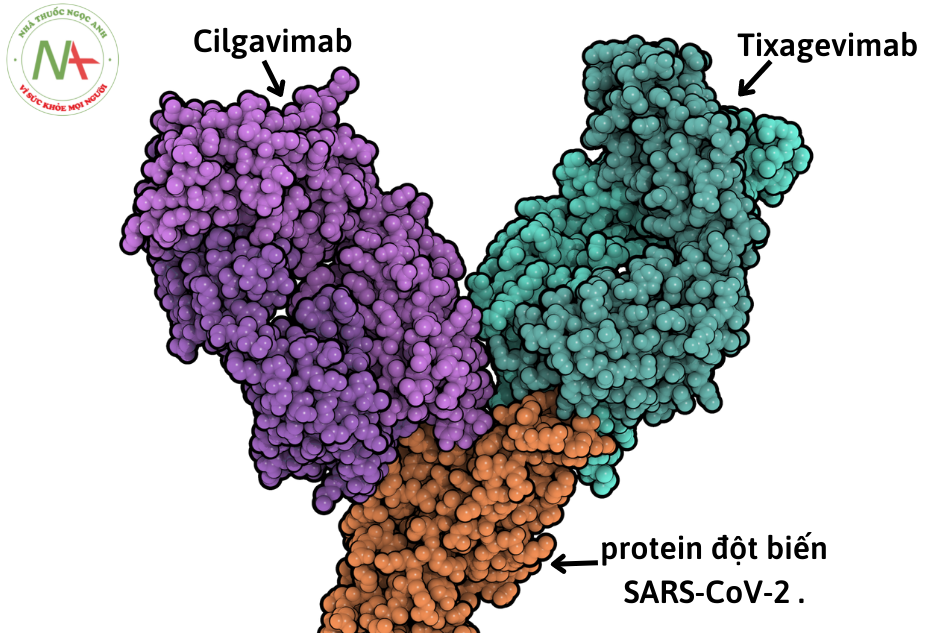
Evusheld (AZD7442) là hỗn hợp kháng thể đơn dòng được tạo thành từ 2 kháng thể đơn dòng tác dụng kéo dài tixagevimab (AZD8895) và cilgavimab (AZD1061)
Mã ATC
J06BD03
J06 Huyết thanh miễn dịch và globulin miễn dịch
J06B Globulin miễn dịch
J06BD Kháng thể đơn dòng kháng vi rút
J06BD03 Tixagevimab and cilgavimab
Mã KEGG
D12262
Danh mục thuốc
Thuốc kê đơn (ETC)
Phân loại nguy cơ cho phụ nữ có thai
Nhóm B2
Cấu trúc phân tử
Tixagevimab
Công thức: C6488H10034N1746O2038S50
Khối lượng phân tử: 146706.82g/mol
Cilgavimab
Công thức: C6626H10218N1750O2078S44
Khối lượng phân tử: 149 053 .44 g /mol −1
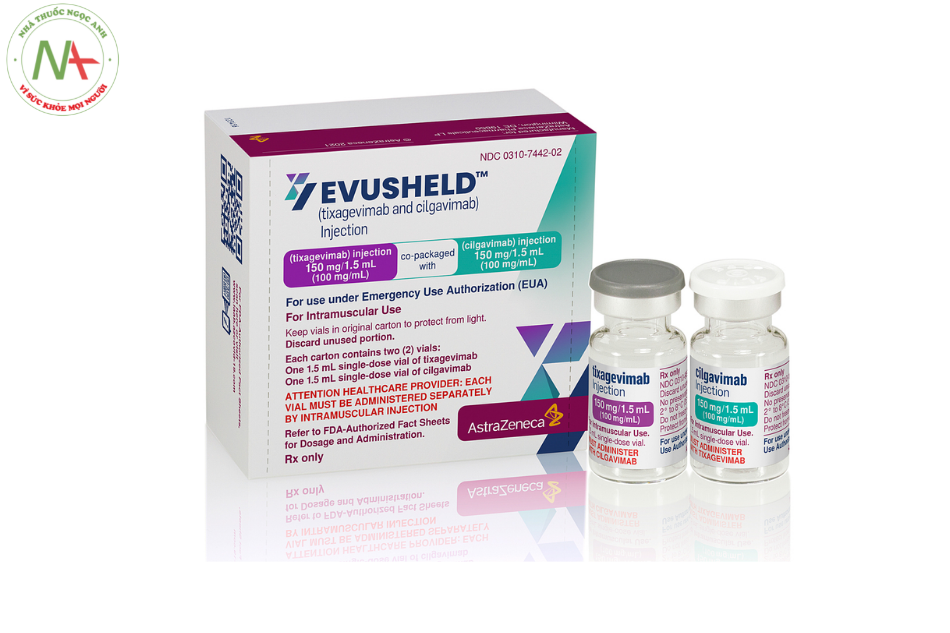
Dạng bào chế và hàm lượng
Dung dịch tiêm bắp gồm:
- 1 ống 150 mg tixagevimab trong 1,5 mL (100 mg / mL).
- 1 ống 150 mg Cilgavimab trong 1,5 mL (100 mg / mL).
Tá dược gồm có: L-Histidine hydrochloride monohydrate , Histidin, Saccharose, Polysorbate 80 và Nước cất pha tiêm
Cảm quan
Dung dịch trong đến trắng đục, không màu đến hơi vàng, pH 6,0.
Độ ổn định và bảo quản
Bảo quản trong tủ lạnh ( từ 2ºC đến 8ºC), tránh ánh sáng và không lắc và để vào đóng băng.
Độ ổn định:
- Đối với lọ thuốc tiêm chưa sử dụng: 18 tháng
- Đối với lọ thuốc tiêm đã mở: Tính ổn định trong sử dụng hóa học và vật lý đã được chứng minh trong 4 giờ ở 2ºC đến 25ºC. Sản phẩm phải được sử dụng ngay lập tức để tránh vi sinh vật.
- Đối với ống tiêm đã bơm thuốc: Các ống tiêm đã chuẩn bị sẵn nên được tiêm ngay lập tức. Nếu không thể sử dụng ngay lập tức, thời gian sử dụng và điều kiện bảo quản trước khi sử dụng sẽ ảnh hưởng đến tác dụng và thông thường sẽ không lâu hơn 4 giờ ở 2ºC đến 25ºC.
Nguồn gốc
Vào năm 2020, các nhà nghiên cứu tại Trung tâm Y tế Đại học Vanderbilt đã phát hiện ra kháng thể đơn dòng đặc biệt mạnh , được phân lập từ bệnh nhân COVID-19 bị nhiễm SARS-CoV-2 đang lưu hành vào thời điểm đó. Ban đầu được chỉ định là COV2-2196 và COV2-2130, kỹ thuật kháng thể được sử dụng để chuyển tính đặc hiệu liên kết SARS-CoV-2 của chúng vào giàn IgG sẽ tồn tại lâu hơn trong cơ thể và các kháng thể được thiết kế này được đặt tên lần lượt là AZD8895 và AZD1061 (và sự kết hợp được gọi là AZD7442).
Qua quá trình sàng lọc từ hơn 1500 kháng thể, Trung tâm Y tế Đại học Vanderbilt đã chọn ra 2 kháng thể có hoạt lực mạnh nhất và có khả năng hiệp đồng. Hai kháng thể là tixagevimab (AZD8895) và cilgavimab (AZD1061) đã được hãng dược phẩm AstraZeneca mua lại giấy phép và tạo ra Evusheld,
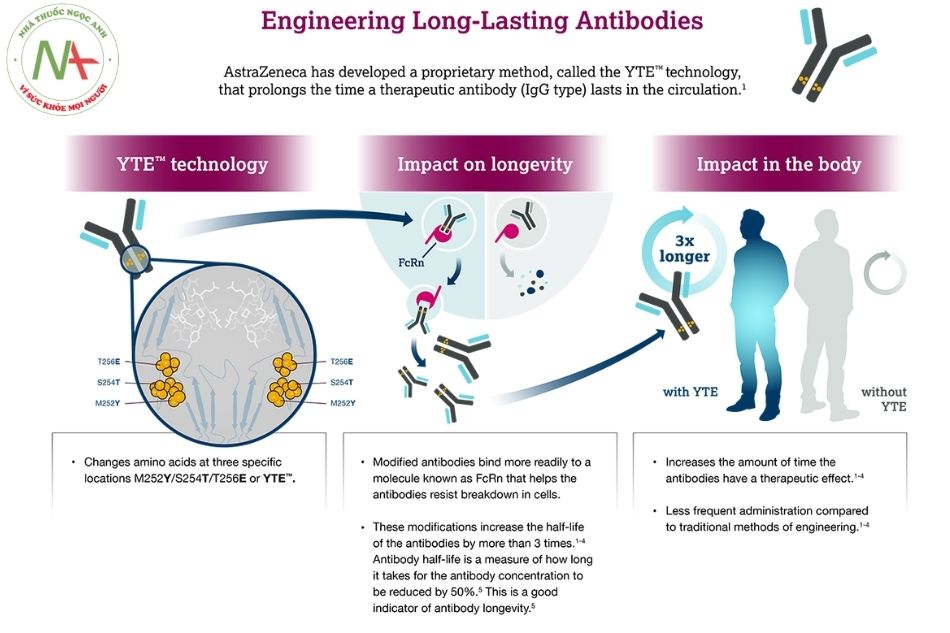
Evushel sau đó được AstraZeneca tối ưu hóa bằng công nghệ độc quyền tiên tiến, nhằm kéo dài thời gian bán thải lâu hơn gấp 3 lần và có khả năng bảo vệ ít nhất 6 tháng chỉ sau 1 lần tiêm. Đồng thời, điều chỉnh này cũng giúp thuốc tập trung với nồng độ cao ở niêm mạc vùng mũi hầu và giảm nguy cơ các bệnh lý liên quan đến miễn dịch như hiện tượng tăng cường phụ thuộc kháng thể đối với bệnh .
Các nghiên cứu của AstraZeneca sau này cũng phát hiện ra rằng hỗn hợp kháng thể vô hiệu hóa các biến thể virus SARS-CoV-2 mới nổi gần đây bao gồm cả biến thể Delta , và biến thể Omicron .
Cơ chế hoạt động
Tixagevimab và Cilgavimab là hai loại globulin miễn dịch tái tổ hợp của người G1κ (kháng thể đơn dòng IgG1κ, với sự thay thế axit amin để kéo dài thời gian bán hủy của kháng thể (bằng cách sửa đổi M252Y / S254T / T256E (YTE)) và để giảm chức năng hiệu ứng kháng thể và nguy cơ tăng cường phụ thuộc vào kháng thể của bệnh (do sửa đổi L234F / L235E / P331S (TM)).
Tixagevimab và cilgavimab có thể liên kết đồng thời với các vùng không chồng chéo của vùng liên kết thụ thể protein đột biến (RBD) của virus SARS-CoV-2. Hai kháng thể này liên kết với protein gai đột biến của virus tại 2 vị trí riêng biệt, không trùng nhau trên với hằng số phân li cân bằng của Kd= 2,8 pM (picomolar), 13,0 pM và 13,7 pM, tương ứng, ngăn chặn sự tương tác của nó với thụ thể enzym chuyển đổi angiotensin 2 (ACE2) ở người, dẫn đến ngăn chặn sự xâm nhập của vi rút vào tế bào con người, vô hiệu hóa hiệu quả SARS-CoV-2. Việc phối hợp cùng lúc cả 2 kháng thể mang đến tác dụng hiệp đồng và giảm nguy cơ đề kháng của virus SARS-CoV-2 đối với Evusheld.
Tixagevimab, cilgavimab và sự kết hợp của chúng chặn RBD liên kết với thụ thể ACE2 ở người với một nửa giá trị nồng độ ức chế tối đa (IC 50 ) là 0,32 nM (nanomolar) (48 ng / mL), 0,53 nM (80 ng / mL) và 0,43 nM (65 ng / mL), tương ứng .
Chỉ định
Phần lớn cộng đồng đều có đáp ứng tốt với vắc xin phòng COVID-19, do đó những người khỏe mạnh bình thường không cần thiết phải sử dụng Kháng thể đơn dòng Evusheld thay thế cho vắc xin COVID-19.
Evusheld được chỉ định điều trị dự phòng cho những người suy giảm miễn dịch, người đủ điều kiện tiêm vắc xin COVID-19 hoặc đã tiêm nhưng không có đáp ứng về miễn dịch với vắc xin COVID-19.
Một liều thuốc Evusheld có tác dụng trong thời gian ít nhất 6 tháng cho người lớn và trẻ em từ 12 tuổi có cân nặng từ 40kg trở lên . Đồng thời các đối tượng này hiện không nhiễm SARS-CoV-2 và không có tiếp xúc với người nhiễm SARS-CoV-2 và phải thuộc một trong các trường hợp sau:
- Mắc chứng suy giảm miễn dịch mức độ vừa đến nặng do một tình trạng bệnh lý, hoặc sử dụng các thuốc hoặc phác đồ điều trị ức chế miễn dịch và có khả năng không tạo được đáp ứng miễn dịch đối với vắc xin COVID-19.
- Không thể tiêm vắc xin COVID-19 vì có tiền sử dị ứng với thành phần nào của vắc xin COVID-19.
Ngoài ra các tình trạng y khoa hoặc phương pháp điều trị có thể dẫn tới suy giảm miễn dịch mức độ vừa đến nặng và đáp ứng miễn dịch không thỏa đáng đối với vaccine phòng COVID-19 bao gồm:
- Ung thư tạng đặc hay các bệnh lý máu ác tính đang điều trị hồi sức tích cực
- Điều trị chống thải ghép sau ghép tạng.
- Điều trị với chimeric antigen receptor (CAR)-T-Cell hay cấy ghép tế bào gốc tạo máu (trong vòng 2 năm của cấy ghép hay đang điều trị liệu pháp ức chế miễn dịch).
- Các bệnh khiếm khuyết miễn dịch nguyên phát trung bình và nặng (vd: hội chứng DiGeorge, Wiskott-Aldrich..)
- HIV tiến triển hay không điều trị (Bệnh nhân HIV có số lượng CD4<200/mm3, có tiền sử bị các bệnh xác định AIDS mà không bị hội chứng viêm phục hồi miễn dịch, hay biểu hiện lâm sàng của HIV có triệu chứng)
- Điều trị tích cực với corticosteroid liều cao (≥20 mg prednisone hay tương đương/ngày và dùng ≥2 tuần), alkylating agents, antimetabolites, các thuốc chống thải ghép, các thuốc hóa trị gây suy giảm miễn dịch nặng, các thuốc chẹn TNF, và các thuốc sinh học gây ức chế hay điều chỉnh miễn dịch (vd: các thuốc gây suy giảm tế bào B như rituximab…)
Chống chỉ định
- Người có tiền sử quá mẫn, bao gồm sốc phản vệ với bất kỳ thành phần nào của Evusheld
- Phụ nữ đang mang thai và phụ nữ đang con bú
Dược lực học
Chưa ghi nhận nghiên cứu nào về tương tác dược lực học đã được thực hiện.
Dược động học
Hấp thu
Sau khi tiêm bắp với liều 150 mg tixagevimab và 150 mg cilgavimab ở người tình nguyện khỏe mạnh, nồng độ tối đa trung bình (% CV) (Cmax) tương ứng là 16,5 (35,6%) và 15,3 (38,5%) µg / mL đối với tixagevimab và cilgavimab, đã đạt được Tmax trung bình trong 14 ngày. Sinh khả dụng tuyệt đối ước tính sau một liều tiêm bắp 150 mg duy nhất là 68,5% đối với tixagevimab và 65,8% đối với cilgavimab.
Dựa trên mô hình dược động học / dược lực học, thời gian để đạt được nồng độ huyết thanh bảo vệ tối thiểu (2,2 µg / mL) được ước tính là 6 giờ sau khi tiêm bắp 150 mg tixagevimab và 150 mg cilgavimab vào vùng mông.
Phân bố
Dựa trên mô hình PK, thể tích phân phối trung tâm là 2,72 L đối với tixagevimab và 2,48 L đối với cilgavimab. Thể tích phân phối ngoại vi là 2,64 L đối với tixagevimab và 2,57 L đối với cilgavimab.
Chuyển hóa
Tixagevimab và cilgavimab được cho là sẽ bị phân hủy thành các peptit nhỏ và các axit amin thành phần thông qua con đường dị hóa giống như các kháng thể IgG nội sinh
Thải trừ
Độ thanh thải (CL) là 0,041 L / ngày đối với tixagevimab và 0,041 L / ngày đối với cilgavimab với sự thay đổi giữa các cá nhân tương ứng là 21% và 29%. Thời gian bán hủy giai đoạn cuối trung bình của quần thể ước tính là 89 ngày đối với tixagevimab và 84 ngày đối với cilgavimab.
Thử nghiệm lâm sàng
Để đánh giá tiềm năng của các kháng thể trong vai trò dự phòng dựa trên kháng thể đơn dòng, thử nghiệm lâm sàng ‘Provent’ đã thu nhận 5197 người có nguy cơ cao nhưng chưa bị nhiễm bệnh và theo dõi họ trong 15 tháng. Thử nghiệm báo cáo rằng những người nhận loại cocktail cho thấy giảm 77% COVID-19 có triệu chứng và không có trường hợp nghiêm trọng hoặc tử vong.
Đồng thời, kết quả từ thử nghiệm điều trị ngoại trú ‘TACKLE’ giai đoạn III (cỡ mẫu 903 người) đã chứng minh rằng AZD7442 làm giảm nguy cơ phát triển từ bệnh Covid-19 mức độ nhẹ-trung bình thành bệnh nặng hoặc tử vong so với giả dược, cụ thể là: giảm 88% nguy cơ trên nếu bệnh nhân dùng trong vòng 3 ngày kể từ khi khởi phát triệu chứng, giảm 67% nếu bệnh nhân sử dụng trong vòng 5 ngày và giảm 50% nguy cơ tiến triển bệnh nặng hay tử vong ở bệnh nhân dùng AZD7442 trong vòng 7 ngày,
Evusheld (AZD7442) vẫn duy trì hiệu quả trung hòa đối với biến thể mới như Omicron. Các thử nghiệm độc lập do Cơ quan quản lý thực phẩm và dược phẩm Hoa Kỳ (FDA) tiến hành để đánh giá hiệu quả của AZD7442 về khả năng trung hòa trên virus giả lập cho thấy AZD7442 có khả năng duy trì việc trung hòa biến thể Omicron (B.1.1.529). Kết quả cho thấy, nồng độ ức chế tối thiểu 50% hoạt động virus (IC50) của AZD7442 là 171 ng/ml và 277 ng/ml trong hai xét nghiệm đối chứng, vẫn nằm trong phạm vi hiệu giá trung hòa đã được xác định ở người đã mắc Covid-19 trước đó.

Nghiên cứu của Đại học Oxford cũng ghi nhận AZD7442 vẫn duy trì khả năng trung hòa đối với biến thể Omicron, với hoạt động trung hòa chỉ giảm 37,1 lần so với chủng nguyên gốc. Đồng thời, từ 4 kiểm nghiệm độc lập bởi Viện nghiên cứu Sức khỏe Hoa Kỳ (NIEHS) ghi nhận ở nồng độ ức chế tối thiểu từ 147-247 MIC đã chứng minh hiệu lực trung hòa không thay đổi trên biến thể Omicron.
Kết quả nghiên cứu từ Đại học Y khoa Washington cũng cho thấy AZD7442 duy trì khả năng trung hòa mạnh mẽ biến thể phụ BA.2, có khả năng lây lan nhanh và hiện đang thống trị tại nhiều quốc gia ở châu Âu chiếm hơn 60% tổng số ca lây nhiễm). Nghiên cứu trên cũng chỉ ra rằng AZD7442 giúp giảm tải lượng vi rút và giảm tình trạng viêm nhiễm ở phổi (trong thử nghiệm trên sinh vật sống) đối với tất cả các biến thể phụ của Omicron.
Tính an toàn và độc tính
Đối với Evusheld, hồ sơ an toàn đã được kiểm nghiệm trên hơn 7000 người, qua 3 thử nghiệm pha III: PROVENT (n=5197), STORM CHASER (n=1129) và TACKLE (n=903). Trong thử nghiệm về dự phòng trước phơi nhiễm PROVENT, biến cố ngoại ý gần như tương đương nhau ở 2 nhóm với tỷ lệ là 35.3% ở nhóm dùng Evusheld và 34.2% ở nhóm giả dược. Chỉ có 1/3461 người có phản ứng phản vệ. Do đó, việc sử dụng kháng thể đơn dòng Evusheld là rất an toàn, không lo ngại đến các phản ứng quá mẫn.
Các phản ứng phụ có thể gặp như là
- Tác dụng phụ thường gặp nhất là: đau đầu, mệt mỏi và ho.
- Trong các biến cố ngoại ý được báo cáo, phần lớn ở mức độ nhẹ (73%) và trung bình (24%).
- Tỷ lệ các biến cố ngoại ý nghiêm trọng được báo cáo tương đương nhau ở nhóm dùng AZD7442 và nhóm giả dược (1%).
Tình trạng pháp lý
Trên thế giới
Vào tháng 10 năm 2021, Ủy ban về các sản phẩm thuốc dùng cho người (CHMP) của Cơ quan Dược phẩm Châu Âu (EMA) đã bắt đầu đánh giá tổng thể về tixagevimab / cilgavimab, đang được phát triển bởi AstraZeneca AB, để ngăn ngừa COVID-19 ở người lớn.
Cũng trong tháng 10 năm 2021, AstraZeneca đã yêu cầu Cấp phép Sử dụng Khẩn cấp cho tixagevimab / cilgavimab để ngăn chặn COVID-19 từ Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA).
Vào tháng 11 năm 2021, Bahrain đã cho phép nó sử dụng trong trường hợp khẩn cấp.
Vào tháng 12 năm 2021, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã cấp phép sử dụng khẩn cấp sự kết hợp này để ngăn ngừa COVID-19 (trước khi phơi nhiễm) ở những người có khả năng miễn dịch suy yếu hoặc những người không thể tiêm chủng đầy đủ do tiền sử phản ứng nghiêm trọng với vắc xin coronavirus . và ở một số người từ 12 tuổi trở lên nặng ít nhất 40 kg.
Sản phẩm chỉ được ủy quyền cho những cá nhân không bị nhiễm vi rút SARS-CoV-2 và những người gần đây chưa tiếp xúc với cá nhân bị nhiễm SARS-CoV-2. Mặc dù Evusheld được FDA chấp thuận để sử dụng trong trường hợp khẩn cấp ở Mỹ, nhưng ước tính khoảng 80% liều thuốc có sẵn không được sử dụng trong kho và trên kệ thuốc và bệnh viện do sự nhầm lẫn giữa bệnh nhân và nhà cung cấp dịch vụ chăm sóc sức khỏe.
Vào tháng 3 năm 2022, CHMP đã thông qua ý kiến tích cực, khuyến nghị cấp giấy phép lưu hành cho sản phẩm thuốc Evusheld, nhằm mục đích dự phòng trước phơi nhiễm với COVID-19 ở người lớn và thanh thiếu niên từ 12 tuổi trở lên nặng ít nhất 40 kg. Kể từ đó, nó đã được chấp thuận để sử dụng ở Vương quốc Anh và ở Liên minh Châu Âu.
Tại Việt Nam
Vào ngày 2/3/2022, Cục quản lý dược (Bộ Y tế) đã căn cứ các quy định hiện hành để cấp Giấy phép nhập khẩu thuốc Evusheld đáp ứng nhu cầu điều trị đặc biệt của cơ sở khám chữa bệnh.
Evusheld hiện được Bộ Y tế cấp phép cho hệ thống Bệnh viện Tâm Anh nhập khẩu và sử dụng thông qua sự phân phối của Công ty vắc-xin Việt Nam (VNVC) và Công ty AstraZeneca. Người bệnh phải được cơ sở khám chữa bệnh thông tin về tình trạng hồ sơ cấp phép của thuốc và cơ sở chỉ được sử dụng thuốc khi có sự đồng ý của bệnh nhân hoặc người nhà của bệnh nhân.
Tài liệu tham khảo
- 1.US Food and Drug Administration. Fact sheet for healthcare providers: emergency use authorization for evusheld (tixagevimab co-packaged with cilgavimab). truy cập ngày 29 tháng 3 năm 2022.
- 2. AstraZeneca news release. AZD7442 PROVENT Phase III prophylaxis trial met primary endpoint in preventing COVID-19. truy cập ngày 29 tháng 3 năm 2022.
- 3.AstraZeneca news release. New analyses of two AZD7442 COVID-19 trials in high-risk populations confirm robust efficacy and long-term prevention. truy cập ngày 29 tháng 3 năm 2022.
- 4. Dejnirattisai W, et al. SARS-CoV-2 Omicron-B.1.1.529 leads to widespread escape from neutralizing antibody responses. Cell. 2022;185(3):467-484.e15
- 5. VanBlargan LA, et al. An infectious SARS-CoV-2 B.1.1.529 Omicron virus escapes neutralization by therapeutic monoclonal antibodies. Nature Medicine. 2022; 28:490-495
- 6. Case, J et al. Resilience of S309 and AZD7442 monoclonal antibody treatments against infection by SARS-CoV-2 Omicron lineage strains. truy cập ngày 29 tháng 3 năm 2022.
- 7. COVID CG. (2022). GISAID. truy cập ngày 29 tháng 3 năm 2022.
- 8. Centers for Disease Control and Prevention. Altered Immunocompetence. General Best Practice Guideline for Immunization: Best Practices Guidance of the Advisory Committee on Immunization Practices. truy cập ngày 29 tháng 3 năm 2022.
- 9. Boyarsky BJ, et al. Immunogenicity of a single dose of SARS-CoV-2 messenger RNA vaccine in solid organ transplant recipients. JAMA. 2021; 325 (17):1784-1786.
- 10. Rabinowich L, et al. Low immunogenicity to SARS-CoV-2 vaccination among liver transplant recipients. J Hepatol. 2021; 75(2):435-438.
- 11. Simon D, et al. SARS-CoV-2 vaccination responses in untreated, conventionally treated and anticytokine-treated patients with immune-mediated inflammatory diseases. Ann Rheum Dis. 2021; 80(10):1312–1316.
- 12. Centers of Disease Control and Prevention. Risk Factors of Exposure to COVID-19: Racial and Ethnic Health Disparities.truy cập ngày 29 tháng 3 năm 2022.
- 13. AstraZeneca news release. Evusheld reduced risk of developing severe COVID-19 or death in TACKLE Phase III outpatient treatment trial. truy cập ngày 29 tháng 3 năm 2022..
