Entecavir
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
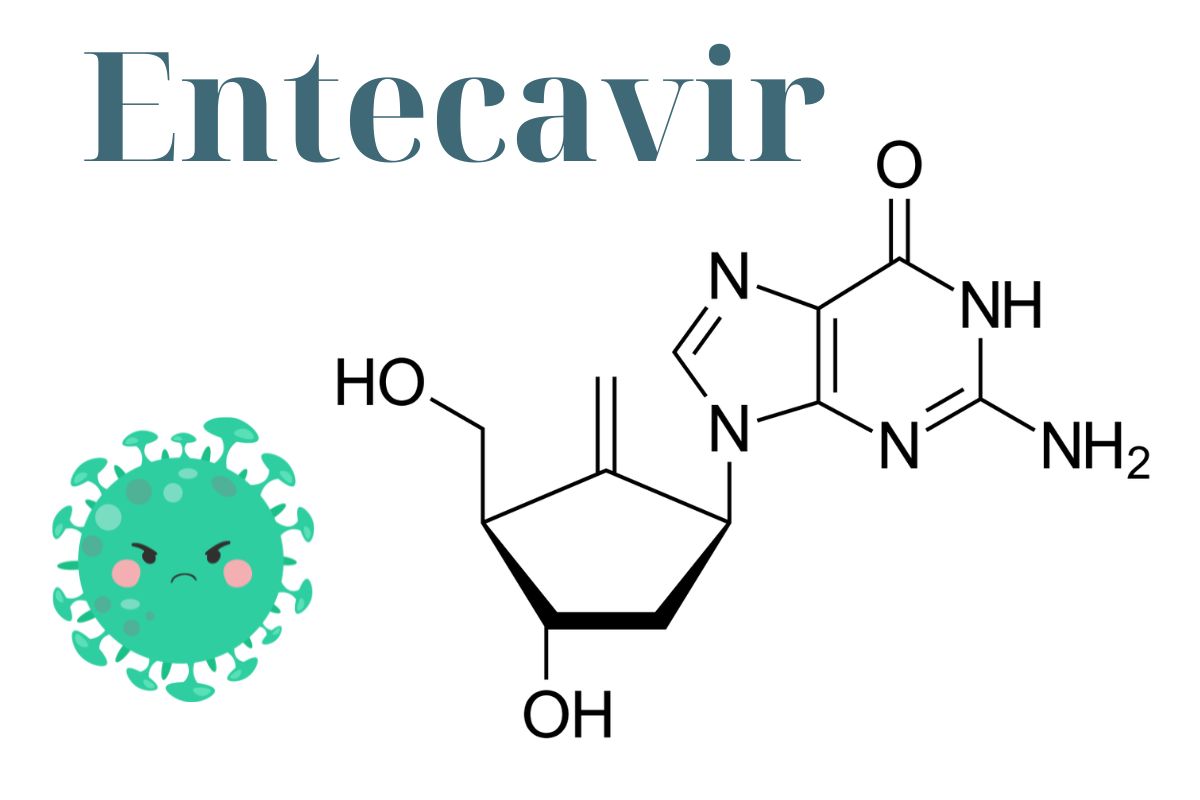
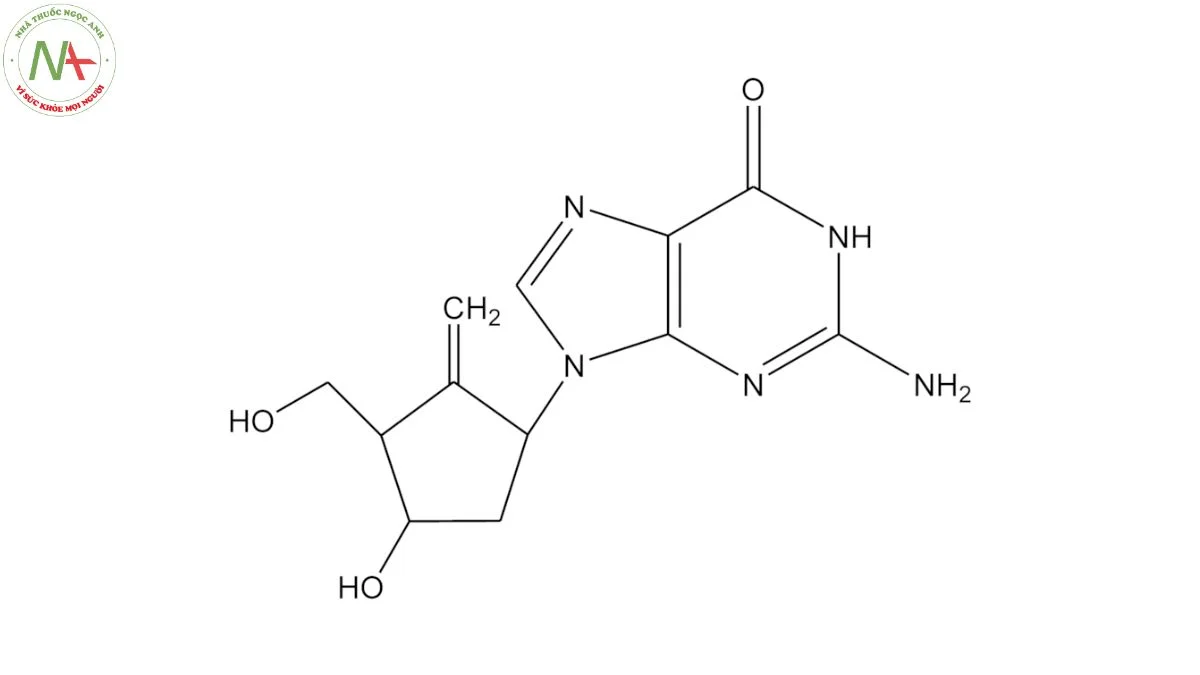
2-amino-9-[(1S,3R,4S)-4-hydroxy-3-(hydroxymethyl)-2-methylidenecyclopentyl]-1H-purin-6-one
Nhóm thuốc
Thuốc kháng retrovirus, có tác dụng chống virus viêm gan B ở người (HBV)
Mã ATC
J – Kháng khuẩn tác dụng toàn thân
J05 – Thuốc chống Virus dùng toàn thân
J05A – Thuốc chống Virus trực tiếp
J05AF – Các chất ức chế Enzym phiên mã ngược Nucleosid
J05AF10 – Entecavir
Mã UNII
NNU2O4609D
Mã CAS
142217-69-4
Cấu trúc phân tử
Công thức phân tử
C12H15N5O3
Phân tử lượng
277.28 g/mol
Cấu trúc phân tử
Entecavir là guanine được thay thế ở vị trí số 9 bằng nhóm 4-hydroxy-3-(hydroxymethyl)-2-methylidenecyclopentyl.
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 5
Số liên kết có thể xoay: 2
Diện tích bề mặt tôpô: 126Ų
Số lượng nguyên tử nặng: 20
Các tính chất đặc trưng
Tỷ trọng riêng: 1.8±0.1 g/cm3
Độ pH: 7.9
Độ tan trong nước: 2.4 mg/mL ở pH 7.9, 25 °C
Hằng số phân ly pKa: 8.00
Chu kì bán hủy: 24 giờ
Khả năng liên kết với Protein huyết tương: 13%
Dạng bào chế
Viên bao phim Entecavir 0,5mg và 1 mg.
Dung dịch uống thườngl (pha sẵn để dùng): liều entecavir cho trẻ em là 0,05 mg/ml.

Độ ổn định và điều kiện bảo quản
Bảo quản trong bao bì kín, ở nhiệt độ không quá 30 °C, tránh ánh sáng. Dung dịch uống sau khi mở lọ, dung dịch có thể dùng tới thời hạn hết hạn ghi trên lọ.
Dung dịch uống không được hòa vào nước, các dung môi khác hoặc với các thuốc khác.
Nguồn gốc
Entecavir là một loại thuốc được sử dụng để điều trị viêm gan B mạn tính (chronic hepatitis B). Entecavir được phát triển bởi hãng dược phẩm Bristol-Myers Squibb (nay đã sáp nhập với công ty pharma Celgene Corporation vào năm 2019 và trở thành một phần của Bristol Myers Squibb). Thuốc này đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) chấp thuận cho việc điều trị viêm gan B mạn tính vào năm 2005.
Dược lý và cơ chế hoạt động
Entecavir là một loại thuốc tổng hợp có xuất phát từ guanin, thuộc nhóm nucleosid purin, và đã được phát triển với mục tiêu kháng lại virus viêm gan B (HBV) ở con người. Entecavir cơ chế hoạt động bắt đầu khi nó được tác động bởi các enzym trong tế bào, dẫn đến sự phosphoryl hóa và tạo thành entecavir triphosphat – một dạng có hoạt tính sinh học quan trọng.
Entecavir triphosphat hoạt động bằng cách canh tranh với một loại chất tự nhiên trong tế bào, được gọi là deoxyguanosin triphosphat, mà virus HBV sử dụng để sao chép và nhân đôi DNA của nó. Bằng cách cản trở sự tương tác này, entecavir triphosphat hiệu quả ức chế hoạt động của enzyme gọi là DNA polymerase (enzym phiên mã ngược) của virus HBV.
Do đó, entecavir không chỉ ngăn chặn sự phát triển và nhân đôi của virus HBV, mà còn tạo ra một rào cản cho tất cả các giai đoạn của quá trình biểu đạo gene của virus. Điều này giúp kiểm soát sự lây lan của virus và giảm tình trạng viêm nhiễm gan, đặc biệt là trong điều trị viêm gan B mạn tính.
Phổ tác dụng
Entecavir thể hiện khả năng chống lại virus viêm gan B (HBV) cả trong điều kiện in vitro và in vivo, bao gồm cả các biến thể của HBV mà có khả năng chống lại lamivudin. Ngoài ra, thuốc này đã được nghiên cứu về khả năng ức chế một số virus ở con người trong điều kiện in vitro, bao gồm virus Herpes simplex typ 1 và 2 (HSV-1 và HSV-2), virus Varicella zoster và cytomegalovirus. Tuy nhiên, trong thực tế lâm sàng, entecavir không thể hiện hiệu quả đáng kể đối với các loại virus này.
Entecavir cũng có tác dụng đối với virus HIV-1, tuy nhiên, nồng độ entecavir cần thiết để ức chế sao chép virus HIV-1 là khá cao (được đo bằng EC50 – nồng độ cần thiết để ức chế virus 50%), dao động từ 0,026 đến hơn 10 microM. Điều này ngụ ý rằng entecavir không phải là một lựa chọn hiệu quả chính trong việc điều trị HIV-1, và do đó, không được sử dụng rộng rãi cho mục đích này trong lâm sàng.
Kháng thuốc
Trong quá trình điều trị kéo dài cho một số bệnh nhân, có dấu hiệu cho thấy virus viêm gan B (HBV) có thể trở nên kháng cự entecavir. Đối với những bệnh nhân chưa từng sử dụng thuốc nucleosid trước đó và được điều trị bằng entecavir trong suốt 96 tuần, tình trạng kháng thuốc xuất hiện ở ít hơn 1% số bệnh nhân.
Tuy nhiên, đối với những người bệnh đã phản ứng kháng lamivudin, sự tái phát của virus viêm gan B do kháng entecavir đã được báo cáo ở 1% trong năm đầu điều trị và 9% trong năm thứ hai điều trị.
Kháng entecavir diễn ra qua hai giai đoạn. Ban đầu, có sự đột biến ở vị trí M204V/I, sau đó là sự thay đổi amino acid ở vị trí rtI169, rtT184, stS202, hoặc rtM250.
Ngoài ra, đã ghi nhận sự kháng thuốc chéo giữa entecavir và một số loại thuốc nucleosid tương tự có tác dụng chống lại HBV. Cụ thể, HBV kháng lamivudin và kháng telbivudin đã cho thấy sự giảm nhạy cảm với entecavir trong điều kiện nghiên cứu in vitro. Tuy nhiên, HBV kháng adenofir vẫn duy trì độ nhạy cảm với entecavir trong môi trường in vitro.
Entecavir có khả năng ức chế virus viêm gan B, bao gồm cả các biến thể kháng lamivudin và adefovir.
Cần lưu ý rằng hiện nay, các phương pháp điều trị viêm gan B mạn tính như entecavir, adefovir, lamivudin, telbivudin, tenofovir, interferon alfa, peginterferon alfa chỉ có tác dụng ức chế sự phát triển của virus mà không loại bỏ hoàn toàn HBV.
Do đó, quyết định về thời điểm bắt đầu điều trị cần xem xét nhiều yếu tố như tuổi tác của bệnh nhân, mức độ tổn thương gan, khả năng đáp ứng với điều trị, tiềm năng xuất hiện của chủng HBV kháng thuốc, tác dụng phụ, các biến chứng và nồng độ DNA-HBV trong huyết thanh. Mục tiêu chính của điều trị kéo dài là ngăn chặn sự phát triển của xơ gan, suy gan, và nguy cơ bệnh ung thư gan.
Ứng dụng trong y học
Ứng dụng chính của entecavir là trong điều trị viêm gan B mạn tính. Viêm gan B mạn tính có thể gây ra tổn thương nghiêm trọng cho gan và dẫn đến biến chứng nguy hiểm như xơ gan và ung thư gan. Entecavir hoạt động bằng cách ức chế sao chép và nhân đôi virus HBV trong cơ thể, giúp kiểm soát lây lan virus và ngăn chặn sự phát triển của bệnh.
Bệnh viêm gan B mạn tính tăng nguy cơ mắc ung thư gan, đặc biệt là ung thư biểu mô gan (hepatocellular carcinoma). Sử dụng entecavir có thể giảm nguy cơ này bằng cách kiểm soát sự phát triển của virus và giảm viêm nhiễm gan, đồng thời cải thiện tình trạng chức năng gan.
Entecavir cũng có thể được sử dụng để ngăn chặn lây truyền viêm gan B từ người sang người, đặc biệt trong các trường hợp có nguy cơ cao như trong các môi trường chăm sóc sức khỏe hoặc trong gia đình có người bị nhiễm HBV.
Entecavir cũng có thể được sử dụng trong điều trị viêm gan B ở người nhiễm HIV, một nhóm bệnh nhân đặc biệt nhạy cảm với viêm gan B. Thuốc này có thể được kết hợp với các loại thuốc khác để đảm bảo hiệu quả điều trị.
Entecavir vẫn đang được nghiên cứu để xem xét khả năng ứng dụng trong các lĩnh vực khác của y học, bao gồm điều trị các bệnh lý khác liên quan đến virus HBV và một số bệnh khác liên quan đến gan.
Dược động học
Hấp thu
Entecavir có quá trình hấp thu nhanh chóng sau khi được uống. Nồng độ cao nhất trong huyết thanh (Cmax) thường đạt được trong khoảng từ 30 đến 90 phút sau khi dùng một liều và sau 6 đến 10 ngày điều trị, nồng độ này sẽ ổn định.
Trong trường hợp người khỏe mạnh, sau khi uống một liều 0,5 mg, Cmax đạt khoảng 4,2 nanogam/ml, trong khi uống liều 1 mg, Cmax đạt khoảng 8,2 nanogam/ml.
Với một liều mỗi ngày, entecavir có nửa đời trong huyết thanh khoảng 24 giờ. Tuy nhiên, việc ăn uống có thể làm chậm và giảm quá trình hấp thu của thuốc. Do đó, để đảm bảo hiệu suất tốt nhất, entecavir cần phải được uống khi đói (ít nhất là 2 giờ sau hoặc 2 giờ trước bữa ăn).
Phân bố
Thể tích phân bố biểu kiến ước tính cho thấy entecavir lan rộng khắp toàn bộ nước cơ thể, cho thấy rằng thuốc phân tán đều trong các mô trong cơ thể. Thuốc viên và dung dịch uống entecavir có khả năng thay thế lẫn nhau. Khoảng 13% entecavir kết dính vào các protein trong huyết thanh trong điều kiện in vitro.
Chuyển hóa và thải trừ
Entecavir không chịu tác động từ hệ thống enzyme cytochrom P450 trong cơ thể. Thuốc chủ yếu được loại trừ qua thận thông qua quá trình lọc cầu thận và bài tiết tích cực qua ống thận. Nửa đời loại trừ cuối cùng của entecavir dao động từ 128 đến 149 giờ. Một phần nhỏ của thuốc được chuyển hóa thành các hợp chất glucuronid và sulfat. Có khả năng rằng một phần nhỏ của entecavir có thể được loại bỏ qua quá trình thanh lọc máu.
Độc tính ở người
Thông tin về tình trạng quá liều của entecavir hiện còn hạn chế. Có những trường hợp người dùng đã sử dụng 20 mg/ngày trong 14 ngày hoặc một liều 40 mg mà không ghi nhận được bất kỳ triệu chứng nhiễm độc nào. Tuy nhiên, khi xảy ra tình trạng quá liều, cần phải theo dõi sự tiến triển và hỗ trợ xử trí phù hợp.
Tính an toàn
Tính an toàn của việc sử dụng entecavir trong thai kỳ chưa được xác định. Thêm vào đó, chưa có dữ liệu nào về tác động của entecavir đối với việc lây truyền viêm gan B từ mẹ sang con. Vì vậy, đối với trường hợp thai phụ nhiễm HBV, khuyến nghị sử dụng chương trình tiêm chủng phối hợp bao gồm vắc-xin viêm gan B và globulin miễn dịch viêm gan B (HBIG) cho trẻ mới sinh.
Về việc entecavir có chuyển vào sữa mẹ hay không, thông tin hiện chưa rõ ràng. Do đó, trong trường hợp cho con bú và cần sử dụng entecavir, quyết định nên ngừng cho con bú hay tiếp tục sử dụng thuốc cần dựa vào tầm quan trọng của thuốc đối với sức khỏe của mẹ.
Tương tác với thuốc khác
Hiện chưa có thông tin về bất kỳ tương tác nào mà cần cảnh báo tránh sử dụng đồng thời với entecavir. Tuy nhiên, entecavir có thể tương tác với một số thuốc khác như ganciclovir, valganciclovir, và ribavirin, dẫn đến tăng hàm lượng và tác dụng của entecavir.
Entecavir không phải là một cơ chất và không ảnh hưởng đến hoặc bị ảnh hưởng bởi các isoenzyme cytochrome P450 (CYP). Khả năng tương tác dược động với các thuốc chuyển hóa bởi các isoenzyme CYP là ít.
Đối với các thuốc có tác động đến chức năng thận hoặc được đào thải qua thận, có khả năng tương tác với entecavir. Điều này có thể dẫn đến tăng nồng độ huyết thanh của entecavir hoặc thuốc kết hợp, và cần phải theo dõi tình trạng này để ngăn ngừa các tác dụng phụ không mong muốn.
Đối với adefovir, lamivudin, tenofovir disoproxil, không có tương tác dược động được xác định.
Về thuốc ức chế miễn dịch, có khả năng tương tác với entecavir, đặc biệt là khi sử dụng cùng với cyclosporine, tacrolimus hoặc các thuốc ức chế miễn dịch khác có thể ảnh hưởng đến chức năng thận. Do đó, cần phải theo dõi chức năng thận khi điều trị entecavir ở các bệnh nhân sử dụng các loại thuốc này.
Về các thuốc ức chế enzym phiên mã ngược nucleosid và nucleosid, không có tương tác dược động được xác định với lamivudin hoặc tenofovir disoproxil fumarate.
Lưu ý khi sử dụng Entecavir
Theo dõi nồng độ huyết thanh ALAT: Trong quá trình điều trị, viêm gan B có thể chuyển từ dạng tự phát sang trạng thái nặng hơn, thường được biểu hiện qua sự tăng nhất thời của nồng độ huyết thanh ALAT. Một số người bệnh đã điều trị bằng entecavir trải qua giai đoạn nặng lên, thường xảy ra khoảng 4 đến 5 tuần sau khi bắt đầu điều trị. Trong trường hợp bệnh nhân có bệnh gan còn bù, tăng nồng độ huyết thanh ALAT thường không đi kèm với sự tăng bilirubin huyết. Tuy nhiên, nếu người bệnh đã từng có xơ gan, có nguy cơ cao bệnh gan mất bù khi bệnh nặng lên. Do đó, quá trình điều trị cần được theo dõi chặt chẽ về mặt lâm sàng và sinh hóa.
Nồng độ huyết thanh DNA của HBV: Nồng độ huyết thanh DNA của HBV có thể giảm khi bắt đầu điều trị, mặc dù nồng độ huyết thanh ALAT tăng. Sau khi ngừng điều trị bằng entecavir, một số trường hợp đã trải qua giai đoạn nặng lên, thường xảy ra trong khoảng 23 đến 24 tuần sau khi ngừng điều trị. Do đó, cần theo dõi gan của bệnh nhân và thực hiện xét nghiệm gợi ý ít nhất 6 tháng sau khi ngừng điều trị và điều trị lại nếu cần thiết.
Gan mất bù: Đối với người bệnh có gan mất bù, cần phải đề phòng các biến chứng có thể xảy ra, bao gồm cả nguy cơ nhiễm toan acid lactic.
Nghiên cứu HIV và chống HIV: Trước khi bắt đầu điều trị bằng entecavir, cần phải kiểm tra HIV. Điều này quan trọng vì việc sử dụng entecavir ở người nhiễm HIV có thể gây ra sự xuất hiện của các chủng HIV kháng các thuốc nucleosid ức chế enzym phiên mã ngược (NRTI). Do đó, không nên sử dụng entecavir để điều trị viêm gan B ở người bệnh nhiễm HIV.
Nguy cơ nhiễm toan acid lactic: Entecavir có thể gây ra nguy cơ nhiễm toan acid lactic, đặc biệt là ở những người dùng duy nhất các thuốc tương tự nucleosid hoặc kết hợp với các thuốc kháng virus khác. Đa số trường hợp xảy ra ở phụ nữ, đặc biệt là những người béo phì và điều trị lâu dài bằng các thuốc nucleosid ức chế enzym phiên mã ngược. Cần thận trọng đặc biệt đối với người được biết có nguy cơ cao về bệnh gan, nhưng nhiễm toan acid lactic, gan to nhiều và nhiễm mỡ gan đã xảy ra ở người không có nguy cơ nào được biết. Nếu bất kỳ bệnh nhân nào có dấu hiệu lâm sàng hoặc xét nghiệm gợi ý nhiễm toan acid lactic hoặc gan bị tổn thương nặng, thậm chí khi transaminase không tăng, cần phải ngừng ngay entecavir.
Người ghép gan: Hiện chưa có thông tin đáng tin cậy về độ an toàn và hiệu quả của entecavir đối với người ghép gan. Nếu cần sử dụng entecavir cho người ghép gan đã hoặc đang sử dụng các thuốc ức chế miễn dịch có thể tác động đến chức năng thận như cyclosporin, tacrolimus, cần giám sát cẩn thận chức năng thận trước và trong khi điều trị entecavir.
Người cao tuổi: Cần lưu ý rằng người cao tuổi (65 tuổi trở lên) có thể có đáp ứng khác với entecavir so với người trẻ tuổi. Vì entecavir chủ yếu được đào thải qua thận, nguy cơ nhiễm độc do entecavir có thể tăng ở người suy thận. Do đó, cần điều chỉnh liều dựa trên mức độ suy thận và theo dõi chức năng thận.
Dự phòng lây truyền virus: Entecavir không làm giảm nguy cơ lây truyền virus sang người khác, do đó, các biện pháp dự phòng truyền bệnh vẫn cần được thực hiện.
Một vài nghiên cứu của Entecavir trong Y học
Tác dụng của Tenofovir so với Entecavir đối với nguy cơ ung thư biểu mô tế bào gan ở bệnh nhân nhiễm HBV mạn tính
Bối cảnh & mục đích: Tenofovir disoproxil fumarate (TDF) và entecavir được khuyến cáo là phương pháp điều trị đầu tay đối với nhiễm virus viêm gan B mãn tính (HBV). Tuy nhiên, vẫn còn tranh cãi về hiệu quả so sánh của các loại thuốc này trong việc ngăn ngừa ung thư biểu mô tế bào gan (HCC).
Chúng tôi đã thực hiện đánh giá hệ thống và phân tích tổng hợp về hiệu quả của TDF so với entecavir trong việc giảm tỷ lệ mắc ung thư biểu mô tế bào gan ở những bệnh nhân nhiễm HBV mạn tính.
Phương pháp: Chúng tôi đã thực hiện đánh giá có hệ thống về MEDLINE, EMBASE, Web of Science và Thư viện Cochrane từ năm 2010 đến năm 2019 đối với các bài báo toàn văn và tóm tắt hội nghị về các nghiên cứu về tác dụng của TDF so với entecavir ở bệnh nhân nhiễm HBV.
Dữ liệu trích xuất được phân tích với mô hình hiệu ứng ngẫu nhiên. Các nguồn không đồng nhất tiềm năng đã được nghiên cứu bằng cách sử dụng các phân tích độ nhạy, hồi quy tổng hợp và phân nhóm.
Kết quả: Phân tích cuối cùng của chúng tôi bao gồm 15 nghiên cứu (61.787 bệnh nhân; 16.101 bệnh nhân dùng TDF và 45.686 bệnh nhân dùng entecavir).
Điều trị TDF có liên quan đến nguy cơ mắc ung thư biểu mô tế bào gan thấp hơn đáng kể so với entecavir (tỷ lệ rủi ro, 0,80; KTC 95%, 0,69-0,93; P = 0,003; I2 = 13%). Nguy cơ mắc ung thư biểu mô tế bào gan thấp hơn ở những bệnh nhân dùng TDF so với entecavir vẫn tồn tại trong các phân tích độ nhạy và nhóm nhỏ được thực hiện với các nhóm thuần tập có điểm xu hướng phù hợp và các nhóm nhỏ xơ gan.
Việc đưa bệnh nhân xơ gan mất bù vào và cỡ mẫu là những yếu tố có ảnh hưởng lớn nhất đến tính không đồng nhất giữa các nghiên cứu trong phân tích hồi quy tổng hợp. Các phân tích dưới nhóm tiếp theo cho thấy không có sự khác biệt thống kê về tỷ lệ tử vong hoặc ghép tạng (tỷ lệ rủi ro, 0,93; KTC 95%, 0,73-1,17; P = 0,519; I2 = 6%) giữa các bệnh nhân dùng TDF so với entecavir.
Kết luận: Trong một phân tích tổng hợp các nghiên cứu trên bệnh nhân nhiễm HBV mạn tính, chúng tôi thấy rằng điều trị TDF có liên quan đến nguy cơ mắc ung thư biểu mô tế bào gan thấp hơn đáng kể (20%) so với điều trị bằng entecavir. Các thử nghiệm ngẫu nhiên là cần thiết để hỗ trợ phát hiện này.
Tài liệu tham khảo
- Choi, W. M., Choi, J., & Lim, Y. S. (2021). Effects of Tenofovir vs Entecavir on Risk of Hepatocellular Carcinoma in Patients With Chronic HBV Infection: A Systematic Review and Meta-analysis. Clinical gastroenterology and hepatology : the official clinical practice journal of the American Gastroenterological Association, 19(2), 246–258.e9. https://doi.org/10.1016/j.cgh.2020.05.008
- Drugbank, Entecavir, truy cập ngày 8 tháng 9 năm 2023.
- Pubchem, Entecavir, truy cập ngày 8 tháng 9 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Xuất xứ: Cyprus
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Mỹ
Xuất xứ: Việt Nam
Xuất xứ: Bangladesh
Xuất xứ: Canada
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Bangladesh
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam