Deferasirox
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
Axit benzoic 4-[3,5-bis(2-hydroxyphenyl)-1,2,4-triazol-1-yl]
Nhóm thuốc
Chất chelat hóa sắt
Mã ATC
V – Khác nhau
V03 – Tất cả các sản phẩm trị liệu khác
V03A – Tất cả các sản phẩm trị liệu khác
V03AC – Chất chelat hóa sắt
V03AC03 – Deferasirox
Mã UNII
V8G4MOF2V9
Mã CAS
201530-41-8
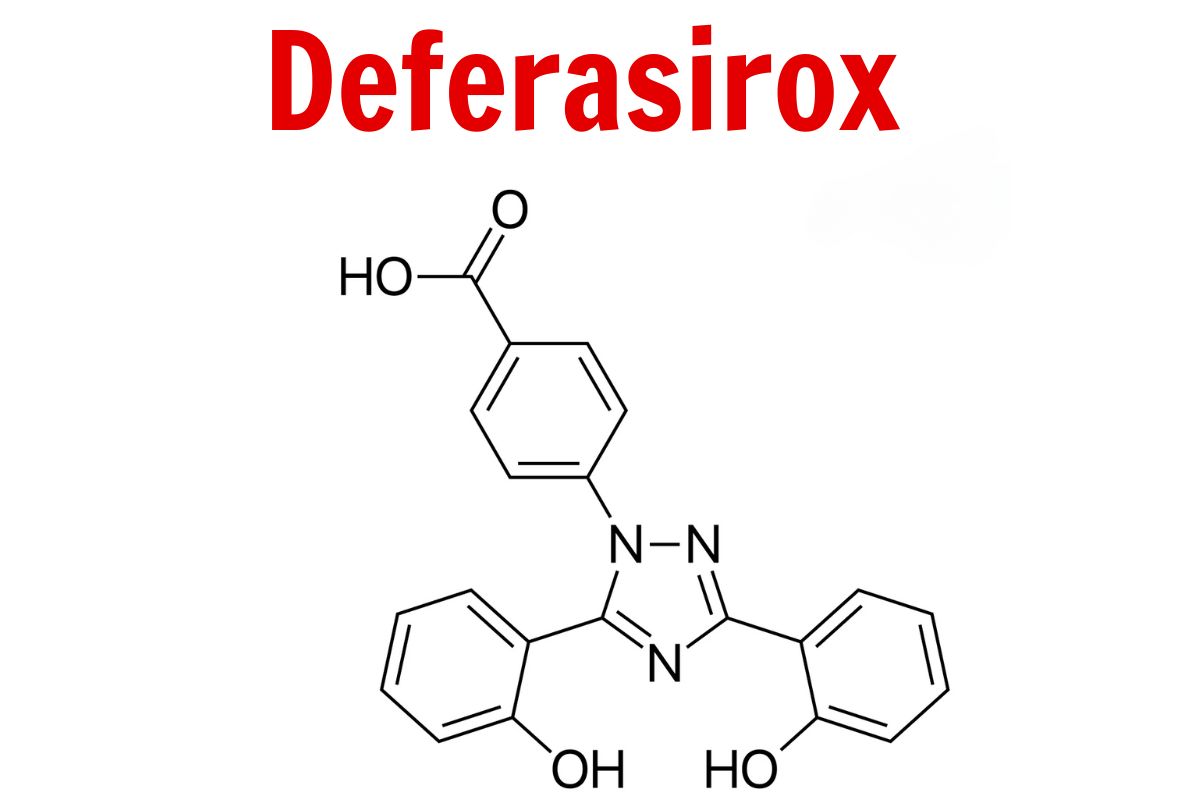
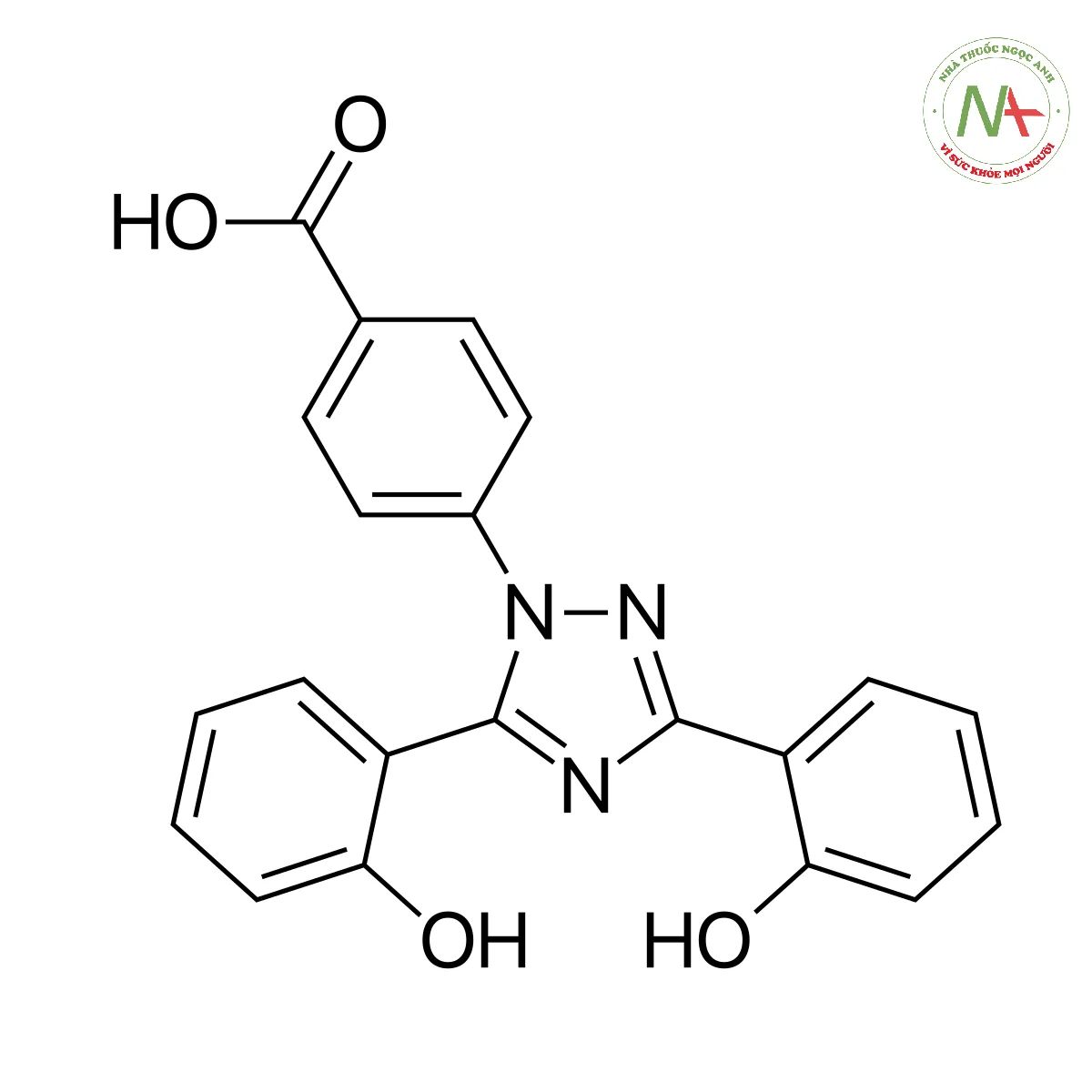
Cấu trúc phân tử
Công thức phân tử
C21H15N3O4
Phân tử lượng
373.4 g/mol
Cấu trúc phân tử
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 6
Số liên kết có thể xoay: 4
Diện tích bề mặt cực tôpô: 109
Liên kết cộng hóa trị: 1
Tính chất
Chất rắn hoặc tinh thể từ ethanol. Bột màu trắng đến hơi vàng
Điểm nóng chảy 116-117°C
Dạng bào chế
Viên nén bao phim: Deferasirox 360mg, Deferasirox 180mg, Deferasirox 250mg,…
Viên nén phân tán: Deferasirox 500mg,…

Dược lý và cơ chế hoạt động
Deferasirox là thuốc thải sắt có hoạt tính dùng đường uống có tính chọn lọc đối với sắt (dưới dạng Fe3+). Nó là phối tử đinh ba liên kết sắt với ái lực cao theo tỷ lệ 2:1. Mặc dù deferasirox có ái lực rất thấp với kẽm và đồng nhưng nồng độ trong huyết thanh của các kim loại vi lượng này có sự giảm khác nhau sau khi dùng deferasirox.
Dược động học
Hấp thu
Sinh khả dụng tuyệt đối (AUC) của viên deferasirox hỗn dịch uống là 70% so với liều tiêm tĩnh mạch. Exjade được hấp thu sau khi uống với thời gian trung bình để đạt được nồng độ tối đa trong huyết tương (tmax) là khoảng 1,5-4 giờ. Cmax và AUC của deferasirox tăng gần như tuyến tính theo liều dùng sau khi dùng liều đơn và trong điều kiện ổn định. Sự tiếp xúc với deferasirox tăng lên với hệ số tích lũy là 1,3-2,3 sau nhiều liều. Sinh khả dụng tuyệt đối (AUC) của viên deferasirox hỗn dịch uống là 70% so với liều tiêm tĩnh mạch. Sinh khả dụng (AUC) của deferasirox tăng lên đáng kể khi dùng trong bữa ăn.Nghiên cứu hiện tại đã đánh giá sinh khả dụng tuyệt đối của một liều duy nhất 375 mg deferasirox uống dưới dạng viên nén so với deferasirox truyền tĩnh mạch 130 mg. Vì đây là nghiên cứu đầu tiên trên người sử dụng công thức deferasirox tiêm tĩnh mạch (IV), nên tính an toàn và khả năng dung nạp của công thức tiêm tĩnh mạch đã được đánh giá trong giai đoạn thí điểm với liều thấp hơn (65 mg) ở 3 đối tượng trước giai đoạn chính. Giai đoạn nghiên cứu chính bao gồm 17 tình nguyện viên nam khỏe mạnh. Nồng độ deferasirox trong huyết tương được đo sau mỗi lần điều trị và các thông số dược động học bao gồm sinh khả dụng tuyệt đối qua đường uống cũng được xác định. Sinh khả dụng tuyệt đối qua đường uống của viên deferasirox là 70% (khoảng tin cậy 90%, 62%-80%). Deferasirox được đặc trưng là có độ thanh thải huyết tương thấp ở mức 3,53 (+/- 0,87) L/giờ.
Ảnh hưởng của thức ăn và thời gian ăn đến dược động học của deferasirox đã được nghiên cứu ở những người tình nguyện khỏe mạnh và bệnh nhân mắc bệnh hemosiderosis do truyền máu. Tương đương sinh học của một liều uống deferasirox (20 mg/kg) được đánh giá sau khi dùng trước bữa sáng tiêu chuẩn hoặc giàu chất béo hoặc đồng thời với bữa sáng tiêu chuẩn so với tình trạng nhịn ăn ở những người tình nguyện khỏe mạnh. Sinh khả dụng của deferasirox được xác định sau khi bệnh nhân uống một liều duy nhất (20 mg/kg) trong điều kiện lúc đói và lúc đói. Những dữ liệu này cho thấy loại thức ăn, hàm lượng calo và hàm lượng chất béo trong bữa ăn ảnh hưởng đến sinh khả dụng của deferasirox khi dùng đồng thời. Ngược lại, điều này không xảy ra khi dùng deferasirox ít nhất 30 phút trước bữa ăn. Tóm lại là, khuyến cáo nên dùng deferasirox ít nhất 30 phút trước bữa ăn. Khi điều này không khả thi, nên dùng deferasirox một cách nhất quán vào cùng thời điểm trước bữa ăn để hạn chế các nguồn gây biến đổi ảnh hưởng đến sự hấp thu.
Chuyển hóa
Sự chuyển hóa deferasirox được xúc tác bởi CYP450 (oxy hóa) dường như rất ít ở người (khoảng 8%).
Phân bố
Deferasirox hầu như chỉ gắn với albumin huyết thanh với tỷ lệ cao (khoảng 99%) là protein. Tỷ lệ deferasirox giới hạn trong tế bào máu ở người là 5%. Thể tích phân bố ở trạng thái ổn định (Vss) của deferasirox là 14,37 +/- 2,69 L ở người lớn.
Thải trừ
Thời gian bán hủy trung bình của Deferasirox từ 8 – 16 giờ sau khi uống.
Ứng dụng trong y học
Deferasirox (Exjade) là thuốc thải sắt dùng đường uống, dùng một lần mỗi ngày, được phê duyệt rộng rãi để điều trị tình trạng quá tải sắt mạn tính do truyền máu. Tại EU, deferasirox được chỉ định ở những bệnh nhân mắc bệnh beta-thalassemia thể nặng > hoặc = 6 tuổi và ở Hoa Kỳ, ở tất cả các bệnh nhân quá tải sắt mạn tính do truyền máu > hoặc = 2 tuổi. Deferasirox có tính chọn lọc cao đối với sắt ở dạng Fe3+. Trong các thử nghiệm lâm sàng kéo dài khoảng 1 năm trên những bệnh nhân bị quá tải sắt mãn tính do truyền máu liên quan đến beta-thalassemia, bệnh hồng cầu hình liềm, hội chứng rối loạn sinh tủy hoặc các bệnh thiếu máu mãn tính hiếm gặp khác, deferasirox 20 hoặc 30 mg/kg/ngày có tác dụng có lợi đối với nồng độ sắt trong gan ( LIC) và nồng độ ferritin huyết thanh; các vấn đề về dung nạp có thể kiểm soát được trên lâm sàng bằng cách theo dõi bệnh nhân thường xuyên. Mặc dù cần có dữ liệu về hiệu quả và khả năng dung nạp lâu dài
Tác dụng phụ
Deferasirox có thể gây ra tác dụng phụ vấn đề về thị giác hoặc thính giác; nước tiểu sẫm màu, vấn đề về gan – buồn nôn, sưng bàn chân hoặc mắt cá chân, cảm thấy mệt mỏi hoặc khó thở; vấn đề về thận – đi tiểu ít hoặc không đi tiểu,đau dạ dày trên, ngứa, dấu hiệu chảy máu dạ dày – phân có máu, cảm giác mệt mỏi, chán ăn số lượng tế bào máu thấp – sốt, ớn lạnh, da nhợt nhạt, dễ bầm tím, chảy máu bất thường, tay chân lạnh, cảm thấy nhẹ đầu, khó thở, lở miệng, lở da, , phân màu đất sét, vàng da; ho ra máu hoặc nôn mửa trông giống như bã cà phê.
Độc tính ở người
Trong các thử nghiệm lâm sàng lớn về deferasirox, nồng độ aminotransferase trong huyết thanh tăng trên 5 lần giới hạn trên của mức bình thường (ULN) xảy ra ở 6% bệnh nhân và dẫn đến phải ngừng thuốc ở 1% đến 2%. Ngoài ra, đã có một số báo cáo trường hợp riêng lẻ về tổn thương gan rõ ràng trên lâm sàng phát sinh trong quá trình điều trị bằng deferasirox, thường nghiêm trọng và đôi khi gây tử vong. Sự khởi phát của tổn thương gan cấp tính dao động từ vài ngày đến vài năm sau khi bắt đầu dùng deferasirox nhưng hầu hết các trường hợp xảy ra trong vòng 1 đến 3 tháng. Mô hình tổn thương gan thường là tế bào gan hoặc kết hợp với sự gia tăng rõ rệt nồng độ aminotransferase trong huyết thanh. Các đặc điểm miễn dịch dị ứng và tự miễn dịch không có. Sự phục hồi thường nhanh chóng sau khi ngừng dùng deferasirox, nhưng một số trường hợp có liên quan đến tổn thương gan tiến triển và suy gan.Tình trạng ứ sắt thường có bệnh gan tiềm ẩn, tổn thương tế bào gan cấp tính chồng lên có thể làm tăng nguy cơ suy gan cấp. Deferasirox có một khung cảnh báo liên quan đến nhiễm độc gan và nên theo dõi thường xuyên nồng độ bilirubin và aminotransferase trong huyết thanh.
Tương tác với thuốc khác
- Kết hợp deferasirox cùng với aspirin,celecoxib, có thể làm tăng nguy cơ bị loét và chảy máu đường tiêu hóa.
- Tenofovir có thể gây ra các vấn đề về thận và việc kết hợp nó với các loại thuốc khác cũng có thể ảnh hưởng đến thận như deferasirox có thể làm tăng nguy cơ đó.
- Deferasirox có thể làm giảm nồng độ trong máu và tác dụng của Diltiazem.
- Deferasirox có thể làm tăng nồng độ trong máu và tác dụng của acetaminophen
Lưu ý khi sử dụng
- Bạn không nên sử dụng deferasirox nếu bạn mắc bệnh thận hoặc gan nặng, ung thư giai đoạn nặng, rối loạn tế bào máu hoặc tủy xương hoặc lượng tiểu cầu trong máu thấp.
- Deferasirox có thể gây hại cho gan hoặc thận của bạn. Gọi cho bác sĩ ngay nếu bạn bị sưng, khó thở, đau bụng trên, chán ăn, đi tiểu ít hoặc không đi tiểu, nước tiểu sẫm màu, phân màu đất sét hoặc vàng da (vàng da hoặc mắt).
Một vài nghiên cứu của Deferasirox trong Y học
Nghiên cứu 1
Hiệu quả và an toàn của deferasirox, một thuốc thải sắt dạng uống, ở những bệnh nhân bị ứ sắt nặng do beta-thalassemia: nghiên cứu ESCALATOR

Mục tiêu: Nhiều bệnh nhân bị quá tải sắt do truyền máu có nguy cơ rối loạn chức năng cơ quan tiến triển và tử vong sớm và việc tuân thủ kém các liệu pháp thải sắt cũ được cho là yếu tố góp phần chính. Các nghiên cứu pha II/III đã chỉ ra rằng deferasirox đường uống 20-30 mg/kg/ngày làm giảm gánh nặng sắt, tùy thuộc vào lượng sắt đưa vào qua truyền máu.
Phương pháp: Nghiên cứu ESCALATOR tiến cứu, nhãn mở, kéo dài 1 năm ở Trung Đông được thiết kế để đánh giá deferasirox một lần mỗi ngày ở những bệnh nhân > hoặc = 2 tuổi mắc bệnh beta-thalassemia thể nặng và quá tải sắt, những người trước đây đã được thải sắt bằng deferoxamine và/hoặc deferipron. Hầu hết bệnh nhân bắt đầu điều trị bằng deferasirox 20 mg/kg/ngày; liều lượng được điều chỉnh để đáp ứng với các dấu hiệu thải sắt quá mức hoặc dưới mức. Tiêu chí chính là thành công của điều trị, được định nghĩa là giảm nồng độ sắt trong gan (LIC) > hoặc = 3 mg Fe/g trọng lượng khô (dw) nếu LIC ban đầu > hoặc = 10 mg Fe/g dw, hoặc LIC cuối cùng là 1-7 mg Fe/g dw đối với bệnh nhân có LIC ban đầu từ 2 đến <10 mg Fe/g dw.
Kết quả: Nhìn chung, 233/237 bệnh nhân đăng ký đã hoàn thành điều trị 1 năm. LIC ban đầu trung bình là 18,0 +/- 9,1 mg Fe/g dw, trong khi ferritin huyết thanh trung bình là 3356 ng/mL. Sau 1 năm điều trị bằng deferasirox, nhóm đối tượng có ý định điều trị có tỷ lệ điều trị thành công đáng kể là 57,0% (P = 0,016) và mức giảm LIC trung bình là 3,4 mg Fe/g dw. Những thay đổi về ferritin huyết thanh xuất hiện song song với việc tăng liều vào khoảng 24 tuần. Hầu hết bệnh nhân (78,1%) phải tăng liều trên 20 mg/kg/ngày, chủ yếu lên 30 mg/kg/ngày. Các tác dụng phụ liên quan đến thuốc hầu hết ở mức độ nhẹ đến trung bình và được giải quyết mà không cần ngừng điều trị.
Kết luận: Kết quả của nghiên cứu ESCALATOR ở những bệnh nhân chủ yếu bị ứ sắt nặng đã xác nhận những quan sát trước đây ở bệnh nhân mắc bệnh beta-thalassemia, nhấn mạnh tầm quan trọng của việc điều chỉnh liều deferasirox kịp thời dựa trên nồng độ ferritin huyết thanh và lượng sắt đưa vào qua đường truyền để đảm bảo bệnh nhân đạt được mục tiêu điều trị là duy trì hoặc giảm gánh nặng sắt.
Nghiên cứu 2
Hiệu quả và khả năng dung nạp của thuốc thải sắt qua đường uống, Deferasirox
Đặt vấn đề:Thalassemia thể nặng là thể nặng của bệnh β thalassemia đặc trưng bởi tình trạng thiếu máu nặng, gan lách to và các thay đổi ở mặt do tăng tan máu các hồng cầu khiếm khuyết. Trong tình trạng quá tải sắt, nồng độ sắt cao vượt quá khả năng vận chuyển sắt của transferrin trong huyết tương, dẫn đến sự hình thành dạng sắt không liên kết với transferrin. Những dạng sắt không liên kết với transferrin này có thể được đưa vào các tế bào, bao gồm tế bào gan, tim và nội tiết, dẫn đến tổn thương các cơ quan. Để ngăn ngừa các biến chứng liên quan đến bệnh hemosiderosis, liệu pháp thải sắt vẫn là một trong những mục tiêu chính trong quản lý lâm sàng đối với bệnh nhân mắc bệnh Thalassemia thể nặng.
Phương pháp: Ba mươi bảy bệnh nhân được tuyển chọn sử dụng kỹ thuật lấy mẫu thuận tiện không ngẫu nhiên sau khi có sự đồng ý bằng văn bản của bệnh nhân. Bệnh nhân từ 2-30 tuổi được ghi danh vào nghiên cứu này. Ferritin huyết thanh, ALT, Creatinine huyết thanh được kiểm tra khi bắt đầu nghiên cứu, 3 tháng, 6 tháng và sau đó là khi kết thúc nghiên cứu, tức là lúc 9 tháng kể từ khi bắt đầu nghiên cứu. Họ cũng được đánh giá về các tác dụng phụ khác liên quan đến khả năng dung nạp thuốc qua đường uống như nôn mửa, buồn nôn, khó chịu ở đường tiêu hóa, tiêu chảy, phàn nàn về tiết niệu hoặc bất kỳ phàn nàn chủ quan nào khác.
Kết quả: Trong 37 bệnh nhân có 20 bệnh nhân nam (54,1%) và 17 bệnh nhân nữ (45,9%). Tuổi trung bình của bệnh nhân là 10,2 tuổi (Tối thiểu 3 tuổi, Tối đa 21 tuổi). Ferritin huyết thanh trung bình lúc ban đầu được ghi nhận là 3440 và tăng sau khoảng thời gian 3 tháng, 6 tháng và 9 tháng với mức trung bình lần lượt là 3359, 3677 và 4394. Sau khoảng thời gian 9 tháng, khoảng tin cậy lớn nhất 95% của nồng độ Ferritin huyết thanh được quan sát thấy trong khoảng từ 3420,17 đến 5368,63. Trong nghiên cứu của chúng tôi, 17 bệnh nhân cần thải sắt thay thế (46%). Những bệnh nhân này cần Deferioxamine truyền tĩnh mạch vì xu hướng Ferritin huyết thanh tăng lên sau nghiên cứu.
Kết luận: Từ kết quả nghiên cứu của chúng tôi, chúng tôi suy ra rằng Deferasirox đường uống không phải là chất thải sắt hiệu quả. Nếu bệnh nhân đang dùng deferasirox đường uống, nên kiểm tra Ferritin huyết thanh của họ 3 tháng một lần. Thuốc chỉ có tác dụng duy trì nồng độ Ferritin huyết thanh ở mức dưới 1500ng/ml. Deferioxamine tiêm tĩnh mạch vẫn nên được ưu tiên hơn so với thải sắt qua đường uống để kiểm soát hiệu quả tình trạng quá tải sắt và các biến chứng của nó.Hiệu quả và khả năng dung nạp của thuốc thải sắt qua đường uống.
Tài liệu tham khảo
- Thư viện y học quốc gia, Deferasirox, pubchem. Truy cập ngày 05/09/2023.
- Amal El-Beshlawy, Mohsen S Elalfy, Kusai Al Zir, Shahina Daar, Dany Habr, Ulrike Kriemler-Krahn, Abdel Hmissi, Abdullah Al Jefri (2009), Efficacy and safety of deferasirox, an oral iron chelator, in heavily iron-overloaded patients with beta-thalassaemia: the ESCALATOR study,pubmed.com. Truy cập ngày 05/09/2023.
- Syed Ibrar Hussain, Huma Saleem Khan, Sumaira Khalil, Syed Zulfiqar Haider, Munir Akmal Lodhi (2021), Efficacy And Tolerability Of Oral Iron Chelator, Deferasirox, pubmed.com. Truy cập ngày 05/09/2023.
Xuất xứ: Việt Nam
Xuất xứ: Canada
Xuất xứ: Thuỵ Sỹ
Xuất xứ: Thụy Sĩ
Xuất xứ: Thuỵ Sĩ
Xuất xứ: Ấn Độ