Dapagliflozin
Biên soạn và Hiệu đính
Dược sĩ Phan Hữu Xuân Hạo
Danh pháp
Tên chung quốc tế
Dapagliflozin
Tên danh pháp theo IUPAC
(2S,3R,4R,5S,6R)-2-[4-chloro-3-[(4-ethoxyphenyl)methyl]phenyl]-6-(hydroxymethyl)oxane-3,4,5-triol
Nhóm thuốc
Thuốc chống đái tháo đường nhóm ức chế SGLT-2
Mã ATC
A – Đường tiêu hóa và trao đổi chất
A10 – Thuốc điều trị đái tháo đường
A10B – Thuốc hạ đường huyết, không bao gồm insulin
A10BK – Chất ức chế đồng vận chuyển natri-glucose 2 (SGLT2)
A10BK01 – Dapagliflozin
Mã UNII
1ULL0QJ8UC
Mã CAS
461432-26-8
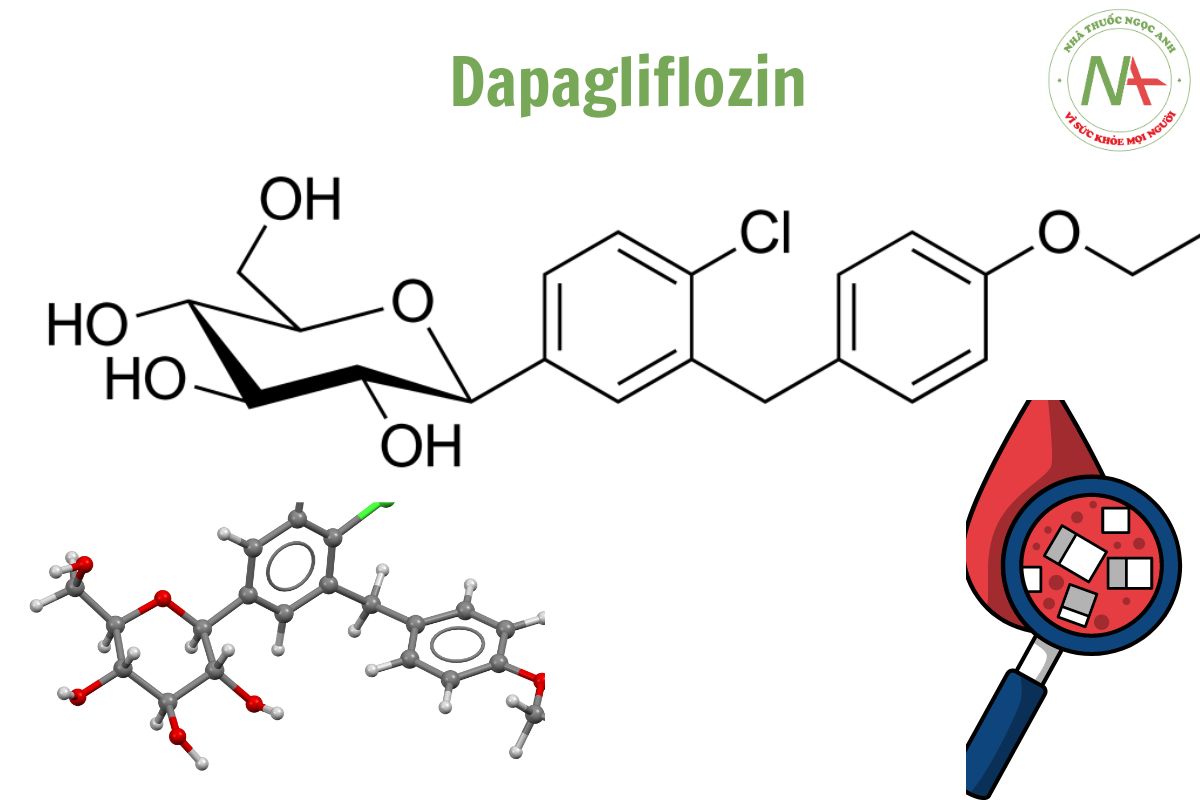
Cấu trúc phân tử
Công thức phân tử
C21H25ClO6
Phân tử lượng
408.9
Cấu trúc phân tử
Dapagliflozin là một C-glycosyl, có cấu trúc bao gồm beta-D-glucose. Trong đó nhóm hydroxy dị thường được thay thế bằng nhóm phenyl 4-chloro-3-(4-ethoxybenzyl).
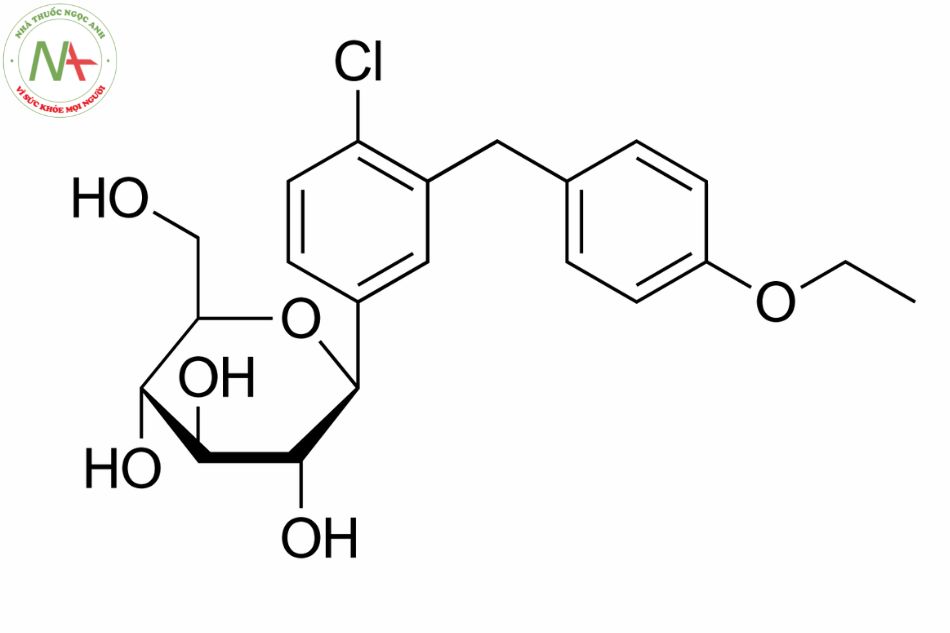
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 6
Số liên kết có thể xoay: 6
Diện tích bề mặt tôpô: 99.4 Ų
Số lượng nguyên tử nặng: 28
Các tính chất đặc trưng
Điểm nóng chảy: 65°C
Điểm sôi: 609°C
Tỷ trọng riêng: 1.3 ± 0.1 g/cm3
Độ tan trong nước: 0.173 mg/mL
Hằng số phân ly pKa: 12.57
Chu kì bán hủy: 13.8 giờ
Khả năng liên kết với Protein huyết tương: 91%
Cảm quan
Dapagliflozin có dạng bột kết tinh màu trắng, không mùi, ít tan trong nước.
Dạng bào chế
Viên nén bao phim: 5 mg; 10 mg.

Độ ổn định và điều kiện bảo quản
Dapagliflozin nên được bảo quản trong bao bì gốc của nhà sản xuất, để ở nhiệt độ phòng và tránh ánh sáng trực tiếp từ mặt trời.
Nguồn gốc
Dapagliflozin lần đầu tiên được phát triển bởi Bristol-Myers Squibb hợp tác với AstraZeneca vào năm 2002. Đến năm 2012, Ủy ban về Thuốc dùng cho Con người (CHMP) của Cơ quan Dược phẩm Châu Âu (EMA) đã đưa ra ý kiến tích cực về loại thuốc này. Theo đó, dapagliflozin được phát hiện là có hiệu quả trong một số nghiên cứu ở những người tham gia mắc bệnh týp 2. Thước đo hiệu quả chính là mức độ glycated hemoglobin (HbA1c), cho biết mức độ kiểm soát đường huyết.
Dapagliflozin đã được chấp thuận cho sử dụng trong y tế tại Liên minh Châu Âu vào tháng 11 năm 2012 và được bán trên thị trường ở một số quốc gia Châu Âu. Sau đó, dapagliflozin cũng đã được chấp thuận sử dụng trong y tế tại Hoa Kỳ vào tháng 1 năm 2014.
Dapagliflozin nằm trong Danh sách các loại thuốc thiết yếu của Tổ chức Y tế Thế giới. Vào năm 2020, đây là loại thuốc được kê đơn nhiều thứ 217 ở Hoa Kỳ, với hơn 2 triệu đơn thuốc.
Dược lý và cơ chế hoạt động
Dapagliflozin có khả năng ức chế chất vận chuyển natri-glucose 2 (SGLT2) – chủ yếu nằm ở ống lượn gần của nephron. Trong khi SGLT2 tạo điều kiện thuận lợi cho 90% lượng glucose được tái hấp thu ở thận thì sự ức chế này cho phép glucose được bài tiết qua nước tiểu. Sự bài tiết glucose thể hiện tác dụng kiểm soát đường huyết tốt hơn và có khả năng giảm cân ở bệnh nhân đái tháo đường týp 2.
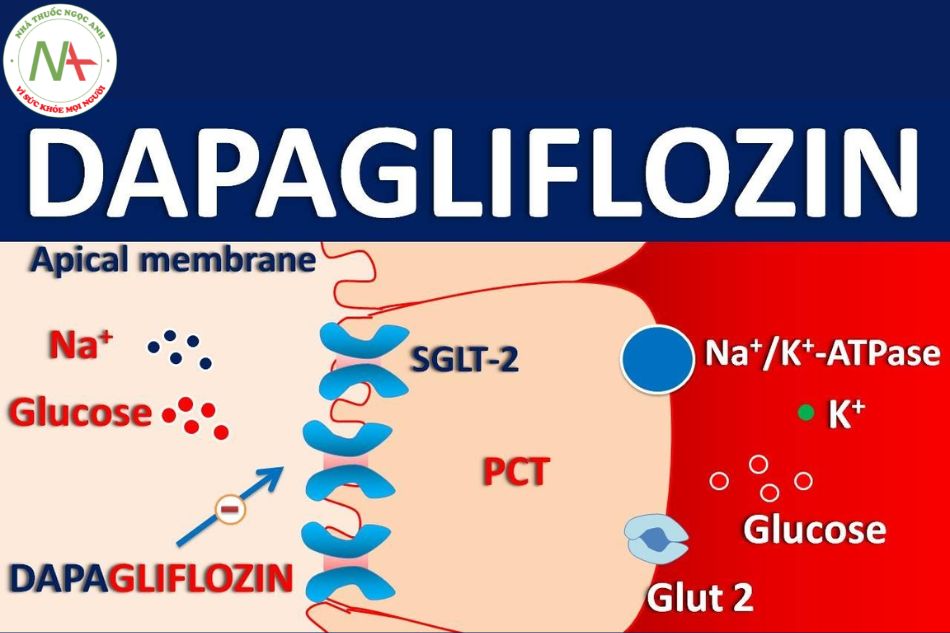
Ứng dụng trong y học
Đái tháo đường týp 2
Dapagliflozin được sử dụng cùng với chế độ ăn kiêng, tập thể dục và thường phối hợp với các thuốc hạ đường huyết khác, để cải thiện việc kiểm soát đường huyết ở người lớn mắc bệnh đái tháo đường týp 2. Đồng thời làm giảm nguy cơ nhập viện vì suy tim ở người lớn mắc bệnh đái tháo đường týp 2 và bệnh tim mạch đã biết hoặc các nguy cơ tim mạch khác, bao gồm huyết áp cao, cholesterol cao và người hút thuốc.
Suy tim với phân suất tống máu giảm
Dapagliflozin là một lựa chọn điều trị quan trọng ở bệnh nhân đái tháo đường týp 2 mắc kèm suy tim với phân suất tống máu giảm (ngoài điều trị y tế và/hoặc thiết bị tiêu chuẩn), đồng thời làm giảm nguy cơ nhập viện vì suy tim và tử vong do tim mạch ở nhóm này (cũng như bệnh nhân HFrEF không đái tháo đường).
Tất cả các thuốc ức chế SGLT-2 nói chung đều hữu ích để làm giảm nguy cơ nhập viện vì suy tim ở những người mắc bệnh tim mạch do xơ vữa động mạch, nhưng một số ít phân tích tổng hợp và nghiên cứu thuần tập đã chỉ ra rằng hiệu quả của dapagliflozin vượt trội hơn các thuốc khác như empagliflozin.
Do đó, vào năm 2020, FDA Hoa Kỳ đã mở rộng các chỉ định cho dapagliflozin bao gồm điều trị cho người lớn bị suy tim với phân suất tống máu giảm nhằm giảm nguy cơ tử vong do tim mạch và nhập viện vì suy tim. Đây là thuốc đầu tiên trong nhóm thuốc đặc biệt này (ức chế SGLT2) được chấp thuận để điều trị cho người lớn bị suy tim chức năng II-IV của Hiệp hội Tim mạch New York với phân suất tống máu giảm.
Thử nghiệm ngẫu nhiên, mù đôi, đối chứng giả dược DELIVER đăng trên New England Journal of Medicine vào tháng 8/2022 cho thấy hiệu quả của dapagliflozin trên người bệnh suy tim phân suất tống máu bảo tồn (HFpEF) và giảm nhẹ (HFmrEF).
Thử nghiệm được thực hiện ở 20 quốc gia, gồm 6263 người bệnh HFpEF và HFmrEF, trong đó có 20% người bệnh Châu Á.Trong thời gian trung vị là 2.3 năm, lợi ích của dapagliflozin được thể hiện qua:
- Giảm tỷ lệ gộp của tử vong do tim mạch và suy tim nặng hơn (nhập viện hoặc thăm khám khẩn cấp vì suy tim) với HR 0.82 (95%CI 0.73-0.92).
- Chậm tiến triển suy tim nặng hơn so với giả dược với HR 0.79 (95%CI 0.69-0.91).
- Lợi ích được duy trì trên nhiều phân nhóm, bao gồm EF ≥60%, EF <60%, có/không đái tháo đường, có/không rung nhĩ.
- Biến cố có hại tương đồng so với nhóm giả dược.
Trước DELIVER, một thuốc ức chế SGLT2 khác là empagliflozin với thử nghiệm EMPEROR-Preserved thực hiện trên người bệnh suy tim với phân suất tống máu >40% cho kết quả khả quan [1]. Thử nghiệm này cũng đã đưa empagliflozin trở thành thuốc đầu tiên có bằng chứng rõ ràng trên đối tượng HFpEF và HFmrEF được khuyến nghị trong hướng dẫn AHA/ACC/HFSA 2022.
Kết quả từ DELIVER có thể sẽ được cập nhật vào các hướng dẫn và mở rộng các đối tượng được hưởng lợi từ việc dùng dapagliflozin trên lâm sàng. Tuy nhiên trong nghiên cứu này, dapagliflozin làm giảm tỷ lệ tử vong nhưng không có ý nghĩa thống kê (HR 0.88, 95% CI 0.74-1.05). Đồng thời, độ thay đổi KCCQ còn khiêm tốn (win ratio 1.11, 95% CI 1.03–1.21). Do đó, quyết định dùng các thuốc ức chế SGLT2 nên dựa vào các yếu tố khác như mức độ thanh toán của bảo hiểm, khả năng chi trả và kỳ vọng sống của người bệnh cùng nhiều yếu tố khác
Bệnh thận mãn tính không đái tháo đường
Trong một phát hiện gần đây, dapagliflozin đã được chứng minh là làm giảm tốc độ suy giảm chức năng thận và suy thận ở người lớn mắc bệnh đái tháo đường týp 2 và ở cả người không đái tháo đường. Do đó, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) và EMA đã mở rộng các chỉ định cho dapagliflozin để bao gồm điều trị cho bệnh nhân mắc bệnh thận mãn tính (CKD) nhưng không mắc bệnh đái tháo đường vào năm 2021.
Việc cấp duyệt dựa trên kết quả từ thử nghiệm DAPA-CKD giai đoạn 3, chỉ gồm hơn 4300 bệnh nhân. Trong số những bệnh nhân đó, mức lọc cầu thận ước tính (eGFR) là 25–75 mL / phút / 1,73m2, và tỷ lệ albumin-creatinine trong nước tiểu là 200–5000. Bệnh nhân được chỉ định ngẫu nhiên dùng dapagliflozin 10 mg mỗi ngày hoặc giả dược khi điều trị tiêu chuẩn. Khoảng 2/3 bệnh nhân tham gia DAPA-CKD bệnh tiểu đường loại 2.
Nghiên cứu lần đầu tiên được trình bày tại Đại hội Hội Tim mạch Châu Âu (ESC) vào năm 2020 và sau đó được báo cáo trên Tạp chí Y học New England. Kết quả thấy điều trị bằng dapagliflozin làm giảm 39% nguy cơ tương đối tỷ lệ bệnh kết hợp giữa thận và tim mạch trong thời gian theo dõi trung bình 2,4 năm, với mức giảm nguy cơ tuyệt đối là 5,3%. Điểm cuối kết hợp tính toán tỷ lệ giảm 50% hoặc cao hơn eGFR so với ban đầu, khởi phát bệnh thận giai đoạn cuối, hoặc tử vong do thận hoặc tim mạch.
Dapagliflozin làm chậm quá trình bắt đầu chạy thận và giảm số ca tử vong bất kể tình trạng bệnh tiểu đường, điều tra viên chính Hiddo JL Heerspink, Tiến sĩ, PharmD, Trung tâm Y tế Đại học Groningen, Groningen, Hà Lan, báo cáo tại Đại hội ESC.
Thử nghiệm DAPA-CKD thấy tiềm năng của dapagliflozin như 1 phương pháp điều trị mới được chờ đợi từ lâu đối với những bệnh nhân có bệnh thận mãn tính.
Suy tim phân suất tống máu thất trái (LVEF)
Vào tháng 2 năm 2023, dapagliflozin tiếp tục được Liên minh Châu Âu phê duyệt để sử dụng mở rộng cho bệnh nhân suy tim ở tất cả các bệnh nhân có phân suất tống máu thất trái (LVEF), bao gồm cả những bệnh nhân có phân suất tống máu bảo tồn và giảm nhẹ.
Dược động học
Hấp thu
Dapagliflozin đường uống đạt nồng độ tối đa trong vòng 1 giờ khi đói. Khi ăn một bữa ăn nhiều chất béo, thời gian để đạt được nồng độ tối đa là 2 giờ và nồng độ tối đa sẽ giảm đi một nửa mặc dù không cần điều chỉnh liều. Sinh khả dụng đường uống là 78%.
Phân bố
Thể tích phân bố của dapagliflozin là 118L/h và tỉ lệ liên kết với protein huyết tương là 91%.
Chuyển hóa
Dapagliflozin chủ yếu được glucuronid hóa để trở thành chất chuyển hóa 3-O-glucuronid không có hoạt tính (60,7%). Dapagliflozin cũng tạo ra một chất chuyển hóa glucuronid hóa nhỏ khác (5,4%), một chất chuyển hóa khử ethyl hóa (<5%) và một chất chuyển hóa hydroxyl hóa (<5%).
Chuyển hóa của dapagliflozin được trung gian bởi cytochrome P450, bao gồm CYP1A1, CYP1A2, CYP2A6, CYP2C9, CYP2D6, CYP3A4, uridine diphosphate glucuronyltransferase(UGT)1A9, UGT2B4, và UGT2B7.
Quá trình glucuronid hóa thành chất chuyển hóa chính được thực hiện qua trung gian UGT1A9.
Thải trừ
Khoảng 75,2% lượng dapagliflozin được thải trừ qua nước tiểu với 1,6% liều dùng ở dạng không chuyển hóa. 21% liều dùng được bài tiết qua phân với 15% ở dạng nguyên vẹn.
Thời gian bán thải của thuốc là 13,8 giờ. Độ thanh thải huyết tương đường uống là 4,9 mL/phút/kg và độ thanh thải thận là 5,6 mL/phút.
Phương pháp sản xuất
Sự tổng hợp đầu tiên của dapaglifloxin đã được tiết lộ trong một bằng sáng chế do Bristol Myers Squibb đệ trình vào năm 2002.
Theo đó, hai mảnh chứa carbon chính được kết hợp bằng phản ứng của aryl lithium với gluconolactone được bảo vệ bằng trimethylsilyl. Các nhóm trimethylsilyl sau đó được loại bỏ bằng cách xử lý với axit metansulfonic trong metanol. Điều này tạo ra một chất trung gian có nhóm methoxy không mong muốn ở trung tâm dị thường, nhưng được loại bỏ bằng phản ứng với triethylsilane với sự có mặt của boron triflorua ete.
Độc tính ở người
Các tác dụng phụ thường gặp khi sử dụng dapagliflozin bao gồm hạ đường huyết (lượng đường trong máu thấp), nhiễm trùng đường tiết niệu, nhiễm trùng bộ phận sinh dục và suy giảm thể tích (giảm lượng nước trong cơ thể). Đặc biệt, nhiễm toan ceton do tiểu đường là một tác dụng phụ thường gặp ở bệnh nhân đái tháo đường týp 1. Ngoài ra, các tác dụng phụ nghiêm trọng nhưng hiếm gặp khác bao gồm chứng hoại thư Fournier.
Tính an toàn
Tuổi tác, giới tính, chủng tộc và trọng lượng cơ thể không ảnh hưởng đến yêu cầu về liều lượng dapagliflozin. Mặc dù tuổi tác không ảnh hưởng đến các yêu cầu về liều lượng, nhưng độ an toàn chưa được thiết lập ở trẻ em và bệnh nhân ở độ tuổi đặc biệt cao có thể dễ bị tác dụng phụ hơn.
Các nghiên cứu trên động vật trong thời kỳ mang thai cho thấy không có độc tính cho bào thai trong ba tháng đầu tiên nhưng việc tiếp xúc sau đó trong thai kỳ có liên quan đến sự giãn nở vùng chậu thận và gây độc cho mẹ ở liều cao hơn nhiều so với liều khuyến cáo tối đa cho người. Do dữ liệu này, dapagliflozin không được khuyến cáo sử dụng trong 3 tháng giữa và 3 tháng cuối của thai kỳ.
Dapagliflozin được bài tiết qua sữa của chuột cống, mặc dù điều này có thể không nhất thiết xảy ra ở người, nhưng dapagliflozin không được khuyến cáo cho phụ nữ đang cho con bú.
Trẻ em dưới 2 tuổi tiếp xúc với dapagliflozin có thể có nguy cơ gây bất thường thận.
Dapagliflozin không được khuyến cáo ở những bệnh nhân có độ thanh thải creatinin dưới 45mL/phút và chống chỉ định ở những bệnh nhân có độ thanh thải creatinin dưới 30mL/phút.
Không cần điều chỉnh liều ở bệnh nhân suy gan ở bất kỳ giai đoạn nào, mặc dù nguy cơ và lợi ích đối với bệnh nhân phải được đánh giá do dữ liệu về việc sử dụng dapagliflozin ở nhóm đối tượng này còn hạn chế.
Tương tác với thuốc khác
Các dữ liệu về tương tác của dapagliflozin với các thuốc khác dưới đây chỉ mang tính chất tham khảo:
| Thuốc | Tương tác | Mức độ |
| Gatifloxacin | Tăng hoặc hạ đường huyết | Major |
| Acebutolol | Tăng nguy cơ gây mất nước và hạ huyết áp | Moderate |
| Betamethasone | Giảm hiệu quả kiểm soát đường huyết | Moderate |
| Captopril | Tăng nguy cơ gây mất nước và hạ huyết áp | Moderate |
| Clarithromycin | Tăng nguy cơ hạ đường huyết | Moderate |
| Ephedrine | Giảm hiệu quả kiểm soát đường huyết | Moderate |
| Furosemide | Tăng nguy cơ mất nước, các vấn đề về thận và huyết áp thấp, đồng thời làm giảm hiệu quả kiểm soát đường huyết | Moderate |
| Insulin | Tăng nguy cơ hạ đường huyết | Moderate |
| Valsartan | Tăng nguy cơ gây mất nước và hạ huyết áp | Moderate |
Lưu ý khi sử dụng Dapagliflozin
Dapagliflozin không được khuyến cáo cho bệnh nhân đái tháo đường týp 1 hoặc điều trị nhiễm toan ceton do đái tháo đường.
Việc theo dõi kiểm soát đường huyết bằng xét nghiệm glucose trong nước tiểu không được khuyến cáo ở những bệnh nhân dùng thuốc ức chế SGLT2 vì thuốc ức chế SGLT2 làm tăng bài tiết glucose trong nước tiểu và sẽ dẫn đến xét nghiệm glucose trong nước tiểu dương tính.
Việc theo dõi kiểm soát đường huyết bằng xét nghiệm 1,5-AG không được khuyến cáo vì phép đo 1,5-AG có độ tin cậy thấp trong việc đánh giá kiểm soát đường huyết ở bệnh nhân dùng thuốc ức chế SGLT2.
Mất nước: Dapagliflozin có thể khiến một số người bị mất nước (cơ thể mất nước và muối), dẫn đến chóng mặt, ngất xỉu, choáng váng hoặc yếu ớt, đặc biệt là khi đứng lên (hạ huyết áp thế đứng). Nguy cơ mất nước cao hơn nếu bệnh nhân thuộc một trong các trường hợp sau:
– Huyết áp thấp.
– Uống thuốc hạ huyết áp, kể cả thuốc nước (thuốc lợi tiểu).
– Từ 65 tuổi trở lên.
– Đang ăn kiêng ít muối.
– Có vấn đề về thận.
Hạ huyết áp: Trước khi bắt đầu dùng dapagliflozin, cần đánh giá tình trạng thể tích và điều chỉnh tình trạng giảm thể tích tuần hoàn ở người cao tuổi, bệnh nhân suy thận hoặc huyết áp tâm thu thấp và bệnh nhân dùng thuốc lợi tiểu. Theo dõi các dấu hiệu và triệu chứng trong quá trình điều trị.
Nhiễm toan ceton: Trước khi bắt đầu dùng dapagliflozin, hãy xem xét các yếu tố nguy cơ nhiễm toan ceton. Bệnh nhân dùng dapagliflozin có thể yêu cầu theo dõi và tạm thời ngừng điều trị trong các tình huống lâm sàng được biết là dễ dẫn đến nhiễm toan ceton.
Tổn thương thận cấp tính và suy giảm chức năng thận: Cân nhắc ngừng thuốc tạm thời trong trường hợp giảm lượng uống hoặc mất nước. Nếu xảy ra tổn thương thận cấp tính, ngừng thuốc và điều trị kịp thời. Đồng thời phải theo dõi chức năng thận trong quá trình điều trị.
Viêm niệu đạo và viêm bể thận: Đánh giá các dấu hiệu và triệu chứng của nhiễm trùng đường tiết niệu và điều trị kịp thời, nếu có chỉ định.
Hạ đường huyết: Ở những bệnh nhân dùng insulin hoặc thuốc kích thích tiết insulin với dapagliflozin, hãy cân nhắc dùng liều insulin hoặc thuốc kích thích tiết insulin thấp hơn để giảm nguy cơ hạ đường huyết.
Viêm cân hoại tử đáy chậu (Hoại thư Fournier): Các trường hợp nghiêm trọng, đe dọa đến tính mạng đã xảy ra ở cả nam và nữ. Cần theo dõi các biểu hiện đau hoặc nhạy cảm, ban đỏ hoặc sưng tấy ở vùng sinh dục hoặc vùng đáy chậu, cùng với sốt hoặc khó chịu. Nếu nghi ngờ, tiến hành điều trị kịp thời.
Nhiễm nấm sinh dục:
– Phụ nữ dùng dapagliflozin có thể bị nhiễm nấm âm đạo. Do đó cần theo dõi và điều trị nếu có chỉ định. Các triệu chứng bao gồm:
+ Mùi âm đạo
+ Dịch tiết âm đạo màu trắng hoặc hơi vàng (dịch tiết có thể vón cục hoặc trông giống phô mai)
+ Ngứa âm đạo
– Nam giới dùng dapagliflozin cũng có thể bị nhiễm trùng nấm men vùng da xung quanh dương vật. Một số nam giới không cắt bao quy đầu có thể bị sưng dương vật khiến da quanh đầu dương vật khó kéo trở lại. Các triệu chứng khác của nhiễm trùng nấm men ở dương vật bao gồm:
+ Đỏ, ngứa hoặc sưng dương vật
+ Phát ban dương vật
+ Dương vật có mùi hôi
+ Đau vùng da xung quanh dương vật
Tăng LDL-C: Theo dõi và điều trị theo tiêu chuẩn chăm sóc.
Ung thư bàng quang: Sự mất cân bằng trong ung thư bàng quang đã được quan sát thấy trong các thử nghiệm lâm sàng. Không nên sử dụng dapagliflozin cho những bệnh nhân bị ung thư bàng quang đang hoạt động và nên thận trọng khi sử dụng cho những bệnh nhân có tiền sử ung thư bàng quang.
Một vài nghiên cứu của Dapagliflozin trong Y học
Dapagliflozin ở bệnh nhân suy tim và giảm phân suất tống máu
Cơ sở: Ở bệnh nhân đái tháo đường týp 2, thuốc ức chế chất đồng vận chuyển natri-glucose 2 (SGLT2) làm giảm nguy cơ nhập viện lần đầu vì suy tim, có thể thông qua cơ chế không phụ thuộc vào glucose. Cần có thêm dữ liệu về tác dụng của thuốc ức chế SGLT2 ở những bệnh nhân bị suy tim và giảm phân suất tống máu, bất kể có hay không có bệnh đái tháo đường týp 2.
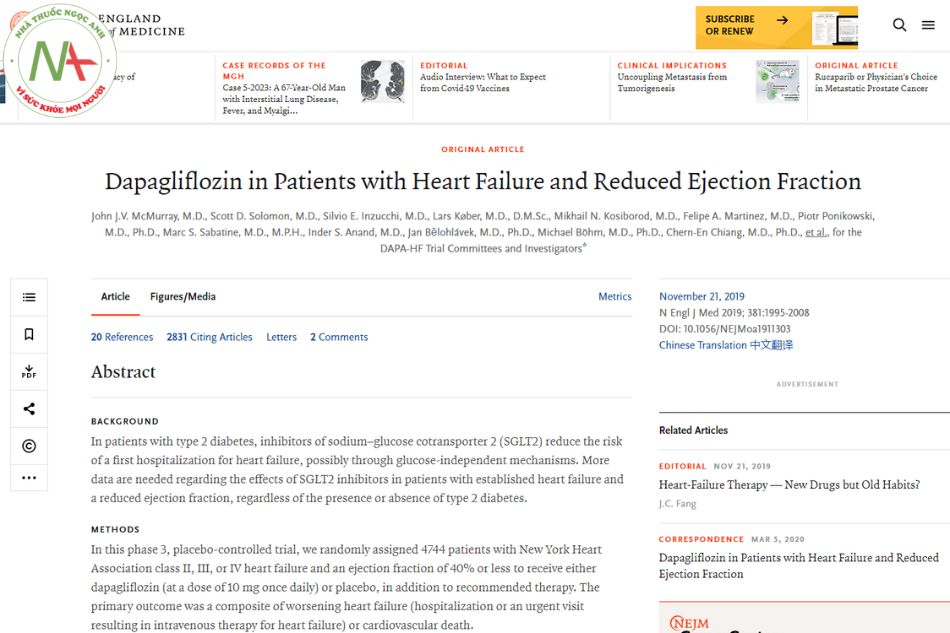
Phương pháp: Trong giai đoạn 3, thử nghiệm có đối chứng với giả dược này, nghiên cứu chỉ định ngẫu nhiên 4744 bệnh nhân bị suy tim độ II, III hoặc IV của Hiệp hội Tim mạch New York và phân suất tống máu từ 40% trở xuống để dùng dapagliflozin (với liều 10 mg một lần mỗi ngày) hoặc giả dược, ngoài liệu pháp được khuyến cáo.
Kết quả chính là tổng hợp tình trạng suy tim nặng hơn (nhập viện hoặc thăm khám khẩn cấp dẫn đến điều trị suy tim bằng đường tĩnh mạch) hoặc tử vong do tim mạch.
Kết quả: Trong khoảng thời gian trung bình là 18,2 tháng, kết cục chính xảy ra ở 386 trong số 2373 bệnh nhân (16,3%) ở nhóm dapagliflozin và ở 502 trong số 2371 bệnh nhân (21,2%) ở nhóm giả dược (tỷ số nguy cơ, 0,74; khoảng tin cậy 95%). [CI], 0,65 đến 0,85; P<0,001).
Biến cố suy tim nặng lên đầu tiên xảy ra ở 237 bệnh nhân (10,0%) trong nhóm dapagliflozin và 326 bệnh nhân (13,7%) trong nhóm giả dược (tỷ số nguy cơ, 0,70; 95% CI, 0,59 đến 0,83).
Tử vong do nguyên nhân tim mạch xảy ra ở 227 bệnh nhân (9,6%) trong nhóm dapagliflozin và 273 bệnh nhân (11,5%) trong nhóm giả dược (tỷ số nguy cơ, 0,82; 95% CI, 0,69 đến 0,98); 276 bệnh nhân (11,6%) và 329 bệnh nhân (13,9%), tương ứng, tử vong do mọi nguyên nhân (tỷ số nguy cơ, 0,83; KTC 95%, 0,71 đến 0,97).
Những phát hiện ở những bệnh nhân mắc bệnh đái tháo đường tương tự như ở những bệnh nhân không mắc bệnh tiểu đường. Tần suất các tác dụng phụ liên quan đến giảm thể tích tuần hoàn, rối loạn chức năng thận và hạ đường huyết không khác nhau giữa các nhóm điều trị.
Kết luận: Trong số những bệnh nhân bị suy tim và giảm phân suất tống máu, nguy cơ suy tim nặng hơn hoặc tử vong do nguyên nhân tim mạch ở những người dùng dapagliflozin thấp hơn so với những người dùng giả dược, bất kể có hay không có bệnh đái tháo đường.
Nghiên cứu DICTATE-AHF về việc sử dụng sớm dapaglifozin trong bệnh cảnh suy tim cấp
Thiết kế:
– Nghiên cứu được thực hiện trên người trưởng thành mắc ĐTĐ type 2, MLCT ước tính >= 30 ml/ph/1.73m2
– Nhập viện do đợt cấp suy tim, đã hoặc có kế hoạch sử dụng lợi tiểu tĩnh mạch
– Nghiên cứu thử nghiệm ngẫu nhiên tiến cứu, đa trung tâm, nhãn mở, được tiến hành trên 240 bệnh nhân tại Hoa Kỳ. BN được chọn ngẫu nhiên để dùng 10mg dapaglifozin hàng ngày hoặc được chăm sóc thông thường trong vòng 5 ngày hoặc cho tới khi xuất viện. Cả hai nhóm đều được điều trị bằng liều lợi tiểu tĩnh mạch tiêu chuẩn vầ tăng liều mỗi 12-24h trong suốt nghiên cứu cho tới khi đạt mục tiêu lượng nước tiểu là 3-5 l/ngày.
Mục tiêu:
Đánh giá độ hiệu quả và an toàn của dapaglifozin trong 24h đầu nhập viện ở bệnh nhân suy tim cấp so với điều trị thông thường.
Tiêu chí chính: Hiệu quả lợi tiểu (đáp ứng lợi tiểu) dựa trên cân nặng thay đổi/liều lợi tiểu (cả đường tĩnh mạch và đường uống)
Tiêu chí phụ: Lượng nước tiểu, natri niệu 24h và thời gian xuất viện.
Kết quả:
Việc dùng Dapaglifozin sớm không cho cải thiện có ý nghĩa thống kê về mức độ lợi tiểu so với điều trị thông thường ở bệnh nhân nhập viện do suy tim mất bù cấp. Nhưng ở các tiêu chí phụ cho thấy cải thiện natri niệu, lượng nước tiểu ở thời điểm 24h và giảm thời gian nằm viện
Kết luận:
Có thể hi vọng dapaglifozin cải thiện tinh trạng sung huyết và giảm thời gian nằm viện ở nhóm bệnh nhân này.
Tài liệu tham khảo
- Drugbank, Dapagliflozin, truy cập ngày 18 tháng 2 năm 2023.
- McMurray, J. J. V., Solomon, S. D., Inzucchi, S. E., Køber, L., Kosiborod, M. N., Martinez, F. A., Ponikowski, P., Sabatine, M. S., Anand, I. S., Bělohlávek, J., Böhm, M., Chiang, C. E., Chopra, V. K., de Boer, R. A., Desai, A. S., Diez, M., Drozdz, J., Dukát, A., Ge, J., Howlett, J. G., … DAPA-HF Trial Committees and Investigators (2019). Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. The New England journal of medicine, 381(21), 1995–2008. https://doi.org/10.1056/NEJMoa1911303
- Pubchem, Dapagliflozin, truy cập ngày 18 tháng 2 năm 2023.
- Forxiga approved in the EU for the treatment of chronic kidney disease in patients with and without type-2 diabetes. AstraZeneca. truy cập ngày 18 tháng 2 năm 2023.
- Forxiga (dapagliflozin) An overview of Forxiga and why it is authorised in the EU. truy cập ngày 18 tháng 2 năm 2023.
- Marlene Busko (Ngày đăng: 23/07/2021). Dapagliflozin Safe, Protective in Advanced Kidney Disease. Medscape.com. truy cập ngày 18 tháng 2 năm 2023.
- Anker SD, Butler J, Filippatos G, et al. Empagliflozin in Heart Failure with a Preserved Ejection Fraction. N Engl J Med. 2021 Oct 14;385(16):1451-1461. doi: 10.1056/NEJMoa2107038.
- Writing Committee Members; ACC/AHA Joint Committee Members. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure. J Card Fail. 2022 May;28(5):e1-e167. doi: 10.1016/j.cardfail.2022.02.010.
- Scott D. Solomon, M.D., John J.V. McMurray, M.D., Brian Claggett, Ph.D., Rudolf A. de Boer, M.D., David DeMets, Ph.D., Adrian F. Hernandez, M.D., Silvio E. Inzucchi, M.D., Mikhail N. Kosiborod, M.D., Carolyn S.P. Lam, M.D., Felipe Martinez, M.D., Sanjiv J. Shah, M.D., Akshay S. Desai, M.D., et al., for the DELIVER Trial Committees and Investigators*. Ngày đăng: 22/09/2022. Dapagliflozin in Heart Failure with Mildly Reduced or Preserved Ejection Fraction. NEJM. truy cập ngày 18 tháng 2 năm 2023.
Xuất xứ: Tiêu chuẩn cơ sở
Xuất xứ: Ấn Độ
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Việt Nam
Xuất xứ: Mỹ
Xuất xứ: Mỹ
Xuất xứ: Mỹ