Dacomitinib
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
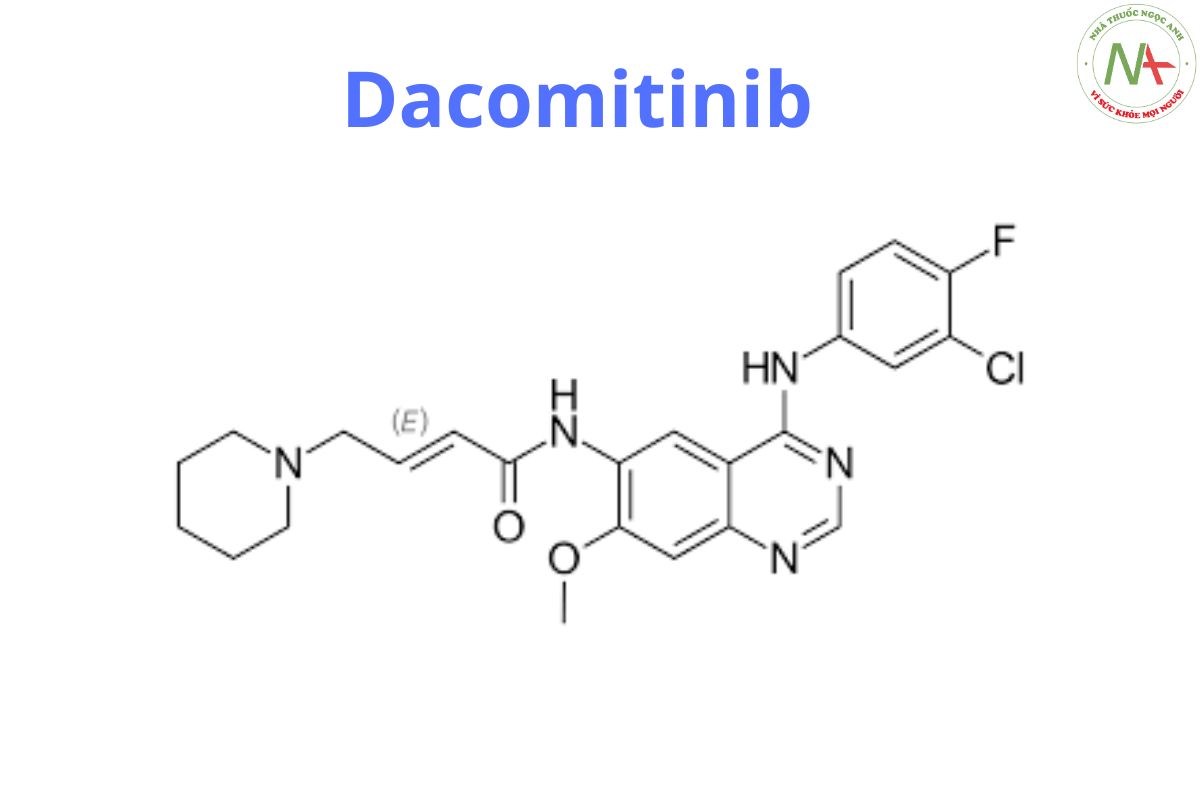
(E)-N-[4-(3-chloro-4-fluoroanilino)-7-methoxyquinazolin-6-yl]-4-piperidin-1-ylbut-2-enamide;hydrate
Nhóm thuốc
Thuốc chống ung thư và điều hòa miễn dịch
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Thuốc chống ung thư
L01E – Chất ức chế protein kinase
L01EB – Chất ức chế tyrosine kinase thụ thể yếu tố tăng trưởng biểu bì (egfr)
L01EB07 – Dacomitinib
Mã UNII
5092U85G58
Mã CAS
1042385-75-0
Cấu trúc phân tử
Công thức phân tử
C24H27ClFN5O3
Phân tử lượng
488.0 g/mol
Đặc điểm cấu tạo
Dacomitinib có cấu tạo dạng (2E)-N-16-4-(piperidin-1-yl) but-2-enamide
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 8
Số liên kết có thể xoay: 7
Diện tích bề mặt cực tôpô: 80,4
Số lượng nguyên tử nặng: 34
Số lượng nguyên tử trung tâm xác định được: 1
Liên kết cộng hóa trị: 2
Tính chất
Dacomitinib có điểm nóng chảy 184-187ºC
Dạng bào chế
Dacomitinib được bào chế dưới dạng viên uống
Nguồn gốc
Vào tháng 1/2014, Dacomitinib đã được tiến hành thử nghiệm lâm sàng nhưng kết quả đem lại không được như mục tiêu của nghiên cứu, sau đó các thử nghiệm về Dacomitinib vẫn tiếp tục được tiến hành. Đến tháng 9/2018 Dacomitinib được chấp nhận dùng vào mục đích y tế tại Nhật Bản. Đến năm 2019, Dacomitinib được Liên minh Châu Âu chấp nhận sử dụng
Dược lý và cơ chế hoạt động
Dacomitinib là chất có khả năng ức chế các phân tử nhỏ không thuận nghịch trên các thụ thể yếu tố tăng trưởng biểu bì ở người tyrosine kinase.
Dược động học
Hấp thu
Dacomitinib đạt nồng độ tối đa trong huyết tương sau khi dùng liều 45mg là sau 6 giờ và Cmax= 104 ng/ml. Sinh khả dụng của thuốc khoảng 80% và thức ăn không làm ảnh hướng đến sự hấp thu và phân bố thuốc
Chuyển hóa
Dacomitinib được chuyển hóa qua quá trình liên hợp và quá trình oxy hóa nhờ các enzyme glutathione và cytochrome P450. Chất chuyển hóa chính của Dacomitinib là O-desmethyl dacomitinib, chất này được tạo thành nhờ quá trình oxy hóa Dacomitinib bởi CYP2D6. Ngoài ra còn có 1 số chất chuyển hóa nhỏ hơn
Phân bố
Dacomitinib có thể tích phân bố là 2415 lít và khả năng liên kết với protein khoảng 98%
Thải trừ
Dacomitinib được bài tiết 79% qua phân và 20% dưới dạng không chuyển hóa, có 3% thuốc được tìm thấy trong nước tiểu và trong đó có < 1% Dacomitinib được tìm thấy dưới dạng không đổi. Độ thanh thải của Dacomitinib là 27,06 L/h.
Ứng dụng trong y học
Dacomitinib được ứng dụng chỉ định là phương pháp điều trị đầu tay cho bệnh nhân ung thư phổi không phải tế bào nhỏ di căn có đột biến mất đoạn exon 19 hoặc đột biến thay thế L858R exon 21 thụ thể yếu tố tăng trưởng biểu bì. Bằng cách ức chế thụ thể yếu tố tăng trưởng này, Dacomitinib ức chế sự phát triển của tế bào ác tính nhờ ngăn chặn chuỗi truyền tín hiệu Ras nội bào.
Tác dụng phụ
- Các tác dụng phụ thường gặp của Dacomitinib bao gồm viêm quanh móng, ngứa và mệt mỏi, rụng tóc, loét miệng, viêm kết mạc, nôn, chán ăn, tiêu chảy, phát ban, da khô, buồn nôn.
- Ít gặp: phát ban nghiêm trọng, bệnh phổi kẽ, tiêu chảy, độc tính đối với phôi thai.
Một vài nghiên cứu của trong Y học
Một nghiên cứu đã được tiến hành vào năm 2017 với mục tiêu so sánh hiệu quả và độ an toàn của Dacomitinib với gefitinib trong điều trị tuyến đầu cho bệnh nhân ung thư phổi không phải tế bào nhỏ tiến triển dương tính với đột biến EGFR. Nghiên cứu tiến hành , đa trung tâm, ngẫu nhiên trên 452 bệnh nhân được phân ngẫu nhiên cho dùng dacomitinib (n = 227) hoặc gefitinib (n = 225). Kết quả cho thấy Dacomitinib cải thiện đáng kể thời gian sống so với gefitinib trong điều trị cho bệnh nhân ung thư phổi không phải tế bào nhỏ (NSCLC) dương tính với đột biến EGFR
Tài liệu tham khảo
- Thư viện y học quốc gia, Dacomitinib , pubchem. Truy cập ngày 21/04/2025
- Yi-Long Wu 1, Ying Cheng 2, Xiangdong Zhou 3, Ki Hyeong Lee 4, Kazuhiko Nakagawa 5, Seiji Niho 6, Fumito Tsuji 7, Rolf Linke 8, Rafael Rosell 9, Jesus Corral 10, Maria Rita Migliorino 11, Adam Pluzanski 12, Eric I Sbar 13, Tao Wang 14, Jane Liang White 14, Sashi Nadanaciva 14, Rickard Sandin 15, Tony S Mok (2017) Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial , pubmed.com. Truy cập ngày 21/04/2025
