Daclatasvir
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
methyl N-[(2S)-1-[(2S)-2-[5-[4-[4-[2-[(2S)-1-[(2S)-2-(methoxycarbonylamino)-3-methylbutanoyl]pyrrolidin-2-yl]-1H-imidazol-5-yl]phenyl]phenyl]-1H-imidazol-2-yl]pyrrolidin-1-yl]-3-methyl-1-oxobutan-2-yl]carbamate
Nhóm thuốc
Daclatasvir thuộc nhóm nào? Thuốc kháng vi-rút điều trị nhiễm hcv
Mã ATC
J – Thuốc chống nhiễm trùng để sử dụng toàn thân
J05 – Thuốc kháng virus dùng toàn thân
J05A – Thuốc kháng virus tác dụng trực tiếp
J05AP – Thuốc kháng vi-rút điều trị nhiễm hcv
J05AP07 – Daclatasvir
Mã UNII
LI2427F9CI
Mã CAS
1009119-64-5
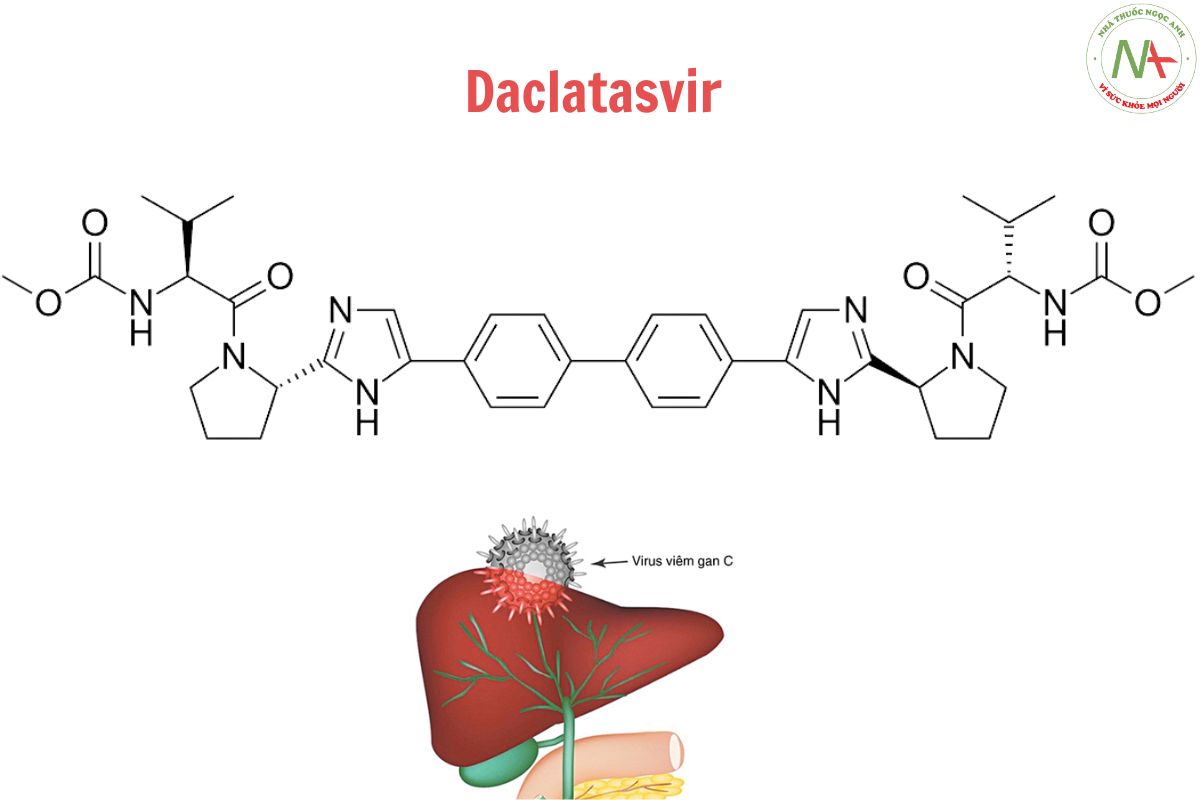
Cấu trúc phân tử
Công thức phân tử
C40H50N8O6
Phân tử lượng
738.9 g/mol
Cấu trúc phân tử
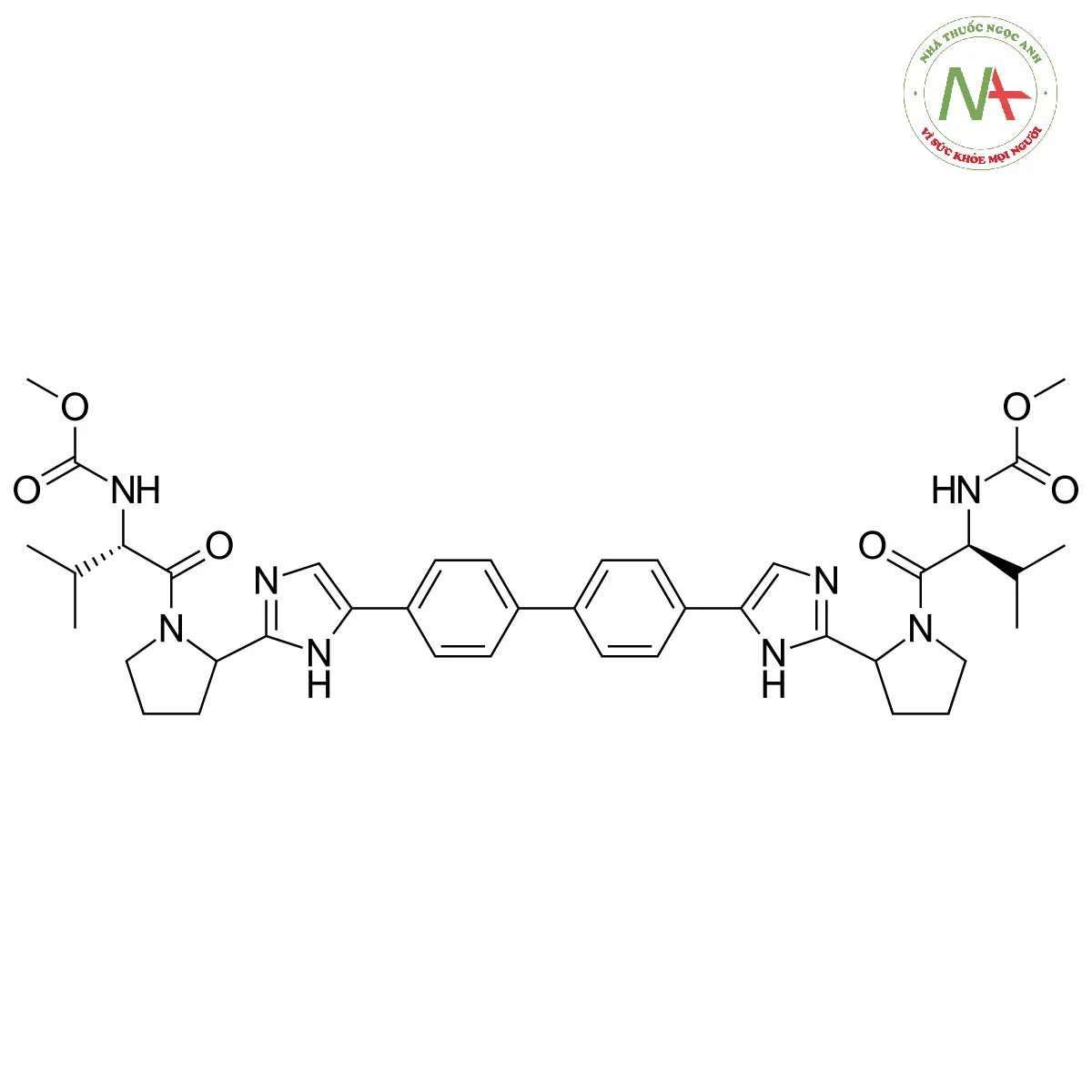
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 8
Số liên kết có thể xoay: 13
Diện tích bề mặt cực tôpô: 175
Số lượng nguyên tử nặng: 54
Số lượng nguyên tử trung tâm xác định được: 4
Liên kết cộng hóa trị: 1
Dạng bào chế
Viên nén bao phim: thuốc daclatasvir 60 mg,…
Viên nén: sofosbuvir daclatasvir,…
Nguồn gốc
Daklinza được phát hiện bởi các nhà khoa học tại Bristol-Myers Squibb (BMS); tiền thân được xác định bằng cách sàng lọc kiểu hình trong đó hệ thống sao chép GT-1b được triển khai trong các tế bào Huh7 và virus tiêu chảy do virus bò cũng có trong các tế bào Huh7 được sử dụng làm màn hình phản đối tính đặc hiệu. Bristol Myers Squibb cũng đã phát triển loại thuốc này và xuất bản thử nghiệm Giai đoạn I đầu tiên vào năm 2010.
Nó đã được phê duyệt để sử dụng ở Châu Âu vào tháng 8 năm 2014, ở Mỹ vào tháng 7 năm 2015 và ở Ấn Độ vào tháng 12 năm 2015; đây là loại thuốc ức chế NS5A đầu tiên được tung ra thị trường.
Dược lý và cơ chế hoạt động
Daclatasvir là thuốc gì? Daclatasvir là một thuốc kháng vi-rút có tác dụng ức chế vùng NS5A của vi-rút viêm gan C và được sử dụng đơn trị hay kết hợp với các thuốc kháng vi-rút đường uống khác.
NS5A chứa một túi liên kết ở miền 1, nơi daclatasvir có thể chèn vào. Do cấu trúc đối xứng và liên quan đến axit amin của daclatasvir nên nó dẫn đến tương tác liên kết H giữa daclatasvir và các axit amin của túi liên kết. Điều đó gây ra sự biến đổi cấu trúc của NS5A, dẫn đến mất tác dụng và dẫn đến ức chế sự hình thành virion.
Bằng cách thay đổi cấu trúc của NS5A, việc tuyển dụng PI4KA và do đó việc tích lũy PI4P bị vô hiệu hóa. Các giọt lipid mới và các thành phần màng không còn có thể được PI4P tuyển dụng vào mạng màng và mạng không thể duy trì được nữa. Nhưng điều quan trọng cần đề cập là daclatasvir không ức chế trực tiếp PI4KA, bởi vì người ta quan sát thấy rằng trong các tế bào được điều trị bằng daclatasvir, PI4P vẫn hiện diện trong màng sinh chất và bộ máy Golgi. Daclatasvir cũng không ức chế quá trình định vị PI4KA ban đầu do NS5A gây ra vì người ta đã chứng minh rằng daclatasvir không có tác động đến chức năng của NS5A trong các tế bào chỉ biểu hiện NS5A. Có khả năng là daclatasvir chỉ ức chế các chức năng của NS5A liên kết với các protein khác trong phức hợp sao chép HCV giống như NS4B sao chép RNA.
Hiện tượng này gắn liền với cấu trúc miền 1 của NS5A. Người ta quan sát thấy rằng miền 1 có hai sự phù hợp khác nhau. Daclatasvir liên kết với một trong những thứ này và kết quả là khóa miền 1 trong cấu hình này. Mặc dù vậy, NS5A vẫn có thể liên kết PI4KA, điều này có thể giải thích chức năng còn lại của NS5A trong các tế bào không bị nhiễm đã đề cập trước đó. Cấu hình thứ hai của miền 1, xuất hiện trong các tế bào không được xử lý, khi đó rất có thể liên quan đến sự tích lũy siêu PI4P cần thiết cho sự hình thành và duy trì phức hợp sao chép và mạng màng. Vì vậy, PI4KA vẫn có thể tương tác với NS5A, nhưng do bị phong tỏa về cấu trúc nên NS5A không thể kích hoạt PI4KA một cách hiệu quả như bình thường.
Sự ức chế quá trình tích lũy PI4P dẫn đến sự sụp đổ của mạng màng và hình thành các cấu trúc tổng hợp lớn được hình thành từ các protein của phức hợp sao chép. Hơn nữa, NS5A dường như di chuyển từ mạng màng sang các giọt lipid trong bào tương. Kết quả từ quan sát này, có khả năng phức hợp sao chép HCV và vỏ virion vẫn được hình thành nhưng bị suy giảm nghiêm trọng khi điều trị bằng daclatasvir.
Hơn nữa, người ta đã quan sát thấy rằng việc điều trị các tế bào bị nhiễm HCV bằng daclatasvir dẫn đến thiếu dạng NS5A siêu phosphoryl hóa. Không rõ liệu sự hình thành p58 có bị ức chế trực tiếp bởi daclatasvir hay đó chỉ là một tác dụng phụ. Nhưng có khả năng việc thiếu p58 là yếu tố quyết định cho việc ức chế sự tập hợp virion.
Dược động học
Daclatasvir đạt trạng thái ổn định ở người sau khoảng 4 ngày uống 60 mg một lần mỗi ngày, với nồng độ đỉnh đạt được khoảng 2 giờ sau khi dùng. Nó có dạng viên uống, với sinh khả dụng là 67%. Daclatasvir được chuyển hóa chủ yếu bởi enzyme gan CYP3A4 và cũng là chất nền P-gp. Nó có khả năng gắn kết cao với protein . Sự liên kết với protein được đo là khoảng 99% ở những người dùng daclatasvir nhiều lần mà không phụ thuộc vào cường độ liều. Daclatasvir có thể tích phân bốlà 47L sau liều uống 60 mg và liều tiêm tĩnh mạch 100 μg
Ứng dụng trong y học
Daclatasvir chỉ được sử dụng trong liệu pháp phối hợp để điều trị nhiễm trùng viêm gan C kiểu gen 1, 3 hoặc 4; các tác nhân được sử dụng kết hợp, bao gồm sofosbuvir, ribavirin và interferon, khác nhau tùy theo kiểu gen của vi rút, liệu người đó có bị xơ gan hay không và liệu việc ghép gan có diễn ra hay không.
Người ta không biết liệu daclatasvir có truyền vào sữa mẹ hay có ảnh hưởng gì đến trẻ sơ sinh hay không.
Tác dụng phụ
Các tác dụng phụ thường gặp nhất ở những bệnh nhân đang điều trị bằng daclatasvir và sofosbuvir bao gồm đau đầu, mệt mỏi, buồn nôn và tiêu chảy. Các tác dụng phụ tương tự cũng xảy ra khi thêm ribavirin, ngoài phát ban, mất ngủ, thiếu máu, chóng mặt và buồn ngủ. Có những trường hợp sau khi đưa thuốc ra thị trường liên kết nhịp tim chậm có triệu chứng nghiêm trọng với Daklinza khi dùng kết hợp với sofosbuvir và amiodarone. Không nên dùng đồng thời ba loại thuốc này trừ khi không có lựa chọn thay thế nào khác.
Tương tác với thuốc khác
- Chống chỉ định sử dụng đồng thời các thuốc gây cảm ứng mạnh cytochrome P450 CYP3A do giảm hiệu quả điều trị và tình trạng kháng thuốc. Một số loại thuốc phổ biến gây cảm ứng CYP3A mạnh bao gồm dexamethasone, phenytoin, carbamazepine, rifampin và St. John’s Wort.
- Daclatasvir là cơ chất của CYP3A và p-glycoprotein, do đó, các thuốc gây cảm ứng hoặc ức chế mạnh các enzyme này sẽ ảnh hưởng đến nồng độ daclatasvir trong cơ thể. Việc điều chỉnh liều được thực hiện khi sử dụng đồng thời daclatasvir và các thuốc ảnh hưởng đến CYP3A hoặc p-gp. Khi dùng daclatasvir với thuốc ức chế men sao chép ngược không nucleoside, liều daclatasvir được tăng lên để khắc phục cảm ứng CYP3A. Nên giảm liều daclatasvir khi dùng chung với thuốc chống nấm, chẳng hạn như ketoconazole. Hiện tại, không có yêu cầu điều chỉnh liều lượng khi sử dụng đồng thời daclatasvir và thuốc ức chế miễn dịch, thuốc giảm đau gây mê, thuốc chống trầm cảm, thuốc an thần và thuốc tim mạch.
- Sử dụng đồng thời với amiodarone, sofosbuvir và daclatasvir có thể làm tăng nguy cơ nhịp tim chậm nghiêm trọng.
Tổng hợp
- Phân tử daclatasvir chứa hai axit amin proline và valine ở dạng L tự nhiên, giúp tổng hợp dễ dàng hơn theo cấu hình âm thanh nổi phù hợp. Phần sau đây mô tả một cơ chế mẫu mực của việc tổng hợp daclatasvir làm cơ sở tự do của nó. Bước đầu tiên là phản ứng acyl hóa biphenyl của Friedel-Crafts với chloroacetyl clorua và nhôm clorua được sử dụng làm chất xúc tác. Vì biphenyl là tinh thể rắn nên nó tan trong 1,2-dichloroethane(DCE). Hỗn hợp cloroacetyl clorua và nhôm clorua cũng được sử dụng trong dung dịch có DCE. Để tách sản phẩm ra khỏi các hợp chất khác, hỗn hợp phản ứng thu được được xử lý bằng dung dịch HCl 2N.
- Ở bước tiếp theo, sản phẩm acetyl hóa đối xứng từ bước đầu tiên phản ứng với dipeptide N-methoxycarbonyl trong phản ứng este hóa. Dipeptide bao gồm các axit amin L -proline và L -valine và được phân giải trong acetonitril (MeCN). Trong khi đầu amino của valine được bảo vệ bởi nhóm methoxycarbonyl thì đầu carboxy của proline phản ứng với sản phẩm của bước một tạo thành sản phẩm este hóa của cả hai hóa chất. Trong phản ứng này triethylamine hoạt động như một dung môi cơ bản.
- Ở bước cuối cùng, phân tử hiện tại phản ứng với amoni axetat trong nước tạo thành dị vòng imidazole ở cả hai phía của phân tử.
- Một lựa chọn khác là este hóa nó bằng proline được bảo vệ bằng boc trước, sau đó tạo thành các dị vòng imidazole với amoni axetat và cuối cùng thêm valine sau khi khử axit của prolines N-terminus. Trong cả hai trường hợp, sản phẩm cuối cùng là chất nền không chứa daclatasvir. Trong thuốc, daclatasvir tồn tại ở dạng muối hydrochloride.
Độc tính
Trong các thử nghiệm ngẫu nhiên có đối chứng lớn, daclatasvir không liên quan đến việc tăng enzyme huyết thanh trong quá trình điều trị. Tuy nhiên, một khó khăn trong việc đánh giá tác dụng phụ của daclatasvir và các thuốc chống HCV khác là chúng không bao giờ được sử dụng dưới dạng đơn trị liệu mà còn được kết hợp với các thuốc có hoạt tính chống lại các mục tiêu HCV khác, chẳng hạn như protease virus (NS3) hoặc polymerase (NS5B). Daclatasvir cũng thường được sử dụng kết hợp với các thuốc điều trị viêm gan C truyền thống hơn, chẳng hạn như peginterferon và ribavirin, cả hai đều có tác dụng phụ nổi bật. Khi kết hợp với asunaprevir (một chất ức chế protease HCV), daclatasvir có liên quan đến ALT huyết thanh tăng ở 3% đến 11% bệnh nhân và với một số trường hợp quá mẫn cấp tính và viêm gan, một số trường hợp nặng. Tuy nhiên, nguyên nhân gây ra phản ứng quá mẫn dường như là do asunaprevir. Khi kết hợp với sofosbuvir, daclatasvir không liên quan đến tăng men huyết thanh hoặc tổn thương gan rõ ràng trên lâm sàng.
Tuy nhiên, Daclatasvir có liên quan đến một số ít trường hợp xơ gan mất bù cấp tính liên quan đến HCV. Tuy nhiên, vai trò của daclatasvir và các thuốc kháng virus HCV khác trong hội chứng này vẫn chưa rõ ràng. Tổn thương gan thường xảy ra trong vòng 2 đến 6 tuần kể từ khi bắt đầu điều trị, nhưng đôi khi muộn hơn và thậm chí sau khi ngừng điều trị. Vết thương được đánh dấu bằng tình trạng vàng da ngày càng trầm trọng và có dấu hiệu suy gan. Trong một số trường hợp, nhiễm toan lactic xuất hiện sớm. Trong hầu hết nhưng không phải tất cả các trường hợp, men huyết thanh tăng rất ít, dù tình trạng suy gan ngày càng trầm trọng. Một số trường hợp dẫn đến tử vong hoặc cần ghép gan khẩn cấp. Vì lý do này, người ta khuyến cáo rằng những bệnh nhân bị xơ gan đang điều trị bằng thuốc kháng vi-rút bằng các thuốc tác động trực tiếp mạnh nên được theo dõi cẩn thận.
Cuối cùng, sự tái hoạt động của bệnh viêm gan B đã xảy ra ở một số ít bệnh nhân đang được điều trị bệnh viêm gan C mãn tính, một số người trong số họ đã dùng daclatasvir. Mối liên quan giữa sự tái hoạt động của HBV với việc điều trị nhiễm HCV bằng thuốc kháng vi-rút vẫn chưa rõ ràng, nhưng có thể là do sự loại bỏ sự sao chép của HCV khiến nồng độ HBV DNA tăng lên
Một số nghiên cứu của Daclatasvir trong y học
Daclatasvir cộng với sofosbuvir, có hoặc không có ribavirin, đã đạt được tỷ lệ đáp ứng virus bền vững cao ở những bệnh nhân nhiễm HCV và bệnh gan tiến triển trong một đoàn hệ thực tế

Mục tiêu: Nghiên cứu đã đánh giá tính hiệu quả và an toàn của daclatasvir (DCV) cộng với sofosbuvir (SOF), có hoặc không có ribavirin (RBV), trong một nhóm thuần tập thực tế lớn, bao gồm cả những bệnh nhân mắc bệnh gan tiến triển.
Thiết kế: Người lớn bị nhiễm HCV mạn tính có nguy cơ mất bù hoặc tử vong cao trong vòng 12 tháng và không có lựa chọn điều trị sẵn có nào đã được điều trị theo chương trình sử dụng nhân ái của Châu Âu. Phác đồ được khuyến nghị là DCV 60 mg cộng với SOF 400 mg trong 24 tuần; Việc bổ sung RBV hoặc thời gian ngắn hơn được cho phép theo quyết định của bác sĩ. Tiêu chí chính là đáp ứng virus kéo dài ở tuần thứ 12 sau điều trị (SVR12).
Kết quả: Trong số 485 bệnh nhân được đánh giá, 359 bệnh nhân được nhận DCV+SOF và 126 bệnh nhân DCV+SOF+RBV. Hầu hết bệnh nhân là nam giới (66%), người da trắng (93%) và đã từng điều trị (70%). Các kiểu gen HCV thường gặp nhất là 1b (36%), 1a (33%) và 3 (21%) và 80% bệnh nhân bị xơ gan (42% Child-Pugh B/C; 46% Mô hình cho Bệnh gan giai đoạn cuối điểm >10). SVR12 (ý định điều trị đã được sửa đổi) đã đạt được ở 91% bệnh nhân (419/460); 1 bệnh nhân bùng phát virus và 13 bệnh nhân tái phát. Thất bại về virus không liên quan đến nhóm điều trị (chênh lệch rủi ro đã điều chỉnh DCV+SOF trừ DCV+SOF+RBV: 1,06%; 95% CI -2,22% đến 4,35%). SVR12 cao được quan sát thấy bất kể kiểu gen HCV hay xơ gan, ghép gan hoặc tình trạng đồng nhiễm HIV/HCV. 28 bệnh nhân đã ngừng điều trị do tác dụng phụ (n=18) hoặc tử vong (n=10) và 18 bệnh nhân tử vong trong quá trình theo dõi.
Kết luận: DCV+SOF có hoặc không có RBV đạt được SVR12 cao và được dung nạp tốt ở nhiều nhóm bệnh nhân mắc bệnh gan nặng.
Tài liệu tham khảo
- Thư viện y học quốc gia, Daclatasvir, pubchem. Truy cập ngày 06/09/2023.
- Markus Peck-Radosavljevic, Maria Jesus Jimenez-Exposito, Stefan Zeuzem (2016), Daclatasvir plus sofosbuvir, with or without ribavirin, achieved high sustained virological response rates in patients with HCV infection and advanced liver disease in a real-world cohort,pubmed.com. Truy cập ngày 06/09/2023
Xuất xứ: Việt Nam
Xuất xứ: Ấn Độ