Capecitabine
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
pentyl N-[1-[(2R,3R,4S,5R)-3,4-dihydroxy-5-methyloxolan-2-yl]-5-fluoro-2-oxopyrimidin-4-yl]carbamate
Nhóm thuốc
Thuốc chống ung thư, tiền chất của fluorouracil
Mã ATC
L – Chất chống ung thư và tác nhân điều hòa miễn dịch
L01 – Chất chống ung thư
L01B – Các chất chống chuyển hóa
L01BC – Các chất tương tự Pyrimidin
L01BC06 – Capecitabine
Phân loại nguy cơ cho phụ nữ có thai
D
Mã UNII
6804DJ8Z9U
Mã CAS
154361-50-9
Cấu trúc phân tử
Công thức phân tử
C15H22FN3O6
Phân tử lượng
359,35 g/mol
Cấu trúc phân tử
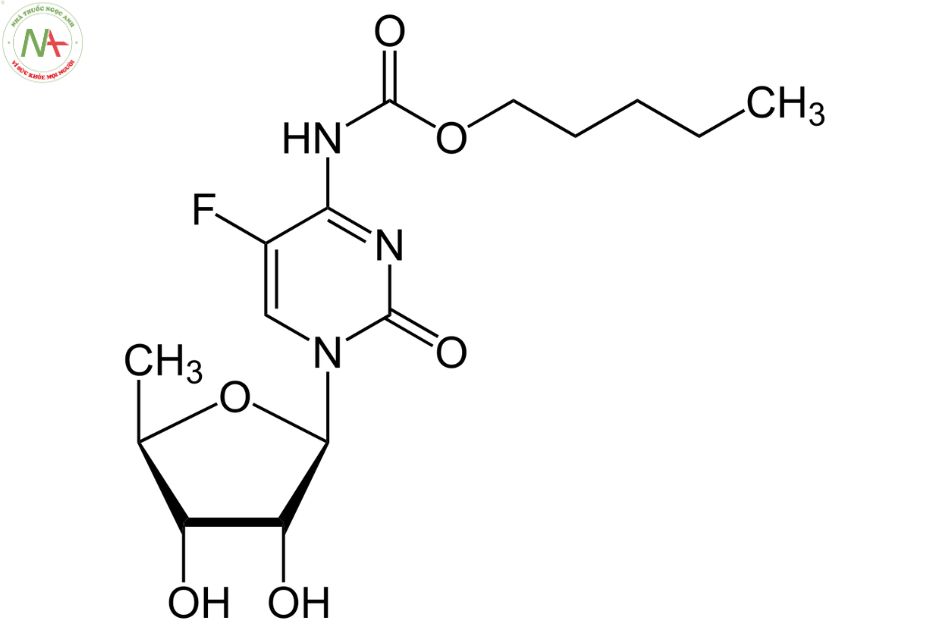
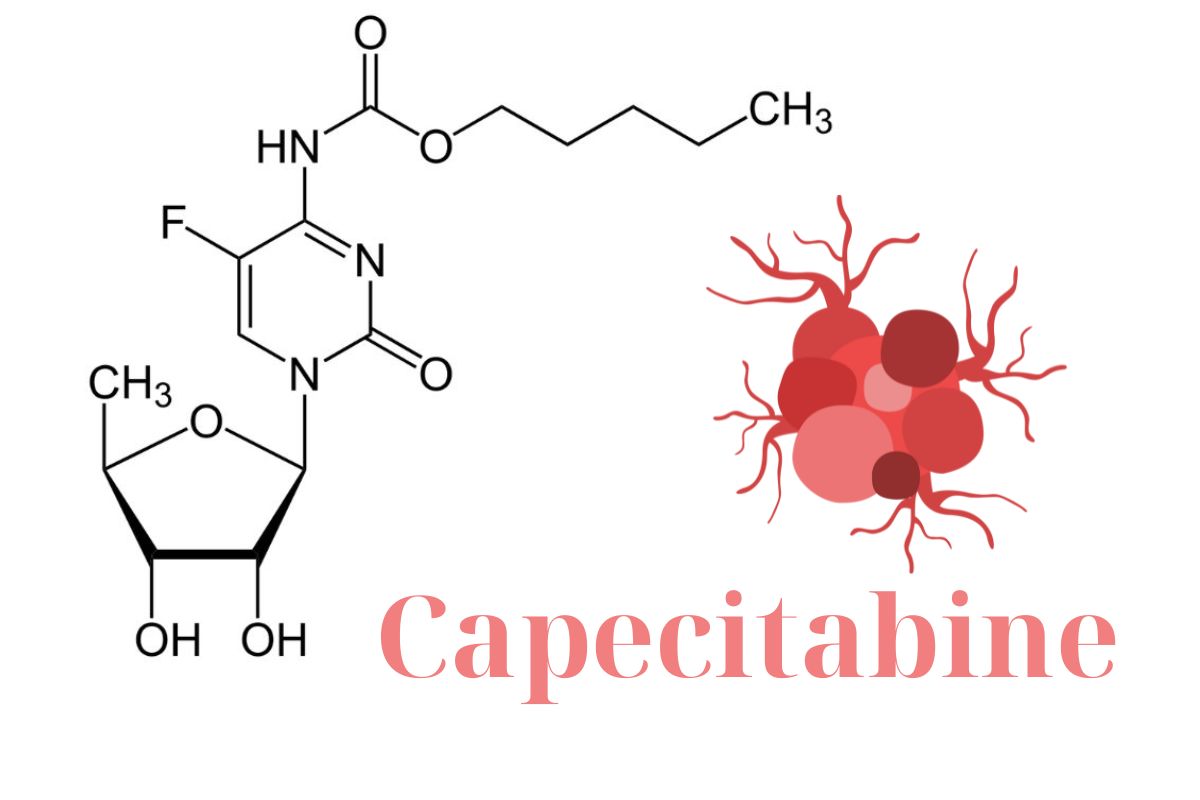
Capecitabine là một este carbamate, có cấu trúc là cytidine trong đó hydro ở vị trí 5 được thay thế bằng flo và trong đó nhóm amin gắn vào vị trí 4 được chuyển đổi thành dẫn xuất carbonyl N-(penyloxy) của nó.
Các tính chất phân tử
Số liên kết hydro cho: 3
Số liên kết hydro nhận: 7
Số liên kết có thể xoay: 7
Diện tích bề mặt tôpô: 121 Ų
Số lượng nguyên tử nặng: 25
Các tính chất đặc trưng
Điểm nóng chảy: 110-121°C
Tỷ trọng riêng: 1.5±0.1 g/cm3
Độ tan trong nước: 26 mg/mL
Hằng số phân ly pKa: 1.9
Chu kì bán hủy: 45 – 60 phút
Khả năng liên kết với Protein huyết tương: <60%
Dạng bào chế
Viên nén 150 mg; Capecitabine 500mg.
Độ ổn định và điều kiện bảo quản
Bảo quản viên nén capecitabin trong lọ kín ở nhiệt độ 15 – 30 °C. Nếu được để trong lọ kín ở nhiệt độ phòng thì thuốc ổn định trong ít nhất là 9 tháng.
Nguồn gốc
Capecitabine là thuốc gì? Capecitabine là một dạng thuốc kháng ung thư thuộc nhóm fluoropyrimidine. Nó được phát triển để chuyển đổi thành 5-fluorouracil (5-FU) trong cơ thể, một chất kháng ung thư có từ lâu đời.
Capecitabine được sử dụng chủ yếu để điều trị ung thư vú và ung thư dạ dày/dày trực tràng ở giai đoạn muộn. Thuốc này thường được sử dụng khi ung thư không phản ứng hoặc tái phát sau các liệu pháp khác.
Capecitabine được phát triển bởi công ty dược phẩm Hoffmann-La Roche và được FDA chấp thuận lần đầu vào năm 1998 dưới tên thương hiệu Xeloda (Xeloda 500mg).
Dược lý và cơ chế hoạt động
Capecitabin trở nên hoạt động khi chuyển hóa thành fluorouracil – một loại thuốc chống chuyển hóa, nhờ sự can thiệp của các enzym. Những enzym này có nồng độ cao hơn trong mô ung thư so với mô khác hoặc huyết tương.
Quá trình chuyển hóa bắt đầu ở gan khi Capecitabin được biến đổi thành 5’-deoxy-5-fluorouridin và sau đó thành 5-fluorouracil ở các mô khác.
Sự tập trung cao của thuốc tại vị trí khối u giúp giảm thiểu tác động độc hại cho cả cơ thể. Cả ở tế bào bình thường và tế bào ung thư, fluorouracil biến đổi thành 5-fluoro-2’-deoxyuridin 5’-monophosphat (FdUMP) và 5-fluorouridin triphosphat (FUTP).
Dù cơ chế hoạt động cụ thể của fluorouracil chưa rõ ràng, FdUMP và một yếu tố folat khác có thể kết hợp với thymidylat synthase, làm giảm sự sản xuất thymidylat và ảnh hưởng đến việc tổng hợp ADN.
Bên cạnh đó, FUTP có thể thay thế uridin triphosphat trong ARN, gây ra sự sai lệch trong quá trình tổng hợp protein.
Fluorouracil chủ yếu ảnh hưởng đến hai giai đoạn của chu trình phân bào: pha G1 và pha S.
Capecitabin cũng cho thấy ảnh hưởng trên một số khối u kháng lại fluorouracil, cho thấy không có sự tương tác hoàn toàn giữa hai thuốc này.
Ứng dụng trong y học
Capecitabine, thường được biết đến với tên thương hiệu Xeloda, đã trở thành một trong những thuốc kháng ung thư quan trọng trong ngành y học từ khi được phát triển. Thuốc này là một prodrug, nghĩa là nó được chuyển đổi thành dạng hoạt động của mình, 5-fluorouracil (5-FU), ngay trong cơ thể người dùng.
Lĩnh vực ứng dụng chính của capecitabine là trong điều trị ung thư vú và ung thư dạ dày/trực tràng. Đối với ung thư vú, nó thường được sử dụng sau khi các phác đồ điều trị tiêu chuẩn khác (như anthracyclines) không còn hiệu quả. Còn đối với ung thư dạ dày và trực tràng, capecitabine thường được sử dụng sau khi phẫu thuật để giảm nguy cơ tái phát bệnh.
Capecitabine có thể được kết hợp với các loại thuốc khác để tăng cường hiệu quả điều trị. Ví dụ, nó có thể được sử dụng cùng với oxaliplatin, một chất kháng ung thư khác, để tạo thành phác đồ điều trị FOLFOX cho bệnh nhân ung thư dạ dày và trực tràng. Bằng cách kết hợp nhiều loại thuốc kháng ung thư, các bác sĩ có thể tiếp cận bệnh từ nhiều góc độ khác nhau, tối đa hóa cơ hội giết chết tế bào ung thư và giảm nguy cơ kháng thuốc.
Với sự tiến bộ trong nghiên cứu ung thư, capecitabine cũng đang được khám phá trong các ứng dụng mới. Một số nghiên cứu đang thử nghiệm hiệu quả của nó đối với các loại ung thư khác, như ung thư tử cung và ung thư tuyến tiền liệt. Dù chưa có kết quả cuối cùng, nhưng triển vọng này cho thấy vai trò của capecitabine trong y học có thể còn mở rộng hơn nữa trong tương lai.
Dược động học
Hấp thu
Khi uống capecitabin, khoảng 70% liều thuốc được hấp thu từ đường tiêu hóa. Nồng độ capecitabin trong huyết tương đạt đỉnh sau khoảng 1,5 giờ, còn fluorouracil sau 2 giờ. Thức ăn ảnh hưởng đến tốc độ và mức hấp thu, từ đó ảnh hưởng đến nồng độ các chất chuyển hóa.
Một nghiên cứu ở Nhật Bản chỉ ra nồng độ thuốc trong người da trắng cao hơn, nhưng lý do chưa rõ.
Phân bố
Capecitabin và các chất chuyển hóa của nó phân bố rộng rãi trong cơ thể, từ khối u, niêm mạc ruột, đến gan và các mô khác. Nghiên cứu trên động vật cho thấy thuốc không qua hàng rào máu-não, và chưa rõ ở người. Nồng độ fluorouracil trong khối u cao hơn nơi khác. Hơn 60% thuốc gắn liền với protein trong huyết tương, chủ yếu là albumin.
Chuyển hóa
Capecitabin chuyển hóa chủ yếu ở gan và khối u. Nửa đời của nó và các chất chuyển hóa, bao gồm fluorouracil, là khoảng từ 45 đến 60 phút. Trong khi đó, α-fluoro-β-alanin (chất chuyển hoá của fluorouracil) có nửa đời khoảng 3 giờ.
Thải trừ
Hầu hết thuốc được loại bỏ qua nước tiểu, với 95,5% dưới dạng chất chuyển hóa và khoảng 3% không thay đổi. Chỉ có một phần nhỏ, khoảng 2,6%, được loại trừ qua phân.
Độc tính ở người
Triệu chứng xuất hiện khi quá liều gồm có cảm giác mệt mỏi, nôn mửa, tiêu chảy, kích thích và chảy máu ở dạ dày, suy tuỷ. Có trường hợp bệnh nhân sử dụng liều 1.657 mg/m2/ngày (chia hai lần) trong vòng 6 tuần gặp phải hiện tượng đỏ da và mất cảm giác ở lòng bàn tay và bàn chân, viêm niêm mạc và tiêu chảy.
Khắc phục tình trạng quá liều capecitabin không dựa vào thuốc đặc biệt nào. Biện pháp chính là ngừng sử dụng thuốc tạm thời và áp dụng các giải pháp hỗ trợ tùy theo triệu chứng xuất hiện. Có thể dùng phương pháp lọc máu để loại bỏ DFUR, một hợp chất chuyển hóa của capecitabin.
Từ tháng 5 năm 2009, FDA của Hoa Kỳ đã xác định uridin triacetat (hay vistonuridin) là một chất giải độc cho fluorouracil, với liều dùng cho người trưởng thành là 10g mỗi 6 giờ, tổng cộng 20 liều sau khi xuất hiện triệu chứng ngộ độc từ 5-FU. Mặc dù không có thông tin cụ thể về tác dụng của uridin triacetat trên ngộ độc capecitabin, nhưng nhiều người tin rằng nó có thể giúp giảm thiểu tác động.
Tính an toàn
Hiện tại, vẫn chưa xác định được liệu capecitabin và các sản phẩm chuyển hóa của nó có được truyền qua nhau thai không. Phụ nữ mang thai nên tránh sử dụng thuốc capecitabin.
Những bệnh nhân đang ở độ tuổi có khả năng mang thai cần được khuyến cáo không nên thụ tinh trong quá trình dùng capecitabin. Trong trường hợp có thai trong quá trình điều trị, hãy tư vấn cho họ về các rủi ro đối với thai nhi.
Về việc capecitabin và các chất chuyển hóa của nó có thể truyền qua sữa mẹ hay không cũng chưa rõ ràng. Tuy nhiên, thí nghiệm trên động vật đã phát hiện ra sự hiện diện của capecitabin và các chất chuyển hóa trong sữa của chuột. Do đó, các bà mẹ đang cho con bú nên ngừng sử dụng capecitabin.
Tương tác với thuốc khác
Tránh kết hợp capecitabin với natalizumab hoặc vắc xin sống.
Sử dụng capecitabin có thể làm tăng hiệu quả hoặc nồng độ của: Các chất ảnh hưởng đến CYP2C9, natalizumab, phenytoin, vắc xin sống và các loại thuốc chống vitamin K.
Đồng thời sử dụng capecitabin và thuốc chống đông coumarin đòi hỏi kiểm tra chỉ số đông máu và có thể cần điều chỉnh liều thuốc.
Capecitabin có thể làm giảm hiệu quả của vắc xin không hoạt động.
Khi kết hợp với acid folinic, liều capecitabin nên giảm (chỉ tối đa 2.000 mg/m2).
Sovuridin và các chất liên quan như brivudin có thể làm gia tăng độc tính, nên chờ ít nhất 4 tuần sau khi dừng các thuốc này mới bắt đầu capecitabin.
Thuốc kháng acid có thể làm tăng nồng độ capecitabin và 5’-DFCR, nên chỉ uống sau ít nhất 2 giờ sau capecitabin.
Không nên kết hợp capecitabin và alopurinol vì alopurinol có thể làm giảm hiệu quả của 5-FU.
Khi dùng cùng interferon alpha-2a, liều tối đa của capecitabin chỉ là 2.000 mg/ngày. Trong trường hợp phối hợp với xạ trị ung thư trực tràng, chỉ nên dùng tối đa 2.000 mg/ngày theo lịch trình liên tục hoặc hàng ngày từ thứ 2-6 trong vòng 6 tuần.
Các thuốc như Leucovorin, levoleucovorin, và trastuzumab có thể làm tăng hiệu quả hoặc nồng độ của capecitabin. Trong khi đó, Echinacea có thể làm giảm hiệu quả của nó.
Lưu ý khi sử dụng Capecitabine
Dùng capecitabin dưới sự giám sát của bác sĩ chuyên ngành có kỹ năng về điều trị ung thư.
Trong quá trình điều trị, có thể cần điều chỉnh liều lượng Thuốc Capecitabine.
Capecitabine tác dụng phụ: Người bệnh nên báo cho bác sĩ biết ngay khi gặp các triệu chứng như: đại tiện thường xuyên, buồn nôn, nôn nhiều lần, tình trạng sưng và đỏ ở bàn chân bàn tay, hoặc các triệu chứng khác như mồm đau. Nếu xuất hiện, dừng thuốc và liên hệ với bác sĩ.
Dùng capecitabin cho người lớn tuổi (≥ 80 tuổi) đòi hỏi sự cẩn trọng vì tác dụng phụ nặng có thể xảy ra.
Người suy gan hoặc có di căn vào gan cũng cần sự giám sát chặt chẽ và thường xuyên kiểm tra chức năng gan. Chưa có thông tin về việc dùng thuốc cho người suy gan nặng.
Đối với người suy thận, cần giảm liều và ngừng thuốc nếu gặp tác dụng phụ nặng.
Dùng capecitabin cho bệnh nhân có tiền sử bệnh tim mạch đòi hỏi sự quan sát chặt chẽ.
Đối với những người dùng thuốc chống đông máu, việc kiểm tra thường xuyên thời gian đông máu là cần thiết.
Capecitabin có thể làm cho người bệnh cảm thấy chóng mặt và mệt mỏi; do đó, người dùng thuốc này nên cẩn thận khi tham gia giao thông hoặc sử dụng máy móc.
Một vài nghiên cứu của Capecitabine trong Y học
Capecitabine trong ung thư vú giai đoạn sớm
Mục đích: Capecitabine là một liệu pháp hiệu quả cho bệnh ung thư vú di căn. Vai trò của nó trong ung thư vú giai đoạn đầu là không chắc chắn do dữ liệu mâu thuẫn từ các thử nghiệm ngẫu nhiên có kiểm soát (RCT).
Phương pháp: PubMed và các thủ tục hội nghị lớn đã được tìm kiếm để xác định các RCT so sánh hóa trị liệu tiêu chuẩn có hoặc không có capecitabine trong môi trường tân dược hoặc tá dược.
Tỷ lệ rủi ro (HRs) đối với tỷ lệ sống sót không mắc bệnh (DFS) và tỷ lệ sống sót chung (OS), cũng như tỷ lệ chênh lệch (OR) đối với độc tính đã được trích xuất hoặc tính toán và tổng hợp trong một phân tích tổng hợp.
Phân tích phân nhóm so sánh ung thư vú bộ ba âm tính (TNBC) với không phải TNBC và liệu capecitabine có được dùng bổ sung hoặc thay cho hóa trị liệu tiêu chuẩn hay không.
Hồi quy meta đã được sử dụng để khám phá ảnh hưởng của TNBC đối với HĐH.
Kết quả: Tám nghiên cứu bao gồm 9302 bệnh nhân đã được đưa vào. Ở những bệnh nhân không được chọn, capecitabine không ảnh hưởng đến DFS (tỷ lệ rủi ro [HR] 0,99, p = 0,93) hoặc OS (HR 0,90, p = 0,36).
Có sự khác biệt đáng kể về DFS khi capecitabine được dùng ngoài điều trị tiêu chuẩn so với khi điều trị tiêu chuẩn thay thế (HR 0,92 so với 1,62, tương tác p = 0,002).
Việc bổ sung capecitabine vào hóa trị liệu tiêu chuẩn có liên quan đến DFS được cải thiện đáng kể ở TNBC so với không TNBC (HR 0,72 so với 1,01, tương tác p = 0,02).
Hồi quy meta cho thấy việc thêm capecitabine vào hóa trị liệu tiêu chuẩn có liên quan đến cải thiện hệ điều hành trong các nghiên cứu với tỷ lệ bệnh nhân mắc TNBC cao hơn (R = -0,967, p = 0,007).
Capecitabine làm tăng tiêu chảy độ 3/4 (tỷ suất chênh [OR] 2,33, p < 0,001) và hội chứng tay chân miệng (OR 8,08, p < 0.
Kết luận: Thêm capecitabine vào hóa trị liệu tiêu chuẩn dường như cải thiện DFS và OS trong TNBC, nhưng làm tăng các tác dụng phụ phù hợp với hồ sơ độc tính đã biết của nó.
Tài liệu tham khảo
- Drugbank, Capecitabine, truy cập ngày 2 tháng 8 năm 2023.
- Natori A, Ethier JL, Amir E, Cescon DW. Capecitabine in early breast cancer: A meta-analysis of randomised controlled trials. Eur J Cancer. 2017 May;77:40-47. doi: 10.1016/j.ejca.2017.02.024. Epub 2017 Mar 27. PMID: 28355581.
- Pubchem, Capecitabine, truy cập ngày 2 tháng 8 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
