Bromfenac
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
2-[2-amino-3-(4-bromobenzoyl)phenyl]acetic acid
Nhóm thuốc
Thuốc chống viêm không Steroid
Mã ATC
S – Các giác quan
S01 – Thuốc mắt
S01B – Các thuốc chống viêm
S01BC – Các thuốc chống viêm không Steroid
S01BC11 – Bromfenac
Mã UNII
864P0921DW
Mã CAS
91714-94-2
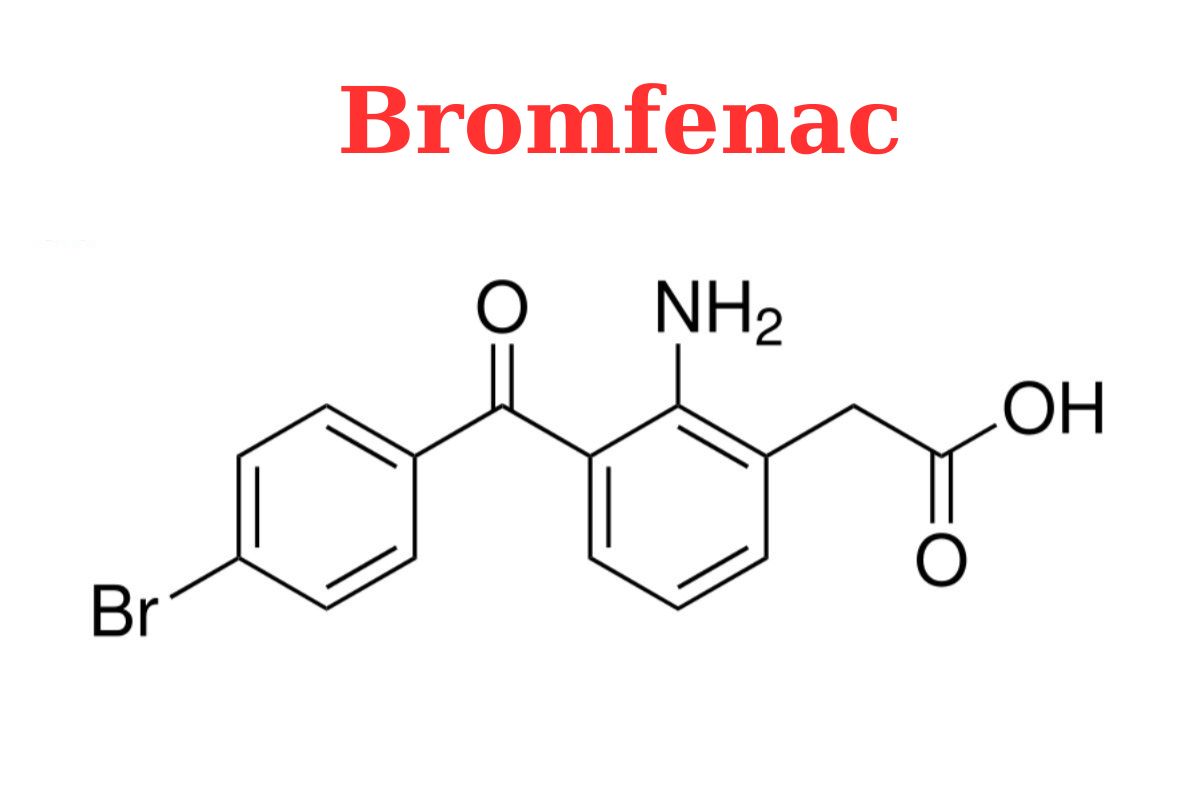
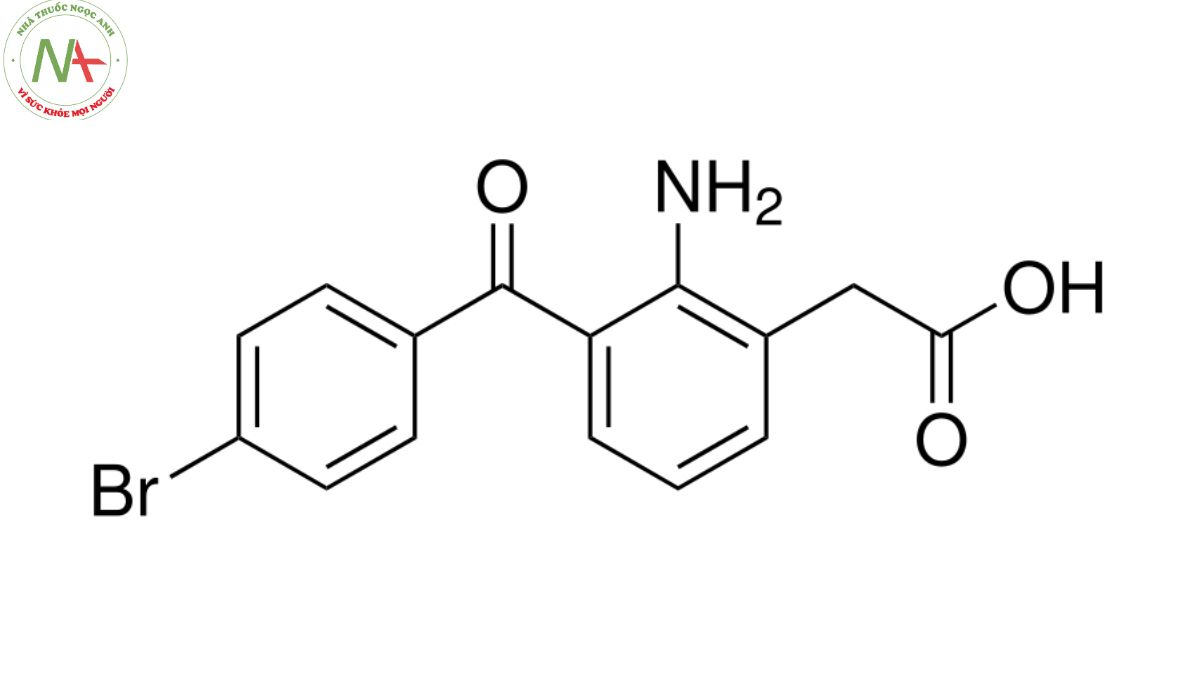
Cấu trúc phân tử
Công thức phân tử
C15H12BrNO3
Phân tử lượng
334.16 g/mol
Cấu trúc phân tử
Bromfenac là amfenac trong đó hydro ở vị trí thứ 4 của nhóm benzoyl được thay thế bằng brom. Nó là dẫn xuất của benzophenones, anilin thay thế, axit amin thơm và hợp chất organobromine.
Các tính chất phân tử
Số liên kết hydro cho: 2
Số liên kết hydro nhận: 4
Số liên kết có thể xoay: 4
Diện tích bề mặt tôpô: 80.4Ų
Số lượng nguyên tử nặng: 20
Các tính chất đặc trưng
Điểm sôi: 562.2±50.0 °C ở 760mmHg
Tỷ trọng riêng: 1.6±0.1 g/cm3
Độ tan trong nước: 0.0126 mg/mL
Hằng số phân ly pKa: 1.59
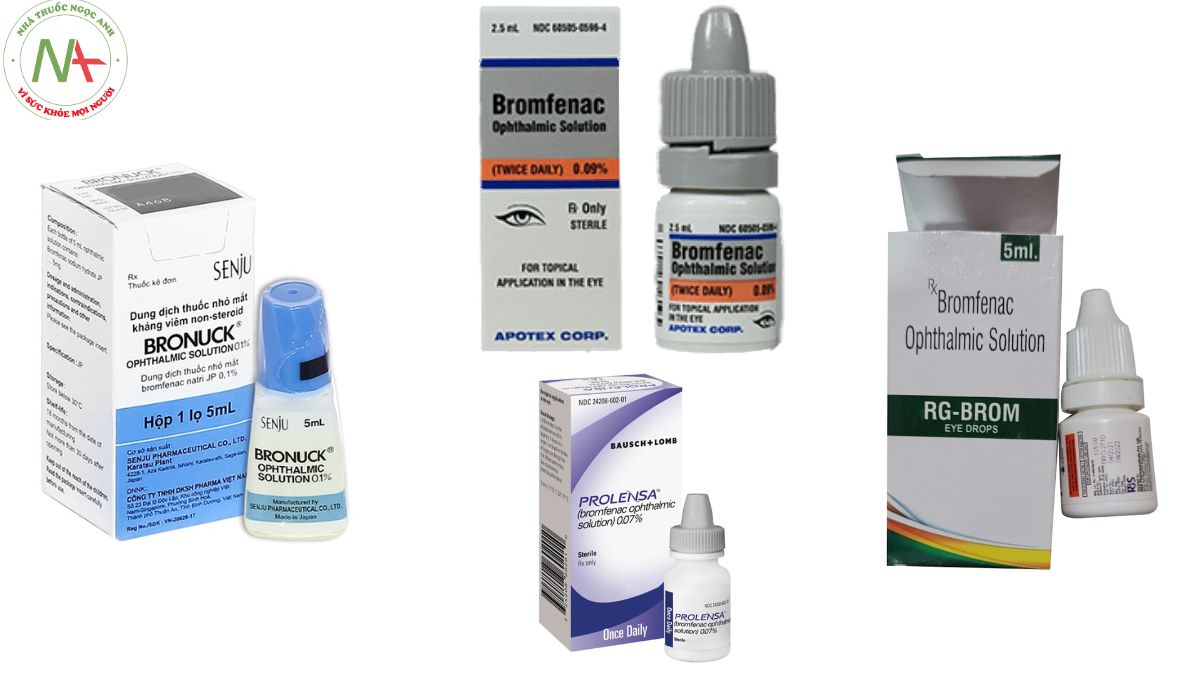
Dạng bào chế
Dung dịch Bromfenac natri hydrat: 0.7 mg/1mL, 0.9 mg/1mL
Độ ổn định và điều kiện bảo quản
Độ ổn định và điều kiện bảo quản của bromfenac phụ thuộc vào nhiều yếu tố, bao gồm nhiệt độ, ánh sáng, độ ẩm và thời gian. Theo hướng dẫn sử dụng, bromfenac nên được bảo quản ở nhiệt độ phòng (khoảng 15-25 độ C) và tránh xa ánh nắng trực tiếp. Ngoài ra, bromfenac không nên được để trong tủ lạnh hoặc đông lạnh, vì điều này có thể làm thay đổi tính chất hóa học của thuốc. Bromfenac cũng nên được sử dụng trong vòng 28 ngày kể từ ngày mở chai lần đầu tiên, và không nên sử dụng quá hạn sử dụng in trên nhãn.
Nguồn gốc
Bronuck là thuốc gì? Bromfenac, dưới hình thức nhãn khoa, đã trở thành sự lựa chọn được tin dùng, với hơn 20 triệu lần kê đơn trên phạm vi toàn cầu. Xuất hiện lần đầu tiên vào năm 2000 tại Nhật Bản dưới cái tên thương mại Thuốc nhỏ mắt Bronuck, loại thuốc nhỏ mắt này sau đó đã nhanh chóng được công nhận trên toàn cầu.
Năm 2005 đánh dấu bước ngoặt khi nó chính thức được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt, và không lâu sau, sản phẩm này đã có mặt trên thị trường Mỹ dưới tên Xibrom với liều dùng hai lần mỗi ngày. Tháng 10 năm 2010 chứng kiến sự ra đời của Bromday, phiên bản cải tiến chỉ cần một liều mỗi ngày, cũng được FDA chấp thuận.
Chưa dừng lại ở đó, vào năm 2013, Prolensa cũng gia nhập danh sách những sản phẩm được FDA đánh giá cao. Từ năm 2011, Bromfenac đã lan rộng tại thị trường Liên minh Châu Âu và đã được phân phối rộng rãi trên thế giới thông qua các thỏa thuận với Bausch & Lomb, Croma-Pharma và nhiều công ty danh tiếng khác.
Trước khi trở thành một sản phẩm nhỏ mắt được yêu thích, Bromfenac đã từng được công ty Wyeth-Ayerst tiếp thị ở Hoa Kỳ dưới dạng viên nén uống Duract, nhằm giảm đau ngắn hạn không quá 10 ngày. Nó được tung ra thị trường vào tháng 7 năm 1997 nhưng đã phải rút lui vào ngày 22 tháng 6 năm 1998 sau khi một số báo cáo chỉ ra nguy cơ nhiễm độc gan ở bệnh nhân sử dụng vượt quá thời gian khuyến nghị.
Dược lý và cơ chế hoạt động
Bromfenac trong dạng dung dịch nhỏ mắt là một phương pháp không phẫu thuật, vô trùng, thuộc nhóm thuốc chống viêm không steroid (NSAID) dành cho lĩnh vực nhãn khoa.
Công dụng chính của Bromfenac được quy cho khả năng hiệu quả của nó trong việc hạn chế sự hình thành của các tuyến tiền liệt, một quá trình nó thực hiện thông qua việc cản trở hoạt động của cyclooxygenase 1 và 2.
Trong các mô hình nghiên cứu động vật, prostaglandin – một yếu tố được biết đến với vai trò làm trung gian cho nhiều dạng viêm nội nhãn – đã được xác định là có liên quan đến nhiều phản ứng viêm.
Các thí nghiệm trên mắt động vật đã minh chứng rằng prostaglandin có thể gây ra các hiện tượng như sự xáo trộn của hàng rào thủy dịch – máu, giãn mạch, tăng tính thấm của mạch máu, sự di chuyển của bạch cầu và sự tăng áp lực bên trong nhãn cầu.
Ứng dụng trong y học
Bromfenac là một loại thuốc thuộc nhóm chống viêm không steroid (NSAID), được biết đến nhiều nhất với công dụng làm giảm viêm và đau sau các phẫu thuật mắt. Thuốc này có hiệu quả trong việc kiểm soát các phản ứng viêm sau can thiệp phẫu thuật, đặc biệt là trong các ca phẫu thuật đục thủy tinh thể và phẫu thuật Lasik. Bromfenac được phát triển với mục đích cải thiện chất lượng điều trị và tăng cường khả năng phục hồi của bệnh nhân sau các tiểu phẫu mắt.
Ứng dụng chính của Bromfenac là trong lĩnh vực nhãn khoa, nơi nó được sử dụng dưới dạng nhỏ mắt. Những giọt thuốc này có khả năng xâm nhập nhanh chóng và sâu vào các mô của mắt, mang lại hiệu quả giảm đau và chống viêm mà không gây ra nhiều tác dụng phụ. Một trong những lợi ích của Bromfenac so với các NSAID khác là khả năng dung nạp tốt và thời gian duy trì tác dụng lâu dài hơn, giúp giảm bớt nhu cầu sử dụng thuốc nhiều lần trong ngày.
Trong quá trình phẫu thuật mắt, việc kiểm soát viêm là rất quan trọng. Viêm có thể gây ra đau, sưng, đỏ và ảnh hưởng đến quá trình lành thương, thậm chí có thể dẫn đến biến chứng nghiêm trọng như phù mắt, tăng nhãn áp, hoặc mờ lớp giác mạc. Bromfenac giúp ngăn chặn quá trình tổng hợp prostaglandins, một loại chất trung gian viêm, qua đó giảm thiểu sự phát triển của các triệu chứng viêm.
Ngoài ra, Bromfenac cũng có ứng dụng trong việc điều trị viêm mắt do các nguyên nhân khác, không chỉ sau phẫu thuật. Đối với các tình trạng như viêm bờ mi, viêm kết mạc hoặc viêm sau khi đeo kính áp tròng, Bromfenac có thể giúp giảm kích ứng, giảm đau và giúp nhanh chóng phục hồi sức khỏe của mắt.
Dược động học
Hấp thu
Bromfenac, khi được nhỏ vào mắt, điều hướng qua giác mạc với hiệu quả cao và đạt nồng độ đỉnh trong thủy dịch chỉ sau khoảng 150 đến 180 phút, sau đó, thuốc sẽ được chuyển hóa với thời gian bán hủy là 1,4 giờ, duy trì nồng độ ổn định trong môi trường mắt trong thời gian lên đến 12 giờ. Đáng chú ý là nồng độ của Bromfenac trong máu thấp đến mức không đủ để phân tích định lượng.
Khi so sánh với amfenac, thì việc cải tiến cấu trúc hóa học của bromfenac bằng cách halogen hóa – cụ thể là thêm nguyên tử brom ở vị trí C4 – đã tăng cường đáng kể khả năng của nó để thâm nhập sâu vào các mô mắt và nâng cao hiệu suất trong việc ức chế các enzyme cyclooxygenase (COX).
Phân bố
Bromfenac chủ yếu được tìm thấy trong thủy dịch và kết mạc, với một lượng nhỏ hơn xuất hiện trong thể thủy tinh. Đặc biệt, có tới 99,8% của hoạt chất này liên kết với các protein trong huyết tương.
Chuyển hóa
Trong quá trình chuyển hóa, enzyme CYP2C9 đóng vai trò quan trọng trong việc biến đổi bromfenac, với các chất chuyển hóa chính được xác định là lactam và các hợp chất liên hợp khác.
Thải trừ
Khoảng 82% của Bromfenac được loại bỏ thông qua nước tiểu, trong khi phần còn lại, khoảng 13%, được đào thải qua phân, phản ánh sự cân bằng trong cách cơ thể xử lý và loại bỏ hoạt chất sau khi nó đã phát huy tác dụng.
Độc tính ở người
Bromfenac dưới dạng thuốc nhỏ mắt, thường được các bệnh nhân dung nạp một cách thuận lợi. Trong những quan sát lâm sàng, một số phản ứng phụ nhẹ đến trung bình đã được ghi nhận, bao gồm các triệu chứng như cảm giác khó chịu tại mắt, chiếm 0.5% trường hợp sử dụng bromfenac, tiếp theo là sự xói mòn giác mạc ở mức độ nhẹ đến trung bình và ngứa mắt cùng lúc ở mức 0.4%, đau mắt 0.3% và kích ứng dẫn đến đỏ mắt cũng ở tỷ lệ 0.3%. Trong khi đó, các tác dụng phụ nặng hơn như việc thủng giác mạc, không hề được ghi nhận trong quá trình nghiên cứu lâm sàng, mà chỉ được báo cáo rải rác, ở tỷ lệ dưới 0.1% sau khi sản phẩm được tung ra thị trường và đến tay người tiêu dùng.
Tính an toàn
Phiên bản dùng cho các ứng dụng khác ngoài nhãn khoa của bromfenac đã không còn xuất hiện trên thị trường Mỹ kể từ năm 1998, sau khi báo cáo về những ca nhiễm độc gan cấp tính liên quan đến bromfenac.
Đối với phụ nữ cho con bú sử dụng bromfenac nhỏ mắt, không có bằng chứng cho thấy nguy cơ tác dụng phụ đối với trẻ sơ sinh. Một biện pháp phòng ngừa được khuyến nghị là áp dụng lực nhẹ lên khu vực ống lệ gần khóe mắt trong ít nhất một phút sau khi nhỏ thuốc, điều này giúp giảm thiểu lượng thuốc có thể chuyển vào sữa mẹ. Thêm vào đó, việc sử dụng khăn giấy để thấm bớt dịch thừa cũng có thể hạn chế việc thuốc đi vào cơ thể.
Về việc sử dụng thuốc này cho trẻ em, đến nay vẫn chưa có thông tin cụ thể nào về sự an toàn hay hiệu quả của nó.
Cũng không có dữ liệu nghiên cứu đặc biệt về tác động của bromfenac đối với những người mắc chứng suy gan hoặc suy thận, do đó cần cân nhắc kỹ lưỡng khi xem xét việc sử dụng thuốc trong các tình huống này.
Tương tác với thuốc khác
Chưa có các nghiên cứu tương tác được thiết kế một cách có hệ thống cho bromfenac. Đến thời điểm này, không ghi nhận được tương tác đáng kể nào giữa bromfenac dưới dạng thuốc nhỏ mắt và các loại thuốc nhỏ mắt kháng sinh khác. Mức độ của bromfenac trong máu sau khi sử dụng thường rất thấp, làm giảm đáng kể khả năng nó tương tác với các loại thuốc dùng qua đường uống.
Lưu ý khi sử dụng Bromfenac
Hãy đảm bảo rằng đầu của lọ thuốc không chạm vào mắt để tránh nhiễm khuẩn.
Nếu bạn đang dùng nhiều loại thuốc nhỏ mắt, hãy tạo ra một khoảng thời gian ít nhất 5 phút giữa các lần nhỏ để tránh sự tương tác giữa chúng.
Bromfenac không nên được sử dụng bởi những người đã có tiền sử phản ứng mẫn cảm với bất kỳ thành phần nào của thuốc, hoặc những người có tiền sử dị ứng với các loại thuốc chống viêm không steroid khác.
Người mắc bệnh hen suyễn, phản ứng dị ứng khi sử dụng aspirin hay các NSAIDs không nên sử dụng sản phẩm này.
Thận trọng khi dùng Bromfenac cho bệnh nhân có nguy cơ cao về chảy máu hoặc đang dùng thuốc có tác dụng chống đông máu. Các phản ứng có thể xảy ra khi sử dụng cùng lúc với aspirin, các dẫn xuất của axit phenylacetic, hoặc NSAIDs khác, đặc biệt ở những người có tiền sử mẫn cảm với các hợp chất này.
Sự cẩn trọng tăng cường nên được áp dụng ở những bệnh nhân có nguy cơ tổn thương mô, giác mạc mỏng, loét giác mạc hoặc thậm chí có khả năng thủng giác mạc khi dùng các NSAIDs đồng thời.
Những người có vấn đề về mắt như mắt mờ, biến dạng giác mạc, bệnh tiểu đường, hội chứng mắt khô hoặc viêm khớp dạng thấp cũng cần được quan tâm đặc biệt khi sử dụng thuốc này.
Trong quá trình điều trị với Bromfenac, việc sử dụng kính áp tròng không được khuyến khích. Nếu bạn cần đeo chúng, hãy gỡ bỏ kính trước khi nhỏ thuốc và chỉ đeo lại sau ít nhất 10 phút để đảm bảo thuốc đã được hấp thụ đầy đủ.
Không bao giờ vượt quá liều lượng đã được chỉ định và ngừng sử dụng ngay lập tức nếu bạn phát hiện ra sản phẩm đã thay đổi màu sắc hoặc có dấu hiệu khác của sự biến chất.
Lưu ý rằng việc sử dụng Bromfenac có thể ảnh hưởng tạm thời đến khả năng lái xe hoặc vận hành máy móc do khả năng gây ra hiện tượng mắt mờ. Trong trường hợp này, hãy dừng việc sử dụng thuốc và không tiếp tục các hoạt động đó cho đến khi thị lực của bạn hoàn toàn phục hồi.
Một vài nghiên cứu của Bromfenac trong Y học
Đánh giá có hệ thống về các NSAID bị rút khỏi thị trường do nhiễm độc gan: bài học rút ra từ kinh nghiệm của bromfenac
Nhiễm độc gan do thuốc là nguyên nhân hàng đầu gây suy gan cấp tính (ALF) ở Hoa Kỳ và là tác dụng phụ phổ biến nhất khiến thuốc không được phê duyệt và thu hồi thuốc bởi Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA). Ba loại thuốc chống viêm không steroid (NSAID) khác nhau đã bị thu hồi ở Anh và/hoặc Mỹ do nhiễm độc gan (bromfenac, ibufenac và benoxaprofen).
Một đánh giá có hệ thống về dữ liệu thử nghiệm lâm sàng đối với các loại thuốc này đã được thực hiện nhằm nỗ lực xác định các tín hiệu ban đầu có thể dự đoán tình trạng nhiễm độc gan nghiêm trọng sau khi đưa thuốc ra thị trường.
Có rất ít dữ liệu được công bố về benoxaprofen và không có dữ liệu nào về ibufenac hoặc bromfenac. Các kho lưu trữ có thể truy cập công khai của FDA đã cung cấp thông tin về bromfenac.
Các triệu chứng giống cúm liên quan đến tăng men gan và trường hợp vàng da tế bào gan có thể liên quan đến thuốc có thể là dấu hiệu của nhiễm độc gan nghiêm trọng trong cơ sở dữ liệu của 1195 đối tượng được FDA xem xét.
Sau khi được phê duyệt, tỷ lệ suy gan cấp tính đối với bromfenac được ước tính vào khoảng 1:10 000. Ngoài ra, cơ sở dữ liệu an toàn của một số loại thuốc cũng được truy cập thông qua kho lưu trữ của FDA đã được xem xét (simvastatin, tacrine, troglitazone và ximelagatran).
Những dữ liệu này cho thấy rằng mặc dù chỉ riêng việc tăng ALT không phải là dấu hiệu đáng tin cậy về nhiễm độc gan nghiêm trọng, nhưng transaminase tăng cao liên quan đến viêm gan hoặc vàng da có triệu chứng có thể là yếu tố dự báo nguy cơ mắc ALF tăng lên.
Tuy nhiên, hiện tại, cơ sở dữ liệu phê duyệt trước thường không đủ lớn để loại trừ tỷ lệ nhiễm độc gan nghiêm trọng thấp. Do đó, điều quan trọng là các bác sĩ lâm sàng phải báo cáo những trường hợp như vậy cho FDA thông qua hệ thống MEDWATCH và các nghiên cứu theo dõi tích cực sau khi đưa thuốc ra thị trường phải được sử dụng để xác định các trường hợp nhiễm độc gan hiếm gặp tiềm ẩn.
Tài liệu tham khảo
- Drugbank, Bromfenac, truy cập ngày 4 tháng 11 năm 2023.
- Goldkind L, Laine L. A systematic review of NSAIDs withdrawn from the market due to hepatotoxicity: lessons learned from the bromfenac experience. Pharmacoepidemiol Drug Saf. 2006 Apr;15(4):213-20. doi: 10.1002/pds.1207. PMID: 16456879.
- Pubchem, Bromfenac, truy cập ngày 4 tháng 11 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Xuất xứ: Hàn Quốc