Bortezomib
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
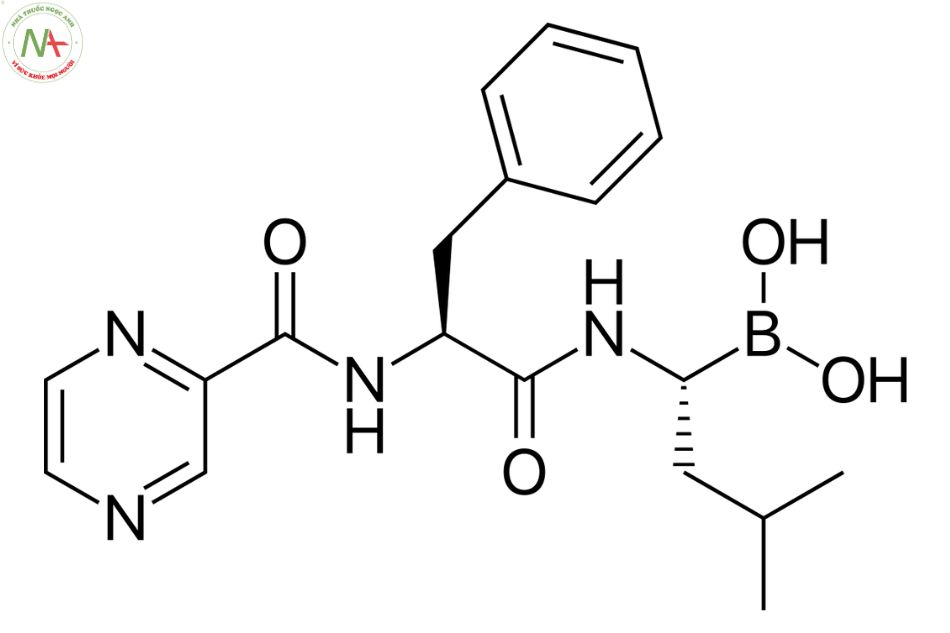
[(1R)-3-methyl-1-[[(2S)-3-phenyl-2-(pyrazine-2-carbonylamino)propanoyl]amino]butyl]boronic acid
Nhóm thuốc
Thuốc thuốc điều trị ung thư. Chất ức chế Proteasome
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Chất chống ung thư
L01X – Thuốc chống ung thư khác
L01XG – Chất ức chế proteasome
L01XG01 – Bortezomib
Mã UNII
69G8BD63PP
Mã CAS
179324-69-7
Xếp hạng phân loại cho phụ nữ có thai
AU TGA loại: C
US FDA loại: D
Cấu trúc phân tử
Công thức phân tử
C19H25BN4O4
Phân tử lượng
384.2 g/mol
Cấu trúc phân tử

Bortezomib là l-Phenylalaninamide được thế ở nitơ amit bằng nhóm 1-(dihydroxyboranyl)-3-metylbutyl và ở N(alpha) bởi nhóm pyrazin-2-ylcarbonyl.
Bortezomib là một axit boronic dipeptidyl ức chế thuận nghịch proteasome 26S.
Các tính chất phân tử
Số liên kết hydro cho: 4
Số liên kết hydro nhận: 6
Số liên kết có thể xoay: 9
Diện tích bề mặt tôpô: 124 Ų
Số lượng nguyên tử nặng: 28
Các tính chất đặc trưng
Điểm nóng chảy: 139-143 oC
Độ hòa tan trong nước: 5,32e-02g/L
LogP: 2.0
Áp suất hơi: 5,1X10-20 mm Hg ở 25 °C (est)
Hằng số Định luật Henry: 3,4X10-22 atm-cu m/mol ở 25 °C (est)
Khả năng liên kết protein: 83%
Thời gian bán hủy: 9 đến 15 giờ
Cảm quan
Bortezomib có dạng bột tinh thể trắng hoặc gần trắng. Bortezomib thường được sản xuất dưới dạng bột khô để hòa tan trước khi sử dụng do độ tan trong nước của Bortezomib thấp.
Dạng bào chế
Bột pha tiêm 1 mg, 2.5 mg, 3.5 mg.
Độ ổn định và điều kiện bảo quản của Bortezomib
Bortezomib, được bán dưới tên thương hiệu Velcade.
Bortezomib thường được cung cấp dưới dạng dạng lyophilized (bột khô) hoặc dạng dung dịch tiêm.
Trước khi sử dụng, bột khô cần phải được hòa tan trong dung môi phù hợp để tạo thành dung dịch tiêm. Tuy nhiên, không cần bảo quản lạnh Bortezomib khi ở dạng bột khô.
Bortezomib dung dịch tiêm đã được hòa tan có thể được bảo quản ở nhiệt độ phòng (20-25°C) trong vòng 8 giờ. Nếu không sử dụng ngay sau khi hòa tan, dung dịch cần được bảo quản trong tủ lạnh ở nhiệt độ 2-8°C và không được đông cứng.
Nếu không sử dụng ngay sau khi mở gói bột khô, cần bảo quản trong điều kiện nhiệt độ phòng, khô ráo và tránh ánh sáng trực tiếp.
Nguồn gốc
Bortezomib ban đầu được sản xuất vào năm 1995 tại Myogenics.
Bortezomib đã được Millennium Pharmaceuticals đưa vào thử nghiệm lâm sàng vào 10 năm 1999.
Vào tháng 5 năm 2003, bortezomib đã được Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt để sử dụng trong bệnh đa u tủy.
Vào năm 2004, Bortezomib được phê duyệt sử dụng ở Liên minh Châu Âu.
Vào tháng 8 năm 2014, Bortezomib đã được phê duyệt tại Hoa Kỳ để điều trị lại cho người lớn mắc bệnh đa u tủy, những người trước đây đã đáp ứng với liệu pháp Velcade và tái phát ít nhất sáu tháng sau khi hoàn thành đợt điều trị trước đó.
Vào tháng 10 năm 2014, Bortezomib đã được phê duyệt tại Hoa Kỳ để điều trị cho những người chưa từng điều trị mắc bệnh ung thư hạch tế bào vỏ (MCL).
Dược lý và cơ chế hoạt động
Thuốc điều trị ung thư Bortezomib hoạt động bằng cách ức chế proteasome, một hệ thống quan trọng trong tế bào giúp phân hủy các protein không cần thiết hoặc bị hư hỏng. Proteasome có vai trò quan trọng trong quá trình kiểm soát các chất thừa (ubiquitin-proteasome) trong tế bào, giúp loại bỏ các protein hư hỏng, không cần thiết, và cân bằng quá trình sinh học.
Khi Bortezomib được tiêm vào cơ thể, nó tương tác với proteasome trong tế bào ung thư và hình thành các phức tạp enzyme không hoạt động. Quá trình này làm gián đoạn chức năng của proteasome, ngăn chặn quá trình phân hủy protein và làm tăng tích tụ các protein không mong muốn trong tế bào ung thư. Việc tích tụ các protein này gây ra một số tác động có lợi đối với điều trị ung thư, như:
Ngừng sự phát triển của tế bào ung thư: Do các protein không cần thiết không được phân hủy, quá trình điều chỉnh của tế bào ung thư sẽ bị ảnh hưởng, dẫn đến ngừng sự phát triển và tồn tại của tế bào ung thư.
Kích hoạt cơ chế tự hủy tế bào: Sự tích tụ protein không mong muốn gây ra mất cân bằng bên trong tế bào, dẫn đến kích hoạt cơ chế tự hủy tế bào (apoptosis), giúp loại bỏ các tế bào ung thư bất thường.
Ức chế sự phát triển của mạch máu: Bortezomib cũng có thể làm giảm sự hình thành các mạch máu mới (angiogenesis) trong khối u, ngăn chặn sự cung cấp máu và các chất dinh dưỡng cho tế bào ung thư.
Ứng dụng trong y học của Bortezomib
Bortezomib có nhiều ứng dụng quan trọng trong lĩnh vực y học, đặc biệt là trong điều trị ung thư.
Điều trị u bạch cầu plasma (multiple myeloma): Bortezomib được sử dụng như một phần của chế độ điều trị dùng cho bệnh nhân mắc u bạch cầu plasma giai đoạn tiến triển hoặc tái phát. Nó hoạt động bằng cách ức chế hoạt động của proteasome trong tế bào ung thư, làm giảm sự tồn tại và phát triển của tế bào ung thư.
Điều trị lymphoma tế bào T: Bortezomib cũng được sử dụng trong một số trường hợp điều trị lymphoma tế bào T. Thuốc có thể giúp kiểm soát tăng trưởng tế bào ung thư và giảm kích thước của khối u.
Các loại ung thư khác: Bortezomib đang được nghiên cứu và sử dụng trong một số loại ung thư khác như ung thư đa u tuyến, ung thư phổi, ung thư vú, ung thư tiền liệt tuyến và các loại ung thư khác.
Dược động học
Hấp thu
Dùng liều 1,0mg/m2 và 1,3mg/m2 tiêm tĩnh mạch Bortezomib ở bệnh nhân đa u tủy, Cmax thu được lần lượt là 57 và 112ng/ml đối với liều đầu tiên, đối với những liều tiếp theo, Cmax tăng dần theo liều.
Cmax sau khi tiêm dưới da (20,4 ng/mL) thấp hơn so với tiêm tĩnh mạch (223 ng/mL). Tỷ lệ phân bố biểu kiến trung bình là 0,99 với khoảng tin cậy 90% từ 80,18% đến 122,80%.
Phân bố
Thể tích phân bố trung bình của Bortezomib khoảng từ 1600 – 32000 L. Bortezomib được phân bố rộng đến các mô ở ngoại biên.
Khả năng liên kết với protein huyết khoảng 83% với nồng độ từ 100-1000 ng/mL.
Chuyển hóa
Bortezomib chuyển hóa chủ yếu bằng sự oxy hóa nhờ hệ cytochrome P450 3A4, 1A2, 2C19. Ngoài ra, Bortezomib còn được chuyển hóa một phần nhỏ qua các hệ enzyme CYP 2D6 và 2C9.
Quá trình chuyển hóa diễn ra chủ yếu là nhờ sự chuyển hóa boronate thành 2 chất chuyển hóa khử boronate, loại bỏ acid boronic ra khỏi hợp chất gốc, sau đó bị thủy phân để tạo ra nhiều chất chuyển hóa khác.
Một chất chuyển hóa khác không có hoạt tính là deboronate-bortezomib cũng được tạo ra, chất này hoạt động chỉ ức chế proteasome 26S và hơn 30 chất chuyển hóa đã được xác định trong các nghiên cứu trên người và động vật.
Thải trừ
Bortezomib được thải trừ qua thận và gan
Thời gian bán thải trung bình (t1/2) của bortezomib khi sử dụng đa liều dao động từ 40-193 giờ.
Với liều dùng đầu tiên, Bortezomib được thải trừ nhanh hơn so với những liều tiếp theo.
Tốc độ thải trừ ra khỏi cơ thể vào khoảng 100 – 112 L/giờ cho cả hai liều 1,0mg/m2 và 1,3mg/m2. Những liều tiếp theo, tốc độ thải trừ giảm dần vào khoảng 15-32L/ giờ.
Phương pháp sản xuất
Không có thông tin
Độc tính của Bortezomib
Liều gây độc thấp nhất được công bố (TD Lo ) ở chuột là 5 mg/kg/14D sau khi tiêm trong màng bụng với liều ngắt quãng và 1,6 mg/kg/12D sau khi tiêm dưới da với liều liên tục.
Liều điều trị của bortezomib được kê theo từng trường hợp bệnh nhân để ngăn ngừa quá liều.
Hậu quả gây tử vong xảy ra ở người sau khi sử dụng hơn hai lần liều điều trị khuyến cáo của bortezomib.
Các triệu chứng do quá liều bao gồm khởi phát cấp tính triệu chứng hạ huyết áp và giảm tiểu cầu.
Vì không có thuốc giải độc cho trường hợp quá liều bortezomib, nên cần theo dõi các dấu hiệu sinh tồn và chăm sóc hỗ trợ kịp thời khi nghi ngờ quá liều thuốc.
Các nghiên cứu ở khỉ và chó, nhịp tim tăng, giảm khả năng co bóp, hạ huyết áp và tử vong đã được quan sát thấy với liều tiêm tĩnh mạch thấp gấp hai lần liều khuyến cáo trên lâm sàng tính theo mg/m2.
Một trường hợp tăng nhẹ khoảng QT đã điều chỉnh dẫn đến tử vong đã xảy ra trong các nghiên cứu trên chó.
Tương tác của Bortezomib với thuốc khác
Dùng chung ketoconazole hay ritonavir với bortezomib kết quả cho thầy AUC của bortezomib tăng ~ 35%.
Dùng các thuốc điều trị tiểu đường dạng uống chung với Bortezomib có thể làm thay đổi nồng độ glucose trong máu.
Polyphenol khi dùng chung với bortezomib làm giảm hiệu quả của bortezomib, tương tác này được phát hiện trong các thí nghiệm nuôi cấy tế bào.
Lưu ý khi dùng Bortezomib
Lưu ý và thận trọng chung
Bortezomib cần được kê đơn và hướng dẫn sử dụng bởi các bác sĩ có kinh nghiệm trong các trường hợp kháng ung thư.
Các chứng bệnh thần kinh ngoại biên
Bortezomib có thể gây ra các bệnh lý thần kinh ngoại biên đặc biệt là bệnh trên thần kinh cảm giác ngoại biên.
Ngoài ra, một số báo cáo còn cho thấy có xuất hiện bệnh lý thần kinh vận động nghiêm trọng kèm theo.
Bệnh nhân có tiền sử mắc các triệu chứng (tê, đau tay chân) hoặc các dấu hiệu đau thần kinh ngoại biên khác khi dùng Bortezomib có thể sẽ bị nặng thêm.
Các triệu chứng đau thần kinh như tăng cảm, dị cảm, cảm giác nóng bỏng, khó chịu, suy kiệt.
Cân nhắc thay đổi liều và lịch trình điều trị Bortezomib nếu như bệnh nhân mới bị đau thần kinh ngoại biên.
Hạ huyết áp
Trong các nghiên cứu về đơn trị liệu giai đoạn 2 và 3 cho bệnh ung thư đa u tủy, tỷ lệ bệnh nhân bị hạ huyết áp (bao gồm cả tư thế đứng) rơi vào khoảng 11%.
Do đó, cần thận trọng khi điều trị Bortezomib đối với những bệnh nhân có tiền sử hạ huyết áp và những bệnh nhân có triệu chứng mất nước.
Để kiểm soát các triệu chứng có thể điều chỉnh liều thuốc Bortezomib, bù nước, có thể sử dụng thêm các thuốc nhóm mineralcorticoids hoặc các chất kích thích thần kinh giao cảm.
Rối loạn trên tim
Các trường hợp suy tim cấp tính hoặc cấp kịch phát, và/hoặc giảm phân suất tống máu thất trái cũng đã được ghi nhận.
Việc theo dõi chặt chẽ bệnh nhân có yếu tố nguy cơ tim mạch là rất quan trọng.
Trong nghiên cứu đơn trị liệu về đa u tủy ở giai đoạn 3, tỷ lệ rối loạn tim mạch do dùng Bortezomib vào khoảng 15% .
Tỷ lệ các biến cố suy tim (bao gồm suy tim, sốc tim, phù phổi cấp, suy tim xung huyết, phù phổi) khi được điều trị bằng Bortezomib là khoảng 5%
Rối loạn ở gan
Rối loạn gan cấp tính là trường hợp hiếm gặp và thường xuất hiện ở những bệnh nhân đang dùng nhiều loại thuốc và có các bệnh lý nghiêm trọng khác.
Các rối loạn khác tại gan được ghi nhận bao gồm tăng men gan, tăng bilirubin máu và viêm gan.
Rối loạn ở phổi
Báo cáo về viêm phổi thâm nhiễm lan tỏa cấp tính do các tác nhân gây bệnh không rõ nguyên nhân, bao gồm viêm phổi khu trú, viêm phổi mô kẽ, thâm nhiễm phổi và Hội chứng Suy hô hấp cấp (Acute Respiratory Distress Syndrome: ARDS) đã được ghi nhận ở những bệnh nhân dùng Bortezomib, tuy nhiên trường hợp này rất hiếm và có thể gây tử vong.
Các xét nghiệm
Cần thực hiện các xét nghiệm thường quy để kiểm tra thông số huyết đồ (đếm máu toàn phần) trong suốt quá trình điều trị Bortezomib.
Giảm tiểu cầu
Giảm tiểu cầu là một biến cố phổ biến trong suốt quá trình điều trị với Bortezomib và ảnh hưởng tới khoảng 43% bệnh nhân.
Trong nghiên cứu đơn trị liệu giai đoạn 3 về đa u tủy, tỷ lệ các biến cố chảy máu quan trọng (đạt độ 3) khi dùng Bortezomib là 4%. Do đó, cần theo dõi lượng tiểu cầu trước khi tiêm mỗi liều Bortezomib.
Nếu lượng tiểu cầu dưới 25.000/mcL, cần ngưng điều trị Bortezomib hoặc giảm liều khi sử dụng lại thuốc.
Đã có báo cáo về việc xuất huyết đường tiêu hóa và xuất huyết não trong quá trình dùng Bortezomib. Khi có các biến cố này xảy ra, cân nhắc việc truyền máu cho bệnh nhân.
Lưu ý cho người đang mang thai
Trong các nghiên cứu ở chuột và thỏ, Bortezomib không gây quái thai ở liều cao nhất được thử nghiệm.
Tuy nhiên, các nghiên cứu vân chưa kết luận được bortezomib có qua nhau thai hay không. Bên cạnh đó các nghiên cứu ở phụ nữ có thai dùng Bortezomib vẫn chưa đủ dữ kiện. Bệnh nhân cần được tư vấn về các biện pháp tránh thai trong lúc điều trị Bortezomib.
Trong trường hợp, phụ nữ có khả năng mang thai nên tránh điều trị bằng Bortezomib hoặc có biện pháp tránh mang thai.
Lưu ý cho người đang cho con bú
Tương tự như dữ liệu trên phụ nữ đang mang thai, vẫn chưa có kết luận từ các nghiên cứu rằng Bortezomib có được bài tiết vào sữa mẹ hay không. Do đó, không khuyến cáo sử dụng Bortezomib trong thời gian đang cho con bú.
Lưu ý cho người vận hành máy móc hay lái xe
Một số tác dụng không mong muốn của Bortezomib như: hạ huyết áp, choáng váng, mệt mỏi, mệt lả,… do đó bệnh nhân làm những công việc đặc biệt như lái xe hay vận hành máy móc cần cẩn trọng khi dùng Bortezomib.
Một vài nghiên cứu về Bortezomib trong Y học
Carfilzomib và dexamethasone so với bortezomib và dexamethasone cho bệnh nhân đa u tủy tái phát hoặc kháng trị (ENDEAVOR): một nghiên cứu ngẫu nhiên, giai đoạn 3, nhãn mở, đa trung tâm
Đặt vấn đề: Bortezomib với dexamethasone là một lựa chọn điều trị tiêu chuẩn cho bệnh đa u tủy tái phát hoặc kháng trị. Carfilzomib với dexamethasone đã cho thấy hoạt động đầy hứa hẹn ở những bệnh nhân trong môi trường bệnh này. Mục đích của nghiên cứu này là so sánh sự kết hợp của carfilzomib và dexamethasone với bortezomib và dexamethasone ở những bệnh nhân bị đa u tủy tái phát hoặc khó điều trị.
phương pháp: Trong nghiên cứu đa trung tâm, giai đoạn 3, ngẫu nhiên, nhãn mở, này, những bệnh nhân mắc bệnh đa u tủy tái phát hoặc kháng trị đã được điều trị từ một đến ba lần trước đó được chỉ định ngẫu nhiên (1:1) bằng cách sử dụng sơ đồ ngẫu nhiên bị chặn (kích thước khối là bốn) để nhận carfilzomib với dexamethasone (nhóm carfilzomib) hoặc bortezomib với dexamethasone (nhóm bortezomib). Việc ngẫu nhiên hóa được phân tầng theo liệu pháp ức chế proteasome trước đó, các phương pháp điều trị trước đó, giai đoạn Hệ thống Phân loại Giai đoạn Quốc tế và lộ trình sử dụng bortezomib theo kế hoạch nếu được chỉ định ngẫu nhiên bortezomib cùng với dexamethasone. Bệnh nhân được điều trị cho đến khi bệnh tiến triển với carfilzomib (20 mg/m(2) vào ngày 1 và 2 của chu kỳ 1; 56 mg/m(2) sau đó; truyền tĩnh mạch trong 30 phút) và dexamethasone (20 mg uống hoặc truyền tĩnh mạch) hoặc bortezomib (1·3 mg/m(2); bolus tĩnh mạch hoặc tiêm dưới da) và dexamethasone (20 mg uống hoặc truyền tĩnh mạch). Tiêu chí đánh giá chính là sự sống còn không bệnh tiến triển trong quần thể được điều trị theo ý định. Tất cả những người tham gia đã nhận được ít nhất một liều thuốc nghiên cứu đều được đưa vào phân tích an toàn. Nghiên cứu đang diễn ra nhưng không đăng ký người tham gia; kết quả cho phân tích tạm thời của điểm cuối chính được trình bày. Thử nghiệm được đăng ký tại ClinicalTrials.gov, số Tiêu chí đánh giá chính là sự sống còn không bệnh tiến triển trong quần thể được điều trị theo ý định. Tất cả những người tham gia đã nhận được ít nhất một liều thuốc nghiên cứu đều được đưa vào phân tích an toàn. Nghiên cứu đang diễn ra nhưng không đăng ký người tham gia; kết quả cho phân tích tạm thời của điểm cuối chính được trình bày. Thử nghiệm được đăng ký tại ClinicalTrials.gov, số Tiêu chí đánh giá chính là sự sống còn không bệnh tiến triển trong quần thể được điều trị theo ý định. Tất cả những người tham gia đã nhận được ít nhất một liều thuốc nghiên cứu đều được đưa vào phân tích an toàn. Nghiên cứu đang diễn ra nhưng không đăng ký người tham gia; kết quả cho phân tích tạm thời của điểm cuối chính được trình bày.
Kết quả: Từ ngày 20 tháng 6 năm 2012 đến ngày 30 tháng 6 năm 2014, 929 bệnh nhân được chỉ định ngẫu nhiên (464 người vào nhóm carfilzomib; 465 người vào nhóm bortezomib). Thời gian theo dõi trung bình là 11·9 tháng (IQR 9·3-16·1) ở nhóm carfilzomib và 11·1 tháng (8·2-14·3) ở nhóm bortezomib. Thời gian sống không bệnh tiến triển trung bình là 18·7 tháng (95% CI 15·6-không ước tính được) ở nhóm carfilzomib so với 9·4 tháng (8·4-10·4) ở nhóm bortezomib theo một phân tích tạm thời được lên kế hoạch trước (nguy cơ tỷ lệ [HR] 0·53 [KTC 95% 0·44-0·65]; p<0·0001). Tử vong trong nghiên cứu do tác dụng phụ xảy ra ở 18 (4%) trong số 464 bệnh nhân ở nhóm carfilzomib và 16 (3%) trong số 465 bệnh nhân ở nhóm bortezomib. Các tác dụng phụ nghiêm trọng đã được báo cáo ở 224 (48%) trong số 463 bệnh nhân trong nhóm carfilzomib và 162 (36%) trong số 456 bệnh nhân trong nhóm bortezomib.
Tài liệu tham khảo
- Drugbank, Bortezomib , truy cập ngày 26/07/2023.
- Pubchem, Bortezomib, truy cập ngày 26/07/2023.
- Dimopoulos, M. A., Moreau, P., Palumbo, A., Joshua, D., Pour, L., Hájek, R., … & Chng, W. J. (2016). Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): a randomised, phase 3, open-label, multicentre study. The Lancet Oncology, 17(1), 27-38.
