Bicalutamide
Danh pháp
Tên chung quốc tế
Tên danh pháp theo IUPAC
N-[4-cyano-3-(trifluoromethyl)phenyl]-3-(4-fluorophenyl)sulfonyl-2-hydroxy-2-methylpropanamide
Nhóm thuốc
Thuốc chống androgen
Mã ATC
L – Chất chống ung thư và tác nhân điều hòa miễn dịch
L02 – Liệu pháp nội tiết tố
L02B – Hormone antagonists và các tác nhân liên quan
L02BB – Chống Androgen
L02BB03 – Bicalutamide
Phân loại nguy cơ cho phụ nữ có thai
X
Mã UNII
A0Z3NAU9DP
Mã CAS
90357-06-5
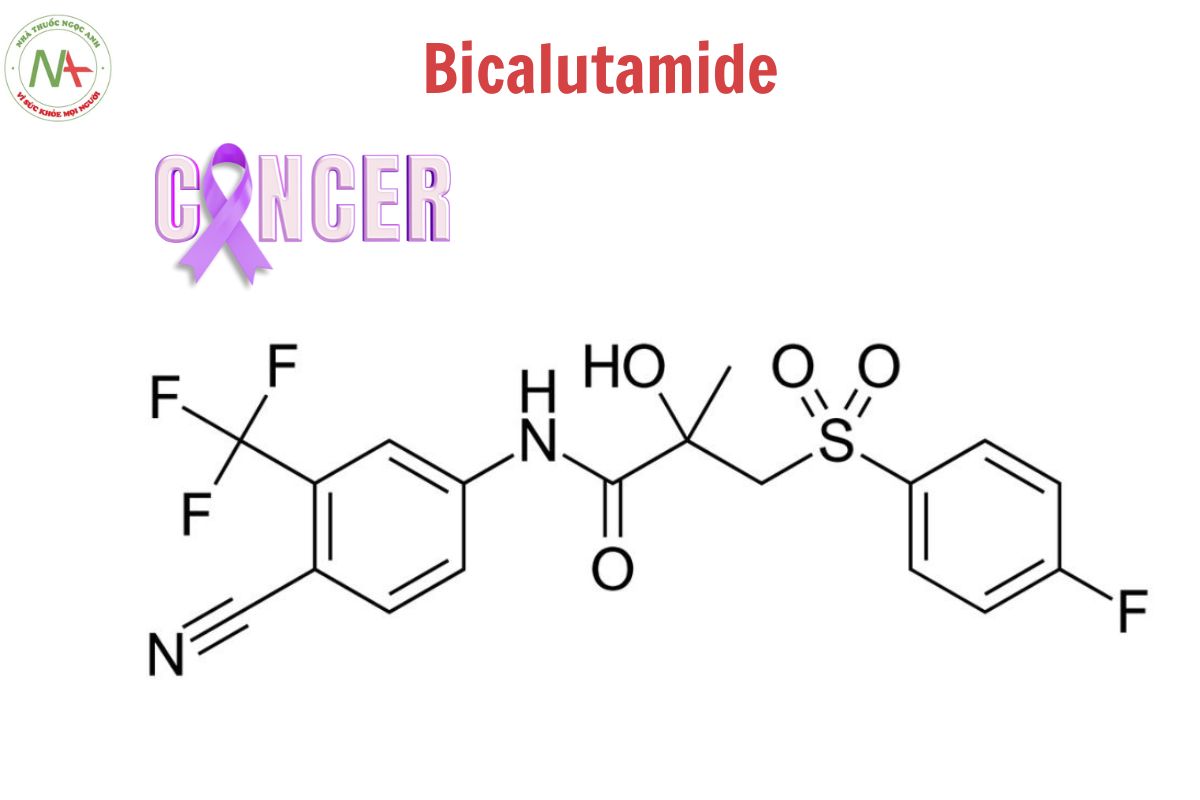
Cấu trúc phân tử
Công thức phân tử
C18H14F4N2O4S
Phân tử lượng
430.4 g/mol
Cấu trúc phân tử
Bicalutamide là dẫn xuất của nhóm (triflometyl)benzen, có cấu trúc là 4-amino-2-(triflometyl)benzonitril trong đó một trong các amino hydro được thế bằng nhóm 3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-metylpropanoyl.
Các tính chất phân tử
Số liên kết hydro cho: 2
Số liên kết hydro nhận: 9
Số liên kết có thể xoay: 5
Diện tích bề mặt tôpô: 116Ų
Số lượng nguyên tử nặng: 29
Các tính chất đặc trưng
Điểm nóng chảy: 191-193 °C
Điểm sôi: 650.3±55.0 °C ở 760 mmHg
Tỷ trọng riêng: 1.5±0.1 g/cm3
Độ tan trong nước: 5mg/L
Hằng số phân ly pKa: 12.0
Chu kì bán hủy: 5,9 ngày
Khả năng liên kết với Protein huyết tương: 96%
Dạng bào chế
Viên nén Bicalutamide 50 mg (Casodex 50mg), 150 mg
Độ ổn định và điều kiện bảo quản
Bicalutamide được coi là ổn định trong điều kiện bình thường. Tuy nhiên, như với bất kỳ loại thuốc nào, nó có thể bị phân hủy theo thời gian hoặc trong môi trường không phù hợp. Do đó, Bicalutamide cần được bảo quản đúng cách để duy trì độ ổn định và đảm bảo tính hiệu quả của nó.
Nguồn gốc
Bicalutamide là một trong số các kháng androgen không steroid (NSAA) hiện đang được bán trên thị trường, có nguồn gốc từ việc biến đổi cấu trúc của flutamide. Ban đầu, flutamide được tổng hợp như một tác nhân kìm khuẩn vào năm 1967 tại Schering Plow Corporation, và sau đó tình cờ được phát hiện có hoạt tính kháng androgen.
Bicalutamide được khám phá bởi Tucker và các đồng nghiệp tại Imperial Chemical Industries (ICI) trong những năm 1980. Nó được lựa chọn để phát triển từ một nhóm gồm hơn 2.000 hợp chất được tổng hợp. Bicalutamide nhận được bằng sáng chế lần đầu tiên vào năm 1982 và lần đầu tiên được báo cáo trong tài liệu khoa học vào tháng 6 năm 1987.
Được nghiên cứu lâm sàng giai đoạn I vào năm 1987, Bicalutamide sau đó đã tham gia thử nghiệm lâm sàng giai đoạn II đầu tiên để điều trị bệnh ung thư tuyến tiền liệt vào năm 1990. Sau đó, công ty dược phẩm của ICI tách ra thành một công ty độc lập có tên là Zeneca vào năm 1993. Zeneca, sau này trở thành AstraZeneca sau khi sáp nhập với Astra AB vào năm 1999, bắt đầu tiếp thị Bicalutamide vào tháng 4 và tháng 5 năm 1995, trước khi nhận được sự chấp thuận để điều trị ung thư tuyến tiền liệt ở Hoa Kỳ.
Bicalutamide lần đầu tiên được giới thiệu ở Vương quốc Anh vào tháng 5 năm 1995 và sau đó đã nhận được sự chấp thuận từ FDA Hoa Kỳ vào ngày 4 tháng 10 năm 1995, để điều trị ung thư tuyến tiền liệt kết hợp với chất tương tự GnRH ở liều 50 mg/ngày.
Sau khi được phê duyệt để sử dụng kết hợp với chất tương tự GnRH, Bicalutamide tiếp tục được phát triển dưới dạng đơn trị liệu với liều 150 mg/ngày để điều trị ung thư tuyến tiền liệt và đã nhận được sự chấp thuận cho chỉ định này ở Châu Âu, Canada và một số quốc gia khác vào cuối những năm 1990 và đầu những năm 2000. Tuy nhiên, ứng dụng này của Bicalutamide cuối cùng không được chấp thuận tại Hoa Kỳ.
Tại Nhật Bản, Bicalutamide đã được cấp phép với liều 80 mg/ngày đơn lẻ hoặc kết hợp với chất tương tự GnRH để điều trị ung thư tuyến tiền liệt. Liều duy nhất 80 mg của Bicalutamide được sử dụng ở Nhật Bản dựa trên quan sát về sự khác biệt về dược động học ở nam giới Nhật Bản.
Sau những kết quả tiêu cực về đơn trị liệu bằng Bicalutamide đối với ung thư tuyến tiền liệt cục bộ (LPC) trong chương trình lâm sàng ung thư tuyến tiền liệt sớm (EPC), việc phê duyệt Bicalutamide để sử dụng đặc biệt trong điều trị LPC đã bị rút lại ở một số quốc gia, bao gồm Vương quốc Anh (vào tháng 10 hoặc tháng 11 năm 2003) và một số quốc gia châu Âu khác và Canada (vào tháng 8 năm 2003). Tuy nhiên, Bicalutamide vẫn hiệu quả và tiếp tục được phê duyệt và sử dụng trong điều trị ung thư tuyến tiền liệt tiến triển cục bộ (LAPC) và ung thư tuyến tiền liệt di căn (mPC).
Bảo vệ bằng sáng chế của Bicalutamide đã hết hạn ở Hoa Kỳ vào tháng 3 năm 2009, và từ đó trở đi, loại thuốc này đã có sẵn dưới dạng thuốc generic với chi phí giảm đáng kể.
Bicalutamide là loại thuốc kháng androgen thứ tư (và NSAA thứ ba) được giới thiệu để điều trị ung thư tuyến tiền liệt, đứng sau kháng androgen steroid (SAA) và cyproteron axetat (CPA) năm 1973, flutamide của NSAA năm 1983 (1989 ở Hoa Kỳ), và nilutamide năm 1989 (1996 ở Hoa Kỳ). Tiếp theo là abiraterone acetate vào năm 2011, enzalutamide vào năm 2012, apalutamide vào năm 2018 và darolutamide vào năm 2019, và có thể được theo sau bởi các loại thuốc đang phát triển như proxalutamide và seviteronel.
Dược lý và cơ chế hoạt động
Bicalutamide là một chất nội tiết tố chống ung thư chủ yếu được sử dụng trong điều trị ung thư tuyến tiền liệt. Bicalutamide là thuốc kháng androgen tinh khiết, không steroid có ái lực với các thụ thể androgen (nhưng không có ái lực với các thụ thể progestogen, estrogen hoặc glucocorticoid). Do đó, Bicalutamide ngăn chặn hoạt động của androgen có nguồn gốc từ tuyến thượng thận và tinh hoàn kích thích sự phát triển của mô tuyến tiền liệt bình thường và ác tính. Ung thư tuyến tiền liệt chủ yếu phụ thuộc vào nội tiết tố nam và có thể được điều trị bằng phẫu thuật hoặc thiến. Cho đến nay, liệu pháp đơn trị liệu bằng thuốc kháng androgen vẫn chưa được chứng minh là tương đương với việc thiến.
Bicalutamide hoạt động bằng cách cạnh tranh với androgen để gắn các thụ thể androgen, do đó ngăn chặn hoạt động của androgen có nguồn gốc từ tuyến thượng thận và tinh hoàn, kích thích sự phát triển của mô tuyến tiền liệt bình thường và ác tính.
Ứng dụng trong y học
Bicalutamide là một loại thuốc có ứng dụng quan trọng trong y học, đặc biệt trong điều trị ung thư tuyến tiền liệt. Đây là một loại kháng androgen không steroid (NSAA), hoạt động bằng cách đối kháng tác dụng của hormone androgen trong cơ thể.
Bicalutamide đã chứng minh tính hiệu quả trong điều trị ung thư tuyến tiền liệt, một loại ung thư phổ biến ảnh hưởng đến nam giới trên toàn thế giới. Loại ung thư này xuất phát từ tuyến tiền liệt, một phần quan trọng của hệ thống sinh sản nam giới. Điều quan trọng là ung thư tuyến tiền liệt thường phát triển dưới tác động của hormone androgen, chẳng hạn như testosterone, cung cấp nguồn năng lượng cho sự tăng trưởng và phân chia của tế bào ung thư. Do đó, việc kiểm soát hoạt động hormone androgen trong cơ thể là mục tiêu chính trong điều trị bệnh này.
Bicalutamide đóng vai trò quan trọng trong việc chặn tác động của hormone androgen lên tế bào ung thư tuyến tiền liệt. Khi uống bicalutamide, thuốc sẽ tương tác với các thụ thể hormone androgen trên bề mặt của tế bào ung thư, ngăn chặn tác động của hormone và giảm sự tăng trưởng của khối u. Điều này giúp kiểm soát và giảm kích thước của khối u, từ đó làm chậm tiến triển của bệnh và giảm nguy cơ lan rộng sang các cơ quan khác trong cơ thể.
Bicalutamide thường được sử dụng kết hợp với các loại thuốc khác trong điều trị ung thư tuyến tiền liệt, như chất tương tự gonadotropin (GnRH) hoặc thuốc giảm lượng hormone androgen. Khi kết hợp với chất tương tự GnRH, bicalutamide cùng nhóm với thuốc kháng androgen khác như abiraterone acetate và enzalutamide để tạo thành một chiến lược điều trị toàn diện. Chiến lược này giúp giảm cung cấp hormone androgen trong cơ thể, ngăn chặn tác động của chúng lên tế bào ung thư và ngăn chặn việc phát triển của bệnh.
Tóm lại, bicalutamide là một loại thuốc quan trọng và hiệu quả trong điều trị ung thư tuyến tiền liệt. Nhờ khả năng kiểm soát hoạt động hormone androgen, nó đã đem lại lợi ích to lớn trong việc ngăn chặn tiến triển của bệnh và cải thiện chất lượng cuộc sống cho bệnh nhân nam giới.
Dược động học
Hấp thu
Bicalutamide được hấp thu hiệu quả sau khi uống, tuy chưa có thông tin chính xác về sinh khả dụng tuyệt đối của thuốc.
Phân bố
Tỉ lệ liên kết của bicalutamide với protein huyết tương là 96%, điều này có ý nghĩa là hầu hết lượng thuốc trong máu được gắn kết với protein.
Chuyển hóa
Bicalutamide trải qua một quá trình chuyển hóa đặc biệt. Đồng phân S (không hoạt động) chủ yếu được chuyển hóa thông qua quá trình glucuronid hóa. Trong khi đó, đồng phân R (hoạt động) cũng trải qua quá trình glucuronid hóa, nhưng sau đó bị oxy hóa thành chất chuyển hóa không hoạt động, trước khi tiếp tục qua quá trình glucuronid hóa.
Thải trừ
Độ thanh thải của bicalutamide là 0.32 L/h và thời gian bán thải của thuốc là 5,9 ngày, điều này cho thấy tốc độ loại trừ khá chậm, giúp duy trì hiệu quả của thuốc trong cơ thể trong thời gian dài.
Phương pháp sản xuất
Có một số phương pháp tổng hợp hóa học đã được công bố liên quan đến bicalutamide. Quy trình tổng hợp bicalutamide lần đầu tiên được công bố như sau:
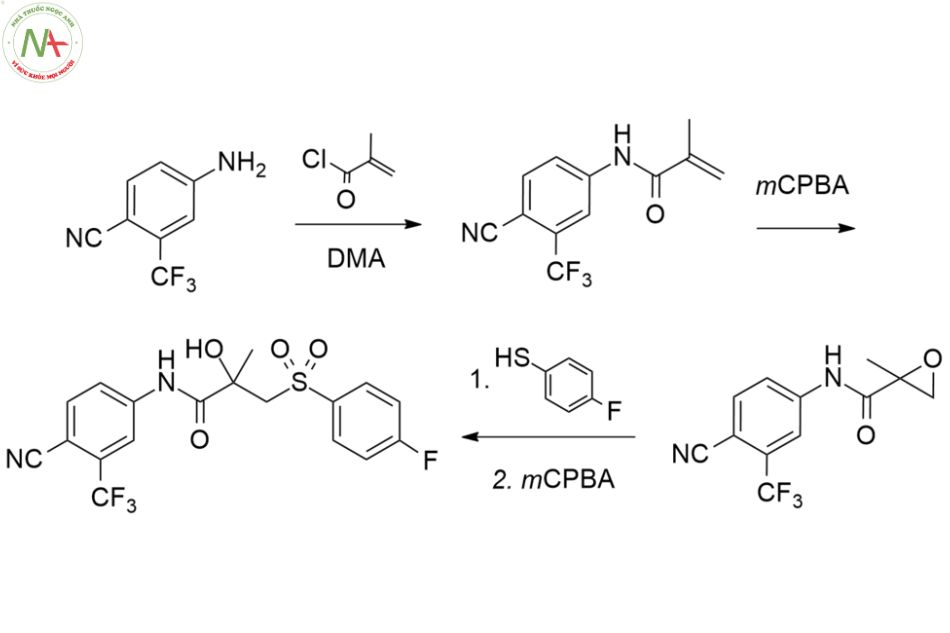
Độc tính ở người
Các tác dụng phụ phổ biến nhất của bicalutamide được gây ra bởi đặc tính dược lý của nó là phong tỏa thụ thể androgen cạnh tranh và bao gồm chứng vú to ở nam giới, bốc hỏa, mệt mỏi và giảm ham muốn tình dục. Mặc dù không phổ biến, nhưng kết quả xét nghiệm chức năng gan cũng tăng khi điều trị bằng bicalutamide.
Các thử nghiệm lâm sàng dài hạn đã được tiến hành với liều lượng bicalutamide lên đến 200 mg mỗi ngày và những liều lượng này đã được dung nạp tốt. Một liều bicalutamide duy nhất dẫn đến các triệu chứng quá liều được coi là đe dọa đến tính mạng chưa được thiết lập.
Tính an toàn
Bicalutamide không có chỉ định cho phụ nữ và không nên sử dụng cho nhóm đối tượng này, đặc biệt đối với các tình trạng không nghiêm trọng hoặc không đe dọa đến tính mạng.
Các nghiên cứu trên động vật và hoặc con người, hoặc các báo cáo điều tra hoặc sau khi đưa ra thị trường, đã chứng minh bằng chứng tích cực về những bất thường hoặc rủi ro đối với thai nhi rõ ràng vượt trội hơn bất kỳ lợi ích nào có thể có đối với bệnh nhân.
Không biết liệu thuốc bicalutamide có bài tiết qua sữa mẹ hay không. Vì nhiều loại thuốc được bài tiết qua sữa mẹ, nên thận trọng khi dùng bicalutamide cho phụ nữ đang cho con bú.
Tương tác với thuốc khác
Các nghiên cứu về sự gắn kết với protein in vitro đã chỉ ra rằng bicalutamide có thể thay thế các chất chống đông máu coumarin khỏi các vị trí gắn kết. Thời gian prothrombin nên được theo dõi chặt chẽ ở những bệnh nhân đã dùng thuốc chống đông máu coumarin bắt đầu dùng bicalutamide.
Các nghiên cứu in vitro đã chỉ ra rằng R-bicalutamide là chất ức chế CYP 3A4 và các nghiên cứu lâm sàng đã chỉ ra rằng khi sử dụng đồng thời bicalutamide, nồng độ trung bình của midazolam (một chất nền của CYP 3A4) có thể tăng lên 1,5 lần (đối với Cmax) và 1,9 lần (đối với AUC). Do đó, nên thận trọng khi sử dụng đồng thời bicalutamid với các cơ chất của CYP 3A4.
Lưu ý khi sử dụng Bicalutamide
Các trường hợp phản ứng quá mẫn hiếm gặp, bao gồm phù mạch và nổi mày đay, và các trường hợp hiếm gặp của bệnh phổi kẽ, bao gồm viêm phổi kẽ và xơ phổi, đã được báo cáo với bicalutamide.
Tổn thương gan nặng, trong một số trường hợp dẫn đến nhập viện và/hoặc tử vong, hiếm khi được báo cáo khi điều trị bằng bicalutamide. Nhiễm độc gan thường xảy ra trong vòng 3-4 tháng đầu điều trị bằng bicalutamide. Viêm gan hoặc tăng rõ rệt nồng độ transaminase gan trong huyết thanh dẫn đến ngừng điều trị bằng bicalutamide đã được báo cáo ở 1% bệnh nhân dùng thuốc trong các thử nghiệm lâm sàng có đối chứng.
Nồng độ transaminase huyết thanh nên được đo trước khi bắt đầu điều trị bằng bicalutamide, đều đặn trong 4 tháng đầu điều trị và định kỳ sau đó. Nếu xảy ra các dấu hiệu hoặc triệu chứng lâm sàng gợi ý rối loạn chức năng gan (ví dụ: đau bụng, buồn nôn, nôn, chán ăn, mệt mỏi, các triệu chứng “giống cúm”, nước tiểu sẫm màu, vàng da hoặc đau hạ sườn phải), nên đo ngay nồng độ transaminase huyết thanh (đặc biệt là ALT). Nên ngừng sử dụng bicalutamide ngay lập tức ở bất kỳ bệnh nhân nào bị vàng da hoặc tăng nồng độ ALT huyết thanh lớn hơn 2 lần giới hạn trên của mức bình thường và cần theo dõi chặt chẽ chức năng gan.
Chương trình điều trị ung thư tuyến tiền liệt sớm (EPC) bicalutamide đã chỉ ra rằng các biến cố ở vú, được định nghĩa là chứng vú to ở nam giới, đau vú hoặc cả hai, là một hạn chế đáng kể của bicalutamide. Gần 90% bệnh nhân trải qua một hoặc cả hai triệu chứng và gần 16% bệnh nhân rút khỏi chương trình EPC do biến cố vú do bicalutamide gây ra.
Một vài nghiên cứu của Bicalutamide trong Y học
Hiệu quả và tác dụng phụ của thuốc ức chế thụ thể androgen thế hệ thứ hai và thông thường đối với ung thư tuyến tiền liệt kháng thiến
Bối cảnh: Thuốc ức chế thụ thể androgen thế hệ thứ hai (ARI) đã được phát triển và phê duyệt để điều trị ung thư tuyến tiền liệt kháng thiến (CRPC). Thiếu sự so sánh trực tiếp về hiệu quả điều trị và tác dụng phụ giữa ARI thông thường (bicalutamide) và ba ARI thế hệ thứ hai (enzalutamide, apalutamide và darolutamide).
Phương pháp: Phân tích tổng hợp mạng lưới của chúng tôi đã đánh giá tác dụng điều trị và tác dụng phụ của ARI thông thường (bicalutamide) và ARI thế hệ thứ hai trong điều trị CRPC. Chúng tôi đã tìm kiếm một cách có hệ thống cơ sở dữ liệu Pubmed, thư viện Cochrane và Embase để tìm các nghiên cứu đã xuất bản cho đến tháng 10 năm 2022 và chỉ đưa vào các thử nghiệm lâm sàng ngẫu nhiên (RCT).
Tỷ lệ sống sót không tiến triển, tỷ lệ sống sót không tiến triển của kháng nguyên đặc hiệu tuyến tiền liệt (PSA), tỷ lệ sống sót chung (PFS/PSA-PFS/OS), tỷ lệ đáp ứng PSA và các tác dụng phụ tương đối (AE) của bệnh nhân CRPC đã được thu thập và tổng hợp. Sau đó chúng tôi đã thực hiện phân tích phân nhóm. Các quan sát CRPC (nm/mCRPC) không di căn và di căn được phân tích riêng. Phân tích dữ liệu được thực hiện bằng phần mềm R (4.2.1) dựa trên khung Bayesian.
Kết quả: 6.993 đối tượng từ bảy RCT đủ điều kiện đã được phân tích. Enzalutamide, apalutamide và darolutamide hiệu quả hơn bicalutamide trong điều trị CRPC và hiệu suất của darolutamide kém hơn một chút so với hai ARI thế hệ thứ hai khác. Tỷ lệ tác dụng phụ tương tự cũng được quan sát thấy giữa các thuốc ARI thế hệ thứ hai và bicalutamide.
Apalutamide cho thấy tỷ lệ AE cấp độ 3+ cao hơn một chút, tỷ lệ cai thuốc liên quan đến AE và tỷ lệ tử vong liên quan đến AE. Bệnh nhân dùng enzalutamide có tỷ lệ tăng huyết áp và mệt mỏi cao hơn đáng kể. Trong phân tích phân nhóm, enzalutamide cho thấy hiệu quả điều trị tốt hơn so với bicalutamide ở cả hai nhóm nmCRPC và mCRPC. Trong nhóm nmCRPC, enzalutamide và apalutamide có nhiều lợi ích hơn đối với PFS và PSA-PFS so với darolutamide. Chúng tôi đã hiển thị bản đồ xếp hạng xác suất của PFS, PSA-PFS, HĐH, thời gian hóa trị liệu gây độc tế bào, tỷ lệ đáp ứng PSA và kết quả AE tương đối.
Kết luận: Phân tích tổng hợp mạng hiện tại chỉ ra rằng ARI thế hệ thứ hai vượt trội so với ARI thông thường, bicalutamide. Ba ARI thế hệ thứ hai cho thấy sự tương đương không hoàn toàn trong điều trị CRPC. Darolutamide kém hiệu quả hơn một chút so với enzalutamide và apalutamide.
Các tác dụng phụ của apalutamide tồi tệ hơn các tác dụng phụ khác, nhưng không có ý nghĩa thống kê nào được ghi nhận trong số các tác dụng không mong muốn quan trọng này. Tất cả các ARI thường được dung nạp tốt. Những kết quả này có thể cung cấp tài liệu tham khảo cho quyết định lâm sàng và các thử nghiệm so sánh trực tiếp hơn nữa.
Tài liệu tham khảo
- Drugbank, Bicalutamide, truy cập ngày 25 tháng 7 năm 2023.
- Pubchem, Bicalutamide, truy cập ngày 25 tháng 7 năm 2023.
- Zhang, X., Zhang, G., Wang, J., & Bi, J. (2023). The efficacy and adverse events of conventional and second-generation androgen receptor inhibitors for castration-resistant prostate cancer: A network meta-analysis. Frontiers in endocrinology, 14, 1131033. https://doi.org/10.3389/fendo.2023.1131033
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
Xuất xứ: Việt Nam