Bevacizumab
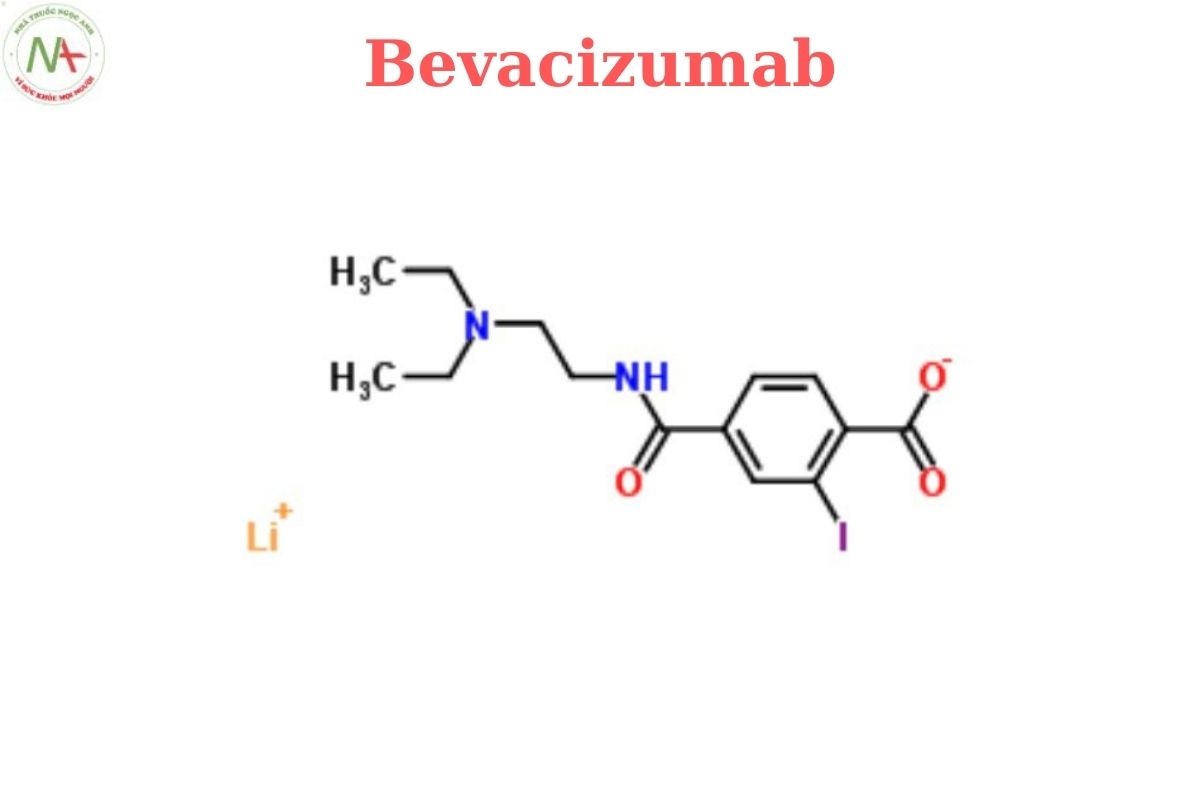
Danh pháp
Tên chung quốc tế
Nhóm thuốc
Thuốc chống ung thư
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Chất chống ung thư
L01F – Kháng thể đơn dòng và thuốc kháng thể liên hợp
L01FG – Chất ức chế Vegf/vegfr (yếu tố tăng trưởng nội mô mạch máu)
L01FG01 – Bevacizumab
S – Cơ quan cảm giác
S01 – Nhãn khoa
S01L – Tác nhân gây rối loạn mạch máu mắt
S01LA – Thuốc chống xơ vữa động mạch
S01LA08 – Bevacizumab
Phân loại nguy cơ cho phụ nữ mang thai
C
Mã UNII
2S9ZZM9Q9V
Mã CAS
216974-75-3
Cấu trúc phân tử
Công thức phân tử
C6538H10034N1716O2033S44
Phân tử lượng
149000.0 Da
Cấu trúc phân tử
Bevacizumab là một kháng thể đơn dòng được tổng hợp (mAb)
Các tính chất đặc trưng
Điểm nóng chảy: 61 °C
Độ pH: 6,2
Chu kì bán hủy: 20 ngày
Khả năng liên kết với Protein huyết tương: >97%
Dạng bào chế
Dung dịch tiêm: 25 mg/ml, 100 mg/4 ml, Bevacizumab 400 mg/16 ml
Độ ổn định và điều kiện bảo quản
Bevacizumab nên được lưu trữ trong tủ lạnh ở nhiệt độ từ 2°C đến 8°C. Tránh để nó ở nhiệt độ cao hoặc bị đông lạnh.
Nguồn gốc
Bevacizumab, một loại kháng thể đơn dòng tái tổ hợp, đã được nhân bản và đưa vào sử dụng lâm sàng từ năm 2004, trở thành chất ức chế sự hình thành mạch đầu tiên được ứng dụng trong điều trị bệnh nhân. Sự tiến bộ của nó xuất phát từ việc khám phá yếu tố tăng trưởng nội mô mạch máu của con người (VEGF) bởi nhà khoa học Napoleone Ferrara của Genentech trong phòng thí nghiệm.
Thực nghiệm của Ferrara đã chứng minh rằng kháng thể chống lại VEGF có khả năng ức chế sự phát triển khối u ở chuột. Công trình này đã xác nhận giả thuyết của Judah Folkman từ năm 1971, nhằm ngăn chặn sự hình thành mạch máu nhằm kiểm soát sự phát triển của ung thư.
Dược lý và cơ chế hoạt động
Bevacizumab là một kháng thể đơn dòng tái tổ hợp, liên kết với yếu tố tăng trưởng có nguồn gốc từ nội mô mạch máu lưu thông (VEGF) và ngăn cản tác dụng của nó bằng cách ngăn chặn sự kết hợp với các thụ thể tương ứng. Điều này dẫn đến hiệu quả giảm tín hiệu xuôi dòng của VEGF. Bevacizumab đã được chứng minh là có khả năng tái thiết hệ thống mạch máu bình thường tại khu vực khối u, tăng cung cấp chất dinh dưỡng và oxy, đồng thời cải thiện việc vận chuyển thuốc hóa trị liệu đến vị trí mục tiêu.
Tuy nhiên, VEGF cũng đóng vai trò quan trọng trong nhiều quá trình sinh lý khác nhau, bao gồm tạo mạch máu, tạo bạch huyết, điều hòa huyết áp, chữa lành vết thương, đông máu và lọc thận. Việc ngăn chặn VEGF có thể ức chế sự tiến triển của bệnh ung thư, nhưng cũng có thể gây ra những tác dụng không mong muốn do vai trò quan trọng của VEGF trong những quá trình này.
VEGF được phiên mã do yếu tố gây thiếu oxy (HIF) trong môi trường thiếu oxy. Khi VEGF tuần hoàn, nó kết hợp với các thụ thể VEGF (VEGFR-1 và VEGFR-2) trên tế bào nội mô, gây ra nhiều hiệu ứng xuôi dòng khác nhau. Điều này cũng áp dụng cho các đồng thụ thể neuropilin (NRP-1 và NRP-1), làm tăng cường tín hiệu.
Trong trường hợp ung thư, tế bào ung thư kích thích sự hình thành mạch máu khối u bằng cách giải phóng VEGF, dẫn đến việc hình thành mạng mạch máu chưa trưởng thành và không có sự tổ chức. Môi trường vi mô thiếu oxy tạo điều kiện thuận lợi cho sự sống sót của tế bào khối u và tạo ra môi trường khá phức tạp đối với hệ thống miễn dịch. Vì vậy, VEGF đã trở thành mục tiêu quan trọng của các loại thuốc chống ung thư như bevacizumab.
Bevacizumab, một loại kháng thể đơn dòng, thực hiện tác dụng của mình bằng cách liên kết và làm cho VEGF huyết thanh không hoạt động. Khi VEGF được liên kết với kháng thể, nó không thể tương tác với các thụ thể trên bề mặt tế bào của nó và tín hiệu xuôi dòng bị ức chế. Điều này ngăn ngừa sự hình thành mạch máu mới, giảm sự phát triển mạch máu của khối u và giảm cung cấp máu cho khối u.
Một điểm đáng chú ý là có bằng chứng cho thấy VEGF được điều chỉnh tăng ở bệnh nhân mắc COVID-19, do đó, bevacizumab đang được nghiên cứu để điều trị các biến chứng liên quan. Mức độ cao của VEGF có thể góp phần vào phù phổi, hội chứng suy hô hấp cấp tính (ARDS) và tổn thương phổi cấp tính (ALI). Các nhà khoa học hy vọng rằng bằng cách ức chế VEGF, bevacizumab có thể điều trị hiệu quả ARDS và ALI, cả hai là đặc điểm chung của các trường hợp COVID-19 nặng.
Ứng dụng trong y học
Ung thư đại trực tràng
Bevacizumab đã được chấp thuận tại Hoa Kỳ vào tháng 2 năm 2004 để sử dụng trong điều trị ung thư đại trực tràng di căn kết hợp với phương pháp điều trị hóa trị tiêu chuẩn (là phương pháp điều trị đầu tiên). Vào tháng 6 năm 2006, nó cũng đã được chấp thuận để sử dụng trong điều trị ung thư đại trực tràng di căn bậc hai kết hợp với liệu pháp dựa trên 5-fluorouracil. Bevacizumab đã nhận được sự chấp thuận từ Cơ quan Dược phẩm Châu Âu (EMA) vào tháng 1 năm 2005 để điều trị bệnh ung thư đại trực tràng.
Ngoài ra, bevacizumab cũng đã được thử nghiệm như một chất bổ sung cho các loại thuốc hóa trị khác cho bệnh nhân mắc ung thư ruột kết không di căn. Tuy nhiên, dữ liệu từ hai nghiên cứu lớn ngẫu nhiên chỉ ra rằng không có lợi ích trong việc ngăn ngừa tái phát ung thư và có khả năng gây hại trong ngữ cảnh này.
Tại Liên minh châu Âu (EU), bevacizumab kết hợp với hóa trị liệu dựa trên fluoropyrimidine được chỉ định để điều trị ung thư biểu mô di căn của đại tràng hoặc trực tràng ở người lớn.
Ung thư phổi
Vào năm 2006, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã chấp thuận bevacizumab để sử dụng trong điều trị ung thư phổi không tế bào nhỏ không vảy ở giai đoạn tiến triển đầu tiên kết hợp với hóa trị liệu carboplatin/paclitaxel. Lời khuyên của Mạng lưới Ung thư Toàn diện Quốc gia (US NCCN) cho rằng bevacizumab nên được sử dụng như phương pháp điều trị đầu tiên kết hợp với bất kỳ hóa trị liệu dựa trên bạch kim nào và sau đó tiếp tục duy trì bevacizumab cho đến khi bệnh tiến triển.
Ở EU, bevacizumab được chỉ định để điều trị ung thư phổi không phải tế bào nhỏ tiến triển, tái phát hoặc di căn không thể cắt bỏ ngoài mô học chủ yếu là tế bào vảy khi kết hợp với liệu pháp hóa trị dựa trên bạch kim. Bevacizumab kết hợp với erlotinib cũng được chỉ định để điều trị ung thư phổi không phải tế bào nhỏ không tế bào vảy tiến triển, di căn hoặc tái phát không thể cắt bỏ với các đột biến kích hoạt Receptor yếu tố tăng trưởng biểu bì (EGFR).
Ung thư vú
Vào tháng 12 năm 2010, Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) đã thông báo rằng họ đang dự định loại bỏ chỉ định bevacizumab trong điều trị ung thư vú, vì không có bằng chứng chứng minh tính an toàn và hiệu quả của nó đối với bệnh nhân ung thư vú.
Kết quả tổng hợp từ bốn thử nghiệm lâm sàng khác nhau chỉ ra rằng bevacizumab không kéo dài thời gian sống chung và không làm chậm tiến triển bệnh đủ để vượt qua nguy cơ mà nó gây ra cho bệnh nhân. Do đó, FDA cấm Genentech tiếp thị bevacizumab cho việc điều trị ung thư vú. Tuy nhiên, các bác sĩ vẫn có thể sử dụng bevacizumab ngoài nhãn hiệu, nhưng việc này thường không được bảo hiểm duyệt.
Vào tháng 6 năm 2011, một hội đồng của FDA đã bác bỏ đơn kháng cáo của Roche liên quan đến việc chấp thuận bevacizumab cho việc điều trị ung thư vú. Hội đồng chuyên gia ung thư đã lần thứ hai ra phán quyết rằng Avastin (tên thương mại của bevacizumab) không nên được sử dụng cho bệnh nhân ung thư vú, và điều này đã mở đường cho chính phủ Hoa Kỳ loại bỏ sự chứng thực của bevacizumab đối với loại thuốc này.
Cuộc họp của ủy ban tư vấn về thuốc ung thư của FDA vào tháng 6 năm 2011 đã là bước cuối cùng trong quá trình kháng cáo của nhà sản xuất. Uỷ ban kết luận rằng không có bằng chứng hỗ trợ việc sử dụng bevacizumab trong điều trị ung thư vú, không cải thiện chất lượng cuộc sống và có những tác dụng phụ đáng kể.
Ung thư thận
Ở một số bệnh ung thư thận, bevacizumab đã cải thiện thời gian sống không bệnh tiến triển, nhưng không có tác động tích cực đáng kể đến tỷ lệ sống sót chung. FDA đã chấp thuận bevacizumab để sử dụng trong điều trị ung thư tế bào thận di căn (một dạng ung thư thận) vào năm 2009 sau khi nhận được các báo cáo trước đó về hiệu quả của nó. Bevacizumab cũng đã được chấp thuận tại EU từ năm 2007 để điều trị ung thư tế bào thận.
Ung thư não
Bevacizumab làm chậm sự phát triển của khối u trong trường hợp u nguyên bào thần kinh đệm, nhưng không ảnh hưởng đến tỷ lệ sống sót chung. FDA đã cấp phép nhanh việc sử dụng bevacizumab để điều trị u nguyên bào thần kinh đệm đa dạng tái phát vào năm 2009. Tuy nhiên, một đánh giá của Cochrane vào năm 2018 cho rằng không có đủ bằng chứng tốt để hỗ trợ việc sử dụng bevacizumab trong trường hợp này.
Bệnh về mắt
Nhiều bệnh về mắt như thoái hóa điểm vàng do tuổi tác (AMD) và bệnh võng mạc do tiểu đường gây tổn thương võng mạc và dẫn đến mù lòa do sự phát triển bất thường và rò rỉ chất lỏng từ các mạch máu xung quanh võng mạc, làm cho các lớp của võng mạc bị tách ra. Tình trạng tăng trưởng bất thường này được gây ra bởi VEGF, và do đó, việc sử dụng bevacizumab đã được chứng minh thành công trong việc ức chế VEGF và làm chậm sự tăng trưởng này.
Bevacizumab đã được các bác sĩ nhãn khoa sử dụng ngoài nhãn hiệu như một tác nhân trong dịch kính để điều trị các bệnh về mắt như tân mạch (chẳng hạn như màng tân mạch màng mạch – CNV) trong AMD. Tiêm 1,25–2,5 mg bevacizumab vào khoang thủy tinh thể đã được thực hiện mà không gây độc tính nội nhãn đáng kể. Nhiều chuyên gia về võng mạc đã ghi nhận những kết quả ấn tượng trong việc điều trị CNV, bệnh võng mạc tiểu đường tăng sinh, bệnh tăng nhãn áp tân mạch, phù hoàng điểm do tiểu đường, bệnh võng mạc ở trẻ sinh non và phù hoàng điểm thứ phát do tắc tĩnh mạch võng mạc.
Một số đánh giá đã kết luận rằng việc sử dụng bevacizumab hoặc ranibizumab đã đạt được các kết quả tương tự về tác dụng và độ an toàn.
Ung thư buồng trứng
Năm 2018, FDA đã chấp thuận việc sử dụng bevacizumab kết hợp với hóa trị liệu cho giai đoạn III hoặc IV của ung thư buồng trứng sau ca phẫu thuật ban đầu. Sau đó, bevacizumab cũng được phê duyệt sử dụng đơn trị liệu. Sự chấp thuận này được dựa trên kết quả của một nghiên cứu nghiên cứu về việc kết hợp bevacizumab vào carboplatin và paclitaxel, giúp thời gian sống không bệnh tiến triển tăng từ 13 tháng lên 18 tháng.
Tại Liên minh Châu Âu (EU), bevacizumab kết hợp với carboplatin và paclitaxel được chỉ định để điều trị tuyến đầu cho người lớn mắc ung thư buồng trứng giai đoạn IIIB, IIIC và IV tiến triển. Ngoài ra, bevacizumab cũng được chỉ định kết hợp với carboplatin và gemcitabine hoặc kết hợp với carboplatin và paclitaxel để điều trị người lớn tái phát lần đầu ung thư ống dẫn trứng, biểu mô buồng trứng hoặc ung thư phúc mạc nguyên phát có tính nhạy cảm với bạch kim và trước đó chưa được điều trị bằng bevacizumab cũng như các chất ức chế VEGF khác hoặc các tác nhân nhắm mục tiêu thụ thể VEGF.
Vào tháng 5 năm 2020, Cục Quản lý Thực phẩm và Dược phẩm đã mở rộng chỉ định của olaparib để bao gồm việc sử dụng kết hợp của nó với bevacizumab để điều trị duy trì giai đoạn cuối đáp ứng hoàn toàn hoặc một phần cho người lớn mắc ung thư biểu mô buồng trứng, ống dẫn trứng hoặc ung thư phúc mạc nguyên phát, có liên quan đến tình trạng dương tính do thiếu hụt tái tổ hợp tương đồng xác định bởi đột biến BRCA có hại hoặc nghi ngờ có hại và/hoặc sự mất ổn định của bộ gen.
Ung thư cổ tử cung
Tại Liên minh Châu Âu (EU), việc kết hợp bevacizumab với paclitaxel và cisplatin, hoặc topotecan và paclitaxel và được chỉ định để điều trị ung thư biểu mô cổ tử cung dai dẳng, tái phát hoặc di căn ở người lớn không thể điều trị bằng phương pháp chủ yếu là bạch kim.
Dược động học
Hấp thu
Việc hấp thu kháng thể đơn dòng (mAbs) như bevacizumab có kích thước lớn, không dễ dàng xuyên qua màng tế bào và không thể tiêu hóa dễ dàng. Do đó, hấp thu qua đường uống không hiệu quả và thay vào đó, mAbs thường được tiêm tĩnh mạch, tiêm bắp hoặc tiêm dưới da.
Trong một nghiên cứu dược động học liều đơn (1mg/kg) để so sánh bevacizumab và TAB008 (một sản phẩm tương tự sinh học), các thông số dược động học của bevacizumab là: Cmax = 17,38 ug/mL, AUCinf = 5.358 ugxh /mL và Tmax = 2,50 giờ.
Phân bố
Thể tích phân bố của bevacizumab khoảng 3,29 L và 2,39 L tương ứng đối với nam và nữ. Hơn 97% VEGF huyết thanh được liên kết với bevacizumab.
Chuyển hóa
Có một số con đường dẫn đến loại bỏ các kháng thể đơn dòng (mAbs). Quá trình thanh thải mAbs không đặc hiệu bao gồm pinocytosis độc lập mục tiêu và phân giải protein thành các axit amin và peptide nhỏ trong hệ thống lưới nội mô (RES) và gan. Quá trình thanh thải thông qua đích trung gian là kết quả của tương tác đặc hiệu giữa mAb và kháng nguyên đích của nó.
Sau khi kết hợp, phức hợp kháng thể-kháng nguyên có thể bị loại bỏ thông qua quá trình thoái biến lysosomal. Ngoài ra, việc hình thành phức hợp kháng thuốc (ADA) có thể xảy ra do phản ứng miễn dịch đối với phương pháp điều trị dựa trên mAb. Phức hợp này có thể ảnh hưởng đến tốc độ thanh thải mAb.
Thải trừ
Vì kích thước lớn, các kháng thể đơn dòng không thể được loại bỏ qua thận trong điều kiện sinh lý bình thường. Thay vào đó, chúng thường bị dị hóa hoặc bài tiết. Thời gian bán hủy của bevacizumab được ước tính là 20 ngày (khoảng 11-50 ngày).
Độ thanh thải (CL) của bevacizumab là khoảng 0,207 L/ngày và có thể tăng hoặc giảm 30% ở những bệnh nhân nặng tương ứng >114 kg hoặc <49 kg. Nam giới có xu hướng loại bỏ bevacizumab nhanh hơn nữ giới (trung bình nhanh hơn 26%). Những yếu tố khác như phosphatase kiềm (ALP), aspartate aminotransferase huyết thanh (AST), albumin huyết thanh và khối u có thể ảnh hưởng đến CL.
Phương pháp sản xuất
Ban đầu, bevacizumab được lấy từ một kháng thể đơn dòng chuột, được tạo ra từ những con chuột được tiêm chủng bằng dạng 165 dư lượng của yếu tố tăng trưởng nội mô mạch máu người tái tổ hợp. Sau đó, nó được nhân bản hóa bằng cách giữ lại vùng liên kết và thay thế phần còn lại bằng chuỗi nhẹ đầy đủ của người và chuỗi nặng IgG1 bị cắt ngắn của người, cùng với một số thay đổi khác. Quá trình này thực hiện thông qua việc truyền plasmid thu được vào các tế bào buồng trứng của chuột đồng Trung Quốc được nuôi cấy trong các hệ thống lên men công nghiệp.
Độc tính ở người
Các tác dụng độc tính của Bevacizumab khác với các tác nhân gây độc tế bào thông thường được sử dụng trong hóa trị liệu và thường liên quan đến suy yếu chức năng của VEGF. Các hiện tượng độc tính phổ biến của bevacizumab bao gồm tăng huyết áp, thủng đường tiêu hóa, huyết khối động mạch, hội chứng bệnh não chất trắng phía sau có hồi phục (RPLS), huyết khối tĩnh mạch, tăng protein niệu, xuất huyết/chảy máu và các biến chứng trong quá trình lành vết thương.
Tính an toàn
Bevacizumab không gây tăng men huyết thanh trong quá trình điều trị hoặc gây tổn thương gan cấp tính đặc thù. Bevacizumab có thể bảo vệ một phần chống lại tổn thương mạch máu ở gan do các tác nhân hóa trị liệu khác gây ra.
Bevacizumab không được chỉ định cho bệnh nhân dưới 18 tuổi.
Bệnh nhân cao tuổi sử dụng bevacizumab và hóa trị liệu (carboplatin và paclitaxel) để điều trị ung thư phổi không phải tế bào nhỏ tiến triển có thể có nguy cơ bị tăng protein niệu cao hơn so với bệnh nhân trẻ tuổi. Các tác dụng phụ khác được báo cáo thường xuyên hơn ở những bệnh nhân từ 65 tuổi trở lên bao gồm chứng khó tiêu, xuất huyết tiêu hóa, phù nề, chảy máu cam, ho nhiều hơn và thay đổi giọng nói.
Bevacizumab có thể đi qua nhau thai (giống các IgG của người) và có thể ức chế sự hình thành mạch máu ở thai nhi, gây dị tật bẩm sinh nghiêm trọng. Vì vậy, không nên sử dụng thuốc này cho phụ nữ có thai.
Hiện chưa có thông tin về việc sử dụng bevacizumab tiêm tĩnh mạch trong thời gian cho con bú. Vì bevacizumab là một phân tử protein lớn có trọng lượng phân tử khoảng 149.000 Da, lượng bevacizumab trong sữa có thể rất ít. Nó cũng có thể bị phá hủy một phần trong đường tiêu hóa của trẻ sơ sinh và khả năng hấp thu của trẻ sơ sinh có lẽ là rất ít. Cho đến khi có thêm dữ liệu, nên thận trọng khi sử dụng bevacizumab tiêm tĩnh mạch trong thời kỳ cho con bú, đặc biệt là khi đang nuôi trẻ sơ sinh hoặc trẻ sinh non. Nhà sản xuất khuyến cáo nên ngừng cho con bú trong khi điều trị bằng bevacizumab và trong 6 tháng sau liều cuối cùng.
Tương tác với thuốc khác
Một số trường hợp thiếu máu tán huyết vi mạch đã được báo cáo. Không khuyến cáo sử dụng bevacizumab kết hợp với sunitinib.
Kết hợp bevacizumab với platin hoặc các taxan có thể gây giảm bạch cầu nặng, giảm bạch cầu do sốt, giảm khả năng miễn dịch hoặc không giảm bạch cầu.
Phối hợp bevacizumab với kháng thể đơn dòng EGFR có thể làm tăng độc tính của bevacizumab.
Lưu ý khi sử dụng Bevacizumab
Bevacizumab có thể gây hình thành lỗ rò, áp xe hoặc thủng đường tiêu hóa trong vòng 50 ngày sau khi bắt đầu sử dụng, thể hiện bởi các triệu chứng như đau bụng, buồn nôn, nôn mửa, táo bón và sốt, có thể dẫn đến hậu quả tử vong. Ngoài ra, bệnh nhân được điều trị ung thư cổ tử cung bằng bevacizumab cũng có nguy cơ phát triển lỗ rò trực tràng – âm đạo.
Bevacizumab có thể ảnh hưởng xấu đến quá trình lành vết thương. Vì vậy, cần ngừng sử dụng bevacizumab ít nhất 28 ngày cả trước và sau khi phẫu thuật (đặc biệt khi vết mổ chưa lành hoàn toàn).
Bevacizumab có thể gây xuất huyết nghiêm trọng (như ra máu; chảy máu cam; xuất huyết tiêu hóa, thần kinh trung ương, âm đạo, phổi…), và đôi khi có thể gây tử vong.
Trong quá trình tiêm bevacizumab, có thể xảy ra các phản ứng phản vệ như tăng huyết áp, kích thích thần kinh, thở khò khè, giảm độ bão hòa oxy, phản ứng quá mẫn độ 3, đau ngực và nhức đầu, và có thể cần truyền thuốc chậm ở những liều đầu và tăng tốc độ khi đã dung nạp.
Bevacizumab làm tăng nguy cơ mắc và mức độ nghiêm trọng của tình trạng huyết khối tắc nghẽn động mạch và tĩnh mạch, đặc biệt là ở bệnh nhân có tiền sử huyết khối hoặc bệnh nhân trên 65 tuổi.
Sử dụng bevacizumab có thể gây tăng huyết áp nặng (độ 3 – 4), cần kiểm tra huyết áp 2–3 tuần/lần trong quá trình điều trị. Tạm ngưng thuốc ở bệnh nhân có tăng huyết áp nặng chưa kiểm soát.
Các biểu hiện của hội chứng rối loạn tuần hoàn não sau có hồi phục (RPLS) thường xuất hiện từ 16 giờ đến 1 năm sau khi bắt đầu sử dụng bevacizumab. Triệu chứng bao gồm nhức đầu, co giật, mất tỉnh táo, lú lẫn, mờ mắt, các rối loạn thị giác và thần kinh khác, cùng với tăng huyết áp từ nhẹ đến nặng.
Tỷ lệ mắc và mức độ nghiêm trọng của tình trạng tăng protein niệu tăng lên ở những bệnh nhân sử dụng bevacizumab đơn trị hoặc kết hợp với các thuốc chống ung thư khác. Nếu bị hội chứng thận hư, cần ngừng điều trị bằng bevacizumab.
Suy buồng trứng có thể xảy ra ở phụ nữ tiền mãn kinh sử dụng bevacizumab kết hợp với phác đồ FOLFOX6 trong điều trị ung thư đại trực tràng. Tỷ lệ phục hồi chức năng buồng trứng sau khi ngừng sử dụng bevacizumab khá thấp (22%).
Điều trị bằng bevacizumab có nguy cơ gây giảm bạch cầu trung tính nặng (độ 3 – 4), giảm bạch cầu do sốt, và gây ra nhiễm trùng nghiêm trọng (như viêm phổi, nhiễm trùng vết thương…).
Cần thận trọng khi chỉ định bevacizumab cho bệnh nhân bị suy tim sung huyết.
Một số bệnh nhân bị viêm nội nhãn (nhiễm trùng và vô trùng), mất thị lực vĩnh viễn, bong võng mạc, tăng nhãn áp, phù thủy tinh thể, xuất huyết, sung huyết mắt và có thể gặp đau hoặc khó chịu sau khi sử dụng bevacizumab.
Một vài nghiên cứu của Bevacizumab trong Y học
Phân tích tổng hợp mạng về tỷ lệ tái điều trị sau Bevacizumab, Ranibizumab, Aflibercept và Laser cho bệnh võng mạc do sinh non
Chủ đề: Để so sánh bevacizumab, ranibizumab, aflibercept và điều trị bằng laser như các liệu pháp điều trị chính cho bệnh võng mạc do sinh non (ROP) về tỷ lệ điều trị lại.
Liên quan đến lâm sàng: Các chất chống VEGF ngày càng được sử dụng làm phương pháp điều trị chính cho ROP và có thể mang lại kết quả vượt trội so với laser trong bệnh lý sau. So sánh trực tiếp giữa các chất chống VEGF khác nhau còn thiếu.
Phương pháp: Chúng tôi đã tìm kiếm cơ sở dữ liệu của CENTRAL, Embase, MEDLINE và CINAHL để tìm các thử nghiệm ngẫu nhiên có đối chứng và các nghiên cứu so sánh không ngẫu nhiên đã được báo cáo vào tháng 3 năm 2022. Chúng tôi đã đưa vào các nghiên cứu sử dụng bevacizumab, ranibizumab, aflibercept hoặc laser cho ROP với các nhóm thuần tập và tiêu chí điều trị có thể so sánh được.
Các nghiên cứu được đánh giá theo Khung phân loại khuyến nghị, đánh giá, phát triển và đánh giá và những nghiên cứu có lựa chọn trường hợp sai lệch, kiểm soát trường hợp không ngẫu nhiên hoặc thiếu nhóm kiểm soát đã bị loại trừ. Các phân tích tổng hợp thường xuyên về tỷ lệ đã xác định tỷ lệ rút lui chính tuyệt đối của từng phương thức và các phân tích tổng hợp mạng Bayesian so sánh các cặp phương pháp điều trị trong ROP loại 1 và Vùng I.
Kết quả: Tổng cộng, 30 nghiên cứu (4686 mắt) đã được đưa vào phân tích tổng hợp mạng. Đối với ROP loại 1, tỷ lệ thành công trong một lần điều trị (nghĩa là khả năng không cần điều trị thêm) là 89,3% (khoảng tin cậy 95% [CI]: 83,8%-93,8%; n = 1552) đối với laser, 87,0% (95% KTC: 78,6%-93,8%; n = 2081) đối với bevacizumab, 80,7% (KTC 95%: 62,0% -94,4%; n = 326) đối với aflibercept và 74,0% (KTC 95%: 62,7% -84,1%; n = 727) đối với ranibizumab.
Phân tích tổng hợp mạng Bayesian chỉ ra rằng điều trị bằng laser có liên quan đến việc giảm đáng kể 62% (khoảng tin cậy 95% [CrI]: 16%-83%) nguy cơ tái điều trị so với ranibizumab, trong khi không tìm thấy sự khác biệt đáng kể nào giữa các so sánh theo cặp khác.
Trung bình ± sai số chuẩn của thời gian trung bình đến khi điều trị lần thứ hai sau liệu pháp điều trị ban đầu bằng aflibercept (12,96 ± 0,47 tuần) và bevacizumab (11,36 ± 0,54 tuần) dài hơn đáng kể so với điều trị ban đầu bằng ranibizumab (9,29 ± 0,43 tuần) (P = 7 × 10-7 và P = 9 × 10-3, tương ứng).
Đối với ROP Vùng I, tỷ lệ thành công trong một lần điều trị là 91,2% (KTC 95%: 83,6-96,9; n = 231) đối với bevacizumab, 78,3% (KTC 95%: 61,4-91,9; n = 100) đối với ranibizumab và 65,9% (95% CI: 41,4-87,2; n=158) đối với điều trị bằng laser. Trong trường hợp này, phân tích tổng hợp mạng Bayesian gợi ý rằng bevacizumab ban đầu có liên quan đến việc giảm đáng kể 67% (95% CrI:10%-90%) nguy cơ tái điều trị so với điều trị bằng laser.
Kết luận: Laser có liên quan đến tốc độ thoái lui thấp hơn so với ranibizumab trong ROP loại 1 (kết hợp Vùng I và II), trong khi bevacizumab có liên quan đến tỷ lệ thoái lui thấp hơn so với laser ở ROP vùng I. Aflibercept và bevacizumab cho thấy thời gian tác dụng dài hơn ranibizumab đối với ROP.
Tài liệu tham khảo
- Chang, E., Josan, A. S., Purohit, R., Patel, C. K., & Xue, K. (2022). A Network Meta-Analysis of Retreatment Rates following Bevacizumab, Ranibizumab, Aflibercept, and Laser for Retinopathy of Prematurity. Ophthalmology, 129(12), 1389–1401. https://doi.org/10.1016/j.ophtha.2022.06.042
- Drugbank, Bevacizumab, truy cập ngày 28 tháng 7 năm 2023.
- Pubchem, Bevacizumab, truy cập ngày 28 tháng 7 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
