Atezolizumab
Danh pháp
Tên chung quốc tế
Nhóm thuốc
Thuốc điều trị ung thư
Mã ATC
L – Thuốc chống ung thư và điều hòa miễn dịch
L01 – Chất chống ung thư
L01F – Kháng thể đơn dòng và thuốc kháng thể liên hợp
L01FF – Chất ức chế Pd-1/pdl-1 (protein chết tế bào được lập trình 1/phối tử chết 1)
L01FF05 – Atezolizumab
Mã UNII
1380723-44-3
Mã CAS
1380723-44-3
Cấu trúc phân tử
Công thức phân tử
C6446H9902N1706O1998S42
Phân tử lượng
145.000 Da
Cấu trúc phân tử
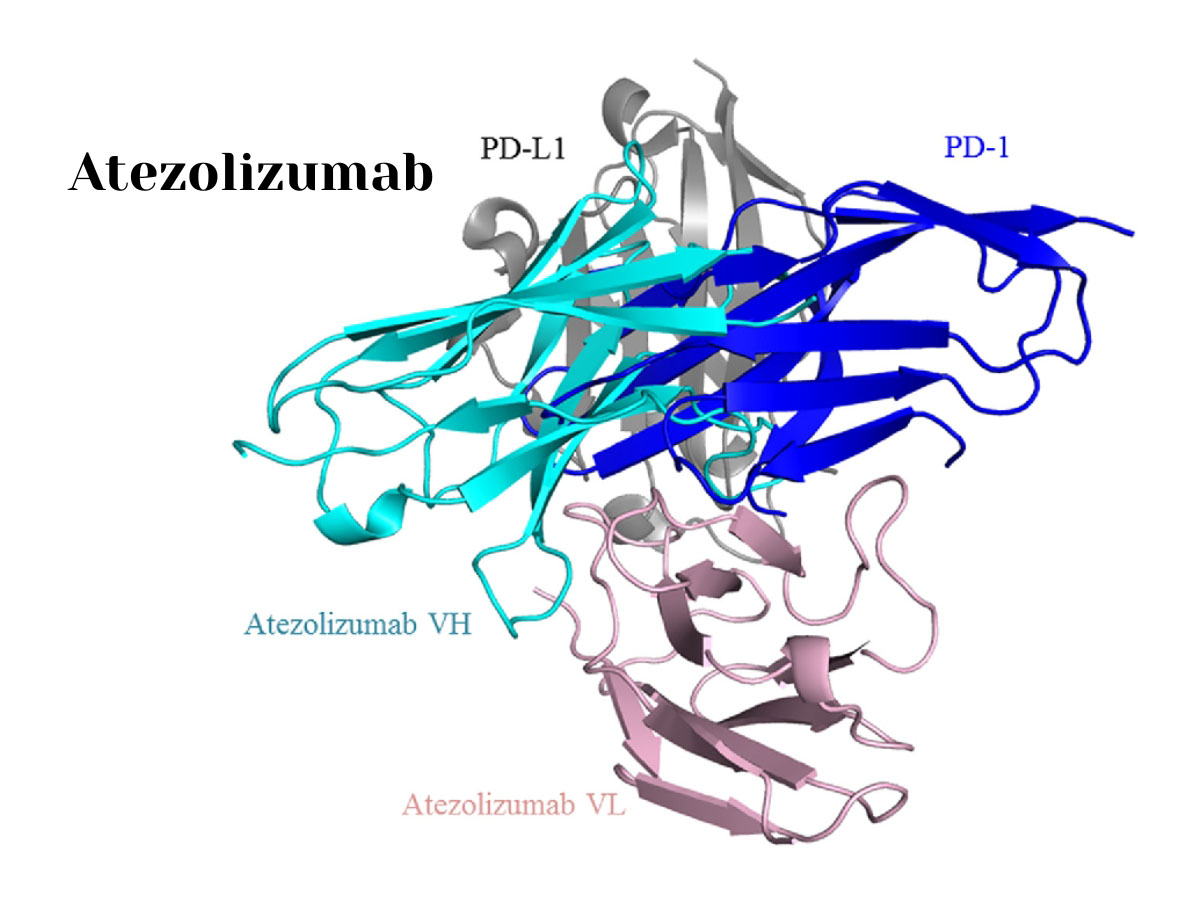
Atezolizumab là một kháng thể đơn dòng, được xử lý công nghệ và nhân bản hoàn toàn của kiểu hình IgG1 chống lại phối tử chết tế bào được lập trình bởi protein 1 (PD-L1)
Các tính chất đặc trưng
Điểm nóng chảy: 78 ºC
Điểm sôi: 60 – 70 ºC
Độ tan trong nước: 50mg / mL
Chu kì bán hủy: 27 ngày
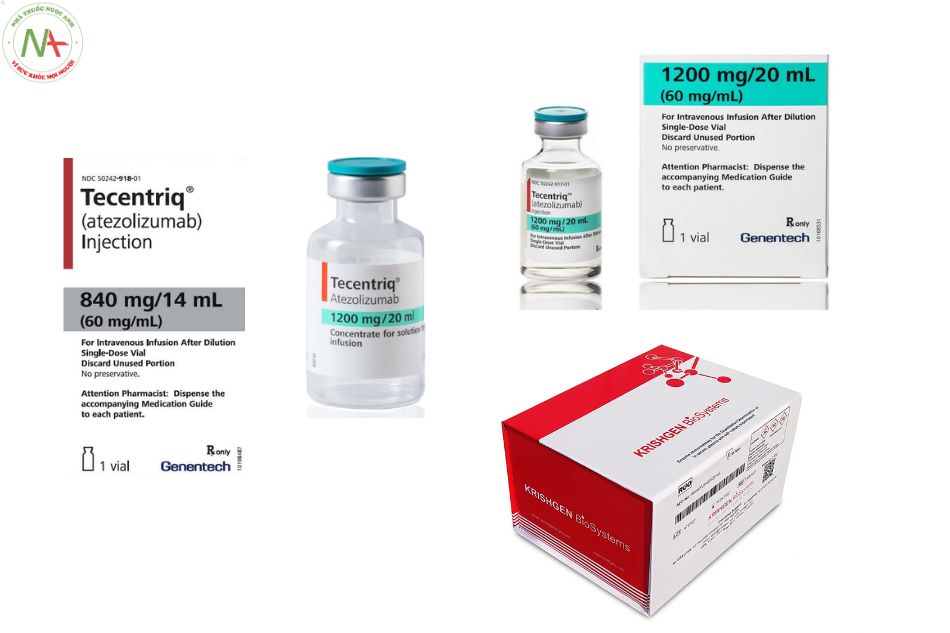
Dạng bào chế
Dung dịch tiêm: 840 mg / 14 mL
Tecentriq 1200mg/20mL
Độ ổn định và điều kiện bảo quản
Độ ổn định lý của atezolizumab là khá cao. Atezolizumab được sản xuất và bảo quản dưới dạng dung dịch tiêm, và nó được đóng gói trong các chai hoặc ống bằng thủy tinh. Dung dịch atezolizumab phải được bảo quản trong điều kiện lạnh từ 2 đến 8 độ C (36 đến 46 độ F).
Nguồn gốc
Atezolizumab, còn được gọi là Tecentriq, là một loại thuốc chủ vận thụ thể PD-L1 được phát triển bởi hãng dược phẩm Roche và công ty con Genentech. Atezolizumab đã được Cơ quan Quản lý Thực phẩm và Dược phẩm Hoa Kỳ (FDA) phê duyệt để sử dụng trong một số loại ung thư, bao gồm giống sưng mô mềm phổi, u gan tế bào chủ, melanoma, và ung thư phổi không tế bào nhỏ. Các nghiên cứu tiến hành để khám phá khả năng điều trị của atezolizumab đối với các loại ung thư khác cũng đang được thực hiện.
Dược lý và cơ chế hoạt động
Atezolizumab có tác dụng dược lý chính là làm giảm sự chặn đầu ra của hệ thống miễn dịch, giúp kích thích phản ứng miễn dịch chống lại tế bào ung thư.
Atezolizumab thuộc vào nhóm các loại thuốc được gọi là chất chủ vận PD-L1 (programmed death-ligand 1). PD-L1 là một protein được tìm thấy trên bề mặt các tế bào ung thư. Khi PD-L1 tương tác với receptor PD-1 trên các tế bào miễn dịch, nó gây ra sự chặn đầu ra của hệ thống miễn dịch, giảm khả năng tấn công của tế bào miễn dịch đối với tế bào ung thư. Atezolizumab hoạt động bằng cách gắn kết với PD-L1 và ngăn chặn tương tác giữa PD-L1 và receptor PD-1, từ đó làm tăng phản ứng miễn dịch chống lại tế bào ung thư.
Tác dụng dược lý của atezolizumab là cải thiện khả năng tiêu diệt tế bào ung thư, đồng thời tăng cường phản ứng miễn dịch chống lại ung thư. Điều này có thể dẫn đến giảm tỷ lệ phát triển và lan truyền của ung thư, cũng như kéo dài thời gian sống và cải thiện chất lượng cuộc sống của bệnh nhân.
Việc ức chế tương tác giữa PD-L1 và PD-1 đã được chứng minh rằng có khả năng loại bỏ sự đình trệ của hệ thống miễn dịch, mà không gây hại cho các tế bào khác phụ thuộc vào kháng thể. Điều này tạo điều kiện cho việc kích thích các phản ứng miễn dịch chống lại khối u mà không gây tác động tiêu cực đến tế bào khỏe mạnh. Đặc biệt, đặc tính thời gian tác dụng kéo dài của thuốc này cho phép sử dụng định kỳ, thường là 3-4 tuần một lần, để duy trì hiệu quả điều trị.
Ứng dụng trong y học
Atezolizumab là một loại thuốc có ứng dụng quan trọng trong lĩnh vực y học, đặc biệt là trong việc điều trị ung thư. Với cơ chế tác động độc đáo của nó, atezolizumab đã mang lại hy vọng cho hàng ngàn bệnh nhân trên khắp thế giới.
Một trong những ứng dụng quan trọng của atezolizumab là trong điều trị sarcom mô mềm phế nang (alveolar soft part sarcoma), một loại ung thư hiếm gặp. Atezolizumab được sử dụng một mình hoặc kết hợp với các thuốc khác để điều trị sarcom mô mềm phế nang đã lan sang các bộ phận khác hoặc không thể phẫu thuật. Điều này đã cung cấp một lựa chọn điều trị mới cho bệnh nhân và tạo điều kiện cho việc kiểm soát và giảm sự lan truyền của ung thư trong cơ thể.
Thêm vào đó, atezolizumab đã được chứng minh là có hiệu quả trong việc điều trị u gan tế bào chủ (hepatocellular carcinoma), một trong những loại ung thư gan phổ biến nhất trên toàn thế giới. Khi được sử dụng kết hợp với thuốc bevacizumab, atezolizumab đã giúp kiểm soát và làm giảm sự lan truyền của ung thư gan, đồng thời cải thiện hiệu quả điều trị cho những bệnh nhân không thể phẫu thuật hoặc đã lan sang các bộ phận khác.
Đối với bệnh nhân mắc melanoma có đột biến trong gen BRAF, atezolizumab kết hợp với cobimetinib fumarate và vemurafenib đã trở thành một phương pháp điều trị quan trọng. Melanoma là một loại ung thư da nguy hiểm, và atezolizumab đã cung cấp một cơ hội mới để kiểm soát và làm giảm sự lan truyền của ung thư này trong cơ thể.
Ngoài ra, atezolizumab còn có tác dụng trong việc điều trị các loại ung thư phổi không tế bào nhỏ (non-small cell lung cancer) và ung thư phổi tế bào nhỏ (small cell lung cancer). Với việc sử dụng đa dạng, atezolizumab có thể được áp dụng sau phẫu thuật và hóa trị platinum cho các bệnh nhân ở giai đoạn sớm của ung thư phổi không tế bào nhỏ. Đối với các bệnh nhân giai đoạn tiến triển hoặc không phản ứng với liệu pháp hóa trị platinum, atezolizumab kết hợp với carboplatin và etoposide đã mang lại hiệu quả trong điều trị ung thư phổi tế bào nhỏ giai đoạn mở rộng.
Không chỉ dừng lại ở những ứng dụng trên, atezolizumab cũng đang được nghiên cứu trong việc điều trị các loại ung thư khác, mở ra nhiều triển vọng và hy vọng mới cho ngành y học và bệnh nhân. Sự tiến bộ trong việc phát triển và ứng dụng của atezolizumab đã mang lại một bước tiến lớn trong cuộc chiến chống lại ung thư, đồng thời cung cấp thêm cơ hội sống và sự cải thiện chất lượng cuộc sống cho những người bị bệnh.
Dược động học
Hấp thu
Phân tích dược động học của atezolizumab đã được thực hiện trên bệnh nhân ung thư có di căn biểu mô tiết niệu. Trong nhóm bệnh nhân này, AUC (Diện tích dưới đường cong thời gian nồng độ) của atezolizumab dao động từ 2,19 đến 2,73 ngày*µg/mL/mg. Cmax (Nồng độ tối đa) của atezolizumab trong huyết tương từ 0,27 đến 0,35 µg/mL/mg và Cmin (Nồng độ tối thiểu) từ 0,004 đến 0,008 µg/mL/mg.
Phân bố
Atezolizumab được phân bố trong cơ thể mà không gắn kết với các protein trong huyết tương. Thể tích phân bố của atezolizumab là 6,91 L, cho thấy khả năng phân bố rộng rãi trong các mô và niêm mạc.
Chuyển hóa
Sau khi sử dụng, atezolizumab được phân hủy thành các polypeptide và axit amin nhỏ hơn thông qua quá trình chuyển hóa.
Thải trừ
Quá trình loại bỏ của atezolizumab không phụ thuộc vào thận. Tỷ lệ thanh thải của atezolizumab là 0,200 L/ngày. Thời gian bán hủy của atezolizumab được ước tính là 27 ngày, cho thấy sự tồn tại lâu dài của thuốc trong cơ thể.
Phương pháp sản xuất
Đang cập nhật
Độc tính ở người
Atezolizumab, tương tự như các chất ức chế điểm kiểm soát khác, có thể gây ra tác dụng phụ nghiêm trọng, đặc biệt là những tác dụng liên quan đến hệ miễn dịch, bao gồm nhưng không giới hạn, tổn thương gan cấp tính và viêm gan ứ mật có thể gây nguy hiểm đến tính mạng.
Các phản ứng bất lợi phổ biến nhất (xuất hiện ở hơn 20% bệnh nhân) bao gồm: nhiễm trùng đường tiết niệu, mệt mỏi, chán ăn, buồn nôn, sốt và táo bón. Hiện vẫn còn ít thông tin về tình trạng quá liều của atezolizumab, nhưng các phản ứng bất lợi phổ biến nhất trong trường hợp này bao gồm: khó thở, mệt mỏi, nhức đầu, buồn nôn, ho, chán ăn, táo bón, tiêu chảy, rụng tóc, tổn thương thần kinh ngoại biên, thiếu máu, giảm bạch cầu trung tính và buồn nôn.
Tính an toàn
Trong các thử nghiệm kiểm soát đăng ký trước của atezolizumab ở các dạng ung thư di căn khác nhau, tăng aminotransferase huyết thanh xảy ra ở 20% đến 30% bệnh nhân nhưng nhìn chung là thoáng qua, nhẹ và không đi kèm với các triệu chứng hoặc vàng da. Tỷ lệ tăng men huyết thanh này tương tự như tỷ lệ với các hình thức hóa trị liệu khác cho các khối u ác tính tiến triển.
Tăng ALT huyết thanh trên 5 lần giới hạn trên của mức bình thường (ULN) xảy ra ở 1% đến 4% bệnh nhân và thường dẫn đến ngừng thuốc tạm thời hoặc vĩnh viễn. Điều quan trọng là, ở 1% đến 2% bệnh nhân, tình trạng tăng men huyết thanh tiến triển thành tổn thương gan qua trung gian miễn dịch rõ ràng về mặt lâm sàng. Khởi phát chấn thương thường sau 2 đến 4 chu kỳ hoặc 1 đến 3 tháng sau khi bắt đầu điều trị.
Mô hình tăng enzym thường ở tế bào gan nhưng đôi khi hỗn hợp và thậm chí ứ mật. Mô học gan thường biểu hiện viêm gan toàn thùy với hoại tử khu trú hoặc hợp lưu và thâm nhiễm tế bào lympho nổi bật của tế bào T hoạt hóa, tương thích với tổn thương gan qua trung gian miễn dịch. Các dạng viêm gan nặng hơn có thể biểu hiện hoại tử trung tâm tiểu thùy (vùng 3). Mặc dù có các đặc điểm của tổn thương gan qua trung gian miễn dịch, nhưng thường không có tự kháng thể và nồng độ globulin miễn dịch là bình thường.
Một tỷ lệ bệnh nhân dùng atezolizumab bị ứ mật hơn là tổn thương tế bào gan. Dạng ứ mật của tổn thương gan qua trung gian miễn dịch thường phát sinh muộn hơn dạng tế bào gan (sau 3 đến 10 chu kỳ) và thường kèm theo đau bụng và vàng da. Nồng độ phosphatase kiềm tăng rõ rệt trong khi nồng độ aminotransferase chỉ tăng vừa phải.
Các nghiên cứu hình ảnh có thể cho thấy sự giãn nở bất thường của các ống mật trong và/hoặc ngoài gan và sự dày lên của túi mật và thành ống mật, nhưng không có bằng chứng về sự tắc nghẽn rõ ràng. Sinh thiết gan cho thấy viêm tĩnh mạch cửa và tổn thương ống mật và nội soi sinh thiết biểu mô ống mật cho thấy viêm và sẹo. Các đặc điểm chung gợi ý một dạng viêm đường mật xơ cứng thứ phát được gọi là bệnh lý đường mật ức chế điểm kiểm soát.
Điều trị bằng corticosteroid có thể cải thiện nồng độ phosphatase kiềm và bilirubin nhưng hiếm khi dẫn đến hồi phục hoàn toàn, và có thể xảy ra tình trạng ứ mật và suy gan lâu dài. Một số bệnh nhân mắc dạng viêm gan liên quan đến miễn dịch do ứ mật không biểu hiện sự thay đổi của ống mật lớn nhưng biểu hiện sự mất và ít của các ống dẫn mật nhỏ hơn, trong cửa gan dẫn đến hội chứng ống mật biến mất tương tự như viêm đường mật nguyên phát (PBC).
Tác dụng của ức chế PD-L1 đối với viêm gan B mãn tính chưa được xác định rõ nhưng các ví dụ thuyết phục về việc tái phát viêm gan B đã được mô tả do các chất ức chế điểm kiểm soát khác. Hầu hết các trường hợp xảy ra ở những bệnh nhân có HBsAg từ trước, nhưng một số trường hợp hiếm gặp được báo cáo ở những người bị nghi ngờ có anti-HBc mà không có HBsAg.
Tương tác với thuốc khác
Thuốc ức chế điểm kiểm soát khác: Khi sử dụng atezolizumab cùng với các loại thuốc ức chế điểm kiểm soát khác, có thể tăng nguy cơ phản ứng miễn dịch quá mức hoặc tác động không mong muốn đến hệ thống miễn dịch.
Thuốc ức chế hoạt động của chuỗi PD-1/PD-L1 khác: Việc kết hợp atezolizumab với các loại thuốc ức chế hoạt động của chuỗi PD-1/PD-L1 khác có thể tăng nguy cơ tác động phản ứng miễn dịch quá mức và tác dụng phụ.
Thuốc có tác động tăng cường miễn dịch: Sử dụng atezolizumab cùng với các loại thuốc có tác động tăng cường miễn dịch khác có thể gây ra tác động miễn dịch không mong muốn hoặc tăng nguy cơ phản ứng miễn dịch quá mức.
Thuốc chống ung thư khác: Khi sử dụng atezolizumab cùng với các loại thuốc chống ung thư khác, có thể xảy ra tương tác dược lý hoặc tác dụng tăng cường hoặc giảm hiệu quả của các thuốc này.
Thuốc chống viêm corticosteroid: Sử dụng corticosteroid có thể ảnh hưởng đến hiệu quả của atezolizumab trong việc kích thích hệ thống miễn dịch.
Lưu ý khi sử dụng Atezolizumab
Do tính chất nghiêm trọng của tổn thương gan, nên theo dõi bằng các xét nghiệm gan định kỳ (bao gồm cả phosphatase kiềm) cho những bệnh nhân được điều trị bằng thuốc ức chế điểm kiểm soát. Điều trị bằng corticosteroid nói chung cho kết quả cải thiện nhanh chóng, cho phép ngừng thuốc trong vòng 1 đến 2 tháng. Tuy nhiên, trong một số trường hợp, đáp ứng lâm sàng và sinh hóa không đầy đủ, cần bổ sung chất ức chế miễn dịch thứ hai như azathioprine hoặc mycophenolate mofetil. Đôi khi có thể sử dụng lại atezolizumab hoặc một chất ức chế điểm kiểm soát khác sau khi giải quyết được tổn thương gan, nhưng có thể dẫn đến tái phát tổn thương và không được chứng minh là cải thiện kết quả của hóa trị liệu ung thư.
Sàng lọc bệnh nhân về HBsAg, anti-HBc và anti-HBs là phù hợp trước khi bắt đầu liệu pháp miễn dịch bằng các chất ức chế điểm kiểm soát. Bệnh nhân có HBsAg nên được xem xét điều trị dự phòng bằng thuốc kháng vi-rút có hoạt tính mạnh chống lại HBV như entecavir hoặc tenofovir. Ở những bệnh nhân có anti-HBc mà không có HBsAg, việc theo dõi và chú ý chặt chẽ đến các bất thường xét nghiệm gan có lẽ là đủ nếu điều trị bằng thuốc kháng vi-rút có thể được đưa ra nhanh chóng để có bằng chứng sớm về sự tái hoạt động.
Chưa có đầy đủ kinh nghiệm với atezolizumab liên quan đến nguy cơ tái khởi phát viêm gan B để đưa ra tỷ lệ tái phát có và không có điều trị dự phòng bằng thuốc kháng vi-rút.
Không có thông tin về việc sử dụng atezolizumab trên lâm sàng trong thời kỳ cho con bú. Vì atezolizumab là một phân tử protein lớn với trọng lượng phân tử là 145.000 Da, nên lượng trong sữa có thể rất thấp và khó hấp thu vì nó có thể bị phá hủy trong đường tiêu hóa của trẻ sơ sinh. Đợi ít nhất 2 tuần sau khi sinh để tiếp tục điều trị có thể giảm thiểu việc thuốc được chuyển sang trẻ sơ sinh. Cho đến khi có thêm dữ liệu, nên thận trọng hoặc tránh sử dụng atezolizumab trong thời kỳ cho con bú, đặc biệt là khi đang nuôi trẻ sơ sinh hoặc trẻ sinh non. Nhà sản xuất khuyến cáo nên ngừng cho con bú trong khi điều trị bằng atezolizumab và trong ít nhất 5 tháng sau liều cuối cùng.
Atezolizumab không nên được sử dụng ở những bệnh nhân bị viêm gan, viêm phổi qua trung gian miễn dịch, viêm đại tràng và một số bệnh nội tiết.
Một vài nghiên cứu của Atezolizumab trong Y học
Hiệu quả lâm sàng và độ an toàn của atezolizumab cộng với bevacizumab so với lenvatinib trong điều trị ung thư biểu mô tế bào gan tiến triển

Bối cảnh: Đánh giá tính hiệu quả và an toàn của các lựa chọn điều trị atezolizumab cộng với bevacizumab (Atez/Bev) hoặc lenvatinib trong thực hành lâm sàng cho bệnh nhân ung thư biểu mô tế bào gan (HCC) tiến triển.
Phương pháp: Để so sánh hiệu quả của Atez/Bev và lenvatinib trong điều trị HCC giai đoạn nặng, các tác giả đã tìm kiếm một cách có hệ thống cơ sở dữ liệu PubMed, EMBASE và Web of Science. Các tác giả đã sử dụng Trình quản lý đánh giá 5.3 để trích xuất và phân tích dữ liệu.
Kết quả: Đánh giá hệ thống hiện tại bao gồm 8 nghiên cứu không ngẫu nhiên bao gồm tổng cộng 6628 trường hợp. Không có sự khác biệt đáng kể về tỷ lệ OS 0,5-, 1-, 1,5 năm và tỷ lệ PFS 0,5-, 1 năm giữa 2 nhóm. Tuy nhiên, bệnh nhân bị HCC do viêm gan siêu vi sẽ được hưởng lợi nhiều hơn từ liệu pháp Atez/Bev (tỷ số nguy cơ = 0,75, khoảng tin cậy 95%: 0,63-0,89) nhưng bệnh nhân có chức năng gan Child-Pugh loại B sẽ được hưởng lợi nhiều hơn từ lenvatinib ( tỷ lệ rủi ro = 1,70, khoảng tin cậy 95%: 1,07-2,70). Đồng thời, không có sự khác biệt lớn về độ an toàn giữa 2 lựa chọn điều trị.
Kết luận: Nghiên cứu này không tìm thấy bất kỳ sự khác biệt đáng kể nào về hiệu quả và độ an toàn giữa Atez/Bev và lenvatinib. Tuy nhiên, cần phải xác minh bổ sung để xác định xem liệu 2 phương pháp trị liệu này có tác dụng khác nhau đối với các quần thể khác nhau hay không.
Tài liệu tham khảo
- Du, S., Cao, K., Wang, Z., & Lin, D. (2023). Clinical efficacy and safety of atezolizumab plus bevacizumab versus lenvatinib in the treatment of advanced hepatocellular carcinoma: A systematic review and meta-analysis. Medicine, 102(23), e33852. https://doi.org/10.1097/MD.0000000000033852
- Drugbank, Atezolizumab, truy cập ngày 3 tháng 7 năm 2023.
- Pubchem, Atezolizumab, truy cập ngày 3 tháng 7 năm 2023.
- Bộ Y Tế (2012), Dược thư quốc gia Việt Nam, Nhà xuất bản Y học, Hà Nội
