Bệnh hô hấp
Hiểu biết về kiềm dư (BE): Những giá trị và cạm bẫy
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Nhà thuốc Ngọc Anh– Chủ đề: Hiểu biết về kiềm dư (BE): Những giá trị và cạm bẫy
Xem cập nhật file pdf bản Tiếng Việt tại đây
Xem cập nhật file pdf bản Tiếng Anh tại đây.
Tác giả: Thomas Langer, Serena Brusatori, Luciano Gattinoni
Giới thiệu
Kiềm dư (BE) được giới thiệu bởi Siggaard-Andersen vào năm 1960 như một câu trả lời trong việc truy tìm chỉ dấu toan CH hay kiềm CH một cách đáng tin cậy, độc lập, độc lập với các rối loạn hô hấp đồng thời tồn tại và có thể định lượng mức độ nghiêm trọng của rối loạn. Trước đây, một số thông số đã được kiểm tra.
Bicacbonat tiêu chuẩn (HCO3−)
Nó nhanh chóng bị loại bỏ do sự phụ thuộc đã biết của nó vào áp suất riêng phần của CO2 (PCO2). Để khử thành phần hô hấp, bicarbonate tiêu chuẩn (HCO3− (st)) được đưa ra, đại diện cho nồng độ bicarbonate trong huyết tương sau khi cân bằng PCO2 ở 40 mmHg. Mặc dù đây chắc chắn là một bước tiến, HCO3− (st) không tính đến sự xuất hiện của hiệu ứng đệm của axit yếu non- cacbonic, tức là protein, bình thường góp phần đệm với 14–16 điện tích âm (A−)mỗi lít. Thật vậy, khi một axit mạnh được thêm vào máu, cả HCO3- và nồng độ A− sẽ giảm. Trong một hệ thống mở, trong đó đối tượng điều chỉnh chính là PCO2 thông qua hơi thở, bộ đệm cacbonic có vai trò chủ yếu (khoảng 75–80%), tuy nhiên, không thể bỏ qua hoàn toàn bộ đệm không-cacbonic. Do đó, sự khác biệt giữa HCO3− chuẩn(st) và giá trị bicarbonate “bình thường” lý tưởng, sẽ đánh giá thấp hơn một chút axit / bazơ được thêm vào hệ thống (ví dụ: việc bổ sung 10 mmol / L axit mạnh vào máu với HCO3− là 24 mmol /L có thể dẫn đến HCO3− chuẩn(st) là 16 mmol / L, thay vì 24–10 = 14 mmol / L).
Để khắc phục vấn đề này, Singer và Hastings đã giới thiệu kiềm đệm (BB), là tổng của tất cả các anion ( ion âm) đệm.
BB = HCO3- + A-
BB coi các chất đệm non- cacbonic và về mặt lý thuyết là không phụ thuộc CO2. Thật không may, sự thay đổi nồng độ các chất đệm non-cacbonic khác nhau theo sinh lí đã được nhận thấy. Để khắc phục hạn chế này, Siggaard- Andersen đã đưa ra kiềm dư (BE), tức là “phần dư thừa” (cả dương hoặc âm) của kiềm đệm BB thực so với BB bình thường (NBB).
BE = ∆BB = BB−NBB
NBB là BB thu được bằng thực nghiệm thông qua quy trình cân bằng và chuẩn độ nhằm đạt được điều kiện thường của pH là 7,40 và PCO2 là 40 mmHg. Do đó, BE là lượng axit / bazơ (mmol / L)phải được thêm vào mẫu máu để đạt được độ pH là 7,40 trong điều kiện tiêu chuẩn (PCO2 40 mmHg, 37 ° C)
Vì rõ ràng là không thể chuẩn độ trực tiếp trong một tình huống lâm sàng, nên các công thức và toán đồ đã được phát triển để ước tính BE. Phương trình phổ biến nhất vẫn được sử dụng như sau:
BE = HCO−−24.8 + β • (pH−7.40)
trong đó 24,8 và 7,40 là giá trị tham chiếu, HCO3− lý tưởng (mmol / L) và các giá trị pH, và β là khả năng đệm của axit yếu non-cacbonic (mmol / L), có thể là một giá trị hằng định (16,2 mmol / L) hoặc được tính toán như chức năng của nồng độ hemoglobin (giả sử nồng độ protein hằng định là 70 g / L). Giá trị β, nhân với sự thay đổi của pH, cung cấp ước tính về sự thay đổi điện tích âm yếu do chất đệm non- cacbonic.
Lưu ý, từ quan điểm lâm sàng, sự thay đổi của giá trị β có tác động nhỏ đến tính toán BE
Nói chung, phạm vi BE giữa – 2 và + 2 mmol / L được coi là bình thường. Các ví dụ lâm sàng về giá trị BE bất thường được báo cáo trong Hình 1.
Kiềm dư có thể được biểu thị cả đối với máu toàn phần— BE (B), không xét đến sự tương tác của máu với dịch mô kẽ, hoặc đối với toàn bộ dịch ngoại bào — BE (ecf), còn được gọi là BE tiêu chuẩn (SBE). Tính toán SBE sử dụng cùng một phương trình nhưng xem xét nồng độ hemoglobin thấp hơn (hoặc 1/3 của hemoglobin thực tế đo được hoặc nồng độ hằng định) để ước tính β. Bất chấp sự khác biệt về khái niệm này, ngay cả khi thiếu máu hoặc đa hồng cầu nặng, khó có thể tưởng tượng được các tình trạng mà BE (B) và BE (ecf) sẽ dẫn đến các kết quả, chẩn đoán và can thiệp điều trị khác nhau rõ rệt.
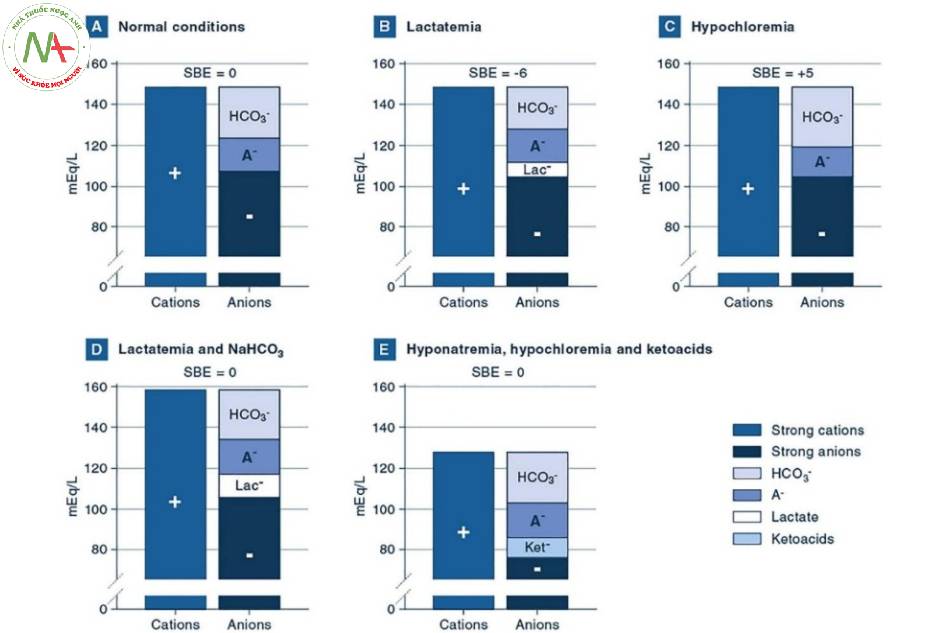
Trong biểu đồ trên:
A Tình trạng bình thường. Biểu đồ này, tức là biểu đồ tóm tắt các điện tích và khái niệm về độ hòa điện, biểu thị một tình huống bình thường, với nồng độ tiêu chuẩn của chất điện giải và thông số axit-bazơ bình thường (HCO3− 24 mmol / L, PCO2 40 mmHg và pH là 7,40 ), dẫn đến SBE là 0 mmol / L.
B Lactat máu. Trong tình huống này, nồng độ lactate tăng lên 6 mmol / L và pH là 7,31. Các chất điện giải khác và PCO2 có giá trị bình thường. Nồng độ HCO3− giảm xuống 20 mmol / L và BE là – 6 mmol / L. Đây là một ví dụ về nhiễm toan chuyển hóa đơn độc.
C Giảm clor máu. Trong tình huống này, nồng độ clorua giảm 5 mmol / L và pH là 7,47. Các chất điện giải khác và PCO2 có giá trị bình thường. Nồng độ HCO3− tăng lên 29 mmol / L và BE là + 5 mmol / L. Đây là một ví dụ về nhiễm kiềm chuyển hóa đơn độc, thường có thể được quan sát thấy trong trường hợp nôn mửa kéo dài hoặc sau khi dùng thuốc lợi tiểu quai.
D Lactat máu và natri bicarbonat (NaHCO3). Trong tình huống này, nồng độ lactat tăng 10 mmol / L và nồng độ natri tăng 10 mmol / L do sử dụng NaHCO3. Các chất điện giải khác và PCO2 có giá trị bình thường. Vì sự gia tăng các cation bằng với sự gia tăng các anion, nên không cần thay đổi nào khác trong chất điện giải để đáp ứng nguyên tắc trung hòa điện tích, tức là nồng độ HCO3− không bị ảnh hưởng (24 mmol / L) và pH là 7,40. Do đó, hai rối loạn axit-bazơ cùng tồn tại và triệt tiêu lẫn nhau. Do đó, SBE được tính toán là 0 mmol / L. Lưu ý, các cột này cao hơn bình thường, nhấn mạnh thực tế rằng việc sử dụng natri-bicacbonat gây ra sự gia tăng độ thẩm thấu.
E Hạ natri máu, hạ clor máu và ketoacids. Trong tình huống này, nồng độ natri và clorua lần lượt giảm 20 và 30 mmol / L. Đồng thời, 10 mmol / L keton có mặt. Cũng trong trường hợp này, các biến thể của các cation và anion mạnh triệt tiêu lẫn nhau và giả sử PCO2 bình thường là 40 mmHg, các giá trị bình thường của pH và HCO3− được mong đợi, dẫn đến SBE bình thường = 0 mmol / L.Rối loạn axit-bazơ này có thể được quan sát thấy ở trẻ sơ sinh bị hẹp môn vị do phì đại, nơi mất điện giải do nôn mửa kéo dài có thể cùng tồn tại với giảm thể tích tuần hoàn và nhiễm toan ceton do đói. HCO3−, bicacbonat; A−, axit yếu non-cacbonic được phân tách ra; Lac−, lactat; Ket−, Keton
Tuy nhiên, nhìn chung SBE thường được coi là một thông số tốt hơn và đáng tin cậy hơn và do đó nên được ưu tiên trong thực hành lâm sàng.
“Không phải tất cả những thứ lấp lánh đều là vàng”
Chúng ta đã nêu bật tính hữu ích và điểm mạnh của SBE, nhưng vẫn tồn tại một số hạn chế và cần được ghi nhớ trong quá trình thực hành hàng ngày của chúng ta. Đầu tiên, trong khi SBE là một ước tính định lượng có giá trị về sự thay đổi axit-bazơ trong chuyển hóa, nó không cung cấp bất kỳ thông tin nào về các cơ chế bên dưới. Thật vậy, để xác định cơ chế bệnh lý cơ bản, chúng ta phải đánh giá các biến số khác, chẳng hạn như điện giải, lactate, protein, phốt phát và tiền sử lâm sàng.
SBE là một chỉ dấu tổng hợp
Tức là một số thành phần đóng góp vào giá trị cuối cùng của nó (ví dụ: chloride, lactate, albumin, ketoacids). Do đó, các thành phần khác nhau có thể hoạt động theo các hướng ngược nhau, có khả năng triệt tiêu lẫn nhau và làm cho việc giải thích giá trị SBE đơn độc rất khó khăn. Hãy để chúng tôi cung cấp một ví dụ. Bệnh nhân có thể bị tăng clo huyết, do đó tăng anion mạnh, cùng với giảm albumin máu, dẫn đến giảm điện tích âm yếu. Nếu mức giảm điện tích âm do giảm albumin máu bằng mức tăng clorua thì nồng độ HCO3− sẽ bình thường. Do đó, bệnh nhân có thể có các thông số axit-bazơ bình thường (pH 7,40, pCO2 40 mmHg, HCO3− 24 mmol /L) qui ra SBE bình thường một cách hoàn hảo là 0 mmol / L. Giá trị của SBE trong bối cảnh này có sai không? Không, nó không phải. SBE tuyên bố một cách chính xác rằng chúng ta không cần thêm axit / bazơ mạnh vào mẫu để đạt được pH là 7,40 với PCO2 là 40 mmHg. Chúng ta đã ở đúng chỗ đó chứ! Tuy nhiên, có hai quá trình bệnh lý (có dấu hiệu trái ngược nhau) và sẽ bị bỏ sót nếu SBE được đánh giá riêng. Đồ thị biểu diễn các thí dụ khác về nhiều rối loạn Toan-Kiềm kết hợp dẫn đến các giá trị SBE bình thường được tóm tắt trong Hình 1.
SBE là một thông số hữu ích để hỗ trợ chẩn đoán các rối loạn chuyển hóa toan-kiềm và đánh giá định lượng sự chuyển dịch của chuyển hóa. Đây là một giá trị được tính toán dựa trên một số biến số đo được (pH, PCO2, nồng độ hemoglobin) và giả định các protein huyết tương bình thường. Điều quan trọng, bản thân SBE không cung cấp thông tin về tình trạng bên dưới và có thể hoàn toàn bình thường trong trường hợp có nhiều tình trạng tác động ngược chiều nhau. Do đó, trong khi SBE bất thường là một dấu hiệu đáng tin cậy của một vấn đề chuyển hóa chủ yếu, thì một SBE bình thường không đủ để loại trừ nó. Vì lý do này, SBE không thể được coi là một tham số độc lập. Thật vậy, điều cơ bản là tích hợp giá trị của nó với các thông tin
khác để xác định các rối loạn Toan –kiềm phức tạp.
Nguồn tham khảo
1. Severinghaus JW, Astrup PB (1985) History of blood gas analysis. II. pH and acid-base balance measurements. J Clin Monit 1:259–277. https:// doi.org/10.1007/bf02832819
2. Van Slyke DD, Cullen GE (1917) Studies of acidosis. I. The bicarbonate concentration of the blood plasma; its significance and its determination as a measure of acidosis. J Biol Chem 30:289
3. Jorgensen K, Astrup P (1957) Standard bicarbonate, its clinical signifi- cance, and a new method for its determination. Scand J Clin Lab Invest 9:122–132. https://doi.org/10.3109/00365515709101210
4. Singer RB, Hastings AB (1948) An improved clinical method for the esti- mation of disturbances of the acid-base balance of human blood. Medi- cine 27:223–242. https://doi.org/10.1097/00005792-194805000-00003
5. Astrup P, Jorgensen K, Siggaard-Andersen O, Engel K (1960) The acid-base metabolism. A new approach. Lancet (London, England) 1:1035–1039. https://doi.org/10.1016/s0140-6736(60)90930-2
6. Siggaard-Andersen O (1974) The acid-base status of the blood. Williams & Wilkins, Munksgaard, Baltimore, Copenhagen
7. Van Slyke DD (1922) On the measurement of buffer values and on the relationship of buffer value to the dissociation constant of the buffer and the concentration and reaction of the buffer solution. J Biol Chem
52:525–570. https://doi.org/10.1016/S0021-9258(18)85845-8
8. Langer T, Brusatori S, Carlesso E, Zadek F, Brambilla P, Ferraris Fusarini C, Duska F, Caironi P, Gattinoni L, Fasano M, Lualdi M, Alberio T, Zanella A, Pesenti A, Grasselli G, (2021) Low noncarbonic buffer power amplifies acute respiratory acid-base disorders in patients with sepsis: an in vitro study. J Appl Physiol (Bethesda, Md : 1985) 131:464–473. https://doi.org/ 10.1152/japplphysiol.00787.2020
9. Siggaard-Andersen O (1977) The van Slyke equation. Scand J Clin Lab Investig Suppl 146:15–20. https://doi.org/10.3109/00365517709098927
10. Lang W, Zander R (2002) The accuracy of calculated base excess in blood. Clin Chem Lab Med 40:404–410. https://doi.org/10.1515/cclm.2002.065
11. Kofstad J (2001) Base excess: a historical review-has the calculation of base excess been more standardised the last 20 years? Clin Chim Acta Int J Clin Chem 307:193–195. https://doi.org/10.1016/s0009-8981(01) 00427-2
12. Morgan TJ, Clark C, Endre ZH (2000) Accuracy of base excess–an in vitro evaluation of the Van Slyke equation. Crit Care Med 28:2932–2936. https://doi.org/10.1097/00003246-200008000-00041
13. Fencl V, Leith DE (1993) Stewart’s quantitative acid-base chemistry: appli- cations in biology and medicine. Respir Physiol 91:1–16. https://doi.org/ 10.1016/0034-5687(93)90085-o
14. Morgan TJ (2011) Partitioning standard base excess: a new approach. J Clin Monit Comput 25:349–352. https://doi.org/10.1007/ s10877-011-9324-y
15. Gamble JL, Ross GS, Tisdall FF (1923) The metabolis of fixed base during fasting. J Biol Chem 57:633–695. https://doi.org/10.1016/S0021-9258(18) 85480-1

Bài viết thật bổ ích
Cảm ơn bạn đã ủng hộ bài viết ạ