Bệnh Nhi khoa
Hướng dẫn cách tiếp cận và điều trị bệnh thận IgA ở trẻ em
Xuất bản: UTC +7
Cập nhật lần cuối: UTC +7
Điều trị bệnh thận IgA ở trẻ em – tải PDF Tại đây.
Resontoc LP, Liu ID and Yap HK
A. Tiếp cận chẩn đoán
Biểu hiện lâm sàng
Biểu hiện bệnh:
- Tiểu máu đại thể ± tiểu đạm.
- Tiểu máu đại thể tái phát.
- Hội chứng thận hư.
- Hội chứng thận viêm cấp tính.
- Viêm cầu thận hình liềm với chức năng thận xấu đi nhanh chóng.
- Tổn thương thận cấp liên quan đến tiểu máu đại thể.
Loại trừ các nguyên nhân thứ phát gây bệnh thận IgA, như:
- Bệnh lý gan.
- Bệnh lý ruột viêm.
- Bệnh celiac.
- Nhiễm HIV.
- Ankylosing spondylitis.
- Viêm da dạng herpes.
- Viêm tiểu phế quản bít tắc.
- Lao toàn thể.
- Lymphomas.
IgA huyết thanh có thể tăng 8-16% trẻ bệnh thận IgA.
Sinh thiết thận
Chỉ định:
Nếu chẩn đoán mô học là cần thiết.
Nếu xem xét bắt đầu điều trị ức chế miễn dịch:
- Protein niệu ≥1 g/ngày/1.73 m2 hoặc protein niệu:creatinine niệu (UPCR) ≥0.1 g/mmol.
- Bệnh thận mạn (CKD) giảm mức lọc cầu thận.
- Tăng huyết áp.
- Chức năng thận xấu đi cấp tính, để phân biệt với hoại tử ống thận cấp do crescentic IgA nephropathy.
The Oxford Classification of IgA Nephropathy
| Variable | Định nghĩa | Điểm |
| Tăng sinh gian mạch | 0 = <4 tế bào gian mạch/vùng gian mạch 1 = 4–5 tế bào gian mạch/vùng gian mạch
2 = 6–7 tế bào gian mạch/vùng gian mạch 3 = >8 tế bào gian mạch/vùng gian mạch (Điểm tăng sinh gian mạch là điểm trung bình ở tất cả cầu thận) |
M0 ≤0.5
M1 >0.5 |
| Xơ chai cầu thận từng vùng | Bất kỳ số lượng tiểu cầu thận nào bị xơ hóa, nhưng không bao gồm toàn bộ tiểu cầu thận hoặc có sự hiện diện của sự kết dính (phì đại podocyte). | S0: Không có S1: Có |
| Tăng sinh nội mạch | Tăng sinh do tăng số lượng tế bào trong lòng mao mạch cầu thận gây hẹp lòng mao mạch. | E0: không
có E1: có |
| Teo ống thận/Xơ kẽ | Phần trăm diện tích vỏ thận bị teo ống thận hoặc xơ kẽ, tùy theo tổn thương nào nhiều hơn. | T0: 0–25%
T1: 26–50% T2: >50% |
| Liềm thể | Không có liềm thể.
Liềm thể <25% cầu thận. Liềm thể > 25% cầu thận |
C0
C1 C2 |
B. Điều trị
Khuyến cáo chung
Điều trị ức chế miễn dịch không dành cho:
- Bệnh nhân nguy cơ thấp tiến triển bệnh lý thận:
- Tiểu máu vi thể không triệu chứng.
- Tiểu máu đại thể tái phát.
- Protein niệu <0.5 g/ngày/1.73m2 hoặc UPCR <0.05 g/mmol.
- Bệnh nhân tiến triển CKD giai đoạn 3-5 trong khi tiến triển bệnh được đánh giá là không thể phục hồi.
Điều trị hỗ trợ bệnh thận IgA để làm chậm tiến triển bệnh thận mạn, đặc biệt là kiểm soát chặt huyết áp.
- Ức chế RAAs (RASBs):
- Ức chế men chuyển (ACEi) và ức chế thụ thể (ARB) được dùng trong kiểm soát huyết áp và tiểu đạm.
- Ở trẻ em, các chuyên gia đề xuất favorable outcome khi tiểu đạm thời gian trung bình giảm <0.5 g/ngày/1.73m2 hoặc urine protein:creatinine ratio (UPCR) <0.05 g/ mmol.
- Xem xét kết hợp UCMC và UCTT nếu đích protein niệu <0.5 g/ngày/1.73m2 hoặc UPCR <0.05 g/mmol không đạt được với đơn trị liệu liều tối đa được khuyến cáo.. Điều trị kết hợp thận trọng vì liên quan đến tăng nguy cơ AKI và tăng kali máu nếu bệnh nhân giảm thể tích.
- Fish oil: Eicosapentaenoic acid (EPA) và docosahexanoic acid (DHA)
- Không có bằng chứng rõ ràng fish oil giúp cải thiện kết cục trong bệnh thận IgA.
- Điều trị bổ trợ trên những bệnh nhân bệnh nhẹ, kết hợp với UCMC và UCTT.
- Liều: 3 g/day.
- Tác dụng phụ: Rối loạn tiêu hóa.
- Statins:
- Điều trị statin trên những bệnh nhân có LDL>3.36 mmol/L.
Bệnh nhân bệnh lý nặng
Chỉ định điều trị ức chế miễn dịch:
- Protein niệu ≥1 g/ngày/1.73m2 hoặc UPCR ≥0.1 g/mmol (bao gồm hội chứng thận hư với tiểu đạm kém chọn lọc).
- Chức năng thận xấu đi nhanh chóng không do hoại tử ống thận cấp.
- Sự hiện diện của liềm thể (crescents) trên sinh thiết thận và bằng chứng phản ứng viêm hoạt động trên mô học (e.g., thay đổi tăng sinh hoặc hoại tử ở cầu thận).
- Bệnh nhân hội chứng thận hư khởi phát cấp tính và hợp chất mỏm gai lan tỏa (diffuse foot process fusion) trên sinh thiết thận được điều trị nếu thuộc thể sang thương tối thiểu.
Phác đồ điều trị thuốc ức chế miễn dịch:
- Corticosteroids:
- Truyền methylprednisolone hàng tháng liều 10–30 mg/kg/liều (tối đa 1g) trong 3 ngày, tối đa 6 liệu trình.
- Sau liệu trình bolus methylprednisolone, prednisolone đường uống liều 0.5–1.0 mg/kg (tối đa 30 mg) hàng ngày. Giảm dần 5 mg/ngày trong tháng sau mỗi đợt bolus methylprednisolone.
- Ngưng điều trị bolus khi:
-
- Protein niệu giảm <0.3 g/ngày/1.73m2 hay UPCR <0.03 g/mmol VÀ
-
- Phục hồi chức năng thận.
- Điều trị prednisolone đường uống giảm dần liều nên tiếp tục háng tháng trong 6-12 tháng và có thể chuyển sang điều trị cách ngày khi protein niệu giảm <1 g/ngày/1.73m2 hoặc UPCR <0.1 g/mmol.
- Thay vào đó, điều trị prednisolone đường uống liều 1–2 mg/kg (tối đa60 mg/ngày) có thể được dùng điều trị ban đầu trong 3 tháng.
- Mycophenolate mofetil (MMF):
- MMF có thể bắt đầu ở thời điểm điều trị steroid, trừ những bệnh nhân hội chứng thận hư (minor abnormalities trên mô bệnh học) với tiểu đạm chọn lọc cao và không có tiểu máu.
- Liều MMF: 600 mg/m2/liều mỗi 12 giờ (15–23 mg/kg/liều mỗi 12 giờ). Liều tối đa: 1 g mỗi 12 giờ.
- Theo dõi công thức máu hàng tháng.
- Ngừng nếu số lượng bạch cầu tuyệt đối <1.5 × 109/L. iv. Xem xét theo dõi nồng độ MPA huyết thanh nếu cần thiết (đích 2-4 mg/L).
- Đánh giá AUC của MPA:
- AUC của MPA 30–60 mg*h/L.
- Tác dụng phụ đường tiêu hóa, bắt đầu famotidine dự phòng với liều 0.5–1 mg/kg/ngày dùng 1 lần về đêm hoặc chia 2 liều mỗi 12 giờ (tối đa 40 mg), hoặc rabeprazole 0.5– 1.0 mg/kg 1 lần về đêm hoặc chia 2 lần mỗi 12 giờ (tối đa 40 mg).
- Xem xét đổi sang Myfortic® nếu tác dụng phụ đường tiêu hóa dai dẳng.
- Các thuốc giảm protein niệu
- Ức chế calcineurin (cyclosporine hoặc tacrolimus) có thể được thêm trên những bệnh nhân tiểu đạm dai dẳng ngưỡng thận hư.
- Angiotensin-converting enzyme inhibitors (ACEi) và angio tensin receptor blockers (ARB).
Cyclophosphamide TM liều cao:
- Corticosteroids:
- Truyền methylprednisolone 10 mg/kg/liều (tối đa 1g) trong 3 ngày.
- Prednisolone đường uống khởi đầu liều 0.5–1.0 mg/kg (tối đa 60 mg) hàng ngày sau bolus methylprednisolone, và giảm dần 5 mg/day trong tháng dựa vào mức độ hoạt động bệnh, và sau đó giảm xuống liều tối thiểu cần để kiểm soát bệnh.
- Cyclophosphamide 500–1000 mg/m2 TM hàng tháng, dùng 6 liều sau đó:
- Cyclophosphamide TM mỗi 3 tháng trong 24 tháng HOẶC
- Azathioprine đường uống liều 2 mg/kg háng ngày HOẶC
- MMF đường uống liều 600 mg/m2/liều mỗi 12 giờ (tối đa 1g mỗi 12 giờ).
Bệnh nhân tiểu đạm mức độ nhẹ đến trung bình
- Bằng chứng mức độ vừa phải cho thấy kết cục thuận lợi khi tiểu đạm thời gian trung bình giảm < 1 g/ngày ở người lớn. • Ở trẻ em, các chuyên gia đề xuất đích <0.5 g/ngày/1.73m2hoặc UPCR <0.05 g/mmol.
- Bắt đầu ACEi hoặc ARB khi tiểu đạm >0.3 g/ngày/1.73m2 hoặc UPCR >0.02 g/mmol.
- Ức chế miễn dịch:
- Xem xét sử dụng thuốc ức chế miễn dịch trên những bệnh nhân tiểu đạm dai dẳng > 0.5 g/ngày/1.73m2 hoặc UPCR >0.05 g/mmol mặc dù đã điều trị hỗ trợ tối ưu 3–6 tháng.
- Thử dùng corticosteroids và/hoặc MMF trong 6-12 tháng.
Bệnh nhân tiểu máu đại thể tái phát
- Bệnh nhân chỉ máu đại thể tái phát, không tiểu đạm, có thể điều trị bảo tồn.
- Theo dõi sát protein niệu nên được thực hiện mỗi 6 tháng hoặc sau tiểu máu đại thể tái phát.
- Không có đủ bằng chứng khuyến cáo cắt amidan trong điều trị tiểu máu đại thể tái phát.
Bệnh nhân CKD giai đoạn G2–G4
- ACEi và ARB được dùng để làm chậm tiến triển bệnh lý thận.
- Xem xét SGLT-2 inhibitors ở người lớn để làm chậm tiến triển bệnh lý thận.
- Bắt đầu điều trị hỗ trợ trên những bệnh nhân CKD giai đoạn G2-G4, bao gồm:
- Kiểm soát huyết áp.
- Kiểm soát từng thành phần trong hội chứng chuyển hóa. c. Kiểm soát dịch vào.
- Hạn chế muối và điều trị lợi tiểu.
- Xem xét đối vận aldosterone với tác dụng anti-fibrotic và giảm protein niệu khi dùng phối hợp với UCMC hoặc UCTT.
- Tránh hút thuốc lá.
- Xem xét allopurinol hoặc febuxostat để làm giảm phản ứng tiền viêm trong tăng uric máu.
- Tránh các thuốc có độc tính lên thận bao gồm NSAIDs. i. Tránh hạ kali máu nặng kéo dài.
- Tránh phosphate cathartics.
- Điều trị thiếu vitamin D.
- Điều trị bệnh lý xương và kiểm soát tăng phospho máu.
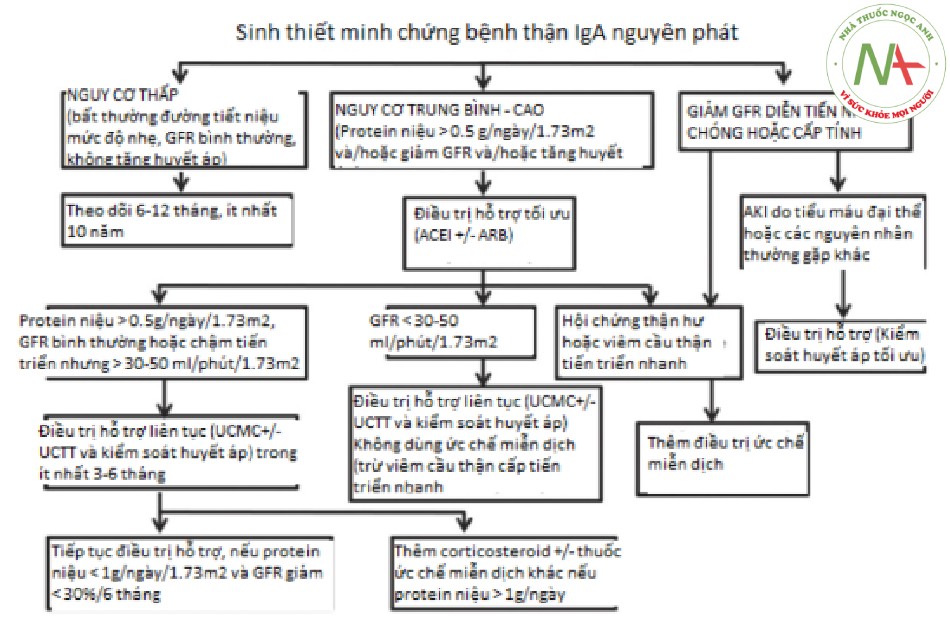
Lưu đồ 
Recommended Reading
- Hogg RJ. (2010) Idiopathic immunoglobulin A nephropathy in children and adolescents. Pediatr Nephrol 25:823–829.
- Floege J, Eitner F. (2011) Current therapy for IgA nephropathy. J Am Soc Nephrol 22:1785–1794.
- Cattran DC, Appel GB, Hunder G. (2021, updated) Treatment and prognosis of IgA nephropathy. Edited by Glassock RJ, Fervenza FC, Forman JP. UpToDate ONLINE. http://www.uptodate.com.
- Trimarchi H, Barratt J, Cattran DC, Cook HT, Coppo R, Haas M, Liu ZH, Roberts IS, Yuzawa Y, Zhang H, Feehally J; IgAN Classification Working Group of the International IgA Nephropathy Network and the Renal Pathology Society, Conference Participants. (2017) Oxford classification of IgA nephropathy 2016: An update from the IgA Nephropathy classification working group. Kidney Int 91:1014–1021.
- Natale P, Palmer SC, Ruospo M, Saglimbene VM, Craig JC, Vecchio M, Samuels JA, Molony DA, Schena FP, Strippoli GF. (2020) Immunosuppressive agents for treating IgA nephropathy. Cochrane Database Syst Rev 3:CD003965. doi: 10.1002/14651858. CD003965.pub3.